Hepatitis im Zusammenhang mit Sitagliptin bei vorbestehender nichtalkoholischer Fettlebererkrankung (Aus der UAW-Datenbank)
Sitagliptin ist ein orales Antidiabetikum, das über die Inkretinhormone den Blutzucker beeinflusst. Die beiden Inkretinhormone Glucagon-like Peptid 1 (GLP-1) und Glucose-dependent-insulinotropic Peptid (GIP) werden nach Stimulation durch Nahrungsaufnahme von Zellen der Darmschleimhaut sezerniert. GLP-1 und GIP beeinflussen den Glukosestoffwechsel u. a. durch eine blutzuckerabhängige Stimulierung der Synthese und Freisetzung von Insulin aus der Bauchspeicheldrüse sowie die Unterdrückung der Glukagon-Sekretion. Die Inkretine haben eine kurze Halbwertszeit von drei bis fünf Minuten. An ihrem Abbau ist unter anderem die Dipeptidylpeptidase-4 (DPP-4) beteiligt. Sitagliptin hemmt die DPP-4 und führt so zu einer Erhöhung der Plasmaspiegel und Verstärkung der Effekte von Inkretinen.
Sitagliptin ist seit 2007 in Deutschland verfügbar und zugelassen für die Behandlung des Diabetes mellitus Typ 2, wenn Diät und Bewegung allein oder eine Behandlung mit anderen oralen Antidiabetika den Blutzucker nicht ausreichend senken (1). Es kann als Monotherapie bei Patienten eingesetzt werden, für die Metformin nicht geeignet ist, sowie als Kombinationspartner bei Zwei- oder Dreifachtherapien mit Metformin, einem Sulfonylharnstoff oder einem PPARγ-Agonisten (Rosiglitazon, Pioglitazon). Sitagliptin ist auch zur Kombination mit Insulin zugelassen.
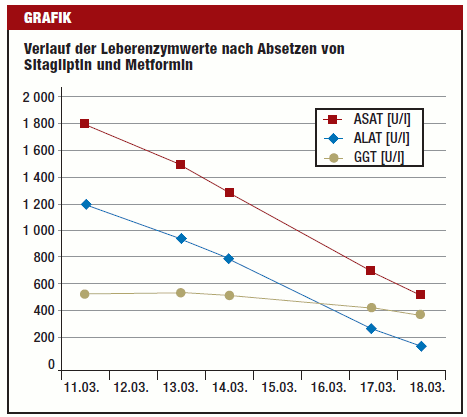
Der AkdÄ wurde der Fall eines 65-jährigen Patienten mit Typ-2-Diabetes mellitus gemeldet (AkdÄ-Fall Nr. 147870), der seit Anfang 2008 (genaues Datum nicht bekannt) mit 100 mg Sitagliptin pro Tag behandelt wurde. Die Dauermedikation bestand aus Metformin, ASS, Fenofibrat, Lisinopril sowie einem Kombinationspräparat aus Bisoprolol und Hydrochlorothiazid. Als weitere Diagnosen wurden neben arterieller Hypertonie und einer Fettstoffwechselstörung eine KHK (Z. n. Myokardinfarkt 1995 und 2003) genannt. Im März 2008 wurden bei dem Patienten erhöhte Leberwerte festgestellt (ASAT 1200 U/l, ALAT 1800 U/l, GGT 520 U/l, LDH 600 U/l, AP 250 U/l, Bilirubin 1,05 mg/dl). Es erfolgte eine stationäre Abklärung. Ein regelmäßiger Alkoholkonsum wurde glaubhaft verneint. Serologisch gab es keine Hinweise auf eine infektiöse Ursache (einschließlich Hepatitis A, B und C sowie CMV; EBV und HSV) oder eine autoimmune Ursache des Leberschadens. Eine Leberpunktion zeigte histologisch einen kombinierten Leberschaden mit einer vorbestehenden metabolisch toxischen Schädigung im Sinne einer mäßiggradigen Verfettung und einer Fibrose im Stadium 2. Darüber hinaus fand man eine portale und intralobuläre Hepatitis mit eosinophilen Granulozyten als Ausdruck einer möglicherweise medikamentös bedingten Entzündung. Aufgrund des zeitlichen Zusammenhangs wurde Sitagliptin als Ursache der Hepatitis in Betracht gezogen, und sowohl Sitagliptin als auch Metformin wurden abgesetzt. Bereits drei Tage später und bei den weiteren Kontrollen bis zur Entlassung aus der stationären Betreuung waren die Transaminasenerhöhungen deutlich rückläufig (siehe Grafik) und im weiteren ambulanten Verlauf wieder normalisiert.
Sowohl aufgrund der klinischen Befunde als auch nach gängigen Scores zur Bestimmung des Kausalzusammenhangs zwischen einem bestimmten Arzneimittel und einem Leberschaden kann im vorliegenden Fall von einem "wahrscheinlichen" Zusammenhang mit Sitagliptin ausgegangen werden (2-4). In der Datenbank des deutschen Spontanmeldesystems (gemeinsame Datenbank von BfArM und AkdÄ) sind 92 Verdachtsberichte unerwünschter Arzneimittelwirkungen im Zusammenhang mit Sitagliptin erfasst, darunter weitere Meldungen von Leberwerterhöhungen. Kürzlich wurde ein Fall einer Transaminasenerhöhung unter Sitagliptin bei einem Patienten mit vorbekannter nichtalkoholischer Steatohepatitis (NASH) veröffentlicht (5).
In der Fachinformation von Sitagliptin-haltigen Arzneimitteln sind Leberschäden, Transaminasenerhöhungen oder andere unerwünschte Wirkungen an der Leber nicht aufgeführt (1). Die geschilderten Daten zeigen jedoch, dass Sitagliptin in sehr seltenen Fällen ursächlich für eine Transaminasenerhöhung beziehungsweise eine schwerwiegende Hepatitis sein kann. Bei Patienten, die unter einer Behandlung pathologische Leberwerte oder klinische Zeichen einer Hepatitis entwickeln, sollte diese Differenzialdiagnose in Erwägung gezogen werden.
Bitte teilen Sie der AkdÄ alle beobachteten Nebenwirkungen (auch Verdachtsfälle) mit. Sie können dafür den Berichtsbogen verwenden, der regelmäßig im Deutschen Ärzteblatt abgedruckt wird oder über die Homepage der AkdÄ abrufbar ist. Es besteht auch die Möglichkeit, über www.akdae.de direkt online einen UAW-Verdachtsfall zu melden.
Literatur
- MSD Sharp & Dohme GmbH: Fachinformation "Januvia® 100 mg Filmtabletten". Stand: November 2009.
- Benichou C, Danan G, Flahault A: Causality assessment of adverse reactions to drugs - II. An original model for validation of drug causality assessment methods: case reports with positive rechallenge. J Clin Epidemiol 1993; 46: 1331-6.
- Danan G, Benichou C: Causality assessment of adverse reactions to drugs - I. A novel method based on the conclusions of international consensus meetings: application to drug-induced liver injuries. J Clin Epidemiol 1993; 46: 1323-30.
- Teschke R, Schwarzenboeck A, Hennermann KH: Causality assessment in hepatotoxicity by drugs and dietary supplements. Br J Clin Pharmacol 2008; 66: 758-66.
- Gross BN, Cross LB, Foard J, Wood Y: Elevated hepatic enzymes potentially associated with sitagliptin. Ann Pharmacother 2010; 44: 394-5.
