„Aus Fehlern lernen“: Versehentliche intrathekale Applikation von Vincristin
Deutsches Ärzteblatt, Jg. 115, Heft 25, 22.06.2018
Das Vinca-Alkaloid Vincristin ist zugelassen zur Behandlung verschiedener Krebserkrankungen, insbesondere hämatologischer Neoplasien (z. B. akute lymphatische Leukämie, maligne Lymphome, multiples Myelom). Als „Spindelgift“ hemmt Vincristin die Zellteilung während der Metaphase, indem es die Funktion des Spindelapparates beeinträchtigt. Ferner kann es auf andere zelluläre Prozesse einwirken, wie beispielsweise die RNA- und DNA-Synthese (1). Vincristin ist neurotoxisch. Bei intravenöser Anwendung passiert Vincristin jedoch nur in geringem Maß die Blut-Hirn-Schranke (1;2). Als häufige Nebenwirkung kann eine periphere Neuropathie auftreten (1). Auf Grund seiner ausgeprägten Neurotoxizität darf Vincristin niemals intrathekal verabreicht werden (1).
Auf die schwerwiegenden Folgen einer versehentlichen intrathekalen Applikation von Vincristin hatte die AkdÄ bereits 2005 hingewiesen (3). Aus aktuellem Anlass möchten wir erneut auf dieses vermeidbare Risiko aufmerksam machen.
Der AkdÄ wurde der Fall einer 65-jährigen Patientin gemeldet, die zur Abklärung einer Panzytopenie stationär aufgenommen wurde. Die differenzialdiagnostische Abklärung führte zur Diagnose einer blastischen, plasmozytoiden, dendritischen Zellneoplasie (BPDCN) mit kutaner und meningealer Beteiligung. Bei der BPDCN handelt es sich um eine sehr seltene, aggressiv verlaufende hämatologische Neoplasie. Da für diese Erkrankung keine Standardtherapie etabliert ist, wurde in Anlehnung an das GMALL-elderly-Protokoll zur Behandlung der akuten lymphatischen Leukämie (4) eine chemotherapeutische Behandlung begonnen. Diese umfasste im Rahmen der Vorphase Cyclophosphamid (intravenös, Tag 3-5), Dexamethason (oral, Tag 1-5) und Methotrexat (intrathekal, Tag 1). Die Induktionsphase I sollte mit Vincristin, Idarubicin, Dexamethason und G-CSF fortgeführt werden. An Tag 7 erfolgte jedoch wegen des ZNS-Befalls zunächst eine intrathekale Dreifachtherapie (5) mit Cytarabin, Methotrexat und – vermeintlich – Dexamethason.
Als am Tag darauf (Tag 8) die intravenöse Behandlung erfolgen sollte, wurde das Fehlen der Spritze mit Vincristin bemerkt, die jedoch von der Apotheke ausgeliefert worden war. Stattdessen war eine Spritze mit Dexamethason überzählig. Offenbar war es am Vortag im Rahmen einer Verwechslung zur akzidentellen intrathekalen Applikation von Vincristin gekommen.
Trotz dann umgehend gelegter Lumbaldrainage verschlechterte sich der Zustand der Patientin. Sie entwickelte eine aufsteigende Spinalparalyse mit Atemlähmung und verstarb knapp drei Wochen nach der versehentlichen intrathekalen Injektion von Vincristin.
In der Literatur finden sich seit den 1960er Jahren zahlreiche Fallberichte zur akzidentellen intrathekalen Applikation von Vincristin, die auch bei zeitnah eingeleiteten neurochirurgischen Interventionen zumeist tödlich endeten (6-15). Die wenigen Überlebenden trugen schwere neurologische Folgeschäden davon (16-18).
Ursachen für versehentliche intrathekale Anwendungen können beispielsweise Verwechslungen mit regulär intrathekal zu verabreichenden Arzneimitteln oder eine falsche Beschriftung von Spritzen sein. Risikofaktoren sind vor allem das gleichzeitige Vorhandensein von intrathekalen und intravenösen Arzneimitteln in einem Behandlungsraum, die Verabreichung von Vincaalkaloiden in nicht spezialisierten onkologischen Abteilungen bzw. durch nicht ausreichend geschultes Personal oder die Applikation außerhalb der regulären Dienstzeiten. Wenn keine doppelte Kontrolle und keine Auszeit („Time-Out“) vor intrathekaler Applikation von Arzneimitteln erfolgen, kann dies ebenfalls zu solchen Fehlern beitragen (19;20). Im vorliegenden Fall konnte durch das gleichzeitige Vorhandensein der intrathekalen Medikation und Vincristin auf der Station die fatale Verwechslung erfolgen.
Die akzidentelle intrathekale Gabe von Vincristin ist insgesamt selten. Ein solcher Fehler kann jedoch im Einzelfall desaströse oder sogar tödliche Folgen haben. Deshalb wurden von verschiedenen Autoren Maßnahmen zur Fehlervermeidung empfohlen (10;11;13;19;21-23). In Deutschland hat das Aktionsbündnis Patientensicherheit (APS) im Jahr 2015 Handlungsempfehlungen zum Umgang mit Vincristin zusammengestellt (Tabelle 1) (22).
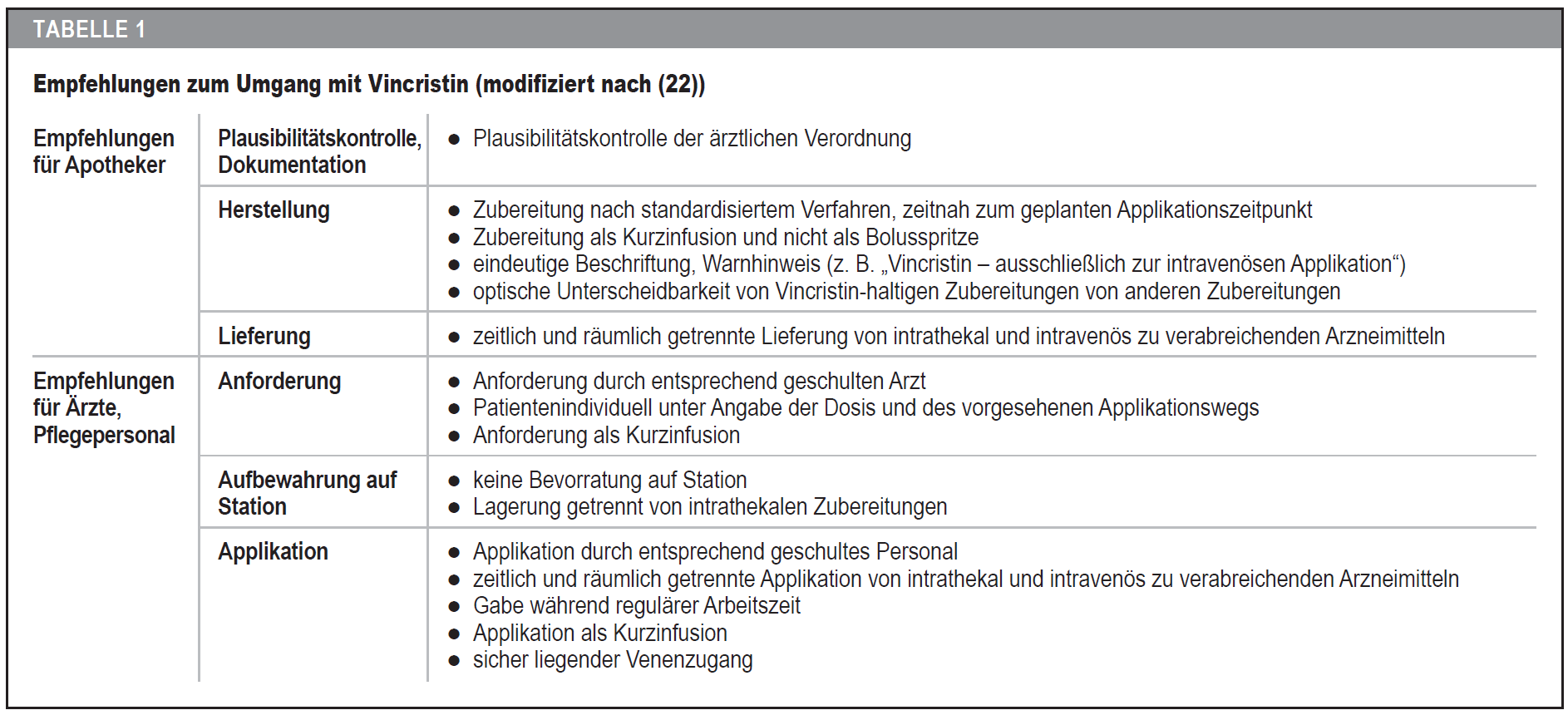
Um das Risiko für Verwechslungen zu minimieren, sollte die Trennung von intravenös zu applizierenden Arzneimitteln von intrathekal zu verabreichenden bei Transport, Lagerung und Applikation strikt eingehalten werden (22). Bei Zubereitung von Vincristin als Kurzinfusion sind bisher keine Fälle einer akzidentellen intrathekalen Verabreichung beschrieben (19). Mehrere Untersuchungen deuten darauf hin, dass Vincristin-Paravasate insgesamt selten sind und anders als häufig befürchtet auch bei Gabe als Kurzinfusion nicht gehäuft auftreten (21;25-27). Auf einen sicher liegenden Venenzugang ist zu achten (24). Durch Verwendung von Non-Luer-Systemen sollen Fehler aufgrund der universell konnektierbaren Luer-Systeme zu vermieden werden (28;29). Für die Anwendung von Vincristin sollte ein einrichtungsinternes, standardisiertes Vorgehen entwickelt werden, um das Risiko einer Fehlapplikation zu mindern. Die Empfehlungen des APS sollten hierbei berücksichtigt werden (22).
Die intrathekale Applikation (anderer) Arzneimittel ist Bestandteil verschiedener onkologischer Protokolle. Da auch sie besondere Risiken (z. B. durch versehentliche Applikation von intravenös zu applizierenden Arzneimitteln) birgt, sollten auch hierfür abteilungsinterne Standards entwickelt und dabei verfügbare Empfehlungen berücksichtigt werden (z. B. Vier-Augen-Prinzip; Time-Out vor Applikation; zeitliche und räumliche Trennung von intravenösen und intrathekalen Arzneimitteln bei Transport, Lagerung und Applikation; Verwendung von Non-Luer-Anschlüssen) (22;30-32).
Zusammenfassung und Empfehlung der AkdÄ
Das Risiko einer akzidentellen intrathekalen Applikation von Vincristin ist gut bekannt, und es gibt entsprechende Handlungsempfehlungen (22). Dennoch kam es (erneut) zu einem Todesfall aufgrund einer versehentlichen intrathekalen Verabreichung von Vincristin.
Vincristin muss ausschließlich intravenös und darf niemals intrathekal verabreicht werden. Neben der konsequenten zeitlichen und räumlichen Trennung von intravenös und intrathekal zu applizierenden Arzneimitteln kann die generelle Bereitstellung und Applikation von Vincristin als Kurzinfusion risikomindernd wirken. Für die Anwendung von Vincristin sollte ein abteilungsinterner Standard etabliert werden. Dabei sollten auch die Empfehlungen des Aktionsbündnisses Patientensicherheit (je nach lokalen Gegebenheiten) berücksichtigt werden (22).
Die intrathekale Anwendung von (anderen) Arzneimitteln sollte nur mit äußerster Sorgfalt und unter Berücksichtigung verfügbarer Empfehlungen durchgeführt werden (22;30-32).
Die AkdÄ erfasst und bewertet Medikationsfehler (33), um ggf. risikomindernde Maßnahmen zu initiieren. Wir bitten um Meldung von Medikationsfehlern und anderen Nebenwirkungen, um weitere Erkenntnisse zum Risikoprofil von Arzneimitteln zu gewinnen.
Literatur
- Teva GmbH: Fachinformation "Vincristinsulfat-Teva® 1 mg/ml Injektionslösung". Stand: März 2011.
- Kellie SJ, Barbaric D, Koopmans P et al.: Cerebrospinal fluid concentrations of vincristine after bolus intravenous dosing: a surrogate marker of brain penetration. Cancer 2002; 94: 1815-1820.
- Arzneimittelkommission der deutschen Ärzteschaft: "Aus der UAW-Datenbank": Vincristin: Tödliche Zwischenfälle nach versehentlicher intrathekaler Gabe. Dtsch Arztebl 2005; 102: A 1615.
- Goekbuget N, Beck J, Brueggemann M et al.: Moderate Intensive Chemotherapy Including CNS-Prophylaxis with Liposomal Cytarabine Is Feasible and effective in Older Patients with Ph-Negative Acute Lymphoblastic Leukemia (ALL): Results of a Prospective Trial From the German Multicenter Study Group for Adult ALL (GMALL). Blood 2012; 120 (ASH Annual Meeting Abstracts): Abstract 1493.
- Gökbuget N, Baldus C, Brüggemann M et al.: DGHO Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie e.V. (Hrsg.): Leitlinie Akute Lymphatische Leukämie (ALL), C91.00: https://www.onkopedia.com/de/onkopedia/guidelines/akute-lymphatische-leukaemie-all/@@view/html/index.html (letzter Zugriff: 28. Februar 2018). Stand: Februar 2018.
- Schochet SS, Jr., Lampert PW, Earle KM: Neuronal changes induced by intrathecal vincristine sulfate. J Neuropathol Exp Neurol 1968; 27: 645-658.
- Slyter H, Liwnicz B, Herrick MK, Mason R: Fatal myeloencephalopathy caused by intrathecal vincristine. Neurology 1980; 30: 867-871.
- Gaidys WG, Dickerman JD, Walters CL, Young PC: Intrathecal vincristine. Report of a fatal case despite CNS washout. Cancer 1983; 52: 799-801.
- Williams ME, Walker AN, Bracikowski JP et al.: Ascending myeloencephalopathy due to intrathecal vincristine sulfate. A fatal chemotherapeutic error. Cancer 1983; 51: 2041-2047.
- Fernandez CV, Esau R, Hamilton D et al.: Intrathecal vincristine: an analysis of reasons for recurrent fatal chemotherapeutic error with recommendations for prevention. J Pediatr Hematol Oncol 1998; 20: 587-590.
- Dettmeyer R, Driever F, Becker A et al.: Fatal myeloencephalopathy due to accidental intrathecal vincristin administration: a report of two cases. Forensic Sci Int 2001; 122: 60-64.
- Alcaraz A, Rey C, Concha A, Medina A: Intrathecal vincristine: fatal myeloencephalopathy despite cerebrospinal fluid perfusion. J Toxicol Clin Toxicol 2002; 40: 557-561.
- Hennipman B, de Vries E, Bokkerink JP et al.: Intrathecal vincristine: 3 fatal cases and a review of the literature. J Pediatr Hematol Oncol 2009; 31: 816-819.
- D'Addario A, Galuppo J, Navari C et al.: Accidental intrathecal administration of vincristine. Am J Forensic Med Pathol 2010; 31: 83-84.
- Chotsampancharoen T, Sripornsawan P, Wongchanchailert M: Two Fatal Cases of Accidental Intrathecal Vincristine Administration: Learning from Death Events. Chemotherapy 2016; 61: 108-110.
- Dyke RW: Treatment of inadvertent intrathecal injection of vincristine. N Engl J Med 1989; 321: 1270-1271.
- Michelagnoli MP, Bailey CC, Wilson I et al.: Potential salvage therapy for inadvertent intrathecal administration of vincristine. Br J Haematol 1997; 99: 364-367.
- Al Ferayan A, Russell NA, Al Wohaibi M et al.: Cerebrospinal fluid lavage in the treatment of inadvertent intrathecal vincristine injection. Childs Nerv Syst 1999; 15: 87-89.
- Grissinger M: Death and Neurological Devastation From Intrathecal Vinca Alkaloids. P t 2016; 41: 464-525.
- Gilbar PJ: Intrathecal chemotherapy: potential for medication error. Cancer Nurs 2014; 37: 299-309.
- Gilbar P, Chambers CR, Larizza M: Medication safety and the administration of intravenous vincristine: international survey of oncology pharmacists. J Oncol Pharm Pract 2015; 21: 10-18.
- Aktionsbündnis Patientensicherheit e.V.: Handlungsempfehlung: Intravenöse Applikation von Vincristin sicherstellen:http://www.aps-ev.de/wp-content/uploads/2016/08/APS_HE_Vincristin.pdf (letzter Zugriff: 10. Januar 2018). Berlin, Dezember 2015.
- World Heath Organization: Information Exchange System: Alert No. 115: Vincristine (and other vinca alkaloids) should only be given intravenously via a minibag: http://www.who.int/medicines/publications/drugalerts/Alert_115_vincristine.pdf (letzter Zugriff: 20. Februar 2018). Genf, 18. Juli 2007.
- Leitlinienprogramm Onkologie, Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF: Supportive Therapie bei onkologischen PatientInnen - Langversion 1.1, AWMF Registernummer: 032/054OL: 11. Paravasate: http://www.leitlinienprogramm-onkologie.de/index.php?id=95&type=0 (letzter Zugriff: 20. Februar 2018). April 2017; 326-347.
- Gilbar PJ, Carrington CV: The incidence of extravasation of vinca alkaloids supplied in syringes or mini-bags. J Oncol Pharm Pract 2006; 12: 113-118.
- Nurgat ZA, Smythe M, Al-Jedai A et al.: Introduction of vincristine mini-bags and an assessment of the subsequent risk of extravasation. J Oncol Pharm Pract 2015; 21: 339-347.
- Institute for Safe Medication Practices (ISMP): Targeted Medication Safety Best Practices for Hospitals: Frequently Asked Questions: http://www.ismp.org/Tools/BestPractices/faq/FAQ-BP1.pdf (zuletzt geprüft: 10. Januar 2018). Horsham, Oktober 2014.
- Arzneimittelkommission der deutschen Ärzteschaft: Umstellung von einheitlichen „Luer-Konnektoren“ auf spezifische Konnektoren für verschiedene Anwendungsbereiche, um Verwechslungen vorzubeugen. AkdÄ Drug Safety Mail 2017-03 vom 24. Januar 2017.
- Aktionsbündnis Patientensicherheit e.V.: Hilfestellung zur Umstellung von Luer-Verbindern auf neue verwechslungssichere Verbinder: http://www.aps-ev.de/wp-content/uploads/2016/08/APS-HE_LUER-Verbinder_lang-1.pdf (letzter Zugriff: 10. Januar 2018). 1. Auflage; Berlin, Dezember 2016.
- The Newcastle upon Tyne Hospitals NHS Foundation Trust: Intrathecal Cytotoxic Chemotherapy (ITC) Policy: http://www.newcastle-hospitals.org.uk/IntrathecalCytotoxicChemotherapyPolicy201712.pdf (letzter Zugriff: 20. Februar 2018). Version 4; 7. Dezember 2017.
- National Cancer Control Programme: Guidance on the Safe Use of Intrathecal Chemotherapy in the Treatment of Cancer: https://www.hse.ie/eng/services/list/5/cancer/profinfo/medonc/safetyreview/itcguidance.pdf (letzter Zugriff: 20. Februar 2018). Oncology Medication Safety Review. Implementation Resources. Rec. 71 Intrathecal Policies. 2. Dezember 2016.
- Clinical Oncological Society of Australia: Guidelines for the Safe Prescribing, Dispensing and Administration of Cancer Chemotherapy: https://www.cosa.org.au/media/1093/cosa_guidelines_safeprescribingchemo2008.pdf (letzter Zugriff: 20. Februar 2018). November 2008.
- Arzneimittelkommission der deutschen Ärzteschaft: "Aus der UAW-Datenbank": Nebenwirkungen durch Medikationsfehler. Dtsch Arztebl 2016; 113: A 1948-1950.
