Finerenon (Kerendia®) ▼
Neue Arzneimittel
Dieser Artikel wurde am 7. Februar 2023 vorab online veröffentlicht.
Zugelassene Indikation und Wirkmechanismus
Finerenon ist ein nichtsteroidaler selektiver Antagonist des Mineralokortikoid-Rezeptors (MR). Dieser wird physiologisch durch Aldosteron und Cortisol aktiviert und reguliert unter anderem die Gentranskription. Durch Bindung von Finerenon an MR entsteht ein spezifischer Rezeptor-Ligand-Komplex, der die Rekrutierung transkriptioneller Koaktivatoren blockiert. Dies vermindert die Expression proinflammatorischer und profibrotischer Mediatoren. Finerenon ist zugelassen zur Behandlung der chronischen Nierenerkrankung (Stadium 3 und 4 mit Albuminurie) bei erwachsenen Patientinnen und Patienten mit Typ-2-Diabetes.
Markteinführung
Finerenon ist seit 01.10.2022 in dieser Indikation auf dem deutschen Markt.
Bewertung
Finerenon erwies sich in der Zulassungsstudie in der Behandlung der chronischen Nierenerkrankung (Stadium 3 und 4 mit Albuminurie) bei erwachsenen Typ-2-Diabetikern gegenüber Placebo als grundsätzlich wirksam. Allerdings fehlen Vergleiche zu alternativen Arzneimitteln wie Spironolacton.
Finerenon reduzierte den kombinierten primären Endpunkt (Progression der Nierenerkrankung) um absolut 3,4 %. Im sekundären, kombinierten Endpunkt (kardiovaskuläre Mortalität und Morbidität) reduzierte Finerenon das Risiko absolut um lediglich 1 %.
Eine häufige Nebenwirkung des Wirkstoffs ist Hyperkaliämie. Finerenon kann zur Verminderung der glomerulären Filtrationsrate (GFR) führen. Unter Finerenon müssen engmaschige Kontrollen des Serumkaliums sowie der GFR durchgeführt werden.
Die frühe Nutzenbewertung im Vergleich zu anderen aktuellen Therapien der Niereninsuffizienz steht aus. Dies betrifft insbesondere die SGLT-2(Sodium-Glucose-Transporter-2)-Inhibitoren. Es ist offen, ob Finerenon im Vergleich zu diesen, allein oder in Kombination, damit einen klinischen Vorteil bringt.
Wirksamkeit in den Zulassungsstudien
FIDELIO-DKD ist die multizentrische, randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie. Es wurden 5734 erwachsene Patientinnen und Patienten mit Diabetes mellitus Typ 2 und chronischer Niereninsuffizienz eingeschlossen. Initial erfolgte eine 4- bis 16-wöchige „Run-in“-Phase zur Optimierung der Begleittherapie. Danach wurden die Patienten 1:1 zu Finerenon- oder Placebo-Arm randomisiert. Die Dosis von Finerenon begann bei 10 mg täglich und wurde auf Basis der initial geschätzten GFR und in Abhängigkeit vom Serumkalium auf 20 mg einmal täglich titriert.
Der kombinierte primäre Endpunkt bestand aus Zeit bis zum Eintreten einer Niereninsuffizienz, Reduktion der eGFR auf 40 % des Initialwertes über mindestens vier Wochen, oder Tod aufgrund nephrogener Ursachen. Der sekundäre kombinierte Endpunkt bestand aus Zeit bis zum Tod aufgrund kardiovaskulärer Ursachen, nichttödlichem Herzinfarkt, nichttödlichem Schlaganfall oder Hospitalisierung wegen Herzversagens.
Insgesamt konnten Daten von 5674 Patientinnen und Patienten analysiert werden. Das mediane Alter betrug 66 Jahre. Es wurden 1691 (29,8 %) Frauen eingeschlossen.
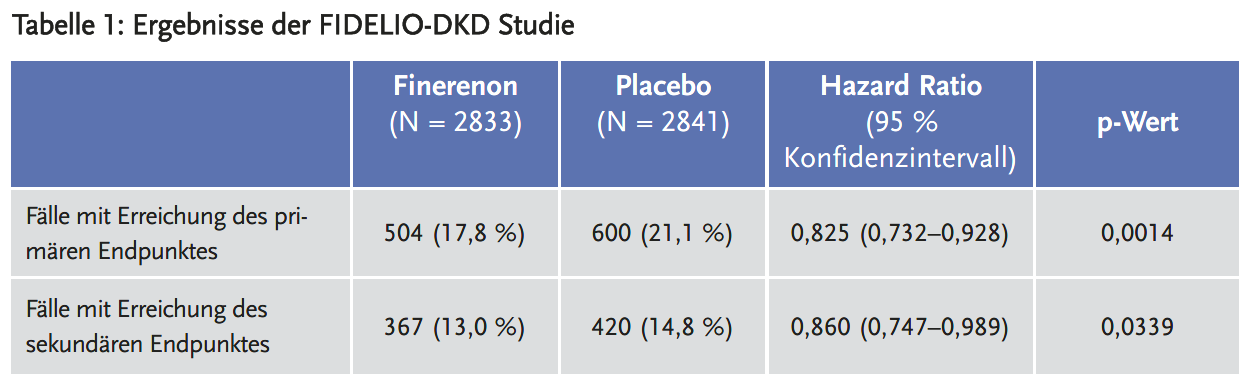
Keiner der Unterschiede der Einzelbestandteile der kombinierten Endpunkte erreichte statistische Signifikanz. Diese zeigte sich nur in den kombinierten primären und sekundären Endpunkten.
Darüber hinaus zeigte sich in den Subgruppenanalysen kein Benefit für Patienten aus Europa, Nord- und Südamerika, sondern nur für die aus Asien. Das stellt die Übertragbarkeit der Ergebnisse auf den deutschen Versorgungskontext infrage.
Ausgewählte Nebenwirkungen
Die häufigsten Nebenwirkungen waren Hyperkaliämie, Hyponatriämie, Hypotonie, Pruritus, Verminderung der GFR, Verminderung des Hämoglobins.
Ausgewählte Interaktionen
Finerenon soll nicht zusammen mit moderaten bis starken CYP3A4-Induktoren eingenommen werden. Grapefruit (Frucht und Saft) sollen während der Gabe von Finerenon nicht verzehrt werden. Kaliumsparende Diuretika sollten nicht gleichzeitig eingenommen werden. Auch die Gabe starker CYP3A4-Inhibitoren zusammen mit Finerenon ist kontraindiziert. Moderate/schwache CYP3A4-Inhibitoren sollten zusammen mit Finerenon zurückhaltend und unter Überwachung des Serumkaliums gegeben werden.
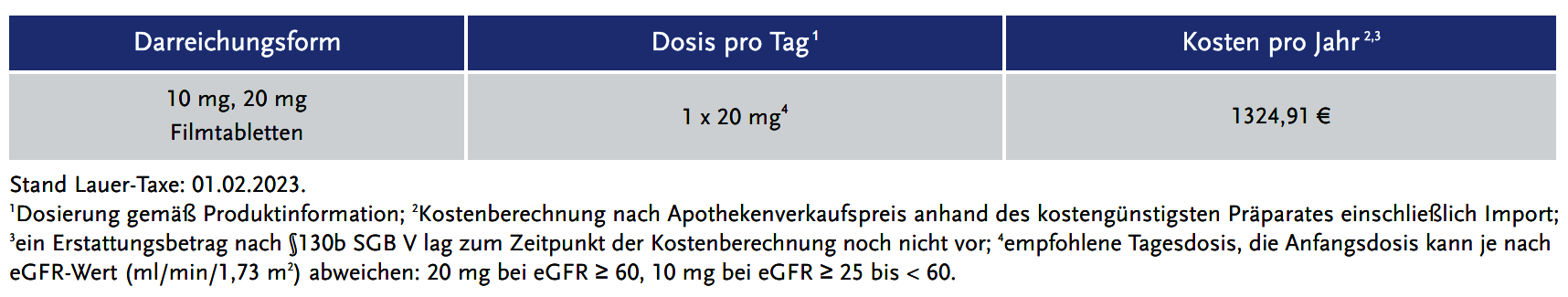
Dosierung und Kosten
Weiterführende Informationen
Die Bewertung des Zusatznutzens von Finerenon (Kerendia®) nach § 35a SGB durch den G-BA wurde bislang noch nicht vorgenommen. Sollte sich die AkdÄ mit einer Stellungnahme äußern, wird diese auf der AkdÄ-Website veröffentlicht.
Quelle: Europäischer Öffentlicher Beurteilungsbericht (EPAR) Kerendia®, erschienen am 11. März 2022. Die vorliegende Information erhebt keinen Anspruch auf Vollständigkeit. Für die Richtigkeit der angegebenen Dosierungen kann keine Gewähr übernommen werden.
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.
