Brolucizumab (Beovu®) ▼ – Indikationserweiterung
Neue Arzneimittel
(Dieser Artikel wurde am 20. Juli 2022 vorab online veröffentlicht.)
Zugelassene Indikation und Wirkmechanismus
Brolucizumab ist nach Ranibizumab und Aflibercept ein weiterer VEGF-Inhibitor, der im Rahmen einer Zulassungserweiterung bei Erwachsenen zur Behandlung einer Visusbeeinträchtigung infolge eines diabetischen Makulaödems (DMÖ) eingesetzt werden kann. Brolucizumab ist das Fragment der variablen Region (scFv) eines humanisierten monoklonalen Antikörpers. Es verhindert die Bindung von VEGF-A an dessen Rezeptoren VEGFR-1 und VEGFR-2. Durch die Hemmung der Bindung von VEGF-A unterdrückt Brolucizumab die Endothelzellproliferation, was zur Verringerung einer pathologischen Neovaskularisierung führt, die vaskuläre Permeabilität vermindert und somit die Entstehung eines Netzhautödems verhindert.
Markteinführung
Brolucizumab wurde zunächst für die Behandlung der neovaskulären (feuchten) altersabhängigen Makuladegeneration zugelassen und am 15.03.2020 in den deutschen Markt eingeführt.
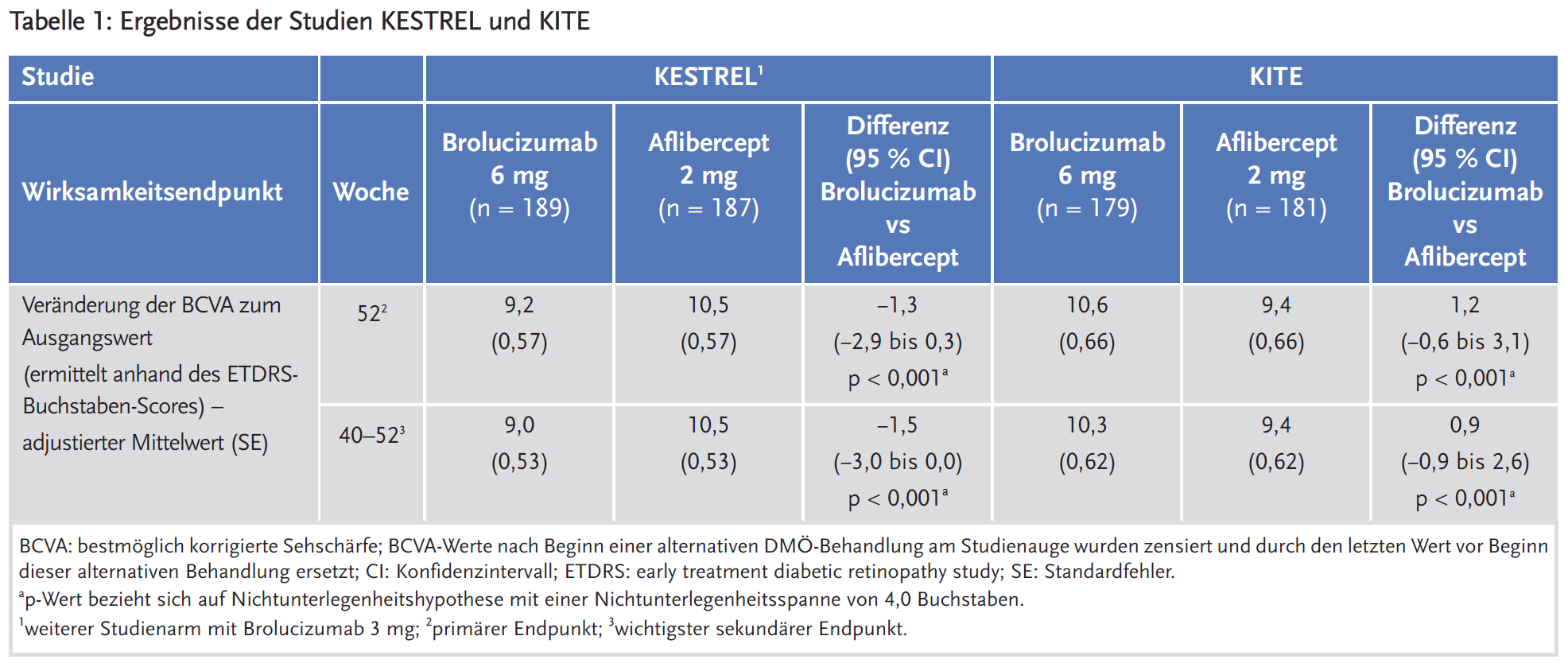
Bewertung
Brolucizumab zeigte in den Zulassungsstudien (KESTREL und KITE) für den primären Endpunkt Veränderung der BCVA nach Woche 52 in der Behandlung einer Visusbeeinträchtigung infolge eines diabetischen Makulaödems (DMÖ) eine Wirksamkeit, die der von Aflibercept nicht unterlegen war (siehe Tabelle 1).
Die am häufigsten berichtete Nebenwirkung unter der Behandlung mit Brolucizumab 6 mg war eine Bindehautblutung (5,7 %). Schwerwiegendste Nebenwirkungen waren intraokuläre Entzündungen (mit 2,7 % deutlich häufiger als unter Aflibercept (1,1 %)), retinale Vaskulitis (0,3 %) und retinaler Gefäßverschluss (0,5 %). Auf diese Risiken wird explizit in einem Rote-Hand-Brief zur Anwendung von Brolucizumab hingewiesen (1).
Kontraindikationen sind Überempfindlichkeit gegen den Wirkstoff oder sonstige Bestandteile des Fertigarzneimittels, Verdacht auf oder bestehende okuläre oder periokuläre Infektionen sowie bestehende intraokuläre Entzündungen.
Die Wirksamkeit und Sicherheit von Brolucizumab gegenüber dem anderen zugelassenen VEGF-Inhibitor Ranibizumab kann derzeit nicht beurteilt werden*, da ein direkter Vergleich fehlt.
Aufgrund der fehlenden Vergleichsdaten und der ebenfalls wie bei den anderen VEGF-Inhibitoren auftretenden schwerwiegenden Nebenwirkungen sowie der deutlich erhöhten Inzidenz von intraokulären Entzündungen sehen wir keine Vorteile für Brolucizumab bei der Anwendung zur Behandlung des DMÖ. Brolucizumab sollte daher nur bei Unverträglichkeit gegenüber den in ihrer Langzeitsicherheit besser untersuchten zugelassenen VEGF-Inhibitoren verordnet werden.
* Das ebenfalls in der Indikation DMÖ angewendete Bevacizumab ist für diese Indikation nicht zugelassen (Off-Label-Use).
Wirksamkeit in den Zulassungsstudien
Die Zulassung von Brolucizumab basiert auf den Ergebnissen von zwei randomisierten, doppelblinden Studien der Phase III (KESTREL, KITE) mit insgesamt 926 Patientinnen und Patienten.
Schulungsmaterial
Brolucizumab darf nur unter Verwendung von Schulungsmaterialien in den Verkehr gebracht werden. Das behördlich beauflagte und genehmigte Material dient dazu, die Wissensvermittlung zu optimieren und Hilfe bei der sicheren Anwendung des Arzneimittels zu geben. Es ist verfügbar auf der Website des PEI.
Dosierung und Kosten

Weiterführende Informationen
Nach der frühen Nutzenbewertung durch das IQWiG entscheidet der G-BA über den Zusatznutzen. Sollte sich die AkdÄ mit einer Stellungnahme äußern, wird diese auf der AkdÄ-Website veröffentlicht.
Quelle: Europäischer Öffentlicher Beurteilungsbericht (EPAR) Beovu®, erschienen am 24. Mai 2022. Die vorliegende Information erhebt keinen Anspruch auf Vollständigkeit. Für die Richtigkeit der angegebenen Dosierungen kann keine Gewähr übernommen werden.
Literatur
- Novartis Pharma GmbH: Rote-Hand-Brief: Beovu® (Brolucizumab): Aktualisierte Empfehlungen zur Verringerung des bekannten Risikos einer intraokularen Entzündung einschließlich retinaler Vaskulitis und/oder retinalem Gefäßverschluss: https://www.akdae.de/fileadmin/user_upload/akdae/Arzneimittelsicherheit/RHB/Archiv/2021/20211105.pdf (letzter Zugriff: 13. Juli 2022). Rote-Hand-Brief vom November 2021.
