Eine seltene Komplikation bei einem häufig verordneten Medikament: Junge Patientin mit einem Basaliom unter Infliximab-Therapie
Unerwünschte Arzneimittelwirkungen
(Nachdruck aus dem Hessischen Ärzteblatt 05/2022, S. 310, frei abrufbar unter www.laekh.de)
Einleitung
Die Colitis ulcerosa ist die häufigste gastroenterologische Erkrankung weltweit (1). Bei einer hohen Inzidenz im westeuropäischen Raum sind derzeit ca. zwei Millionen Menschen mit einer Colitis ulcerosa diagnostiziert (2). Die epidemiologische Verteilung der Krankheit zeigt den größten Peak im Alter von 15–30 Jahren (3). Junge Patienten leiden durch Alltagseinschränkungen besonders unter den typischen Symptomen der Colitis ulcerosa. Studien zeigten unter den Einschränkungen im Alltag der Betroffenen eine subjektiv deutlich verringerte Lebensqualität (4) durch verminderte Energie zur Alltagsbewältigung, soziale Isolation und deutliche Überforderung im Umgang mit der Erkrankung nach Erstdiagnose (5;6).
Nach aktueller AWMF-Leitlinie zur Therapie zählt der Einsatz von Infliximab als TNFα-Blocker zur ersten Wahl bei schwerer oder fulminanter Colitis ulcerosa und Kontraindikationen für Steroidtherapien (7). Dies gilt als optimales Medikament für ein Patientenklientel, welches durch das junge Alter und die alltagseinschränkende Erkrankung eine besonders wirksame, nebenwirkungsarme und schnelle Therapie benötigt (8).
Der monoklonale Antikörper bindet sowohl an den löslichen als auch an den transmembranär gelegenen Tumornekrose-Faktor α an. Dieser spielt eine wichtige Rolle als proinflammatorisches Zytokin zur Dysregulation einer mukosalen Immunreaktion und wird derart neutralisiert (9). Dieses Medikament scheint aufgrund seiner hochspezifischen Wirkweise für Patienten mit schweren Verläufen ein positives Nutzen-Risiko-Verhältnis zu haben. In der Regel handelt es sich um eine langfristige Anwendung.
Der präsentierte Fall mit einer weniger bekannten Nebenwirkung nach langfristiger Anwendung über 15 Jahre ist Anlass, diese Problematik vorzustellen.
Fallbeschreibung
Eine 30-jährige Patientin mit einem Hauttyp Typ 2 nach Fitzpatrick (helle Hautfarbe, blonde Haare, oft Sommersprossen) (10) und kaukasischer Herkunft stellte sich aufgrund einer neu aufgetretenem Hautveränderung mit einer rötlichen, größenprogredienten Hauteffloreszenz im Bereich der linken Wange in unserer Plastischen Sprechstunde vor. Nachdem über vier Monate zuvor keine Besserung bei Größenprogredienz eintrat, überwies der Hausarzt nach bioptischer Sicherung eines Basalioms mit einer R1-Situation die Patientin zur weiteren Behandlung in unsere Klinik.
Die klinische, jedoch für eine junge Patientin eher ungewöhnliche, Diagnose eines Basalioms gab Anlass für eine ausführliche Anamneseerhebung. Bakos et al. beschrieben die Inzidenz des Basalzellkarzinoms bei Patienten unter 40 Jahren mit Hautveränderungen unter 1,4 % (11). Aufgrund dieser niedrigen Inzidenz für das Auftreten sollte in dem vorliegenden Fall ein theoretischer Zusammenhang zwischen der Langzeiteinnahme des TNF-α-Blockers und der Entstehung des Basalioms hergestellt werden. Als Nebenerkrankungen gab die Patientin lediglich eine Colitis ulcerosa an, welche in dieser Altersgruppe nicht selten ist. Sie hatte keine regelmäßige oder intensive UV-Lichtexposition, jedoch sei bei der Großmutter der Patientin ein Basaliom im hohen Alter bioptisch gesichert und chirurgisch exzidiert worden. Als Dauermedikation und Therapie der entzündlichen Darmerkrankung, nehme die Patientin nur Infliximab seit 15 Jahren regelmäßig ein.
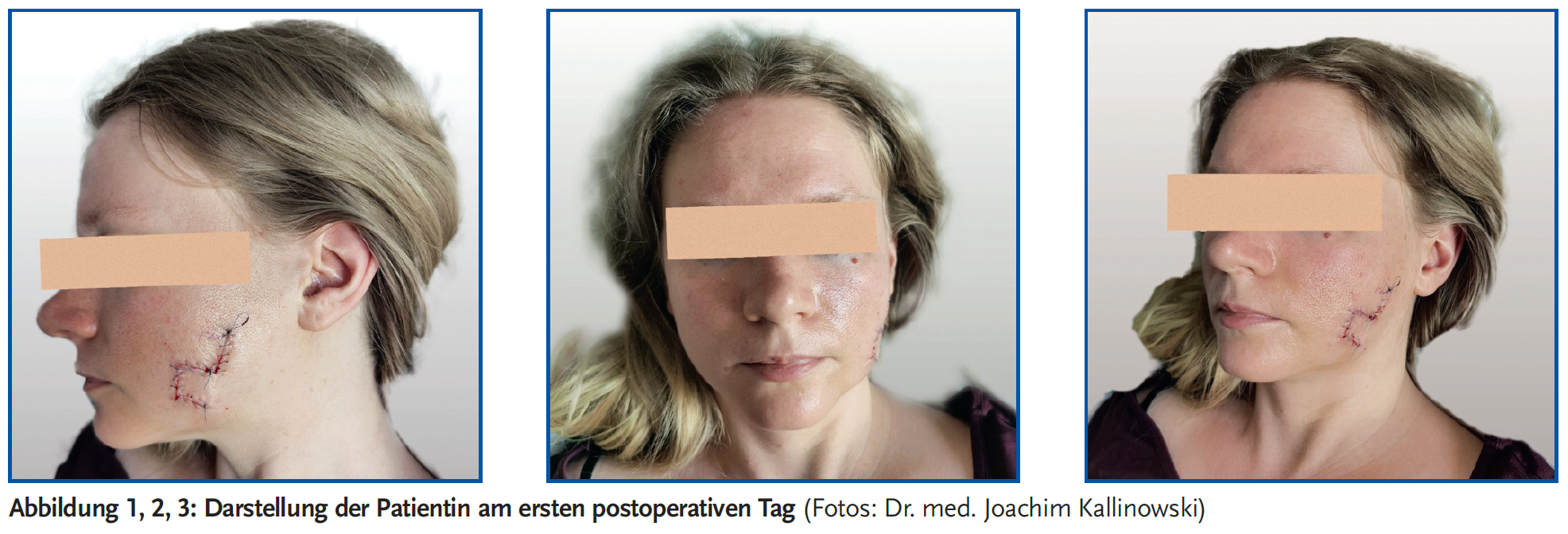
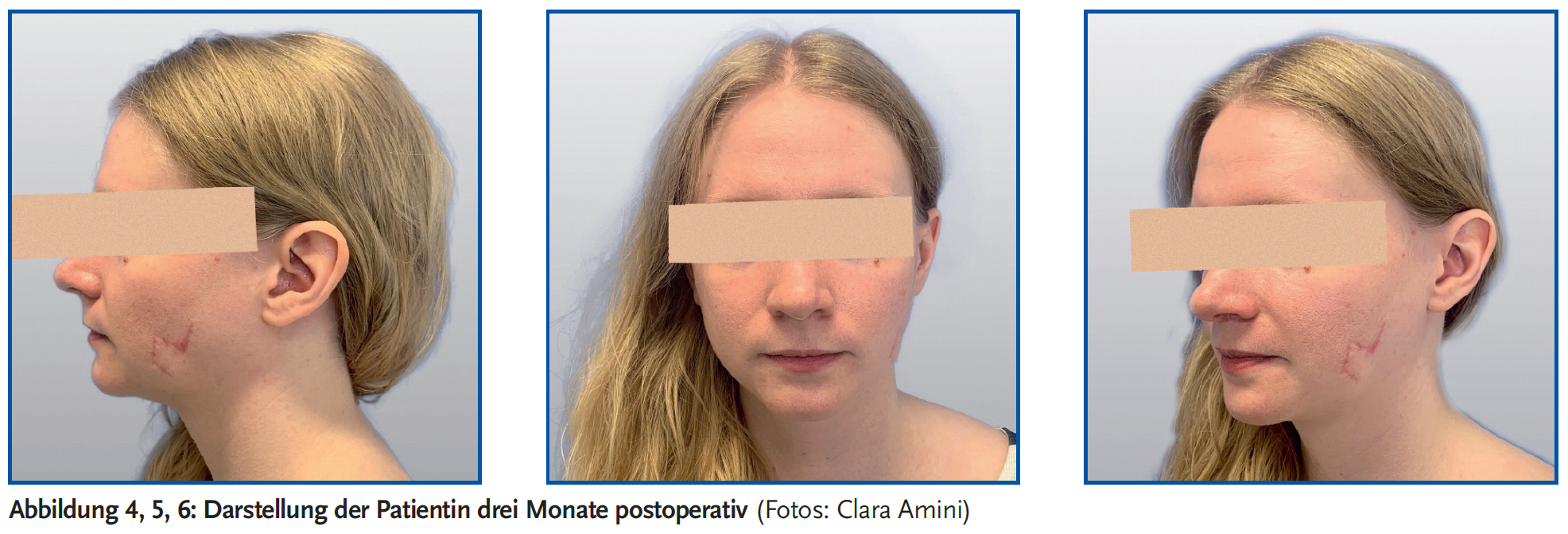
Es erfolgte eine operative Therapie aufgrund der sichtbaren Lokalisation im Gesicht der jungen Patientin nach den Prinzipien der Mohs-Chirurgie (12) zweizeitig mit primärer Exzision und temporärer alloplastischer Deckung des Defektes mit einer Ausdehnung von ca. 2 x 2 cm. Mikroskopisch zeigte sich eine infiltrativ wachsende Läsion bestehend aus basaloid differenzierten Zellkomplexen mit peritumoralem Retraktionsphänomen und peripherer Palisadenstellung der Zellkerne. Die pathologische Untersuchung bestätigte die Diagnose eines nodulären Basalioms mit R0-Situation und den für ein low grade ausreichenden Sicherheitsabstand von 3 mm allseits bei einer max. Infiltrationstiefe von 1 mm. Zur Deckung des in einer ästhetisch anspruchsvollen Region gelegenen Defektes mit möglichst unauffälligem Narbenverlauf ohne Asymmetrie mit Wahrung der ästhetischen Einheiten bei einer jungen Frau entschieden wir uns für einen Transpositionslappen nach Limberg mit hauptsächlicher Lage der Narben in den „relaxed skin tension lines“ (Abb. 1–3). Letztere sind für eine möglichst günstige Narbenentwicklung wesentlich. Der Heilungsverlauf gestaltete sich unauffällig. Abb. 4–6 zeigen das Ergebnis drei Monate postoperativ.

Diskussion
Das Medikament Infliximab wird seit einigen Jahren zur Therapie der Colitis ulcerosa, gerade bei jüngeren Patienten eingesetzt, und stellt aus gastroenterologischer Sicht eine unglaubliche Bereicherung für die Therapie von Patienten mit chronisch entzündlichen Darmerkrankungen dar (13).
Die Datenlage zur Hautkrebsentstehung bei Patienten unter Infliximab ist rar. Genauere Aussagen zur Entstehung von Basaliomen unter diesem Medikament liegen bislang nicht evidenzbasiert vor.
Mehrere TNF-α-Blocker sind für eine hypersensitive Reaktion im Sinne von Flush, Blutdruckveränderungen, Fieber oder Dyspnoe auf die intravenöse Gabe des Antikörpers bekannt. Die meisten Reaktionen gelten hierbei als mild oder moderat (14). Weiterhin gilt für sämtliche TNF-α-Blocker ein erhöhtes Risiko für pulmonale Infektionen (15). Selbst seltene Nebenwirkungen wie die Bildung von Antinukleären Antikörpern (ANA) und somit die Entwicklung von Lupus ähnlicher Symptomatik (16) sind in der gegenwärtigen Literatur gelistet. Neben weiteren möglichen Nebenwirkungen ist auch ein erhöhtes Risiko für maligne Entartungen vieler Zellarten zu berücksichtigen. Eine fallbezogene Übersicht möglicher Komplikationen ist in Tab. 1 zu sehen. Studien berichten über ein erhöhtes Risiko bei Psoriasis-Patienten für die Entwicklung von jeglichen Krebsarten inklusive Hautkrebs (17). Einige Studien beschreiben ein erhöhtes Risiko für maligne Entartungen schon im Rahmen einer Kurzzeitgabe (unter zwölf Monaten) von TNFα-Inhibitoren (15), während andere Studien ein erhöhtes Risiko erst in der Langzeitgabe (mehr als zwölf Monate) sehen (18). Psoriasis-Patienten leiden allgemein unter einem erhöhten Risiko, an einem Hautkrebs zu erkranken (19). Sicherlich haben Patienten, welche zusätzlich eine systemische Therapie mit monoklonalen Antikörpern oder Fototherapie erhalten, ein noch weiter erhöhtes Risiko (20). Diese Studienlage basiert jedoch ausschließlich auf Patienten mit Psoriasis. Besonders bei dieser Patientenkohorte von Psoriasis-Patienten wird von einer erhöhten Wahrscheinlichkeit für die Entstehung von Hautkrebs unter der Therapie mit Infliximab ausgegangen. Daher sehen Leitlinien eine ausführliche Anamneseerhebung als essenziell. Bei erhöhtem familiären Risiko oder einer malignen Vorerkrankung sollte eine Therapie mit einem TNFα-Antagonisten nur mit besonderem Bedacht begonnen werden (21).
Anhand der derzeitigen Studienlage kann daher nicht mit Sicherheit ein Rückschluss auf ein erhöhtes Risiko für die Entstehung von malignen Hauttumoren von Psoriasis-Patienten auf Patienten mit Colitis ulcerosa gezogen werden. In unserem vorgestellten Fall der jungen Patienten zeigt sich eine positive Familienanamnese für Hautkrebs. Einen entsprechenden Hinweis zur Risikoabwägung bei Patienten mit positiver Familienanamnese hinsichtlich maligner Hauterkrankungen und Colitis ulcerosa zur Infliximab-Therapie gibt es derzeit nicht. Die Studienlage zu spezifischen Risiken für die Entwicklung eines Hautkrebses unter Infliximab, besonders bei Colitis ulcerosa Patienten, ist derzeit gering.
Die Anforderungen an die Aufklärungspflicht über mögliche Nebenwirkungen einer medikamentösen Therapie sind hoch. Das Risiko einer erhöhten Hautkrebsinzidenz bei längerfristiger Medikation und sinnvolle Präventivmaßnahmen wie verstärkter UV-Schutz sollten hierbei berücksichtigt werden.
Zusammenfassung
Anhand der Kasuistik einer 30-jährigen Patientin mit einer Colitis ulcerosa wird das Auftreten eines Basalioms unter langjähriger Infliximab-Therapie beschrieben. Die Aufklärung hinsichtlich eines erhöhten Risikos für die Entwicklung eines Hautkrebses und präventive Maßnahmen sollten wie im vorliegenden Fall insbesondere bei Patienten mit positiver Familienanamnese vor Therapieeinleitung mit Infliximab erfolgen.
Literatur
- Bressler, B., et al., Clinical practice guidelines for the medical manage- ment of nonhospitalized ulcerative colitis: the Toronto consensus. Gas- troenterology, 2015. 148(5): p. 1035–1058 e3.
- Biancone, L., et al., European evi- dence-based Consensus on the ma- nagement of ulcerative colitis: Speci- al situations. J Crohns Colitis, 2008. 2(1): p. 63–92.
- .Loftus, E.V., Jr. and W.J. Sandborn, Epidemiology of inflammatory bo- wel disease. Gastroenterol Clin North Am, 2002. 31(1): p. 1–20.
- Petrak, F., et al., Impaired health-re- lated quality of life in inflammatory bowel diseases: psychosocial impact and coping styles in a national Ger- man sample. Scand J Gastroenterol, 2001. 36(4): p. 375–382.
- Casati, J., et al., Concerns of patients with inflammatory bowel disease: a review of emerging themes. Dig Dis Sci, 2000. 45(1): p. 26–31.
- Stjernman, H., et al., Worries and concerns in a large unselected co- hort of patients with Crohn‘s disea- se. Scand J Gastroenterol, 2010. 45(6): p. 696–706.
- Authors and Collaborators, [Up- dated S3-Guideline Colitis ulcerosa. German Society for Digestive and Metabolic Diseases (DGVS) – AWMF Registry 021/009]. Z Gastroenterol, 2018. 56(9): p. 1087–1169.
- Peyrin-Biroulet, L., et al., Selecting Therapeutic Targets in Inflammato- ry Bowel Disease (STRIDE): Deter- mining Therapeutic Goals for Treat- to-Target. Am J Gastroenterol, 2015. 110(9): p. 1324–1338.
- Hemperly, A. and N. Vande Casteele, Clinical Pharmacokinetics and Phar- macodynamics of Infliximab in the Treatment of Inflammatory Bowel Disease. Clin Pharmacokinet, 2018. 57(8): p. 929–942.
- Gupta, V. and V.K. Sharma, Skin typing: Fitzpatrick grading and ot- hers. Clin Dermatol, 2019. 37(5): p. 430–436.
- Bakos, R.M., et al., Risk factors for early-onset basal cell carcinoma in a German institution. Eur J Dermatol, 2011. 21(5): p. 705–709.
- Mansouri, B., et al., Mohs Microgra- phic Surgery for the Management of Cutaneous Malignancies. Facial Plast Surg Clin North Am, 2017. 25(3): p. 291–301.
- Ilias, A., et al., Biosimilars in ulcerati- ve colitis: When and for who? Best Pract Res Clin Gastroenterol, 2018. 32–33: p. 35–42.
- Cheifetz, A., et al., The incidence and management of infusion reactions to infliximab: a large center experience. Am J Gastroenterol, 2003. 98(6): p. 1315–1324.
- Dommasch, E.D., et al., The risk of infection and malignancy with tumor necrosis factor antagonists in adults with psoriatic disease: a systematic review and meta-analysis of rando- mized controlled trials. J Am Acad Dermatol, 2011. 64(6): p. 1035–1050.
- Dogra, S. and G. Khullar, Tumor ne- crosis factor-alpha antagonists: Side effects and their management. Indi- an J Dermatol Venereol Leprol, 2013. 79 Suppl 7: p. S35–546.
- Patel, R.V., et al., Treatments for pso- riasis and the risk of malignancy. J Am Acad Dermatol, 2009. 60(6): p. 1001–1017.
- Fiorentino, D., et al., Risk of mali- gnancy with systemic psoriasis treat- ment in the Psoriasis Longitudinal Assessment Registry. J Am Acad Der- matol, 2017. 77(5): p. 845–854 e5.
- Chiesa Fuxench, Z.C., et al., The Risk of Cancer in Patients With Psoriasis: A Population-Based Cohort Study in the Health Improvement Network. JAMA Dermatol, 2016. 152(3): p. 282–290.
- Pouplard, C., et al., Risk of cancer in psoriasis: a systematic review and meta-analysis of epidemiological studies. J Eur Acad Dermatol Venere- ol, 2013. 27 Suppl 3: p. 36–46.
- Smith, C.H., et al., British Association of Dermatologists guidelines for bio- logic therapy for psoriasis 2017. Br J Dermatol, 2017. 177(3): p. 628–636.
Information der AkdÄ: Meldungen zu Basiliomen unter Infliximab
In der EudraVigilance-Datenbank gemeldeter Verdachtsfälle von Arzneimittelnebenwirkungen (https://www.adrreports.eu/de/index.html) finden sich zum 31.08.2022 folgende Meldungen zu Nebenwirkungen unter Infliximab wieder: Basalzellkarzinom: 695 Meldungen; basosquamöses Basalzellkarzinom: 4 Meldungen; basosquamöses Basalzellkarzinom der Haut: eine Meldung.
Grundsätzlich lassen diese Zahlen keine Aussage über die tatsächliche Inzidenz der jeweiligen Nebenwirkung zu. Diese Meldungen sind keine bestätigten Nebenwirkungen und kein Beweis dafür, dass eine Reaktion tatsächlich aufgrund des Arzneimittels aufgetreten ist. Es muss zudem berücksichtigt werden, dass es sich nicht um einzelne Patientenfälle handelt, sondern um gemeldete mögliche Nebenwirkungen. Zu einem Patienten können dabei mehrere Reaktionen (z. B. Basalzellkarzinom und basosquamöses Basalzellkarzinom der Haut) gemeldet worden sein. Auch ist es ohne eine vertiefende Analyse unklar, ob in allen gemeldeten Fällen ein zumindest theoretisch möglicher (zeitlicher) Zusammenhang mit Infliximab bestand.
