Herpes zoster nach COVID-19-Impfung
Unerwünschte Arzneimittelwirkungen
(Dieser Artikel wurde am 13. September 2022 vorab online veröffentlicht.)
Herpes zoster
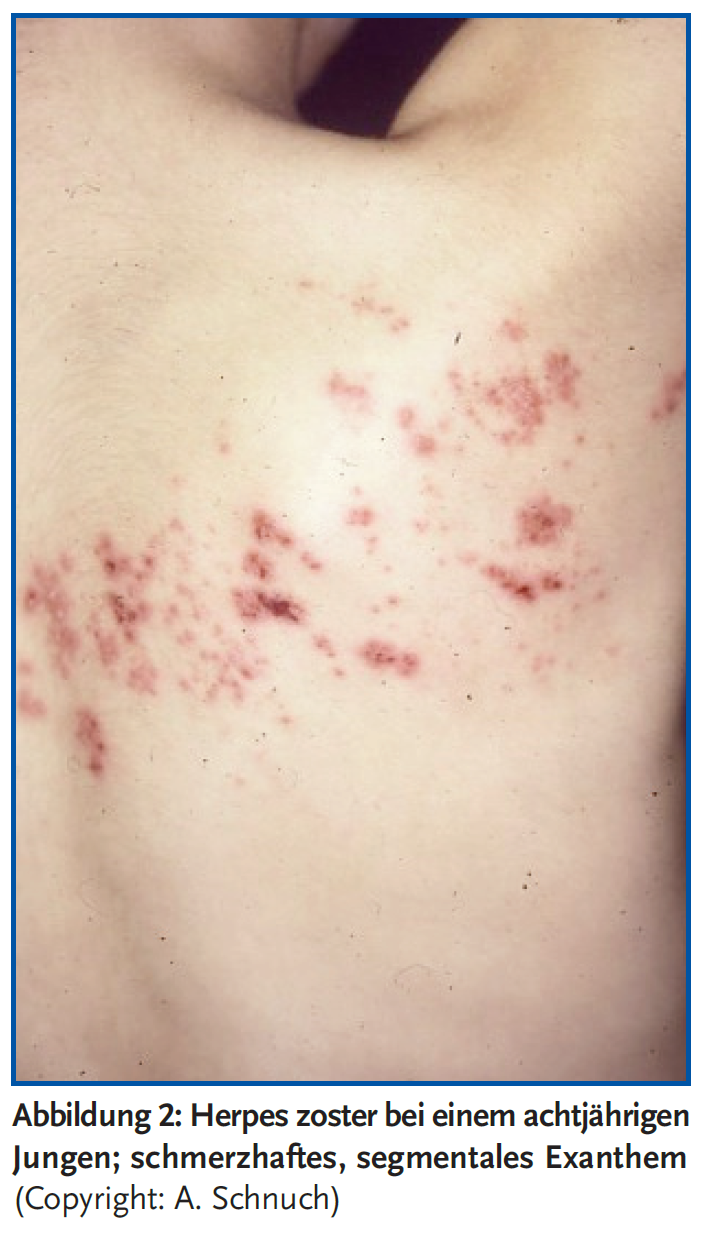
Herpes zoster (HZ) (1) ist klinisch charakterisiert durch die Symptomen-Trias: a) die Hauteffloreszenz „Herpes“, d. h. gruppiert angeordnete Bläschen auf gerötetem Grund (Abbildung 1), b) die in der Regel einseitige Verteilung über ein von einem Nerv versorgten Hautareal (Dermatom) (Abbildung 2), c) Schmerzen, die dem Nervenverlauf im betroffenen Dermatom zuzuordnen sind. Ursächlich ist eine Reaktivierung des Varizella-Zoster-Virus (VZV, Humanes Herpes Virus 3), das im Zuge einer Primärinfektion (Varizellen/Windpocken) verschiedene Ganglien des Rückenmarks oder der Hirnnerven befällt.
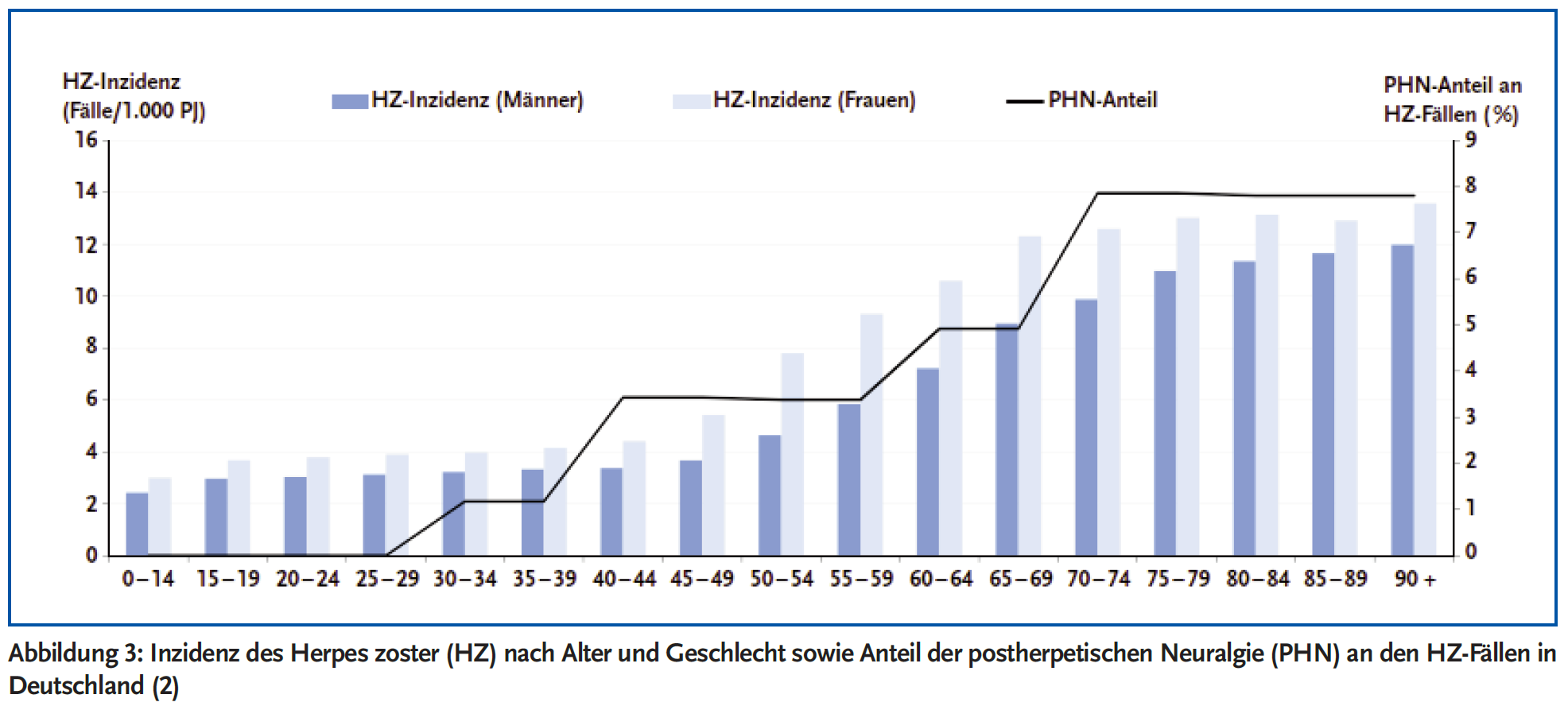
Die Reaktivierung wird gefördert durch eine Beeinträchtigung der zellulären Immunität, in fortgeschrittenem Alter, bei Immunsupression unterschiedlicher Genese oder bei verschiedenen Komorbiditäten, z. B. rheumatoide Arthritis oder Diabetes mellitus. So ist die Inzidenz von HZ altersabhängig und steigt ab Lebensalter (LA) > 50 Jahre deutlich an (Abbildung 3 (2)). In einem Review wurden Inzidenzraten in der Allgemeinbevölkerung Europas mit LA > 50 Jahre im Bereich 5,23–10,9 per 1000 Personenjahre genannt, mit generell höheren Inzidenzen bei Frauen (3). Epidemiologische Studien in jüngerem LA (< 45 Jahre) zeigen niedrigere Inzidenzen: In den Altersgruppen < 40 Jahre lagen die Inzidenzen in Deutschland zwischen 3,04 und 3,5/1000/Jahr und in der Altersgruppe 40–49 Jahre bei 4,13 (4).
Das Paul-Ehrlich-Institut führte im Dezember 2021 im Rahmen des Sicherheitsberichts zu COVID-19-Impfstoffen eine Observed-versus-Expected-Analyse zu Herpes zoster (HZ) unter den COVID-19-Impfstoffen. Berücksichtigt wurden die Meldungen bis zum 30. November 2021 unter den vier damals verfügbaren Impfstoffen: Comirnaty®, JCOVDEN® COVID-19 Vaccine Janssen, Spikevax® und Vaxzevria®. Die berichtete Anzahl von HZ nach 14, 30 und 42 Tagen nach dem Impfen war niedriger als auf Basis der verwendeten Hintergrundrate statistisch zufällig zu erwarten wäre. Informationen dazu: www.pei.de/DE/newsroom/dossier/coronavirus/coronavirus-inhalt.html;jsessionid=7A8EAB9780EF1A8DEEF13EDBD722AC83.intranet242.
COVID-19 und Herpes zoster
Mit dem pandemischen Auftreten von COVID-19 und den COVID-19-Impfungen wurde das Spektrum der Herpes-zoster-assoziierten, möglicherweise ätiologischen Faktoren erweitert (5;6).
In einer retrospektiven Kohortenstudie untersuchten Bhavsar et al. das Risiko für die Entwicklung eines HZ nach COVID-19-Diagnosestellung. Dazu wurden Datensätze von 394.677 Personen ≥ 50 Jahre mit einer COVID-19-Diagnose in die Analyse eingeschlossen. Diesen gegenübergestellt – und dabei unter Einschluss zahlreicher Faktoren exakt gematcht − wurden 1.577.346 Personen im selben Alter, die nicht an COVID-19 erkrankt waren. Die Daten stammten aus mehreren Datenbanken US-amerikanischer Krankenversicherer mit insgesamt mehr als 127 Mio. Versicherten. Personen mit einer COVID-19-Diagnose hatten ein 15 % höheres Risiko als Personen ohne COVID-19 (adjusted incidence rate ratio (aIRR): 1,15; 95 % Konfidenzintervall [CI] 1,07–1,24; p < 0,001). Das Risiko war noch höher (21 %) bei den hospitalisierten Patienten (5).
Barda et al. analysierten die Daten der Clalit Health Services (CHS) in Israel in Bezug auf eine Reihe potenzieller Nebenwirkungen durch Tozinameran (BNT162b2). Ausgehend von 3.455.926 Teilnehmern (CHS-Mitglieder) wurden schließlich 884.828 Geimpfte und 884.828 gematchte Kontrollen (Nichtgeimpfte) verglichen. Für eine HZ-Infektion ergab sich eine signifikante Risikoerhöhung (Risk Ratio (RR), 1,43; 95 % CI 1,20–1,73), wohingegen die COVID-19-Erkrankung selbst in dieser Analyse nicht mit einem erhöhten HZ-Risiko assoziiert war. Es sei angemerkt, dass die Risikoerhöhung durch die Impfung für Myokarditis am ausgeprägtesten war (RR 3,24; 95 % CI 1,55–12,44) – es sei aber auch betont, dass das Risiko durch die Erkrankung selbst (COVID-19) sogar noch höher war (RR 18,28; 95 % CI 3,95–25,12) (6).
Wan et al. berichten über die Ergebnisse einer Fall-Kontroll-Studie aus Hongkong, die die HZ-Hospitalisierung nach Impfung mit dem chinesischen CoronaVac und dem Biontech-Präparat Tozinameran (BNT162b2) untersuchte (7). 545 Patienten waren wegen HZ hospitalisiert, unter ihnen waren 44 mit CoronaVac und 47 mit Tozinameran (BNT162b2) geimpft. In der „self-controlled case series study“ waren die Risiken für eine Hospitalisierung wegen HZ signifikant erhöht (hier wiedergegeben für Tozinameran (BNT162b2): Die aIRR lag zwischen 5,14 und 5,82, jeweils in Abhängigkeit vom Zeitpunkt des Auftretens. In die „nested-case-control-study“ gingen 554 Fälle und 4944 gematchte Kontrollen ein. 27 Fälle und 126 Kontrollen waren mit Tozinameran geimpft. Diese Impfung war signifikant mit einem erhöhten Risiko für eine HZ-Hospitalisierung nach der ersten Impfung assoziiert (adjusted Odds Ratio (OR): 2,60 (0−13 Tage), 3,93 (14−27 Tage)), nicht jedoch nach der zweiten Impfung. Auf der Basis der relativen Raten (mit ähnlichen Ergebnissen für die „nested-case control-study“) schätzten die Autoren für die Tozinameran(BNT162b2)-Impfung einen Exzess von sieben Hospitalisierungsfällen pro einer Million Impfdosen. Die Schlussfolgerung war: Zwar wurde ein signifikant erhöhtes Risiko für eine HZ-Hospitalisierung durch die Impfung identifiziert, das absolute Risiko wurde aber als sehr gering eingestuft. Der protektive Effekt der Impfung würde im Vergleich zur Nebenwirkung deutlich überwiegen.
Neben solchen umfangreichen Studien gibt es eine Reihe von Kasuistiken, die über das Auftreten von HZ nach COVID-19-Impfungen (verschiedene Präparate) berichten, die Komorbiditäten (Hypertonie, Autoimmunerkrankungen, Immunsupression) erfassten (8) oder die Verteilung der Dermatome bei COVID-19-Vakzin-assoziiertem HZ (kein Unterschied) (9)). Diese Kasuistiken, wie aber auch die umfangreichen Statistiken (zitiert bei (1)) ([European EudraVigilance Database, United States Vaccine Adverse Event Report System (VAERS) oder in Deutschland RKI) erlauben jedoch keinen Schluss hinsichtlich der kausalen Rolle der Impfung bei der HZ-Entstehung.
Gleichwohl können die Kasuistiken Besonderheiten aufdecken, insofern, als sich die Vakzin-assoziierten HZ-Fälle offenbar in Bezug auf die Altersverteilung von der HZ-Allgemeinbevölkerung unterscheiden.
Auch Patienten jüngeren Alters (< 50 Jahre) waren betroffen. Von einem ausgesprochen jungen Alter (oft < 30 Jahre) der HZ-Fälle wurde berichtet (10-13). Patienten mit COVID-19-Impfung-assoziiertem HZ (n = 35) wiesen einen LA-Median von 46 Jahren (35–68) auf (14), und waren damit deutlich jünger als die nicht geimpfte HZ-Population (vgl. Abbildung 3). Català et al. betonen, dass besonders der Anteil von COVID-19-geimpften HZ-Patienten ohne Komorbidität und LA < 50 Jahren mit fast 30 % auffallend hoch sei (15). Und Preta et al. merken an, dass die 7728 Vakzin-assoziierten HZ-Fälle in einem großen Register (Vigibase) „jünger“ seien als die HZ-Fälle der Allgemeinbevölkerung, und vermuten eine „spezifische Pathophysiologie“ (16).
Fazit für die Praxis
Zum Risiko eines HZ nach Impfung gegen COVID-19 liegen unterschiedliche Daten vor. Ergebnisse von zwei retrospektiven Untersuchungen in Hongkong und Israel weisen darauf hin, dass das relative Risiko zwar erhöht, das absolute Risiko jedoch sehr gering ist. Fallberichte und Registerdaten zu HZ nach Impfung gegen COVID-19 deuten darauf hin, dass im Vergleich zu ungeimpften HZ-Patienten jüngere Menschen betroffen sein könnten. Auswertungen des PEI ergaben für Deutschland kein Signal, dass HZ nach Impfung gegen COVID-19 vermehrt auftritt, möglicherweise aufgrund der Empfehlung der Ständigen Impfkommission (STIKO) für eine Impfung gegen HZ bei älteren Menschen und Risikopatienten. Weitere Untersuchungen beispielsweise zu möglichen Pathomechanismen sind für eine abschließende Bewertung notwendig.
Literatur
- Patil A, Goldust M, Wollina U: Herpes zoster: a review of clinical manifestations and management. Viruses 2022; 14: 192.
- Mitteilung der Ständigen Impfkommission (STIKO) beim RKI: Wissenschaftliche Begründung zur Empfehlung einer Impfung mit dem Herpes zoster-subunit-Totimpfstoff. Epidemiologisches Bulletin 2018; Nr. 50: 541-567.
- van Oorschot D, Vroling H; Bunge E et al.: Systematic literature review of herpes zoster incidence worldwide. Hum Vaccines Immunother 2021; 17: 1714-1732.
- Ultsch B, Köster I, Reinhold T et al.: Epidemiology and cost of herpes zoster and postherpetic neuralgia in Germany. Eur J Health Econ 2013; 14: 1015-1026.
- Bhavsar A, Lonnet G, Wang C et al.: Increased risk of herpes zoster in adults ≥50 years old diagnosed with COVID-19 in the United States. Open Forum Infect Dis 2022; 9: ofac118.
- Barda N, Dagan N, Ben-Shlomo Y. et al.: Safety of the BNT162b2 mRNA Covid-19 vaccine in a nationwide setting. N Engl J Med 2021; 385: 1078-1090.
- Wan EYF, Chiu CSL, Wang Y et al.: Herpes zoster related hospitalization after inactivated (CoronaVac) and mRNA (BNT162b2) SARS-CoV-2 vaccination: a self-controlled case series and nested case-control study. Lancet Reg Health West Pac 2022; 21: 100393.
- Triantafyllidis KK, Giannos P, Mian IT et al.: Varicella Zoster Virus reactivation following COVID-19 vaccination: a systematic review of case reports. Vaccines 2021, 9: 1013.
- Iwanaga J, Fukuoka H, Fukuoka N et al.: A narrative review and clinical anatomy of Herpes zoster infection following COVID-19 vaccination. Clin Anat 2021; 35: 45-51.
- Lebedeva V, Müller C, Dissemond J: Mehrsegmentaler Zoster eines gesunden 20-Jährigen nach COVID-19-Impfung. Hautarzt 2022; 73: 220-221.
- Rodríguez-Jiménez P, Chicharro P, Cabrera L-M et al.: Varicella-zoster virus reactivation after SARS-CoV-2 BNT162b2 mRNA vaccination: report of 5 cases. JAAD Case Rep 2021; 12: 58-59.
- Özdemir AK, Kayhan S, Cakmak, SK: Herpes zoster after inactivated SARS-CoV-2 vaccine in two healthy young adults. J Eur Acad Dermatol Venereol 2021; 35: e846-e847.
- van Dam CS, Lede I, Schaar et al.: Herpes zoster after COVID vaccination. Int J Infect Dis 2021; 111: 169-171.
- Fathy RA, McMahon DE, Lee C et al.: Varicella-zoster and herpes simplex virus reactivation post-COVID-19 vaccination: a review of 40 cases in an International Dermatology Registry. J Eur Acad Dermatol Venereol 2022; 36: e6-e9.
- Català A, Munoz-Santos C, Galvan-Casas C et al.: Cutaneous reactions after SARS-CoV-2 vaccination: a cross-sectional Spanish nationwide study of 405 cases. Br J Dermatol 2022; 186: 142-152.
- Préta L-H, Contejean A, Salvo F et al.: Association study between herpes zoster reporting and mRNA COVID-19 vaccines (BNT162b2 and mRNA-1273). Br J Clin Pharmacol 2022; 88: 3519-3534.
Interessenkonflikte
Der Autor erklärt, keine Interessenkonflikte zu haben.