Adieu „-mab“! Neue Namen für die monoklonalen Antikörper
Das aktuelle Thema
(Dieser Artikel wurde am 13. September 2022 vorab online veröffentlicht.)
Über drei Jahrzehnte lang haben wir sie an ihrer Endung „-mab“ erkannt: die monoklonalen Antikörper (engl. monoclonal antibodies, kurz mAbs). Damit soll ab dem nächsten Jahr Schluss sein, da die Weltgesundheitsorganisation (WHO) eine neue Nomenklatur für diese Arzneistoffe beschlossen hat (1).
Monoklonale Antikörper
Monoklonale Antikörper sind Antikörper, die von einer Zelllinie („Zellklon“) hergestellt werden, die auf einen einzigen B-Lymphozyten zurückgeht. Die Herstellung erfolgt mit der Hybridom-Technik, bei der B-Lymphozyten, die den gewünschten Antikörper produzieren mit Myelomzellen fusioniert werden, um kultiviert und vermehrt werden zu können. Für die Entwicklung dieser Technik wurde César Milstein, Georges Köhler und Niels Jerne 1984 der Nobelpreis für Physiologie oder Medizin verliehen (2).
Heute beruhen viele diagnostische Verfahren auf der Verwendung von Antikörpern, z. B. Radioimmunoassays und ELISA oder immunhistochemischen Verfahren in der Pathologie. Zudem werden monoklonale Antikörper auch in der In-vivo-Diagnostik verwendet. Das größte Anwendungsfeld monoklonaler Antikörper ist aber die Therapie von Erkrankungen, da diese Antikörper im menschlichen Organismus sehr spezifisch (an) bestimmte Zielmoleküle binden und dadurch ihre pharmakologische Wirkung gezielt entwickeln (2).
Nomenklatur der monoklonalen Antikörper
Mit der Gründung der INN Expert Group bei der WHO im Jahr 1953 wurde das System der internationalen Freinamen für neue Wirkstoffe implementiert. Der International Nonproprietary Name (INN) ist ein weltweit eindeutig mit der Struktur eines Wirkstoffs verknüpfter Name. Der INN soll in allen Sprachen leicht auszusprechen und deutlich von anderen INN und Markennamen abgrenzbar sein. Ein einmal vergebener INN wird niemals rückwirkend geändert, gelöscht oder neu vergeben, insbesondere aus Gründen der Pharmakovigilanz (3).
Danach haben pharmakologisch und/oder strukturell verwandte Wirkstoffe ähnlich endende Namen, da sie in sogenannte INN-Stämme eingruppiert werden. Anhand eines gleichen Suffix erfolgt dabei die Zuordnung von Wirkstoffen mit gleicher bzw. ähnlicher Wirkungsweise: z. B. -ase für Enzyme, -vir für antivirale Substanzen oder -tinib für Tyrosinkinase-Inhibitoren (3).
Die erste Nomenklatur der monoklonalen Antikörper wurde 1991 mit dem eingängigen Stammsuffix -mab eingeführt. Seitdem bestand der INN aus einem Präfix und je einem Infix für den Wortstamm A und den Wortstamm B, die dem gemeinsamen Suffix -mab vorangestellt wurden, sodass der vollständige Name die Hauptcharakteristika bezüglich Zusammensetzung und Anwendung des Antikörpers beinhaltet (4).
Mit dem Wortstamm A wurde in der Regel die Zielstruktur des monoklonalen Antikörpers angezeigt (Tabelle 1). Diese Klassifizierung trifft jedoch in der Regel nur für die erste Indikation eines Antikörpers zu, späteren Indikationserweiterungen, wie sie bei monoklonalen Antikörpern üblich sind, kann nicht mehr Rechnung getragen werden.
Der Wortstamm B definierte hingegen die Herkunft des monoklonalen Antikörpers bzw. den Anteil menschlicher Aminosäuresequenzen im Antikörper (Tabelle 2). In Abbildung 1 ist die Nomenklatur anhand des TNF-alpha-Inhibitors Infliximab dargestellt.

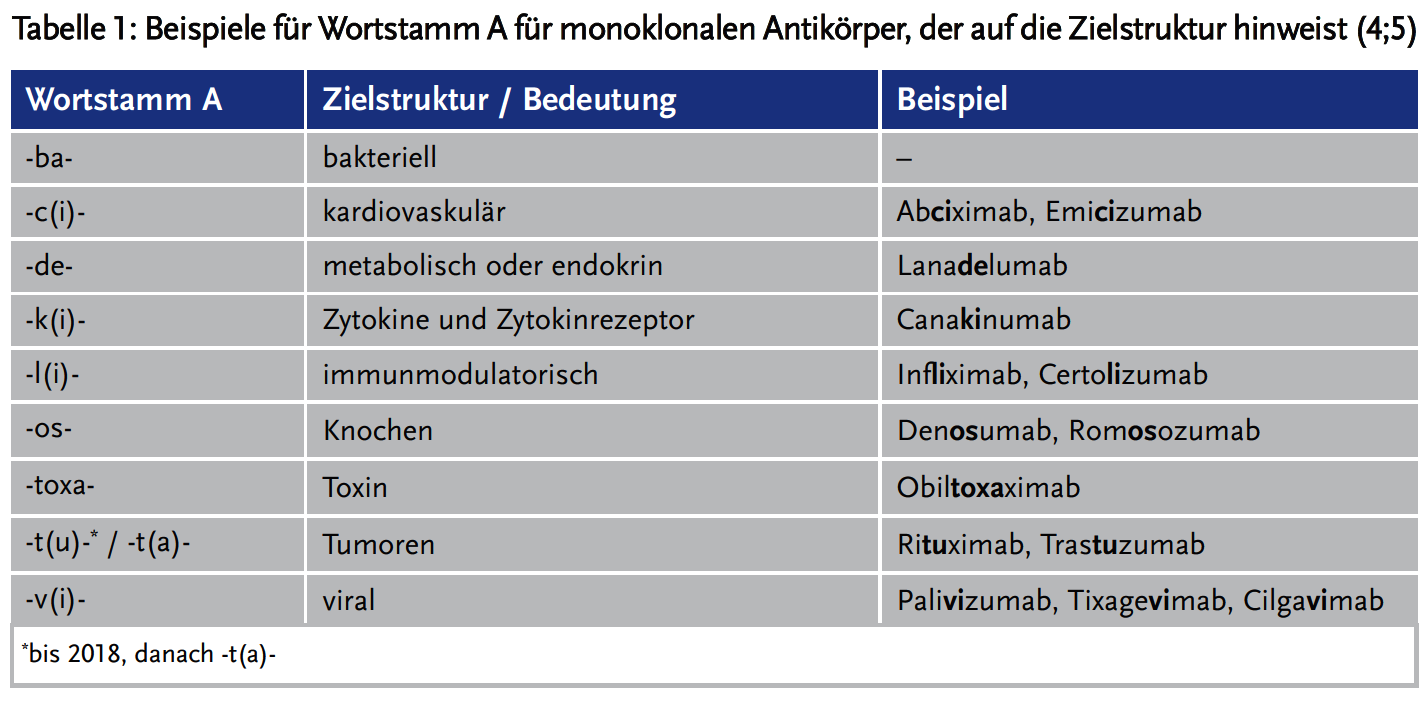
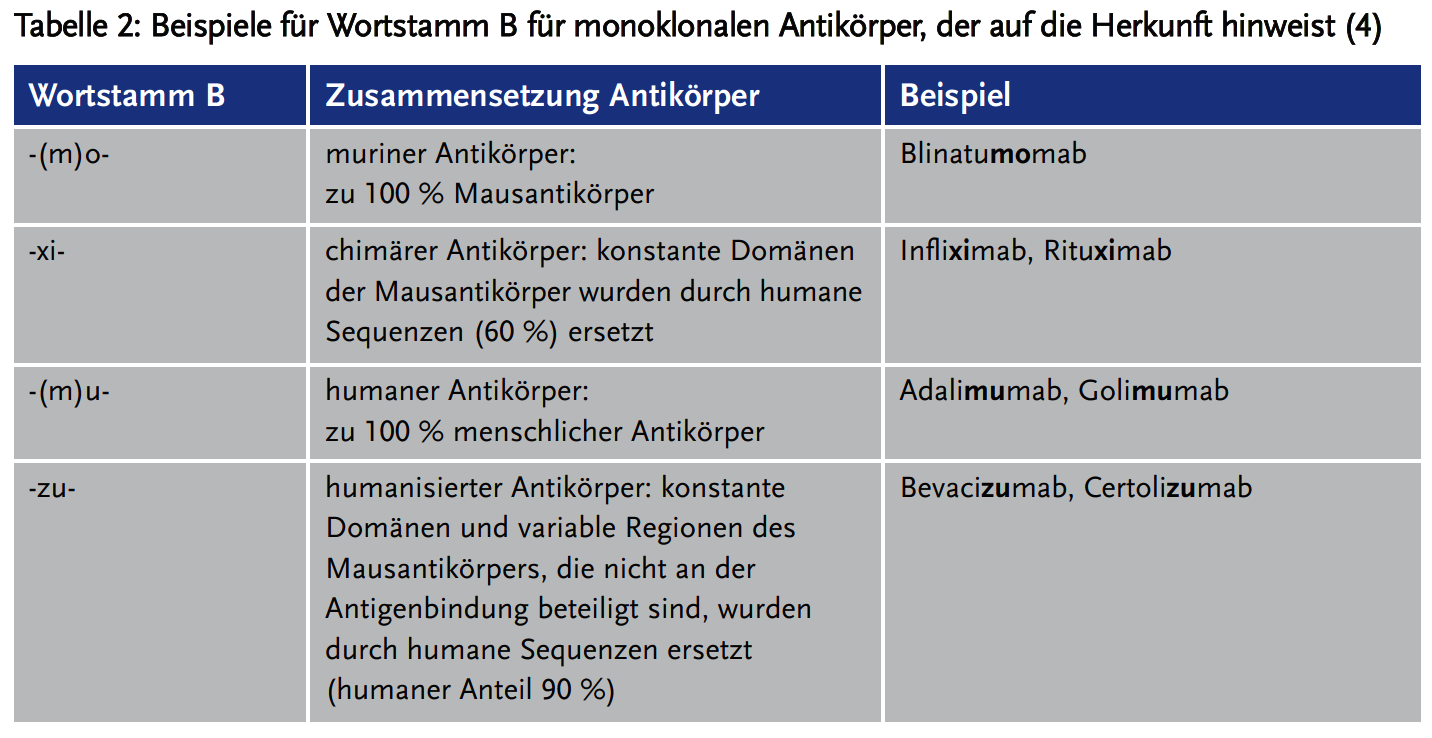
Seither wurden mehrere Anpassungen der Nomenklatur für monoklonale Antikörper vorgenommen. 2017 entfiel das Infix (Wortstamm B), das die Herkunft (Spezies) der Antikörper kennzeichnete und es wurden neue Infixe (Wortstamm A) eingeführt, die pharmakologische Angriffspunkte bezeichnen (z. B. -d(e)- für metabolische oder endokrine Wirkprinzipien) (5).
Neue Nomenklatur für monoklonale Antikörper
Monoklonale Antikörper stellen inzwischen die größte Wirkstoffgruppe innerhalb der biologischen Arzneimittel. Bis April 2022 wurden 879 INN für monoklonale Antikörper vergeben, davon befanden sich Anfang 2022 114 verschiedene monoklonale Antikörper als Arzneimittel auf dem deutschen Markt (6).
Um dem enormen Anstieg an neu entwickelten monoklonalen Antikörpern und der daraus resultierenden enormen Anzahl an neuen unverwechselbaren INN zu begegnet, beschloss die WHO-Expertengruppe 2021, eine neue Nomenklatur für monoklonale Antikörper zu entwickeln (1). Das neue Nomenklaturschema für monoklonale Antikörper verzichtet auf die Nutzung des Stammsuffixes -mab und teilt die monoklonalen Antikörper auf vier neue Stämme ein.
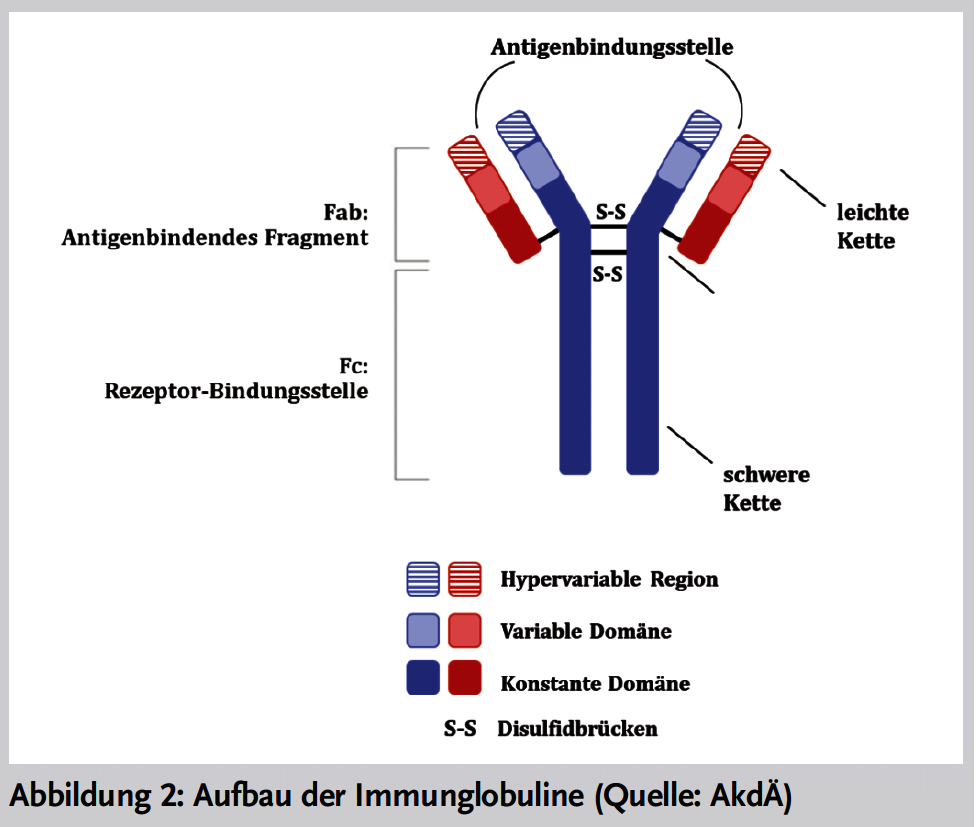
Die Wirkstoffgruppe der monoklonalen Antikörper umfasst alle Moleküle, die mindestens eine variable Domäne eines Immunglobulins enthalten. Dazu gehören sehr kleine Fragmente aus variablen Domänen, vollständige Immunglobuline (Abbildung 2) und multispezifische Immunglobulin-Fusionsproteine. Sie werden in der neuen Nomenklatur auf vier Stämme aufgeteilt, die je eine spezifische Endung (Suffix) im INN erhalten haben. Drei Stämme umfassen die monospezifischen und ein Stamm die bi-/multispezifischen Antikörper:
-tug für nicht modifizierte Immunglobuline („unmodified immunoglobulins“)
Die Stammendung -tug soll für monospezifische, vollständige Immunglobuline verwendet werden, die unveränderte konstante Regionen (Fc) und ein identisches Set von komplementaritätsbestimmenden Regionen (CDRs, complementarity determining regions) aufweisen, die das gleiche Epitop binden. Der Herkunft der Antikörper – aus welcher Spezies sie stammen – sowie die Immunglobulinklasse (IgG, IgM, IgA etc.) ist dabei egal, allerdings entsprechen sie vom Aufbau her den natürlichen Antikörpern, wie sie in vivo vom Immunsystem generiert werden könnten. Auch chimäre und humanisierte Antikörper können in diesen Stamm einsortiert werden.
-bart für künstliche Immunglobuline („artificial immunoglobulins“)
Die Stammendung -bart soll für monospezifische, vollständige Immunglobuline verwendet werden, bei denen die konstanten Regionen (Fc) modifiziert wurden.
-ment für Immunglobulin-Fragmente („immunoglobulin fragments“)
Die Stammendung -ment soll für monospezifische Fragmente verwendet werden, die mindestens eine antigenbindende variable Domäne eines Immunglobulins enthalten, die eine vollständige, nur Teile einer oder gar keine konstante Region beihalten.
-mig für multispezifische Immunglobuline („multi-specific immunoglobulins“)
Die Stammendung -mig soll für alle bi- und multispezifischen Immunglobuline verwendet werden, die verschiedene variable Domänen mit unterschiedlichen Sets von CDRs beinhalten.
Literatur
- World Health Organization: New INN nomenclature scheme for monoclonal antibodies: https://cdn.who.int/media/docs/default-source/international-nonproprietary-names-(inn)/new_mab_nomenclature-_2021rev.pdf (letzter Zugriff: 11. August 2022). Geneva (Switzerland), Mai 2022.
- Dübel S, Breitling F, Frenzel A et al.: Anwendungsgebiete für rekombinante Antikörper. Rekombinante Antikörper 2019; Oct 9: 189-230.
- World Health Organization: Guidance on the use of international nonproprietary names (INNs) for pharmaceutical substances: https://cdn.who.int/media/docs/default-source/international-nonproprietary-names-(inn)/who-pharm-s-nom-1570.pdf (letzter Zugriff: 11. August 2022). Geneva (Switzerland), 2017.
- World Health Organization: International Nonproprietary Names (INN) for biological and biotechnological substances (a review): https://cdn.who.int/media/docs/default-source/international-nonproprietary-names-(inn)/bioreview-2016-final.pdf (letzter Zugriff: 11. August 2022). Geneva (Switzerland), 2016.
- World Health Organization: The use of stems in the selection of International Nonproprietary Names (INN) for pharmaceutical substances 2018 (StemBook2018): https://apps.who.int/iris/handle/10665/275695 (letzter Zugriff: 11. August 2022). Geneva (Switzerland), 2018. Lizenz: CC BY-NC-SA 3.0 IGO.
- Weisser K: Abschied von „-mab“– neue internationale Freinamen (INN) für monoklonale Antikörper. Bulletin zur Arzneimittelsicherheit 2022; 13: 31-35.
Interessenkonflikte
Der Autorin erklärt, keine Interessenkonflikte zu haben.
