Supplemente mit Omega-3-Fettsäuren: Gibt es evidenzbasierte Indikationen?
Omega-3 fatty acids dietary supplements: Are there any evidence-based indications?
Zusammenfassung
Verschiedene Omega-3-Fettsäuren (ω3FS), insbesondere Eicosapentaensäure (EPA) und Docosahexaensäure (DHA), werden in unterschiedlichsten Dosierungen, Mischungsverhältnissen und galenischen Zubereitungen als Nahrungsergänzungsmittel vermarktet. Die für den Menschen ausreichende/optimale Zufuhrmenge an Omega-3-Fettsäuren ist unbekannt. Angesichts der unübersichtlichen Studienlage ist die Beurteilung eines klinischen Nutzens in der Praxis schwierig. Im Rahmen dieses Beitrags wird die aktuelle Datenbasis zusammengefasst und hinsichtlich der Konsequenzen für die klinische Praxis eingeordnet.
Die Ergebnisse methodisch guter Metaanalysen stellen die weit verbreiteten Supplementationsempfehlungen zur kardiologischen Primär- und Sekundärprävention infrage. Während nahezu alle am Markt befindlichen Supplemente EPA und/oder DHA enthalten, für deren Anwendung praktisch keine Wirksamkeit nachgewiesen werden konnte, gibt es Indizien für positive Effekte der α-Linolensäure, die hochkonzentriert beispielsweise in Leinöl und anderen Pflanzenölen enthalten ist.
Die aktuelle Studienlage liefert keine Rationale dafür, die derzeit verfügbaren ω3FS-Supplemente bei irgendeiner Patientengruppe zur Senkung des kardiovaskulären Risikos einzusetzen. Gleiches gilt für die Anwendung zur Prophylaxe oder Therapie von Demenzen, neurodegenerativen Erkrankungen, Depressionen, Tumorkachexie und für die unspezifische Anwendung bei kritisch Kranken. Möglicherweise vorteilhaft ist die (hochdosierte) ω3FS-Supplementation in Schwangerschaft und Stillzeit zur Prophylaxe von Atopie und Frühgeburtlichkeit sowie bei Intensivpatienten mit akutem Atemnotsyndrom (ARDS), akuter Lungenschädigung (ALI) oder Verbrennungstrauma. Die einzigen evidenzbasierten Indikationen für ω3FS-Supplemente sind die Anwendung bei bestimmten Stadien der altersbedingten Makuladegeneration (AMD) und mit Einschränkungen die Zweitlinientherapie bei Hypertriglyzeridämie.
Abstract
Different omega-3 polyunsatured fatty acids, especially eicosapentaenoic acid (EPA) and docosahexaenoic acid (DHA), are merchandised as supplements in various doses, compositions and galenic forms. Neither the adequate nor the optimal intake of omega-3 fatty acids for humans is known. Due to confusing data, the assessment of clinical benefit remains difficult. This article summarises the current literature and draws consequences for clinical practice.
The results of well-conducted meta-analyses challenge common recommendations to supplement omega-3 fatty acids for primary and secondary prevention in cardiology. Most of sold supplements contain EPA and/or DHA, although virtually no efficacy of those compounds has been proven. In contrast, data indicate positive effects of alpha-linolenic acid, which is a major fatty acid in flaxseed oil and other plant oils.
Current data do not support application of presently available omega-3 fatty acids supplements for cardiovascular risk reduction in any patient group. The same applies for prophylaxis or therapy of dementia, neurodegenerative diseases, depression, cancer cachexia and for the unspecific application in critically ill patients. Supplementation of omega-3 fatty acids (high doses) might be favourable during pregnancy and breastfeeding to reduce the risk of asthma and early preterm delivery as well as in intensive care patients with acute respiratory distress syndrome (ARDS), acute lung injury (ALI) or patients with major burns. The only evidence-based indications for omega-3 fatty acid supplementation are specific forms of age-related macular degeneration (ARMD) and – with limitations – the second line therapy of hypertriglyceridemia.
Hintergrund
Omega-3-Fettsäuren (ω3FS) gehören zu den langkettigen, mehrfach ungesättigten Fettsäuren (LCPUFA). Aufgrund ihres Vorkommens in Lebensmitteln und ihrer physiologischen Bedeutung sind insbesondere die essenzielle α-Linolensäure (ALA, verschiedene Pflanzenöle) sowie deren Metaboliten Eicosapentaensäure (EPA) und Docosahexaensäure (DHA) relevant. Letztere werden im Körper in geringem Umfang aus der α-Linolensäure gebildet, können aber auch direkt z. B. über den Verzehr fettreicher Seefische aufgenommen werden. EPA und DHA werden in unterschiedlichsten Dosierungen, Mischungsverhältnissen und galenischen Zubereitungen als Nahrungsergänzungsmittel vermarktet. Die für den Menschen ausreichende/optimale Zufuhrmenge an Omega-3-Fettsäuren ist unbekannt.
Seit den 1960er Jahren wurden mehrere Zehntausend wissenschaftliche Publikationen verfasst, die sich mit gesundheitlichen Wirkungen der ω3FS beschäftigen. Angesichts dieser unübersichtlichen Studienlage ist die Einschätzung eines klinischen Nutzens in der Praxis schwierig. Im Rahmen dieses Beitrags soll daher die aktuelle Datenbasis aus randomisiert-kontrollierten Humanstudien zu den wichtigsten Indikationen zusammengefasst werden.
Kardiovaskuläre Erkrankungen
Randomisiert-kontrollierte Studien
In keinem anderen Bereich wird die Supplementation mit ω3FS derartig postuliert wie zur Prävention und ergänzenden Therapie kardiovaskulärer Erkrankungen. Hintergrund sind epidemiologische Studien, die einen protektiven Effekt einer erhöhten ω3FS-Zufuhr suggerieren. Obwohl die Einnahme von ω3FS-Supplementen von vielen Fachgesellschaften empfohlen wird, liefert die aktuelle Studienlage hierfür keine Evidenz.
Den aktuellsten Überblick zur Wirksamkeit von ω3FS bei kardiovaskulären Indikationen bietet ein Anfang 2018 publiziertes Cochrane Review (1). Darin eingeschlossen wurden 79 randomisiert-kontrollierte Studien mit über 112.000 Teilnehmern, die überwiegend aus westlichen Industrieländern stammten und die gesamte Spanne kardiovaskulärer Risikofaktoren zeigten. Die Dauer der Einzelstudien variierte zwischen 12 und 72 Monaten. Die Interventionen umfassten die kontrollierte Anwendung von ω3FS-Supplementen, ω3FS-angereicherten Lebensmitteln oder Ernährungsinterventionen zur Steigerung der nutritiven ω3FS-Zufuhr, jeweils verglichen gegen Placebo oder Standardernährung.
Dabei konnte mit moderater bis sehr guter Evidenz gezeigt werden, dass die erhöhte Zufuhr von EPA und/oder DHA keinen oder einen allenfalls geringen Effekt auf die kardiovaskuläre Morbidität und Mortalität sowie die Gesamtmortalität besitzt (Tabelle 1). Wurden durch Sensitivitätsanalysen nur Ergebnisse aus Studien mit geringem Biasrisiko berücksichtigt, verschob sich die Effektstärke bei allen primären Endpunkten außer dem Arrhythmierisiko in Richtung Null. In Subgruppenanalysen konnte kein differenzieller Effekt für bestimmte Dosierungen, Interventionszeiträume oder Patientengruppen gefunden werden. Die erhöhte Zufuhr von EPA/DHA senkte die Triglyzeridkonzentrationen bei gleichzeitiger Erhöhung der HDL-Konzentrationen geringfügig. Eine gesteigerte ALA-Zufuhr reduzierte dagegen die HDL-Konzentrationen. Es zeigte sich geringe Evidenz dafür, dass die erhöhte ALA-Zufuhr das Risiko für kardiovaskuläre Ereignisse, KHK-Mortalität und Arrhythmien geringfügig reduzieren könnte. Patienten mit Atherosklerose oder weiteren kardiovaskulären Risikofaktoren, die eine leitliniengerechte Arzneimitteltherapie erhalten, haben durch die ω3FS-Supplementation keinen Zusatznutzen.
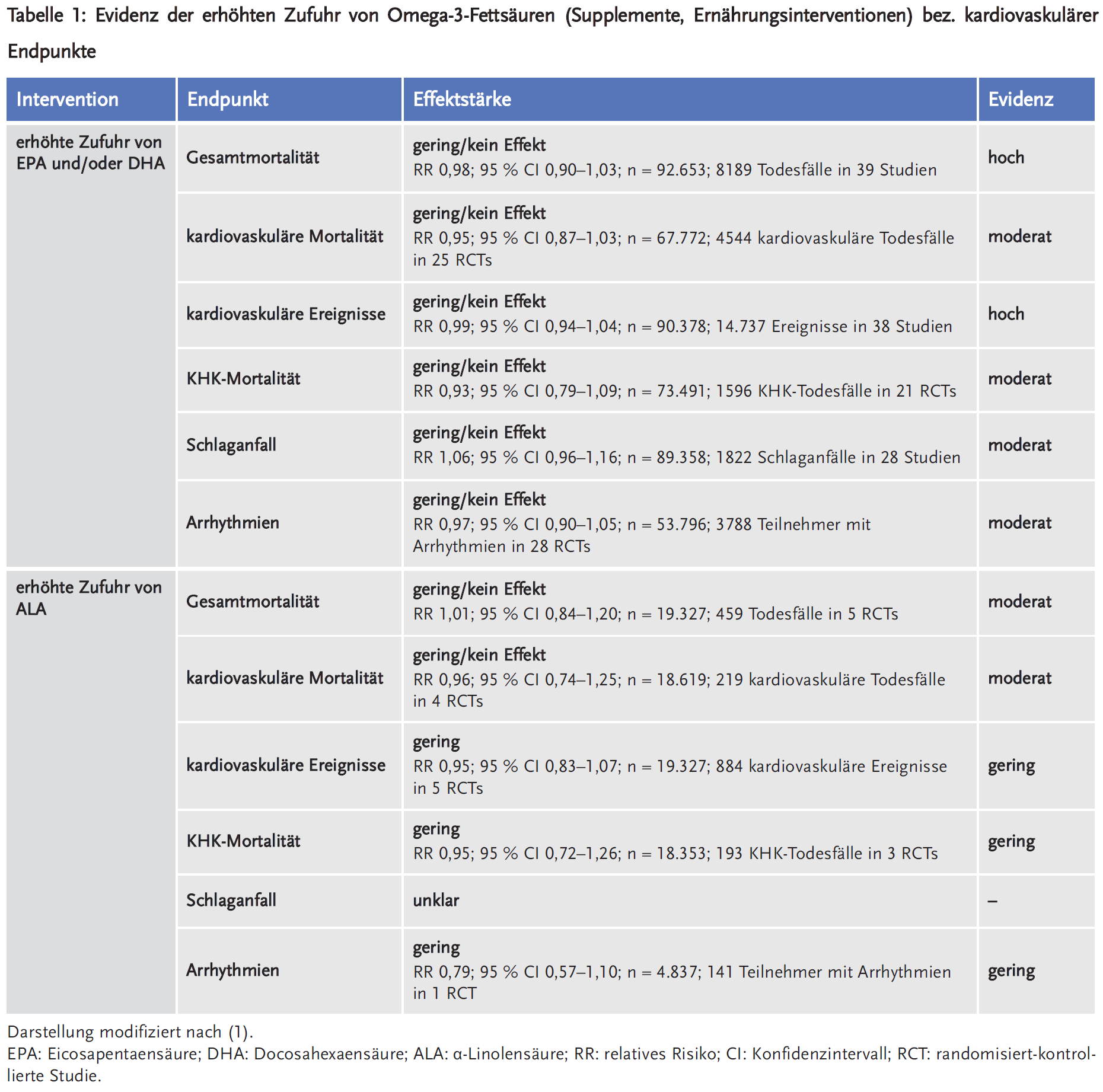
Diese Ergebnisse stellen die weit verbreiteten Supplementationsempfehlungen infrage. Während nahezu alle am Markt befindlichen Supplemente EPA und/oder DHA enthalten, für deren Anwendung praktisch keine Wirksamkeit nachgewiesen werden konnte, liefern die Daten Indizien für positive Effekte der α-Linolensäure, die beispielsweise hochkonzentriert in Leinöl und anderen Pflanzenölen enthalten ist.
Unterstützt wird das Ergebnis des Cochrane-Reviews durch methodisch hochwertige Einzelstudien und weitere Metaanalysen. Wie in der ASCEND-Studie gezeigt, sind ω3FS-Supplemente bei Diabetikern ohne kardiovaskuläre Erkrankungen zur Prävention vaskulärer Ereignisse nicht wirksamer als Placebo (1 g Omega-3-Fettsäuren/d, primärer Endpunkt 8,9 % vs. 9,2 %, RR: 0,97) (2). Die Anfang 2018 von der Omega-3 Treatment Trialists’ Collaboration publizierte Metanalyse über die zehn größten randomisiert-kontrollierten Studien mit ω3FS-Supplementen konnte keinerlei Wirksamkeitsnachweis hinsichtlich tödlicher und nichttödlicher kardiovaskulärer Ereignisse finden (3).
Besonders deutlich wird die Diskrepanz zwischen einem möglicherweise vorhandenen therapeutischen Potenzial und der aktuellen Marktsituation durch die im November 2018 publizierten Ergebnisse der VITAL- und REDUCE-IT-Studien: In der VITAL-Studie war die primärpräventive Anwendung von üblich dosierten Fischölkapseln (1 g/d, mit 460 mg EPA und 380 mg DHA) bei über 25.000 Teilnehmern in randomisiert-placebokontrolliertem Setting (medianes Follow-up: 5,3 Jahre) ohne signifikanten Effekt auf die kardiovaskuläre, Krebs- und Gesamtmortalität (20).
In der REDUCE-IT-Studie dagegen reduzierte die überwiegend sekundärpräventive Anwendung von sehr hoch dosierten EPA-Ethylester-Supplementen (4 g/d) bei über 8000 Patienten mit kardiovaskulärer Vorerkrankung oder Diabetes mellitus, Statintherapie und häufiger Triglyzeriderhöhung (135–499 mg/dl) immerhin die kardiovaskuläre Mortalität (nicht jedoch die Gesamtmortalität) signifikant (4,3 % vs. 5,2 %, HR 0,80; 95 % Konfidenzintervall (CI) 0,66 – 0,98; p = 0,03) (21). Wenig überraschend traten in dieser Hochdosiskonstellation auch vermehrt unerwünschte Wirkungen auf (Vorhofflimmern, periphere Ödeme).
Diese Ergebnisse sind nur vordergründig widersprüchlich: Während die Daten der VITAL-Studie einmal mehr die Unwirksamkeit der üblichen Anwendung von ω3FS-Supplementen widerspiegeln (Primärprävention mit niedrig dosierten, biochemisch unmodifizierten Fischölkapseln), liefern die Daten der REDUCE-IT-Studie Indizien für die Wirksamkeit innovativer Ansätze (Sekundärprävention mit hochdosierten, biochemisch modifizierten ω3FS). Hier darf nicht der Fehler gemacht werden, die Wirksamkeitshinweise aus der REDUCE-IT-Studie auf die marktüblichen ω3FS-Supplemente zu übertragen.
Kein Widerspruch zu epidemiologischen Studien
Diese in randomisiert-kontrollierten Studien gezeigten Null-Effekte stehen nur scheinbar im Gegensatz zu den Ergebnissen epidemiologischer Studien, die einen inversen Zusammenhang zwischen der ω3FS-Konzentration in Erythrozyten und der Gesamtsterblichkeit zeigen. Aus ernährungsmedizinischer Perspektive ist dieser Zusammenhang wenig überraschend. Grund hierfür ist nicht eine quasi-pharmakologische Wirkung der ω3FS; vielmehr ist der ω3FS-Status ein Indikator für das langfristige Ernährungsverhalten der Probanden. So ist die hohe ω3FS-Konzentration in den Erythrozyten Folge einer Ernährungsform, die insgesamt reich an Seefisch, pflanzlichen Ölen, Nüssen, sekundären Pflanzenstoffen, Mikronährstoffen und Ballaststoffen und die umgekehrt arm an (verarbeiteten) Fleischprodukten ist. Es ist diese multifaktorielle Gesamtkonstellation, die zu einer niedrigeren kardiovaskulären und Gesamtmortalität führt.
Zusammenfassend gibt es keine Rationale dafür, ω3FS-Supplemente bei irgendeiner Patientengruppe zur Senkung des kardiovaskulären Risikos zu empfehlen. Entsprechend hat auch die Europäische Arzneimittel-Agentur (EMA) ihre Beurteilung angepasst: In ihrer Stellungnahme vom Dezember 2018 hatte die EMA festgestellt, dass ω3FS-Supplemente in einer Dosierung von 1 g/Tag zur Sekundärprävention nach Herzinfarkt unwirksam sind und für diese Indikation nicht mehr eingesetzt werden sollen (22). Auf Antrag einiger betroffener Zulassungsinhaber wurde diese Stellungnahme vom EMA-Ausschuss für Humanarzneimittel (CHMP) in einem weiteren Gutachten überprüft. In dieser am 29.03.2019 verabschiedeten endgültigen Stellungnahme bestätigt die EMA ihre ursprüngliche Negativbewertung vom Dezember 2018 (23).
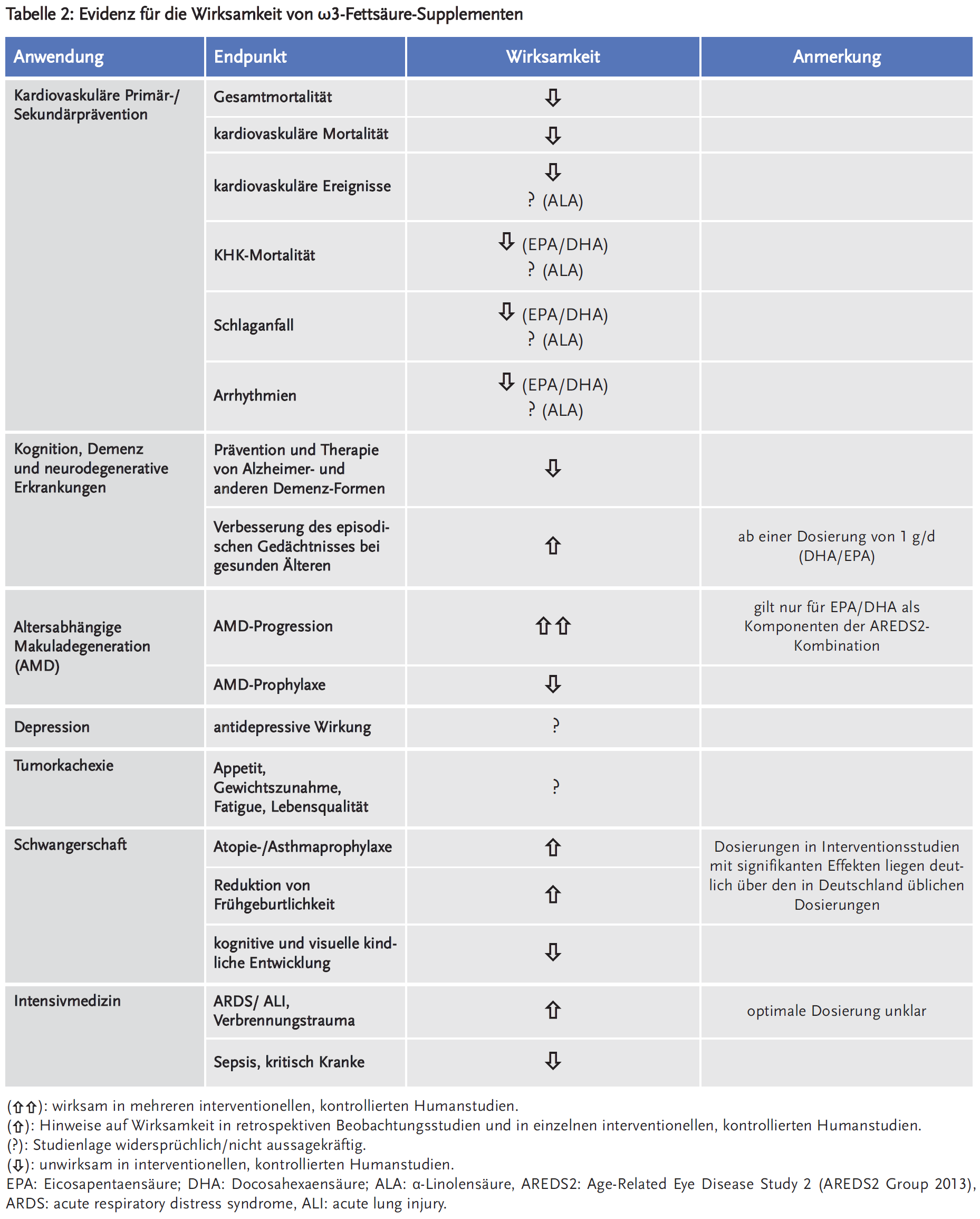
Nicht betroffen von dieser Negativbewertung ist die Anwendung zur Behandlung der Hypertriglyzeridämie. Im Rahmen der Therapie der Hypertriglyzeridämie können ω3FS-Supplemente eingesetzt werden, falls die Triglyzeridkonzentration durch eine geeignete Pharmakotherapie nicht ausreichend kontrolliert werden kann (24). Tabelle 2 gibt einen Überblick zur Evidenzlage von ω3FS-Supplementen.
Kognition und Demenz
Da ω3FS erhebliche Bedeutung für die Entwicklung und Funktion des menschlichen Gehirns besitzen, wird bei neurodegenerativen Erkrankungen eine Beteiligung der ω3FS vermutet. Die Ergebnisse klinischer Studien bestätigen diese Vermutung nicht: Abgesehen von einzelnen, methodisch limitierten Studien mit positiven Effekten überwiegend bei klinisch irrelevanten Surrogatparametern liefert die Gesamtschau der Studienlage keine Evidenz für dieω3FS-Supplementation bei Patienten mit Alzheimer-Demenz oder anderen Demenzformen (4). Bei gesunden Älteren mit leichten Gedächtnisproblemen scheint die Supplementation mit ω3FS ab einer Dosierung von 1 g/d (DHA/EPA) das episodische Gedächtnis zu verbessern (5). Ob die langfristige, hochdosierte Einnahme von ω3FS-Supplementen kognitive Leistungsverluste im Alter oder Demenzen verzögern oder verhindern kann, ist unbekannt.
Weitere Anwendungsgebiete
Altersabhängige Makuladegeneration (AMD)
Bei bestimmten Formen der AMD („AREDS-Kategorien“) ist die Anwendung spezifischer Nahrungsergänzungsmittel Teil der leitliniengerechten Therapie. Die (wie auch die AREDS1-Kombination) wirksame AREDS2-Kombination kann neben verschiedenen Mikronährstoffen EPA (650 mg/d) und DHA (350 mg/d) enthalten. Obwohl unklar ist, welchen Anteil diese EPA und DHA an der Gesamtwirkung der AREDS2-Kombination haben, erscheint die Anwendung aufgrund des klinischen Wirksamkeitsnachweises gerechtfertigt (6).
Depression
Es gibt mehrere ältere randomisiert-kontrollierte Studien, die Hinweise auf eine antidepressive Wirksamkeit kombinierter EPA/DHA-Supplemente liefern, insbesondere bei EPA-Überschuss. Aktuelle Metaanalysen konnten diese Wirksamkeit nicht bestätigen, zeigen bei erheblichen methodischen Schwächen aber teilweise eine Nichtunterlegenheit zur antidepressiven Psychopharmaka-Therapie (7). Für die Anwendung von ω3FS-Supplementen bei Depressionen (einschließlich peripartaler Depression) existiert derzeit keine ausreichende Evidenz.
Tumorkachexie
In der aktuellen Leitlinie der Europäischen Gesellschaft für Klinische Ernährung und Stoffwechsel (ESPEN) wird die Supplementation von ω3FS bei Patienten mit fortgeschrittener Krebserkrankung und laufender Chemotherapie empfohlen, um den Appetit und das Körpergewicht zu steigern (Empfehlungsstärke: „schwach“, Evidenzlevel: „gering“) (8). Die zugrunde liegende Datenbasis ist sehr inkonsistent. Zwar deuten einige Humanstudien darauf hin, dass die ω3FS-Supplementation Vorteile hinsichtlich Appetit, Fatigue, Lebensqualität und Verträglichkeit der antitumoralen Therapie bringen könnte. Unklar ist aber, welche Patientengruppe bei welcher Tumorentitiät und welchem Therapieregime von einer Supplementation profitieren würde. Aktuelle Reviews sehen keinerlei Evidenz für die Anwendung von ω3FS-Supplementen bei Tumorkachexie (9;10). Befürchtungen einer Wirkungsabschwächung chemotherapeutischer Behandlungen durch ω3FS-Supplemente haben sich bisher nicht bestätigt.
Schwangerschaft und Stillzeit
Schon länger gibt es Hinweise darauf, dass eine ω3FS-reiche Ernährung in der Schwangerschaft und Stillzeit das Atopierisiko des Kindes reduziert. Während ein Cochrane-Review aus dem Jahr 2015 nur geringe Evidenz für die ω3FS-Supplementation in der Schwangerschaft zur Atopieprävention findet (11), scheinen neuere Daten aus randomisiert-kontrollierten Studien (COPSAC-Kohorte) mit einem Follow-Up von bis zu 24 Jahren zu bestätigen, dass die ω3FS-Supplementation im letzten Schwangerschaftstrimenon die Prävalenz von Asthma und unteren Atemwegserkrankungen beim Kind signifikant senkt (12). Insgesamt bleibt die Evidenz für die atopiepräventive Wirksamkeit von ω3FS-Supplementen in der Schwangerschaft jedoch schwach.
Daneben führte die Supplementierung von Fischöl oder ω3FS in einigen randomisiert-kontrollierten Studien zu einer signifikanten Reduktion von Frühgeburtlichkeit (13). Die Datenlage zum Effekt vom ω3FS-Supplementen auf die kognitive, psychische und visuelle Entwicklung des Kindes ist inkonsistent und liefert keine evidenzbasierte Rationale für die Supplementation in der Schwangerschaft (14).
Ungeachtet dessen wird Schwangeren ohne regelmäßigen Seefischverzehr (zweimal pro Woche) empfohlen, DHA zu supplementieren (mindestens 200 mg/d). Die EFSA empfiehlt Schwangeren die Aufnahme/Supplementierung von 100 bis 200 mg/d DHA, zusätzlich zur für Nichtschwangere empfohlenen Zufuhr von täglich 250 mg DHA plus EPA. Diese Zufuhrempfehlungen liegen allerdings deutlich unterhalb der in den genannten Interventionsstudien als wirksam gefundenen Dosierungen (2,4 g/d EPA plus DHA).
Intensivmedizin
Die Datenlage zur Anwendung von ω3FS bei Intensivpatienten ist extrem heterogen und nicht aussagekräftig. Entsprechend schwach ist die Evidenz für die Statements in der aktuellen ESPEN-Leitlinie (2018) zur klinischen Ernährung in der Intensivmedizin: Die enterale Ernährung kann mit physiologischen Dosierungen von ω3FS angereichert werden (Empfehlungsgrad: 0), hochdosierte ω3FS-Zusätze sollte nicht routinemäßig verwendet werden (Empfehlungsgrad: B), und parenterale Lipidemulsionen können mit EPA plus DHA (0,1–0,2 g/kg/d) angereichert werden (Empfehlungsgrad: 0) (15).
Die besten Daten für positive Effekte von ω3FS (bei unklarer optimaler Dosierung) gibt es für Patienten mit akutem Atemnotsyndrom (ARDS) und akuter Lungenschädigung (ALI) (Krankenhausverweildauer, Beatmungsdauer, Mortalität) (16) sowie für Intensivpatienten mit schwerem Verbrennungstrauma (Sepsisrate, Komplikationsrate) (17). Weder die Society of Critical Care Medicine (SCCM) noch die American Society for Parenteral and Enteral Nutrition (ASPEN) und die Surviving Sepsis Initiative sehen einen Vorteil in der ω3FS-Anreicherung der parenteralen Nahrung von kritisch Kranken (18;19).
Forschungsbedarf und innovative Ansätze
Ungeachtet der Jahrzehnte umfassenden Studienlage gibt es zur präventiven oder therapeutischen Nutzung von ω3FS noch erheblichen Forschungsbedarf. So ist nach wie vor unklar, welche Effekte deutlich höhere als die bisher üblichen Dosierungen hätten. Auch die Negativbewertung der EMA (siehe oben) (23) bezieht sich nur auf Dosierungen von 1 g/Tag. Ebenfalls weitestgehend unbekannt sind die Bedeutung des ω3FS-Baseline-Status, der Einfluss der zeitgleich mit der Nahrung aufgenommenen ω6-Fettsäuren sowie die über die intestinale Mikrobiota vermittelten Wirkungen. Trotz ihrer unstrittigen physiologischen Relevanz besitzen die ω3FS ein therapeutisches Potenzial, das bisher klinisch noch nicht genutzt werden kann. Hier könnten personalisierte Ansätze und die Identifizierung prädiktiver Faktoren zielführend sein. Vielversprechend sind auch innovative technologische und biochemische Verfahren, um die Bioverfügbarkeit peroral eingenommener ω3FS im Vergleich zu den heute verfügbaren Präparaten deutlich zu steigern.
Fazit für die Praxis
Aufgrund der aktuellen Datenlage gibt es keine Rationale dafür, die derzeit verfügbaren ω3FS-Supplemente bei irgendeiner Patientengruppe zur Senkung des kardiovaskulären Risikos zu empfehlen. Gleiches gilt für die Anwendung zur Prophylaxe oder Therapie von Krebs, Demenzen, neurodegenerativen Erkrankungen, Depressionen, Tumorkachexie und für die unspezifische Anwendung bei kritisch Kranken. Möglicherweise vorteilhaft ist die (hochdosierte) ω3FS-Supplementation in Schwangerschaft und Stillzeit zur Prophylaxe von Atopie und Frühgeburtlichkeit sowie bei Intensivpatienten mit ARDS, ALI oder Verbrennungstrauma. Die einzigen evidenzbasierten Indikationen für ω3FS-Supplemente sind die Anwendung bei bestimmten Stadien der altersbedingten Makuladegeneration (AMD) und mit Einschränkungen die Zweitlinientherapie bei Hypertriglyzeridämie.
Interessenkonflikte
Der Autor erhielt für eine Vortragstätigkeit von Bayer ein Honorar (2015).
Literatur
- Abdelhamid AS, Martin N, Bridges C et al.: Polyunsaturated fatty acids for the primary and secondary prevention of cardiovascular disease. Cochrane Database Syst Rev 2018; Issue 7: CD012345.
- Bowman L, Mafham M, Wallendszus K et al.: Effects of Aspirin for Primary Prevention in Persons with Diabetes Mellitus. N Engl J Med 2018; 379: 1529-1539.
- Aung T, Halsey J, Kromhout D et al.: Associations of omega-3 fatty acid supplement use with cardiovascular disease risks. Meta-analysis of 10 trials involving 77 917 individuals. JAMA Cardiol 2018; 3: 225-234.
- Burckhardt M, Herke M, Wustmann T. Omega-3 fatty acids for the treatment of dementia. Cochrane Database Syst Rev 2016; Issue 4: CD009002.
- Yurko-Mauro K, Alexander DD, Van Elswyk ME: Docosahexaenoic acid and adult memory: a systematic review and meta-analysis. PLoS One 2015; 10: e0120391.
- Podlogar J, Smollich M: Mikronährstoff-Supplementation bei altersabhängiger Makuladegeneration (AMD): Evidenz jenseits von AREDS? Med Monatsschr Pharm 2017; 5: 197-201.
- Appleton KM, Sallis HM, Perry R et al.: ω-3 Fatty acids for major depressive disorder in adults: an abridged Cochrane review. BMJ Open 2016; 6: e010172.
- Arends J, Bachmann P, Baracos V et al.: ESPEN guidelines on nutrition in cancer patients. Clin Nutr 2017; 36: 11-48.
- Lavriv DS, Neves PM, Ravasco P: Should omega-3 fatty acids be used for adjuvant treatment of cancer cachexia? Clin Nutr ESPEN 2018; 25: 18-25.
- Mochamat, Cuhls H, Marinova M et al.: A systematic review on the role of vitamins, minerals, proteins, and other supplements for the treatment of cachexia in cancer: a European Palliative Care Research Centre cachexia project. J Cachexia Sarcopenia Muscle 2017; 8: 25-39.
- Gunaratne AW, Makrides M, Collins CT. Maternal prenatal and/or postnatal n-3 long chain polyunsaturated fatty acids (LCPUFA) supplementation for preventing allergies in early childhood. Cochrane Database Syst Rev 2015; Issue 7: CD010085.
- Bisgaard H, Stokholm J, Chawes BL et al.: Fish oil-derived fatty acids in pregnancy and wheeze and asthma in offspring. N Engl J Med 2016; 375: 2530-2539.
- Kar S, Wong M, Rogozinska E et al.: Effects of omega-3 fatty acids in prevention of early preterm delivery: a systematic review and metaanalysis of randomized studies. Eur J Obstet Gynecol Reprod Biol 2016; 198: 40-46.
- Rangel-Huerta OD, Gil A: Effect of omega-3 fatty acids on cognition: an updated systematic review of randomized clinical trials. Nutr Rev 2018; 76: 1-20.
- Singer P, Blaser AR, Berger MM et al.: ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr 2018; 38: 48-79.
- Kagan I, Cohen J, Stein M et al.: Preemptive enteral nutrition enriched with eicosapentaenoic acid, gamma-linolenic acid and antioxidants in severe multiple trauma: a prospective, randomized, double-blind study. Intensive Care Med 2015; 41: 460-469.
- Tihista S, Echavarría E. Effect of omega 3 polyunsaturated fatty acids derived from fish oil in major burn patients: A prospective randomized controlled pilot trial. Clin Nutr 2018; 37: 107-112.
- Taylor BE, McClave SA, Martindale RG et al.: Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (ASPEN). Crit Care Med 2016; 44: 390-438.
- Rhodes A, Evans LE, Alhazzani W et al.: Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med 2017; 43: 304-377.
- Manson JE, Cook NR, Lee IM et al.: Marine n-3 fatty acids and prevention of cardiovascular disease and cancer. NEJM 2019; 380: 23-32.
- Batt DL, Steg G, Miller M et al.: Cardiovascular risk reduction with icosapent ethyl for hypertriglyceridemia. N Engl J Med 2019; 380: 11-22.
- European Medicines Agency (EMA): Omega-3 fatty acid medicines no longer considered effective in preventing heart disease: www.ema.europa.eu/en/documents/referral/omega-3-fatty-acid-medicines-omega-3-fatty-acid-medicines-no-longer-considered-effective-preventing_en.pdf (letzter Zugriff: 2. Mai 2019). EMA/19056/2019; London, 14. Dezember 2018.
- European Medicines Agency (EMA): EMA confirms omega-3 fatty acid medicines are not effective in preventing further heart problems after a heart attack: www.ema.europa.eu/en/documents/press-release/ema-confirms-omega-3-fatty-acid-medicines-are-not-effective-preventing-further-heart-problems-after_en.pdf (letzter Zugriff: 2. Mai 2019). EMA/186168/2019; London, 29. März 2019.
- Catapano AL, Graham I, de Backer G et al.: ESC/EAS Guidelines for the management of dyslipidaemias. Eur Heart J 2016; 37: 2999-3058.
vorab online
Dieser Artikel wurde am 7. Mai 2019 vorab online veröffentlicht.
