Erenumab (Aimovig®) ▼ (frühe Nutzenbewertung)
In Kürze
- Erenumab ist zur Migräneprophylaxe bei Erwachsenen mit mindestens vier Migränetagen pro Monat zugelassen.
- Bei der Markteinführung des Arzneimittels empfahl die AkdÄ, den Einsatz von Erenumab nur nach Versagen aller anderen Arzneimittel zur Migräneprophylaxe oder bei deren Unverträglichkeit, da Langzeitdaten fehlen (1). Aktuell liegt ein Beschluss des Gemeinsamen Bundesauschusses (G-BA) zur frühen Nutzenbewertung vor.
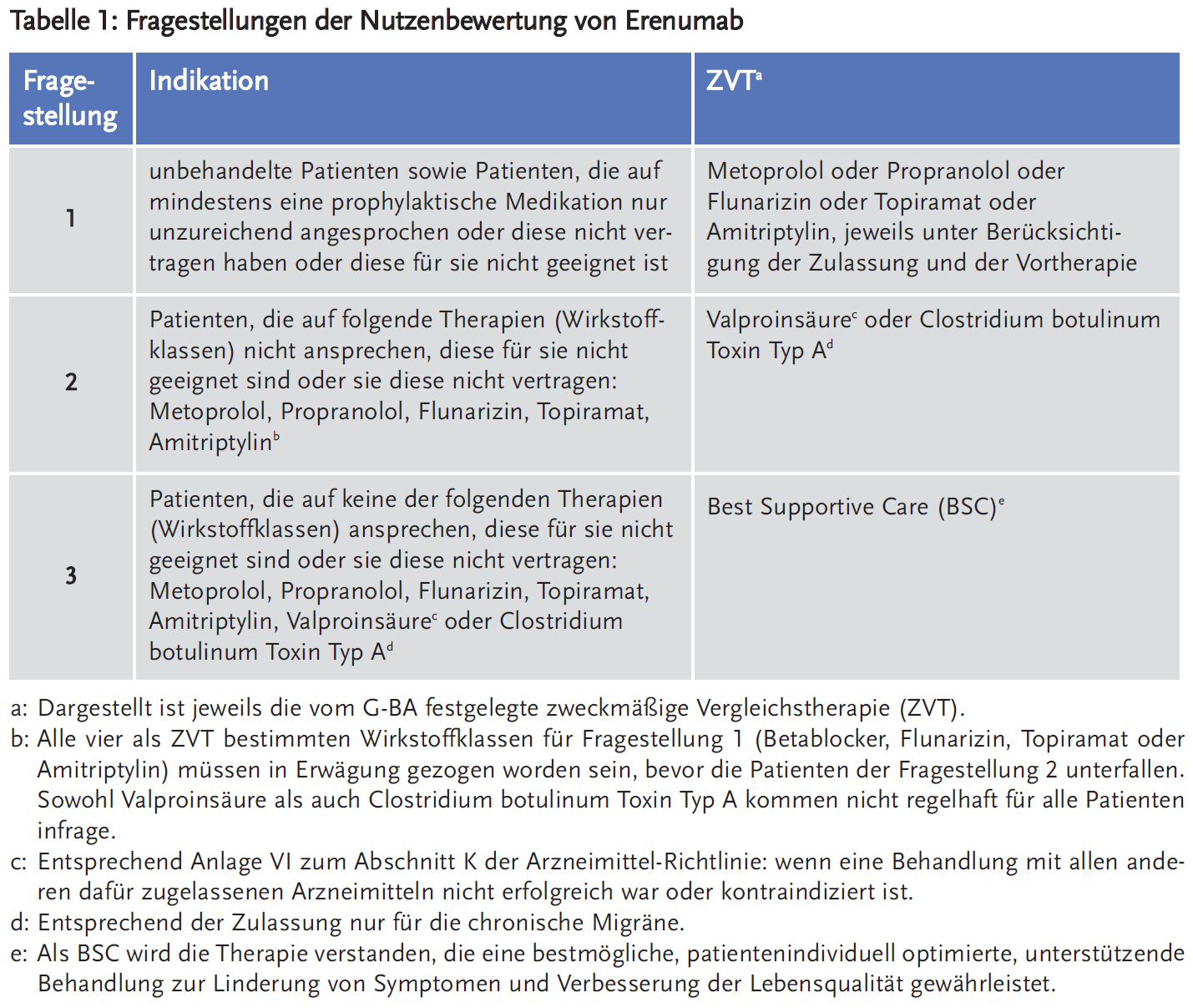
- Je nach Vorbehandlung ergaben sich für den G-BA drei Fragestellungen für die Nutzenbewertung (Tabelle 1), der pU legte jedoch Daten nur zu Fragestellung 3 vor.
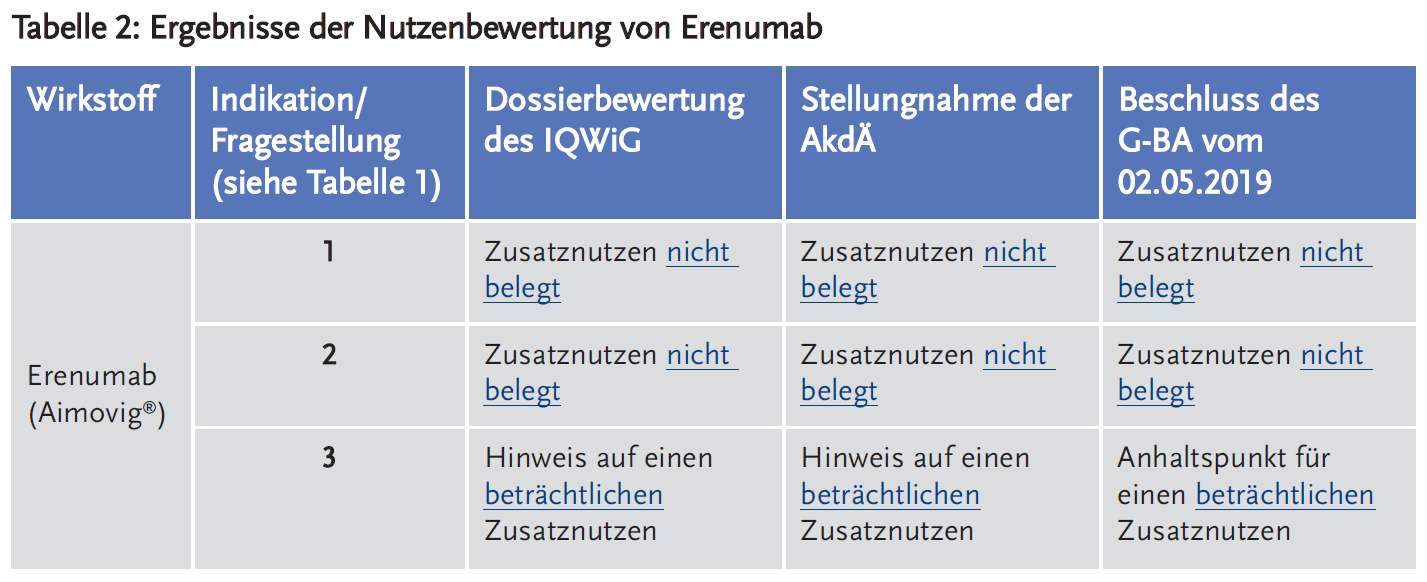
- Das IQWiG bewertete den Zusatznutzen in den Fragestellungen 1 und 2 als nicht belegt, für Fragestellung 3 – also für Patienten, die auf keine der verfügbaren Therapien ansprechen, diese nicht vertragen bzw. diese Therapien für sie nicht geeignet sind – sah es einen Hinweis auf einen beträchtlichen Zusatznutzen. Die AkdÄ schloss sich dieser Bewertung unter der Voraussetzung einer Befristung zur Erhebung von Langzeitdaten zur Sicherheit und Verträglichkeit an.
- Der G-BA beschloss, dass der Zusatznutzen in den Fragestellungen 1 und 2 nicht belegt ist. Für Fragestellung 3 beschloss er einen Anhaltspunkt für einen beträchtlichen Zusatznutzen von Erenumab gegenüber der zweckmäßigen Vergleichstherapie (ZVT) Best Supportive Care (BSC).
Für Migräne besteht eine Lebenszeitprävalenz von etwa 8 bis 11 %. Die Prävalenz ist bei Frauen dreimal höher als bei Männern. Migräne ist eine häufige Ursache für vorübergehende körperliche Einschränkungen, darüber hinaus auch mit anderen Erkrankungen wie Depression, Epilepsie und vaskulären Erkrankungen assoziiert (2). Klinisch äußert sich Migräne durch Attacken heftiger, häufig einseitiger, pulsierender oder pochender Kopfschmerzen. Begleitend können Appetitlosigkeit, Übelkeit, Erbrechen, Lichtscheu, Lärmempfindlichkeit und Überempfindlichkeit gegenüber Gerüchen auftreten (3). Die S1-Leitlinie „Therapie der Migräneattacke und Prophylaxe der Migräne“ der Deutschen Gesellschaft für Neurologie (DGN) leitet die Indikation zu einer medikamentösen Prophylaxe aus besonderem Leidensdruck, Einschränkung der Lebensqualität und dem Risiko eines Medikamentenübergebrauchs ab. Nicht evidenzbasierte Kriterien für eine medikamentöse Prophylaxe stellen u. a. dar: drei und mehr Migräneattacken pro Monat, die die Lebensqualität beeinträchtigen; Migräneattacken, die regelmäßig länger als 72 Stunden anhalten; Attacken, die auf eine Therapie entsprechend den Empfehlungen zur Akuttherapie (inkl. Triptane) nicht ansprechen (4).
Erenumab (Aimovig®) ist zur Migräneprophylaxe bei Erwachsenen mit mindestens vier Migränetagen pro Monat zugelassen. Erenumab ist ein rekombinanter humaner monoklonaler IgG2-Antikörper, der in Ovarialzellen chinesischer Hamster (Chinese Hamster Ovary, CHO) hergestellt wird. Er bindet an den Calcitonin-Gene-Related-Peptide(CGRP)-Rezeptor, der in der Pathophysiologie der Migräne eine wichtige Rolle spielt. CGRP ist ein Neuropeptid, das die nozizeptive Signalübertragung reguliert und als Vasodilatator wirkt. Der CGRP-Spiegel steigt während eines Migräneanfalls an und normalisiert sich beim Abklingen der Kopfschmerzen. Erenumab konkurriert spezifisch mit CGRP um die Bindung am CGRP-Rezeptor und hemmt dadurch seine Funktion (5).
Für die Bewertung des Zusatznutzens von Erenumab ergaben sich drei Fragestellungen, die sich aus der unterschiedlichen Vorbehandlung der Patienten ableiten (Tabelle 1) (6).
Dossierbewertung des IQWiG
In den Fragestellungen 1 und 2 lagen keine Daten zu einem möglichen Zusatznutzen vor. Damit war ein Zusatznutzen von Erenumab gegenüber der ZVT für diese Patienten jeweils nicht zu belegen.
Für die Fragestellung 3 legte der pharmazeutische Unternehmer (pU) die randomisierte, doppelblinde Parallelgruppenstudie LIBERTY zum Vergleich von Erenumab mit Placebo jeweils in Kombination mit BSC über zwölf Wochen vor. Die Studie schloss erwachsene Patienten mit seit mindestens zwölf Monaten dokumentierter episodischer Migräne (EM) und durchschnittlich 4 bis 14 Migränetage pro Monat (im Mittel 9,1) in den letzten drei Monaten ein. Zudem musste ein Therapieversagen unter zwei bis vier vorangegangenen medikamentösen Migräneprophylaxen sowie ein fehlendes Ansprechen auf eine Therapie mit Valproinsäure oder eine Nichteignung für eine solche Therapie vorliegen (7).
Für die Nutzenbewertung wurde die Teilpopulation der Patienten herangezogen, die mit mindestens zwei der folgenden Therapien vorbehandelt waren: Betablocker (Propranolol oder Metoprolol), Flunarizin, Topiramat oder Amitriptylin. Zudem schloss der pU nur diejenigen Patienten mit einer Vorbehandlung mit Valproinsäure ein, bei denen dieses Medikament die zeitlich letzte Therapie vor Studieneinschluss war. Damit wurde der Vorgabe der Arzneimittel-Richtlinie (Anlage VI zum Abschnitt K) Rechnung getragen, dass Valproinsäure nur dann für die Migräneprophylaxe von Erwachsenen verordnungsfähig ist, „wenn eine Behandlung mit anderen dafür zugelassenen Arzneimitteln nicht erfolgreich war oder kontraindiziert ist“.
Die relevante Teilpopulation der Studie LIBERTY umfasste insgesamt 193 Patienten und wurde vom IQWiG als geeignet eingestuft. In der Gesamtschau der Ergebnisse der Studie LIBERTY ergaben sich aus Sicht des IQWiG positive Effekte nur in der Endpunktkategorie Morbidität und keine negativen Effekte in der Kategorie Schaden. Für das IQWiG bestand daher für erwachsene Patienten mit mindestens vier Migränetagen pro Monat, für die nur noch BSC als Therapie infrage kommt, ein Hinweis auf einen beträchtlichen Zusatznutzen von Erenumab. Begründet wurde dies mit den statistisch signifikanten Unterschieden zugunsten von Erenumab bezüglich einer mindestens 50-prozentigen Reduktion der monatlichen Migränetage sowie der Reduktion der Migräneattacken pro Monat. Zudem lagen statistisch signifikante Unterschiede zugunsten von Erenumab vor für die Endpunkte allgemeine Beeinträchtigung durch Kopfschmerz (HIT-6) und körperliche Funktion (MPFID) in den Domänen Auswirkungen auf tägliche Aktivitäten, körperliche Beeinträchtigung und Gesamtauswirkung auf tägliche Aktivitäten. Auch für den Endpunkt Beeinträchtigung der Arbeitsproduktivität und Aktivitäten (WPAI-Headache) zeigte sich für die Scores Präsentismus, Gesamteinschränkung (Absentismus + Präsentismus) und Aktivitätsbeeinträchtigung jeweils ein statistisch signifikanter Effekt zum Vorteil von Erenumab (6).
Erwachsene mit chronischer Migräne (CM), die ebenfalls vom Anwendungsgebiet von Erenumab umfasst sind, wurden in die Studie LIBERTY nicht eingeschlossen. Eine Einschränkung der Aussage zum Zusatznutzen auf Patienten mit EM war aus Sicht des IQWiG zwar nicht gerechtfertigt. Ob die Ergebnisse aus der Studie LIBERTY jedoch auf alle Patienten mit CM, anwendbar sind, war für IQWiG unklar. Für Fragestellung 3 lag damit ein Hinweis auf einen beträchtlichen Zusatznutzen vor (6).
Stellungnahme der AkdÄ
Die AkdÄ schloss sich der Bewertung des IQWIG für alle drei Fragestellungen an. Sie wies aber darauf hin, dass die Einschätzung des IQWiG, dass ein beträchtlicher Zusatznutzen vorliegt, auf standardisierten Verfahren zur Beurteilung beruhte. Für Erenumab beträgt die Number Needed to Treat (NNT) 6, um eine Reduktion der Tage mit Migräne um mehr als 50 % zu bewirken. Aus klinischer Sicht entspricht dies einer lediglich moderaten Verbesserung des therapierelevanten Nutzens und würde streng formal definitionsgemäß einem geringen Zusatznutzen entsprechen. Zu berücksichtigen ist jedoch, dass mit der LIBERTY-Studie anhand relevanter Endpunkte der Morbidität und der gesundheitsbezogenen Lebensqualität belegt wurde, dass Patienten, bei denen zwei bis vier vorangehende Behandlungen versagt haben oder zumindest nicht geeignet waren, von diesem neuen Wirkprinzip profitieren können.
Zudem scheint aus Sicht der AkdÄ die Verträglichkeit von Erenumab, speziell das Fehlen sedierender, metabolischer, kognitiver und depressionsauslösender Eigenschaften, einen Vorteil gegenüber anderen prophylaktischen Maßnahmen darzustellen. Ebenso ist die monatliche Applikation als günstig zu bewerten (8).
Die AkdÄ wies aber auch darauf hin, dass Erenumab der erste monoklonale Antikörper ist, der spezifisch gegen das migräneauslösende Neuropeptid CGRP gerichtet ist. Der langfristige Nutzen und Schaden einer CGRP-Blockierung durch Erenumab können aus Sicht der AkdÄ anhand der vorgelegten Daten nicht abschließend bewertet werden. Daher empfahl die AkdÄ eine erneute Nutzenbewertung nach entsprechender Befristung, damit Daten aus längeren Studien sowie zu den Fragestellungen 1 und 2 vorgelegt werden können. Solche Daten würden dazu beitragen, die aktuelle Wissenslücke zum Stellenwert von Erenumab gegenüber herkömmlichen Migräneprophylaktika zu schließen.
Um das Schadenspotenzial besser abschätzen zu können, sollten außerdem Registerdaten zu kardiovaskulären Nebenwirkungen und Schwangerschaftsverläufen unter Erenumab vorgelegt werden, die durch Daten aus den Spontanmeldesystemen ergänzt werden. Aus Sicht der AkdÄ ist zudem zu berücksichtigen, dass es keinen direkten Vergleich der beiden verfügbaren Dosierungen gibt. Ein solcher wäre aber wünschenswert, um festzustellen, welche Patienten von der höheren Dosierung profitieren. Dies ist patientenrelevant und – auch unter ökonomischen Gesichtspunkten – unbedingt zu fordern (8).
Beschluss des G-BA
Der G-BA beschloss, dass ein Zusatznutzen von Erenumab für Fragestellungen 1 und 2 nicht belegt ist.
Für Fragestellung 3 lag aus Sicht des G-BA ein Anhaltspunkt für einen beträchtlichen Zusatznutzen vor. Begründet wurde dies durch die statistisch signifikanten, beträchtlichen Vorteile für Erenumab für die Morbiditätsendpunkte Migränetage pro Monat und Aktivitätsbeeinträchtigungen sowie für den Endpunkt gesundheitsbezogene Lebensqualität. Zudem ergaben sich in der Kategorie Nebenwirkungen keine Unterschiede zwischen Erenumab und Placebo. Für die Endpunkte Symptomatik (Migränetage pro Monat), körperliche Funktion (MPFID) und Beeinträchtigung der Arbeitsproduktivität und Aktivität (WPAI-Headache) wurde das Verzerrungspotenzial als hoch angesehen. Zudem bestanden für den G-BA Unklarheiten bezüglich der Übertragbarkeit der Studienergebnisse auf den deutschen Versorgungskontext sowie weitere Unsicherheiten, weil in der Studie keine klare Abgrenzung zwischen EM und CM nachvollzogen werden konnte. Daraus resultierte bezüglich der Aussagesicherheit nur ein Anhaltspunkt (9).
Literatur
- Arzneimittelkommission der deutschen Ärzteschaft: Erenumab (Aimovig®). Arzneiverordnung in der Praxis (AVP) 2019; 46: 75-80.
- Bigal ME, Lipton RB: The epidemiology, burden, and comorbidities of migraine. Neurol Clin 2009; 27: 321-334.
- Headache classification committee of the international headache society (IHS) the international classification of headache disorders, 3rd edition. Cephalalgia 2018; 38: 1-211.
- Diener H-C, Gaul C, Kropp P et al.: Therapie der Migräneattacke und Prophylaxe der Migräne: www.dgn.org/leitlinien (letzter Zugriff: 6. Mai 2019). In: Deutsche Gesellschaft für Neurologie (Hrsg.): Leitlinien für Diagnostik und Therapie in der Neurologie, 2018.
- Novartis Pharma GmbH: Fachinformation "Aimovig® 70 mg Injektionslösung in einer Fertigspritze/Injektionslösung im Fertigpen". Stand: August 2018.
- IQWiG-Berichte – Nr. 717: Erenumab (Migräne) – Nutzenbewertung gemäß § 35a SGB V: www.iqwig.de/download/A18-71_Erenumab_Nutzenbewertung-35a-SGB-V_V1-0.pdf. Letzter Zugriff: 6. Mai 2019.
- Reuter U, Goadsby PJ, Lanteri-Minet M et al.: Efficacy and tolerability of erenumab in patients with episodic migraine in whom two-to-four previous preventive treatments were unsuccessful: a randomised, double-blind, placebo-controlled, phase 3b study. Lancet 2018; 392: 2280-2287.
- Arzneimittelkommission der deutschen Ärzteschaft. Stellungnahme zu Erenumab (Migräne), Nr. 717, Auftrag A18-71, Version 1.0, Stand: 30. Januar 2019: www.akdae.de/Stellungnahmen/AMNOG/A-Z/Erenumab/Erenumab-EB.pdf.Letzter Zugriff: 6. Mai 2019.
- Gemeinsamer Bundesausschuss: Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII – Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V – Erenumab. 2. Mai 2019. www.g-ba.de/downloads/40-268-5716/2019-05-02_AM-RL-XII_Erenumab_D-407_TrG.pdf. Letzter Zugriff: 6. Mai 2019.
Hinweise
Arzneimittel, die mit einem schwarzen Dreieck (▼) gekennzeichnet sind, unterliegen einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.
„Neue Arzneimittel“ ist eine Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu neu zugelassenen Arzneimitteln oder zu neu zugelassenen Indikationen. Ziel ist es, den Ärzten zeitnah Informationen zu diesen Arzneimitteln zur Verfügung zu stellen, zunächst bei Markteinführung sowie nach der frühen Nutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA) (§ 35a Absatz 1 SGB V). „Neue Arzneimittel“ bei Markteinführung enthält Informationen basierend auf dem Europäischen Öffentlichen Bewertungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) sowie weiteren bei Markteinführung vorliegenden Daten aus klinischen Studien. Nach Abschluss der frühen Nutzenbewertung wird der Zusatznutzen des neuen Arzneimittels und seine therapeutische Bedeutung auf der Basis der Dossierbewertung des IQWiG, der Stellungnahme der AkdÄ und des Beschlusses des G-BA im Rahmen der frühen Nutzenbewertung dargestellt („Update – Neue Arzneimittel“).
vorab online
Dieser Artikel wurde am 17. Mai 2019 vorab online veröffentlicht.
