Spontanmeldungen von Nebenwirkungen an die AkdÄ im Jahr 2018
Spontaneous reports of suspected adverse drug reactions submitted to the DCGMA in 2018
Zusammenfassung
Die AkdÄ erfasst und bewertet Verdachtsmeldungen von Arzneimittelnebenwirkungen. Sie erhält diese Meldungen vorwiegend von Ärzten aus Klinik und Praxis auf der Grundlage von § 6 der (Muster-)Berufsordnung. Der folgende Artikel gibt eine Übersicht über die Verdachtsmeldungen aus dem Jahr 2018 und stellt ausgewählte Themen aus der Arzneimittelsicherheit dar, die in der AkdÄ diskutiert wurden.
Abstract
The DCGMA collects and assesses reports of suspected adverse drug reactions. Based on § 6 of the professional code for physicians, reports are submitted predominantly by physicians working in hospital or outpatient care. The following article provides an overview of reports in 2018 and presents selected drug safety topics that were discussed within the DCGMA in this year.
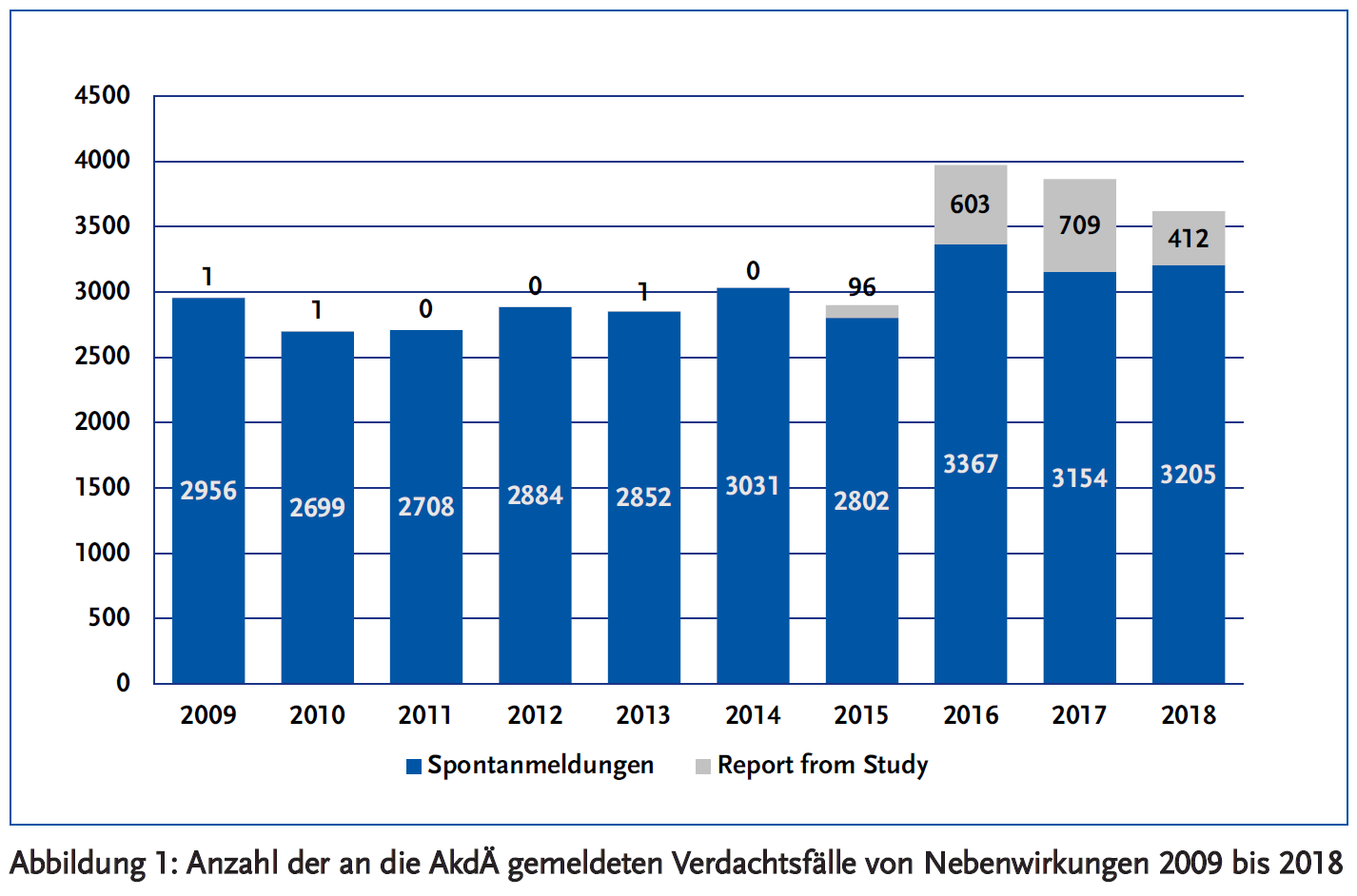
Im Jahr 2018 gingen 3617 Meldungen zu unerwünschten Wirkungen von Arzneimitteln bei der AkdÄ ein (Abbildung 1). Meldungen an die AkdÄ stellen nur einen Teil der aus Deutschland gemeldeten Verdachtsfälle von Nebenwirkungen dar: Weitere Fälle werden an eine der zuständigen Bundesoberbehörden gemeldet (Bundesinstitut für Arzneimittel und Medizinprodukte, BfArM, und Paul-Ehrlich-Institut, PEI) oder an den pharmazeutischen Unternehmer des verdächtigten Arzneimittels. Meldungen werden schließlich in die zentrale europäische Datenbank weitergeleitet. Diese Datenbank ist bei der Europäischen Arzneimittel-Agentur (EMA) angesiedelt; sie bietet die Möglichkeit Online-Recherchen durchzuführen (http://www.adrreports.eu). Darüber hinaus ist bei Spontanmeldungen zu beachten: Es handelt sich lediglich um Verdachtsfälle. Im Einzelfall ist nicht gesichert, dass eine beobachtete Reaktion tatsächlich auf das angeschuldigte Arzneimittel zurückzuführen ist. Weiterhin lässt die Zahl von Spontanmeldungen zu einem bestimmten Arzneimittel einen direkten Rückschluss auf die tatsächliche Zahl der aufgetretenen Nebenwirkungen nicht zu. Auch Vergleiche der Zahlen von Nebenwirkungsmeldungen zu einzelnen Medikamenten untereinander sind problematisch. Es kann viele Gründe geben, warum zu dem einen Medikament eher viele und zu einem anderen eher wenige Meldungen abgegeben werden.
Der leichte Rückgang der Meldungen an die AkdÄ gegenüber dem Vorjahr (2017: 3863 Fälle) ist auf eine Abnahme von Fallmeldungen aus Studien zurückzuführen, während die Zahl der spontan gemeldeten Fälle (n = 3205) leicht zugenommen hat (Abbildung 1). Die Studienmeldungen aus den Jahren 2015 bis 2018 stammen ganz überwiegend aus einem Register für akute Schlaganfälle unter neuen oralen Antikoagulanzien (RASUNOA-Prime, NCT02533960), das bundesweit in etwa 50 neurologischen Kliniken mit Stroke Units konsekutiv Patienten mit Vorhofflimmern und akutem Schlaganfall (ischämischer Schlaganfall oder intrazerebrale Blutung) einschließt. Aus dieser Studie werden ischämische Schlaganfälle oder intrazerebrale Blutungen unter laufender oraler Antikoagulation als Verdachtsfälle von Nebenwirkungen an die AkdÄ berichtet. In der folgenden Analyse werden Meldungen aus Studien nicht weiter berücksichtigt.
Analyse der Spontanmeldungen
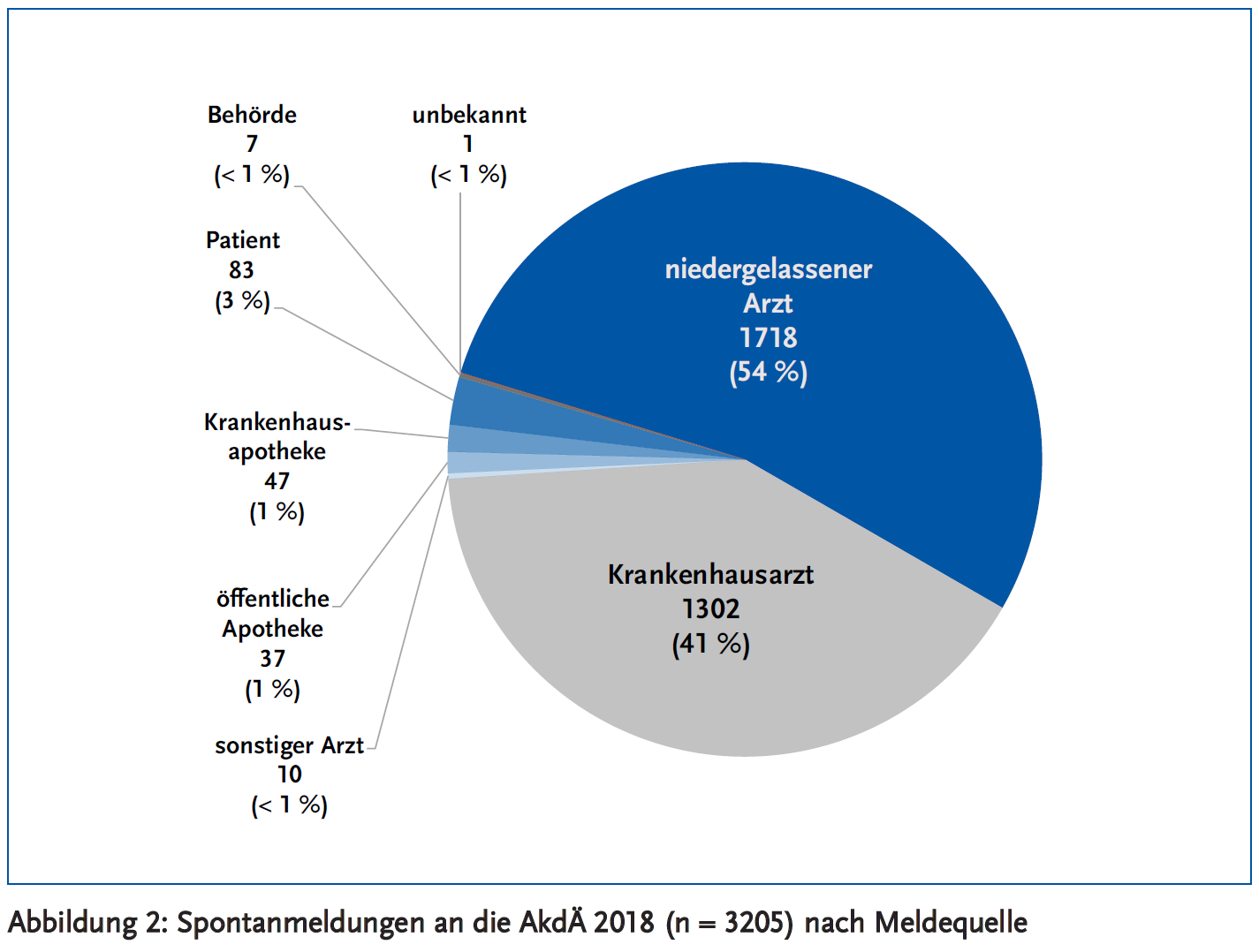
Die spontan (also außerhalb von Studien) gemeldeten Fälle stammen zu 95 % von Ärzten, die im Krankenhaus oder in der Praxis tätig sind (Abbildung 2). Der verbleibende Anteil wurde zum größten Teil von betroffenen Patienten (3 %) oder von Apothekern (2 %) an die AkdÄ gemeldet.
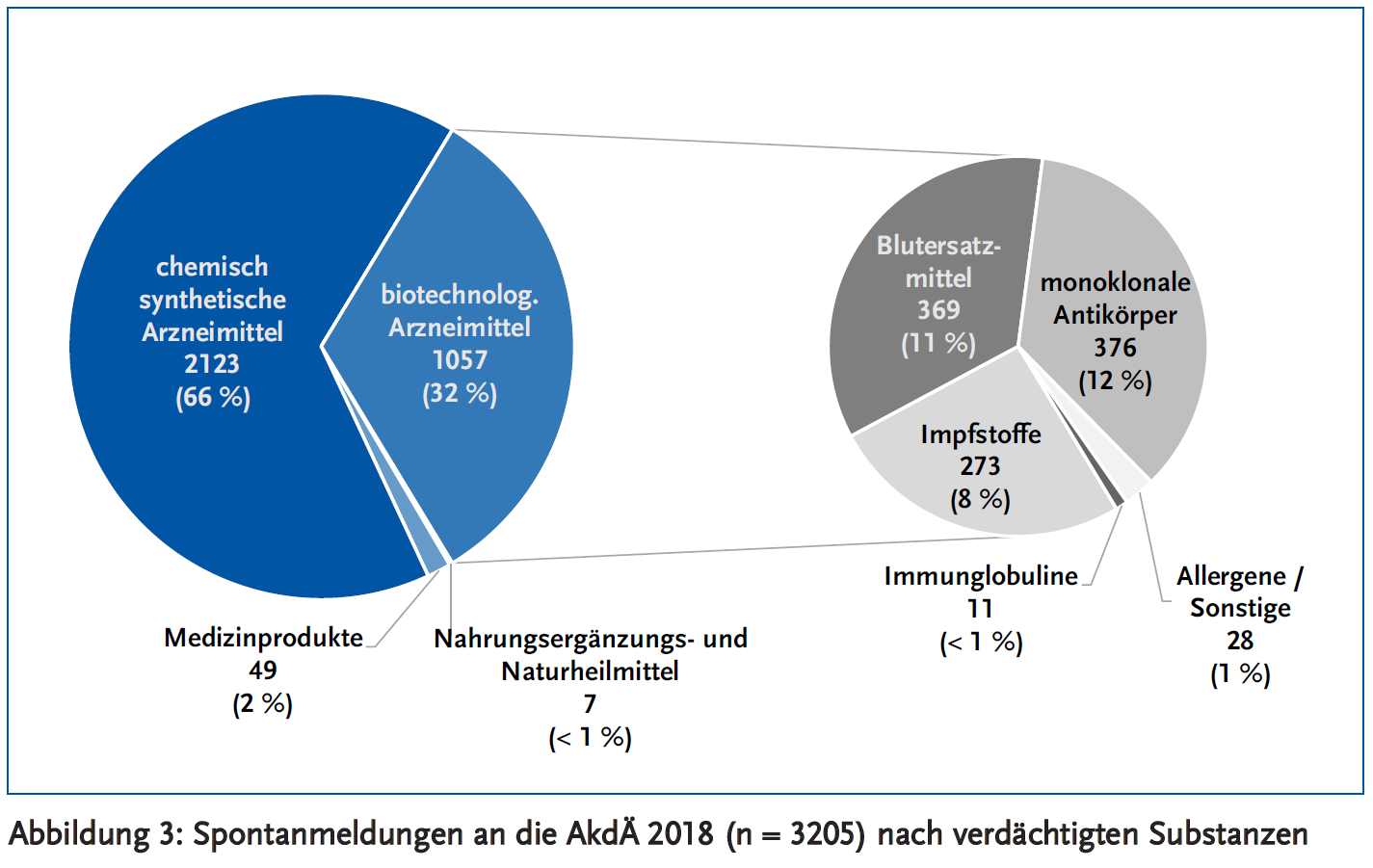
In etwa zwei Drittel der Meldungen werden chemisch-synthetische Arzneimittel als ursächlich für die beobachtete Reaktion angegeben und in knapp einem Drittel biotechnologische Arzneimittel (Abbildung 3). Für die vorliegende Auswertung wurden nur solche Arzneimittel als biotechnologisch eingestuft, die in die Zuständigkeit des PEI fallen, wie Impfstoffe, Blutprodukte oder monoklonale Antikörper. Arzneimittel, die zwar biotechnologisch hergestellt werden, für die aber das BfArM zuständig ist, wurden den chemisch-synthetischen Arzneimitteln zugeordnet (z. B. Etanercept, Filgrastim oder Erythropoetine). Ein kleinerer Teil der Meldungen bezieht sich auf Medizinprodukte, Nahrungsergänzungs- und Naturheilmittel. Von den biotechnologischen Arzneimitteln entfallen die meisten auf monoklonale Antikörper, gefolgt von Blutersatzmitteln und Impfstoffen. Einen geringen Teil machen Allergene und Immunglobuline aus. Bezüglich der Meldungen zu Blutersatzmitteln, auf die in diesem Bericht nicht im Detail eingegangen wird, wird auf die Hämovigilanz-Berichte des Paul-Ehrlich-Instituts verwiesen: https://www.pei.de/DE/infos/patienten/publikationen/functions/blut-bundesgesundheitsblatt/sicherheit-blut-bundesgesundheitsblatt-node.html.

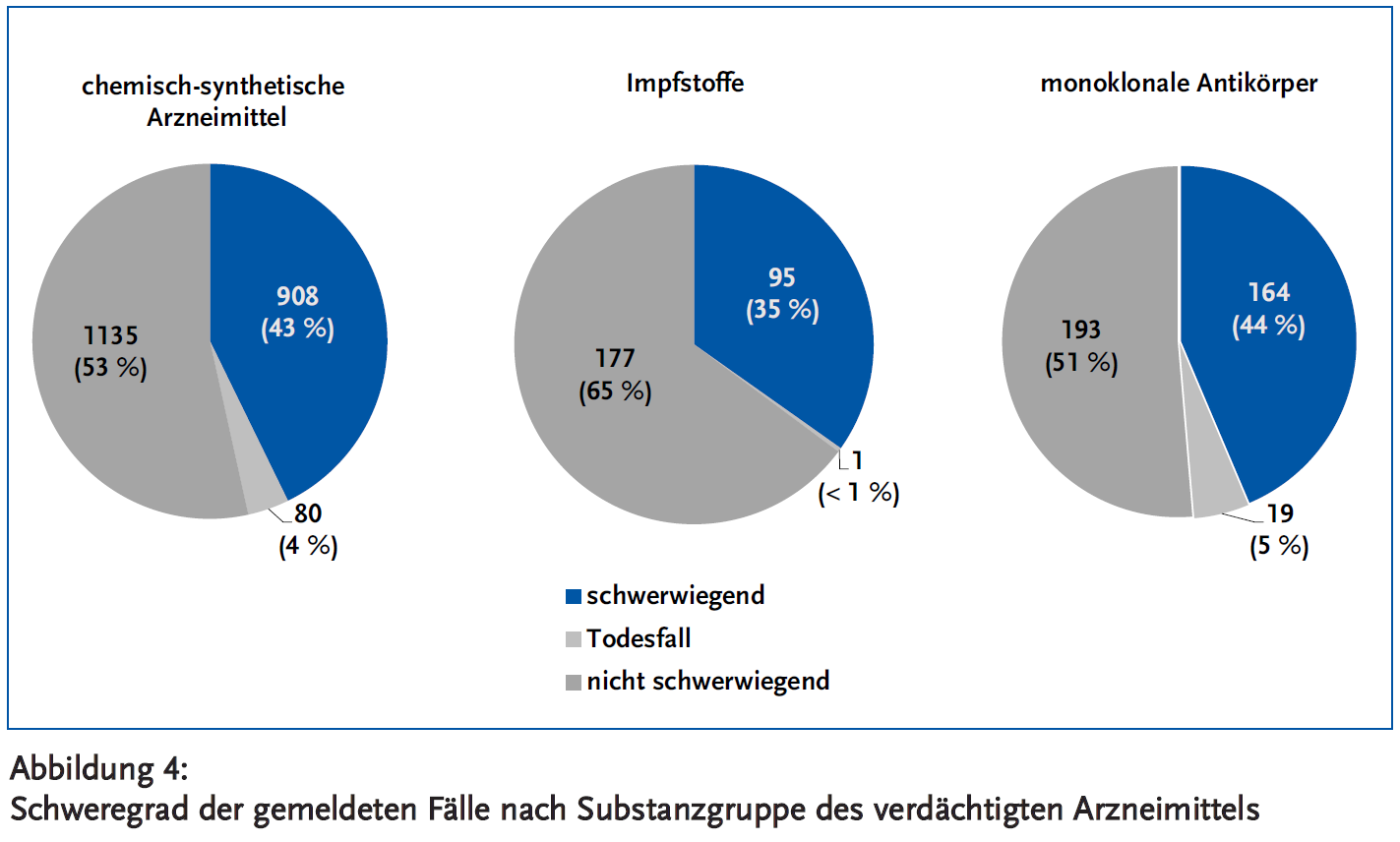
Bei der Bewertung der gemeldeten Fälle wird nach international gültigen Kriterien festgelegt, ob die Nebenwirkung als schwerwiegend oder als nicht schwerwiegend einzuordnen ist (1). Der Anteil der schwerwiegenden Fälle war mit 49 % am höchsten bei monoklonalen Antikörpern (einschließlich Todesfällen) und bei Fällen zu Impfstoffen (35 %) am niedrigsten (Abbildung 4).
Darüber hinaus werden die Fälle bei der AkdÄ in drei Kategorien (A, B, C) entsprechend der CIOMS Working Group V eingeordnet (2). Die Kategorien richten sich nach dem Schweregrad und danach, ob die gemeldete Nebenwirkung in der Fachinformation des verdächtigten Arzneimittels aufgeführt wird Besonders wichtig für die Pharmakovigilanz sind Fälle der Kategorie C, die schwerwiegend sind und die nicht in der Fachinformation gelistet werden (siehe Tabelle 1). Solche Fälle können wichtige Sicherheitssignale darstellen und Maßnahmen erforderlich machen, um das Risiko der Anwendung des Arzneimittels für Patienten zu senken.
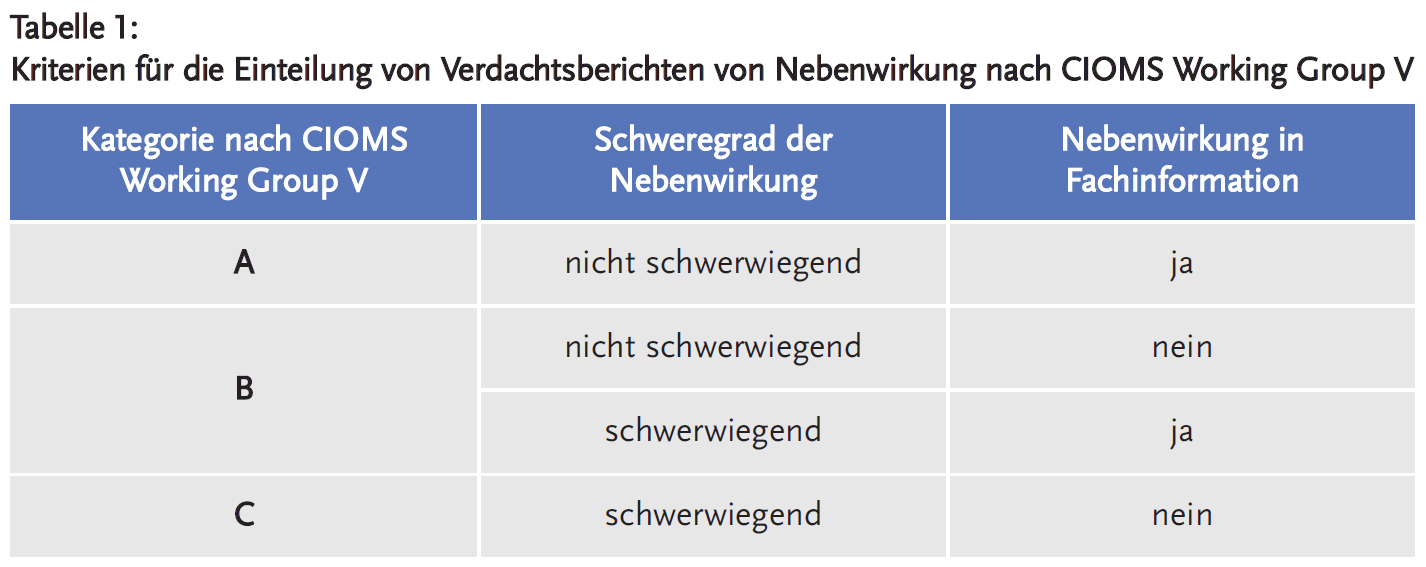
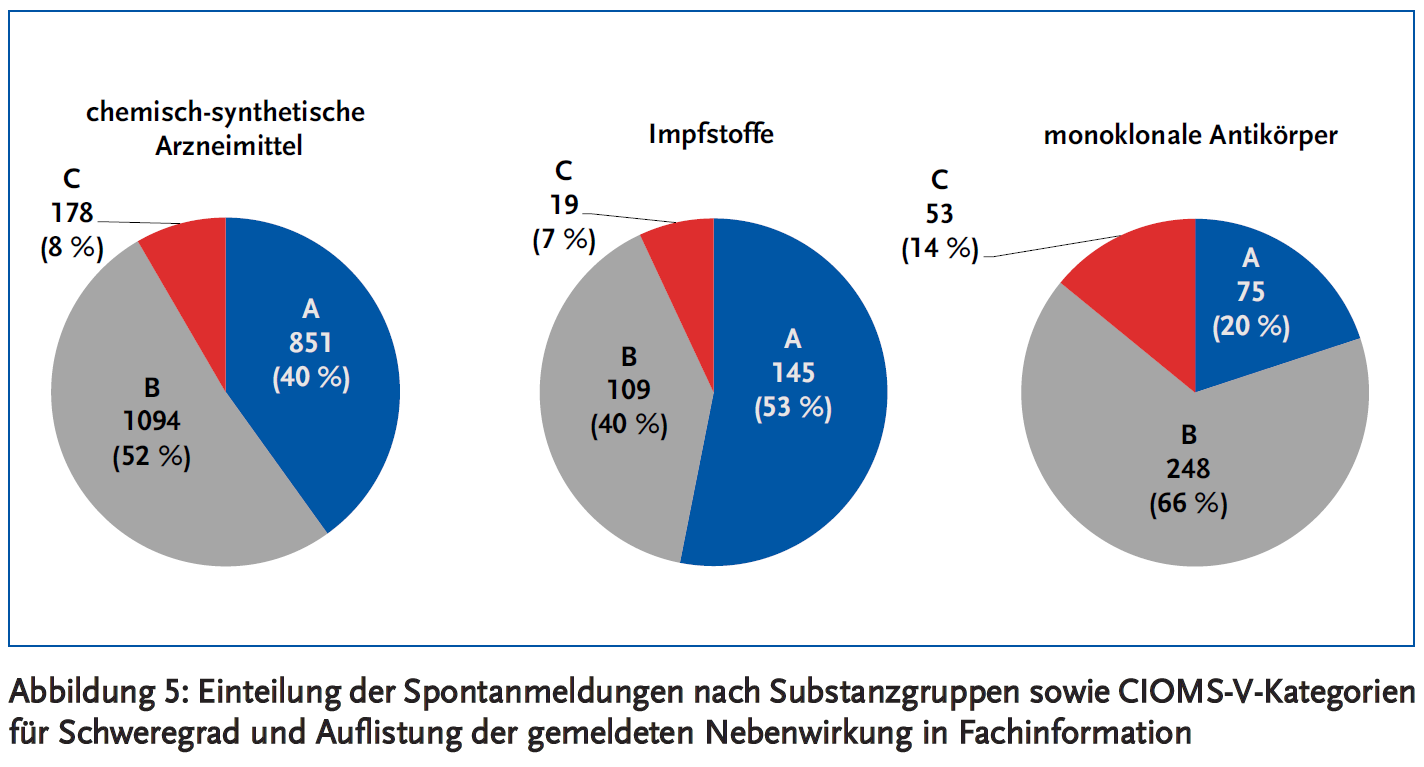
Der Anteil an gemeldeten Nebenwirkungen, die nicht schwerwiegend sind und in den Fachinformationen genannt werden (Kategorie A), ist bei Impfstoffen mit etwas über 50 % am größten (Abbildung 5). So werden bei Impfstoffen häufig Lokalreaktionen an der Injektionsstelle gemeldet. Bei den monoklonalen Antikörper machen Nebenwirkungen der Kategorie A nur 20 % aus, während Nebenwirkungen der Kategorien B und C häufiger sind als bei chemisch-synthetischen Arzneimitteln und Impfstoffen.
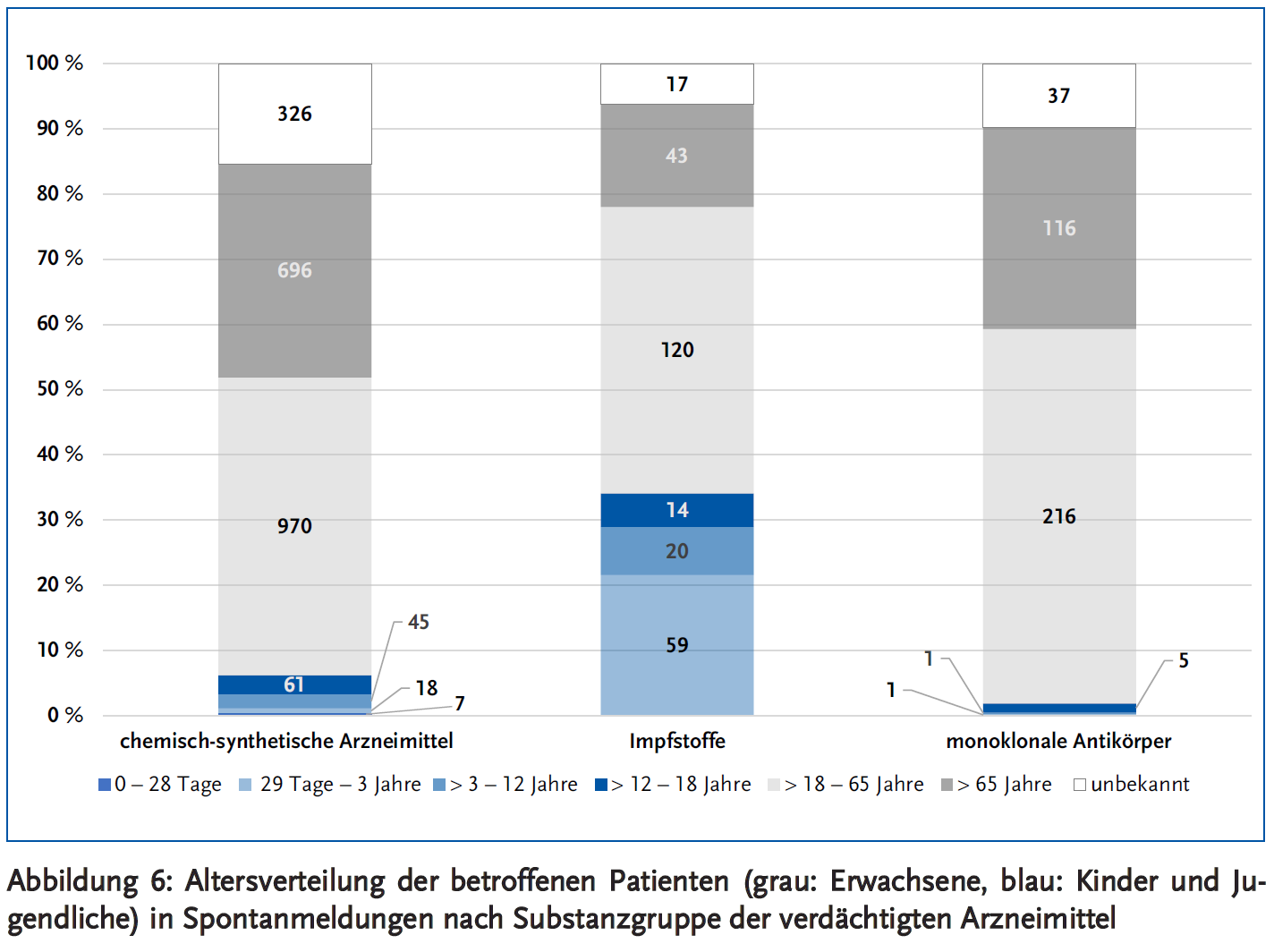
In etwa 55 % der Verdachtsberichte sind die betroffenen Patienten weiblich, in 43,5 % männlich und in den restlichen 1,5 % ist das Geschlecht unbekannt. Die Geschlechterverteilung unterscheidet sich nicht zwischen Meldungen zu chemisch-synthetischen Arzneimittel, Impfstoffen und monoklonalen Antikörpern. Anders sieht es bei der Altersverteilung der Patienten zwischen den drei Substanzgruppen aus: Bei den Meldungen zu Impfstoffen machen Kinder und Jugendliche ungefähr ein Drittel der Betroffenen aus, während ihr Anteil bei den chemisch-synthetischen Arzneimitteln und den Antikörpern bei nur etwa 6 % bzw. unter 2 % liegt (Abbildung 6).
Analyse der am häufigsten verdächtigten Arzneimittel in Nebenwirkungsmeldungen
Bei den folgenden Auswertungen wurden Blutprodukte und Impfstoffe nicht berücksichtigt. Zu diesen Substanzen wird auf den oben bereits erwähnten Hämovigilanz-Bericht bzw. Publikationen zu Impfstoffen des Paul-Ehrlich-Instituts verwiesen (3;4).
Nicht schwerwiegende Fälle: Bei den gemeldeten Verdachtsfällen, die als nicht schwerwiegend eingestuft werden, lagen im Jahr 2018 Arzneimittel gegen Fettstoffwechselstörungen an der Spitze. Am häufigsten angeschuldigt wurden Statine und Ezetimib, die beiden PCSK9-Hemmer Evolocumab und Alirocumab sowie der Anionenaustauscher Colesevelam. Ursächlich für die zahlreichen Meldungen aus diesem Indikationsgebiet ist neben der breiten Anwendung dieser Arzneimittel auch die Richtlinie des Gemeinsamen Bundesausschusses (G-BA) zu Untersuchungs- und Behandlungsmethoden der vertragsärztlichen Versorgung (5): Für die Indikationsstellung von LDL-Apheresen bei Hypercholesterinämie ist vorgeschrieben, dass Nebenwirkungen, die zu einer Änderung oder einem Absetzen der jeweiligen medikamentösen Therapie geführt haben, durch eine Nebenwirkungsmeldung an die AkdÄ oder das BfArM belegt werden sollen. Gemeldet werden in diesem Zusammenhang vor allem bekannte, in der Regel nicht schwerwiegende Reaktionen wie Myalgien unter Statinen. Bei Evolocumab und Alirocumab werden Muskel- und Gelenkschmerzen, Kopfschmerzen und grippeähnliche Erkrankungsbilder am häufigsten berichtet.
Schwerwiegende Fälle: Unter den Arzneimitteln, die verdächtigt werden, schwerwiegende Reaktionen ausgelöst zu haben, werden seit Jahren die oralen Antikoagulanzien mit am häufigsten genannt. Dies betrifft sowohl Phenprocoumon als auch die direkten oralen Antikoagulanzien (Apixaban, Dabigatran, Edoxaban, Rivaroxaban). Gemeldet werden vor allem Blutungen, die am Gastrointestinaltrakt oder ZNS lokalisiert sind, aber auch seltenere Blutungsereignisse wie z. B. Psoasblutungen, die im Alltag diagnostische Schwierigkeiten bereiten können. Da sich aus den Spontanmeldungen keine Vergleiche des Blutungsrisikos zwischen den einzelnen Wirkstoffen ableiten lassen, hat sich die AkdÄ an einer Analyse von Krankenkassendaten zu diesem Thema beteiligt, die Mitte 2018 publiziert wurde (6).
Unter den häufiger gemeldeten schwerwiegenden Nebenwirkungen fallen weiterhin Meldungen über Agranulozytosen und andere Blutbildstörungen im Zusammenhang mit Metamizol auf. Obwohl diese Nebenwirkungen sehr selten sind, führt die breite Anwendung von Metamizol zwangsläufig zu einer relevanten Zahl betroffener Patienten. Im Jahr 2018 erreichten die AkdÄ hierzu über 30 Berichte, von denen einzelne auch einen tödlichen Ausgang berichteten. Es ist bemerkenswert, dass in einigen Fällen eine Begleitmedikation mit Methotrexat angegeben wird. Wegen einer verstärkten Hämatotoxizität sollte die Kombination von Metamizol und Methotrexat laut Fachinformation vermieden werden. Aus einigen anderen Meldungen geht hervor, dass auch bei Patienten mit mehreren verdächtigen Symptomen (Fieber, Tonsillitis, Stomatitis aphthosa) die Agranulozytose nicht immer zeitgerecht erkannt wird. Dies ist problematisch, weil bei einer verzögerten Diagnose eine Agranulozytose zu einem lebensbedrohlichen septischen Krankheitsbild führen kann. Die AkdÄ hat mehrfach auf die Risiken von Metamizol hingewiesen und sich auch an Empfehlungen beteiligt, die die Sicherheit verbessern sollen (7-9).
Auch die beiden SGLT-2-Inhibitoren Empagliflozin und Dapagliflozin wurden 2018 in Meldungen häufiger genannt, wobei in erster Linie diabetische Ketoazidosen sowie einige Fälle von Fournier Gangrän berichtet wurden. Zu beiden Nebenwirkungen existieren Informations- bzw. Rote-Hand-Briefe (10;11). Die AkdÄ hat vor dem Hintergrund der Fallmeldungen zu Ketoazidosen Empfehlungen gegeben, wie diese Risiken gemindert werden können (siehe unten).
Zu den häufiger berichteten schwerwiegenden Nebenwirkungen zählen darüber hinaus venöse thromboembolische Ereignisse unter kombinierten oralen Kontrazeptiva. Das Risiko dieser insgesamt seltenen Ereignisse hängt neben individuellen Faktoren der Patienten auch vom jeweiligen Gestagenanteil der Kombinationspräparate ab (12).
Seit einigen Jahren werden vermehrt immunvermittelte Nebenwirkungen an die AkdÄ gemeldet, die durch sogenannte Checkpoint-Inhibitoren wie z. B. Pembrolizumab und Nivolumab verursacht werden können. Die Reaktionen können prinzipiell an allen Organen auftreten und sich z. B. als Pneumonitis, Thyreoiditis oder Kolitis manifestieren (13).
Weitere Themen der Arzneimittelsicherheit
Vor dem Hintergrund von einzelnen Nebenwirkungsmeldungen oder von wissenschaftlichen Publikationen hat sich die AkdÄ mit weiteren Themen der Arzneimittelsicherheit beschäftigt. Im Folgenden werden einige dieser Themen kurz zusammengefasst.
Schwere Immundefekte nach Behandlung mit Rituximab
Während und nach der Behandlung mit Rituximab können Immundefekte mit protrahierter Depletion der B-Lymphozyten und/oder Hypogammaglobulinämie vorkommen und schwere Infektionen verursachen. Die Lymphozytenzahl und die Konzentration der Immunglobuline sollten daher regelmäßig kontrolliert werden und bei schwerer Hypogammaglobulinämie frühzeitig Immunglobuline substitutiert werden. Da Immundefekte nach Rituximab persistieren können, sollten Patienten mit auffälligen Befunden auch nach Behandlungsende überwacht werden. Vor Behandlungsbeginn sollte möglichst der Impfschutz aufgefrischt werden. Bei der Diagnostik von Infektionen im Zusammenhang mit einer Rituximab-Behandlung können virusspezifische Immunglobuline eventuell fehlen, sodass der direkte Virusnachweis mittels PCR erwogen werden sollte (14).
Kontaktallergien nach Verwendung von FreeStyle Libre
Das FreeStyle Libre Flash Glukose Messsystem ist ein Medizinprodukt zur Messung von Glukosespiegeln in der interstitiellen Flüssigkeit bei Personen mit Diabetes mellitus. Es besteht aus einem tragbaren Lesegerät und einem Einwegsensor, der am Körper getragen wird. Die Anwendung des Messsystems kann zu einer Kontaktallergie gegen den Einwegsensor führen. In der Gebrauchsinformation wird angegeben, dass manche Personen möglicherweise empfindlich auf die Klebefolie reagieren, die den Sensor auf der Haut fixiert. Zwei publizierte Untersuchungen von Patienten mit Hautreaktionen an der Applikationsstelle sprechen jedoch dafür, dass es sich um Kontaktallergien auf Isobornylacrylat (IBOA) handelt. Dieses bekannte Allergen wurde nicht in der Klebefolie, sondern im Sensor selbst nachgewiesen und wird dort vermutlich zum Verbinden von Plastikteilen verwendet (15).
Versehentliche intrathekale Applikation von Vincristin
Vincristin ist zugelassen zur Behandlung verschiedener insbesondere hämatologischer Neoplasien (z. B. akute lymphatische Leukämie, maligne Lymphome, multiples Myelom). Als „Spindelgift“ hemmt Vincristin die Zellteilung, indem es die Funktion des Spindelapparates beeinträchtigt und es kann auf die RNA- und DNA-Synthese einwirken. Vincristin ist neurotoxisch, passiert bei intravenöser Anwendung jedoch nur in geringem Maße die Blut-Hirn-Schranke. Die versehentliche intrathekale Applikation von Vincristin endet auch bei zeitnahen neurochirurgischen Interventionen zumeist tödlich. Die wenigen Überlebenden trugen schwere neurologische Folgeschäden davon (16).
Kann Metamizol die Wirkung von ASS auf die Thrombozytenaggregation behindern? – hinsichtlich klinischer Relevanz und Empfehlungen für die Praxis bleiben Fragen offen
Einige experimentelle Untersuchungen sowie einzelne Beobachtungsstudien an Patienten legen nahe, dass Metamizol bei gleichzeitiger Anwendung die Wirkung von niedrig dosierter ASS auf die Thrombozytenaggregation vermindern kann. Ein Hinweis auf diese potenzielle Interaktion wurde 2014 in die Fachinformation von Metamizol aufgenommen. Jedoch bestätigen nicht alle Untersuchungen diese Interaktion eindeutig und die bislang verfügbaren unkontrollierten Studien zur klinischen Relevanz beruhen auf sehr kleinen Patientenzahlen und lassen noch keine abschließenden Empfehlungen zu (17).
Induktion und/oder Demaskierung von chronisch-entzündlichen Darmerkrankungen unter Secukinumab
Secukinumab ist ein monoklonaler Antikörper, der selektiv an das proinflammatorisch wirkende Interleukin-17A (IL-17A) bindet und es neutralisiert. Daten aus vorklinischen und klinischen Studien sowie Einzelfälle, die der AkdÄ berichtet wurden, sprechen für einen Zusammenhang zwischen der Gabe des Anti-IL-17A-Antikörpers Secukinumab (Cosentyx®) und der Verschlechterung einer vorbestehenden chronisch-entzündlichen Darmerkrankung (CED) und möglicherweise auch der Erstmanifestation. Aufgrund des ähnlichen Wirkmechanismus handelt es sich wahrscheinlich um einen Gruppeneffekt, der auch für die beiden anderen Antikörper zutrifft, die über IL-17A wirken (Ixekizumab (Taltz®) und Brodalumab (Kyntheum®)). Das Risiko liegt nach Auswertung von Daten zu Ixekizumab vermutlich bei unter 1 %. Im Vergleich zur Normalbevölkerung haben Patienten mit einer Psoriasis per se ein höheres Risiko für M. Crohn und Colitis ulcerosa. Bei einer bekannten, vorbestehenden CED sollte eine Behandlung mit einem Anti-IL-17A-Antikörper nur nach sorgfältiger Nutzen-Risiko-Abwägung im Einzelfall erfolgen und dann engmaschig überwacht werden. Laut Fachinformation ist Brodalumab bei aktivem M. Crohn explizit kontraindiziert (18).
Plattenepithelkarzinom des Penis im Zusammenhang mit Fingolimod
Fingolimod ist zugelassen zur krankheitsmodifizierenden Monotherapie der hochaktiven schubförmig-remittierenden Multiplen Sklerose. Der AkdÄ wurde der Fall eines 37-jährigen Patienten gemeldet, der nach fünfjähriger Behandlung mit Fingolimod ein peniles Plattenepithelkarzinom entwickelt hat. Aufgrund einer Psoriasis bestanden seit längerem Hautveränderungen am Penis, sodass der Patient sich erst 18 Monate nach (neuerlicher) Veränderung des Hautbilds ärztlich vorstellte und die Diagnose daher nur verzögert gestellt werden konnte. Plattenepithelkarzinome der Haut sind keine bekannte Nebenwirkung von Fingolimod. Der Patient ist ungewöhnlich jung für ein Plattenepithelkarzinom und die Lokalisation des Karzinoms an einer selten lichtexponierten Stelle ist untypisch. Eine (Mit-)Verursachung durch Fingolimod erscheint daher zumindest denkbar. Da Basalzellkarzinome als Nebenwirkung von Fingolimod bekannt sind, soll die Haut (auch die nicht lichtexponierten Stellen) regelmäßig inspiziert und der Patient ggf. an einen Dermatologen überwiesen werden. Patienten sollten über das Risiko von Hautveränderungen informiert und aufgefordert werden, alle verdächtigen Hautläsionen ohne Zeitverzug ihren behandelnden Ärzten zu berichten (19).
Hydrochlorothiazid: Risiko von nichtmelanozytärem Hautkrebs – Empfehlungen der AkdÄ zur Behandlung von Hypertonie und Herzinsuffizienz (20)
Ein Rote-Hand-Brief vom Oktober 2018 weist auf das Risiko des nichtmelanozytären Hautkrebses im Zusammenhang Hydrochlorothiazid (HCT) hin. Die AkdÄ empfiehlt für die Behandlung der arteriellen Hypertonie und der Herzinsuffizienz mit HCT zusammenfassend Folgendes:
- Eine generelle Therapieumstellung aller mit HCT behandelten Patienten ist nicht erforderlich und sollte individuell geprüft werden.
- Chlortalidon ist eine mögliche Alternative zu HCT. Zum Hautkrebsrisiko im Zusammenhang mit Chlortalidon liegen keine Daten vor.
- Wenn HCT angewendet wird, sollten die im Rote-Hand-Brief genannten Empfehlungen befolgt werden (z. B. regelmäßige Hautinspektion; UV-Schutz).
- Weitere Studien zum Risiko von (Haut-)Krebs im Zusammenhang mit Diuretika und anderen Arzneimitteln zur Behandlung der Hypertonie und der Herzinsuffizienz sollten durchgeführt werden.
Meldungen von Nebenwirkungen
Leitfaden „Nebenwirkungen melden“
Im März 2019 ist zu der Frage, welche Nebenwirkungen Ärzte melden sollten und warum, ein kompakter Leitfaden erschienen. Er gibt Antworten auf diese Fragen und bietet weitere Informationen zum Melden von Nebenwirkungen. Unter anderem wird dargestellt, wie Ärzte Nebenwirkungen melden sollten und was dabei hinsichtlich des Datenschutzes und der ärztlichen Schweigepflicht beachtet werden muss. Darüber hinaus wird dargestellt, was mit den Informationen aus den Nebenwirkungsmeldungen eigentlich geschieht.
Download (PDF):https://www.akdae.de/Arzneimitteltherapie/LF/PDF/Nebenwirkungen_melden.pdf.
Fazit
Spontanmeldungen von Nebenwirkungen sind eines der wichtigsten Instrumente, um Risiken von Arzneimitteln frühzeitig zu erfassen. Meldungen an die AkdÄ werden zum einen anderen Institutionen wie der EMA und der WHO für die Signaldetektion und für Risikobewertungsverfahren zur Verfügung gestellt. Zum anderen sind die gemeldeten Einzelfälle die Basis für eigene Bewertungen der AkdÄ, deren Ergebnisse sie der Ärzteschaft durch Risikoinformationen wie Drug Safety Mails oder Mitteilungen im Deutschen Ärzteblatt weitergibt.
Interessenkonflikte
Ein Interessenkonflikt wird von den Autoren verneint.
Literatur
- Clinical Safety Data Management: Definitions and Standards for Expedited Reporting E2a – Current Step 4 version: www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Efficacy/E2A/Step4/E2A_Guideline.pdf (letzter Zugriff: 17. Juli 2019). ICH Harmonised Tripartite Guideline, 27. Oktober 1994.
- Current Challenges in Pharmacovigilance: Pragmatic Approaches. Report of CIOMS Working Group V. Geneva: Council for International Organizations of Medical Sciences (CIOMS), 2001.
- Oberle D, Mentzer D, Rocha F et al.: Komplikationen nach Schutzimpfungen bei Kindern und Erwachsenen mit Hinweis auf einen kausalen Zusammenhang. Bulletin zur Arzneimittelsicherheit 2019; 10 (1): 15-23.
- Mentzer D, Oberle D, Keller-Stanislawski B: Daten zur Pharmakovigilanz von Impfstoffen aus dem Jahr 2017. Bulletin zur Arzneimittelsicherheit 2019; 10 (1): 19-27.
- Gemeinsamer Bundesausschuss (G-BA): Richtlinie zu Untersuchungs- und Behandlungsmethoden der vertragsärztlichen Versorgung (Richtlinie Methoden vertragsärztliche Versorgung): www.g-ba.de/downloads/62-492-1842/MVV-RL_2019-02-21-iK_2019-04-01.pdf (letzter Zugriff: 17. Juli 2019). Zuletzt geändert am 21. Februar 2019, In Kraft getreten am 1. April 2019.
- Ujeyl M, Koster I, Wille H et al.: Comparative risks of bleeding, ischemic stroke and mortality with direct oral anticoagulants versus phenprocoumon in patients with atrial fibrillation. Eur J Clin Pharmacol 2018.
- Stamer UM, Gundert-Remy U, Biermann E et al.: Metamizol: Überlegungen zum Monitoring zur frühzeitigen Diagnose einer Agranulozytose. Schmerz 2016: Epub ahead of print.
- Stammschulte T, Ludwig W-D, Muhlbauer B et al.: Metamizole (dipyrone)-associated agranulocytosis. An analysis of German spontaneous reports 1990-2012. Eur J Clin Pharmacol 2015; 71: 1129-1138.
- Arzneimittelkommission der deutschen Ärzteschaft: "Aus der UAW-Datenbank": Agranulozytose nach Metamizol - sehr selten, aber häufiger als gedacht. Dtsch Arztebl 2011; 108: A 1758-1759.
- Arzneimittelkommission der deutschen Ärzteschaft: Informationsbrief zu SGLT-2-Inhibitoren: Risiko einer diabetischen Ketoazidose - aktualisierte Hinweise. AkdÄ Drug Safety Mail 2016-11 vom 15. März 2016.
- Arzneimittelkommission der deutschen Ärzteschaft: Informationsbrief zu SGLT-2-Inhibitoren: Risiko einer diabetischen Ketoazidose. AkdÄ Drug Safety Mail 2015-20 vom 10. Juli 2015.
- Arzneimittelkommission der deutschen Ärzteschaft: "UAW-News International": Bei der Verschreibung von kombinierten hormonalen Kontrazeptiva sollte das Risiko für thromboembolische Ereignisse berücksichtigt werden. Dtsch Arztebl 2014; 111: A 1533-1534.
- Postow MA, Sidlow R, Hellmann MD: Immune-Related Adverse Events Associated with Immune Checkpoint Blockade. N Engl J Med 2018; 378: 158-168.
- Arzneimittelkommission der deutschen Ärzteschaft: „Aus der UAW-Datenbank“: Schwere Immundefekte nach Behandlung mit Rituximab. Dtsch Arztebl 2018; 115: A 2313-2314.
- Arzneimittelkommission der deutschen Ärzteschaft: „Aus der UAW-Datenbank“: Kontaktallergien nach Verwendung von FreeStyle Libre. Dtsch Arztebl 2018; 115: A 2260-2261.
- Arzneimittelkommission der deutschen Ärzteschaft: „Aus Fehlern lernen": Versehentliche intrathekale Applikation von Vincristin. Dtsch Arztebl 2018; 115: A 1237-1239.
- Arzneimittelkommission der deutschen Ärzteschaft: „UAW-News International“: Kann Metamizol die Wirkung von ASS auf die Thrombozytenaggregation behindern? – hinsichtlich klinischer Relevanz und Empfehlungen für die Praxis bleiben Fragen offen. Dtsch Arztebl 2018; 115: A 897-898.
- Arzneimittelkommission der deutschen Ärzteschaft: „Aus der UAW-Datenbank“: Induktion und/oder Demaskierung von chronisch-entzündlichen Darmerkrankungen unter Secukinumab (Cosentyx®). Dtsch Arztebl 2018; 115: A 672-674.
- Arzneimittelkommission der deutschen Ärzteschaft: „Aus der UAW-Datenbank“: Plattenepithelkarzinom des Penis im Zusammenhang mit Fingolimod. Dtsch Arztebl 2018; 115: A 551-552.
- Arzneimittelkommission der deutschen Ärzteschaft: Hydrochlorothiazid: Risiko von nichtmelanozytärem Hautkrebs – Empfehlungen der AkdÄ zur Behandlung von Hypertonie und Herzinsuffizienz. Arzneiverordnung in der Praxis (AVP) 2019; 46: 19-23.
vorab online
Dieser Artikel wurde am 16. August 2019 vorab online veröffentlicht.
