Opioidinduzierte Obstipation
Zusammenfassung
Opioide haben einen bedeutenden Stellenwert in der Therapie starker Schmerzen und kommen bei chronischen Schmerzen auch häufig längerfristig zum Einsatz. Neben der gewünschten Analgesie, die über µ-Opioidrezeptoren im Gehirn vermittelt wird, führen Opioide gleichzeitig durch Aktivierung peripherer µ-Opioidrezeptoren im enterischen Nervensystem zu verschiedenen gastrointestinalen Nebenwirkungen. Ein führendes Problem stellt dabei die opioidinduzierte Obstipation (opioid-induced obstipation, OIC) dar, welche nicht nur die Lebensqualität der Patienten beeinträchtigt und Therapieabbrüche fördert, sondern auch Komplikationen verursachen kann. Daher ist ein verstärktes Bewußtsein für diese Begleitproblematik einer Opioidbehandlung wichtig, und eine OIC sollte frühzeitig erfasst und behandelt werden. Dabei sollen im Sinne eines Stufenschemas zu Beginn zunächst herkömmliche, symptomatische Behandlungsformen der Obstipation zum Einsatz kommen. Bei unzureichendem Effekt oder schlechter Verträglichkeit sind die neuen, peripher aktiven µ-Opioidrezeptorantagonisten (peripherally-acting µ-opioid receptor antagonists, PAMORA) Reservepräparate, deren Stellenwert derzeit nicht abschließend beurteilt werden kann.
Abstract
Opioids are of great value in the treatment of strong pain. The analgesic effects of opioids are mediated by µ-opioid receptors in the central nervous system. By activating peripheral µ-opioid receptors in the enteric nervous system they evoke miscellaneous gastrointestinal side effects. A leading problem is opioid-induced obstipation (OIC), which not only affects the quality of life of the patients and leads to therapy discontinuation, but can also cause complications. Therefore, it is important to be aware of these accompanying problems of opioid treatment, and an OIC should be recognised and treated early. At first, conventional symptomatic forms of treatment of obstipation should be used within an escalation plan. In case of insufficient efficacy or poor tolerance new, peripherally-acting µ-opioid receptor antagonists (PAMORA) can be used despite uncertainties concerning the efficacy.
Die Rolle von Opioiden im Gastrointestinaltrakt
Die wesentlichen Funktionen des Gastrointestinaltraktes (GIT), wie z. B. die intestinale Motilität, Sekretion, Resorption und Durchblutung, werden durch das enterische Nervensystem (ENS) weitgehend unabhängig vom zentralen Nervensystem (ZNS) gesteuert. Der Plexus myentericus des ENS erstreckt sich zwischen der Längs- und Ringmuskelschicht und ist maßgeblich für die Steuerung der Darmmuskulatur verantwortlich. Der Plexus submucosus besteht aus einem inneren und äußeren ganglionären Nervengeflecht, liegt in Nachbarschaft zur Mukosa und ist für die luminale Reizaufnahme sowie Steuerung der Sekretion verantwortlich.
Eine der wichtigsten Funktionen des ENS ist der peristaltische Reflex (Abbildung 1) zur Steuerung der propulsiven motorischen Aktivität. Grundlage für den peristaltischen Reflex sind lokale Reflexbögen auf der Ebene des ENS. Dabei nehmen afferente Neurone luminale Reize auf und leiten sie über Interneurone an efferente Neurone weiter, die dann das sogenannte Effektororgan (glatte Muskelzellen der Darmwand) erreichen. Die Weiterleitung über Interneurone erfolgt dabei sowohl in orale als auch in aborale Richtung, um eine räumlich und zeitlich koordinierte Bewegung der Darmwandmuskulatur zu gewährleisten. Oralwärts wird durch exzitatorische Neurone eine Kontraktion der Darmwandmuskulatur hervorgerufen, die den Speisebolus in aborale Richtung schiebt. Aboralwärts wird durch inhibitorische Neurone eine Relaxation der Darmwandmuskulatur hervorgerufen, die das Darmrohr erweitert und somit die Passage des Speisebolus nach aboral freigibt.
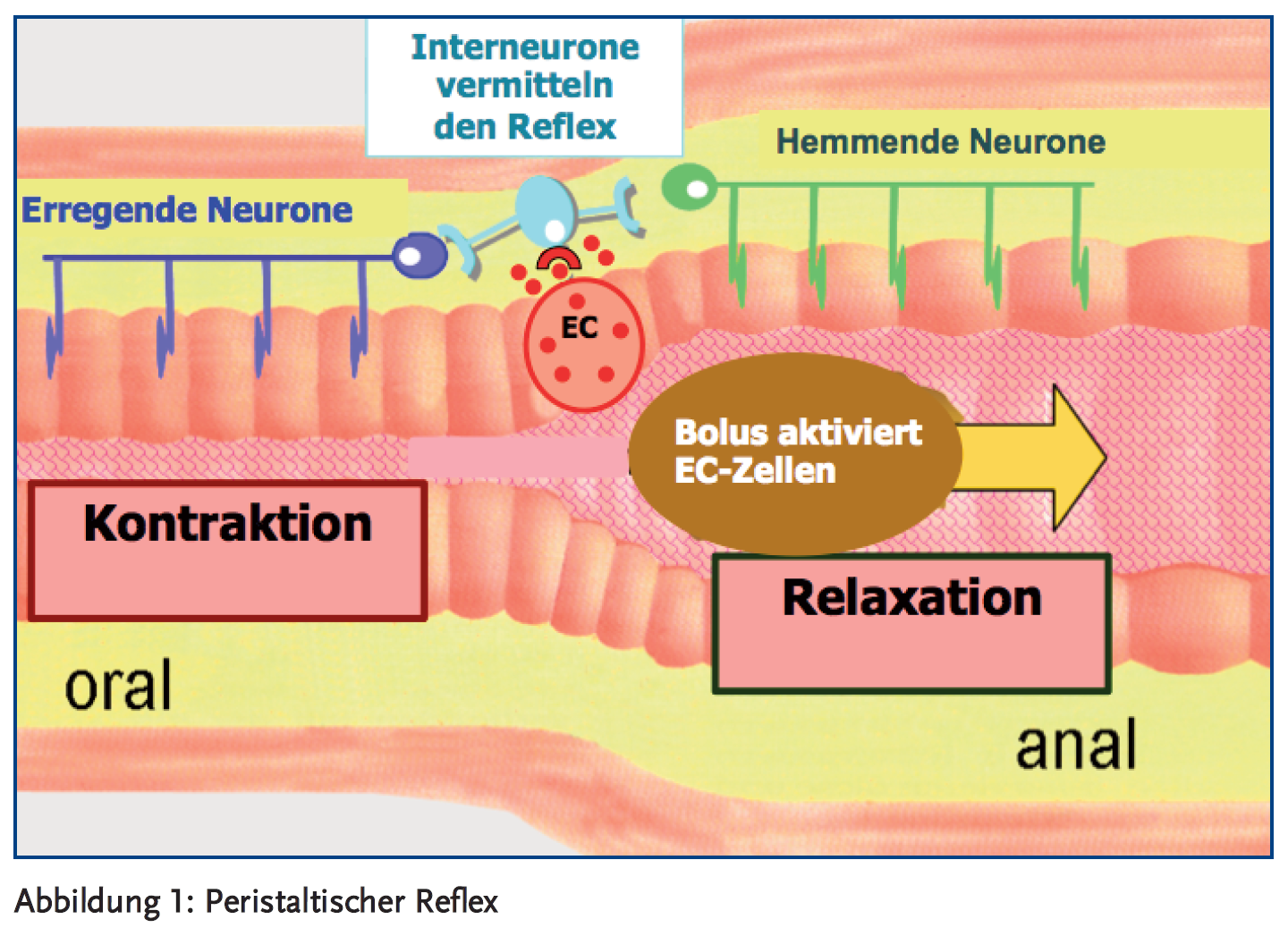
Die Funktionen des ENS werden über ein breites Spektrum von Neurotransmittersystemen vermittelt u. a. auch über das im GIT exprimierte Opioidsystem mit seinen verschiedenen Rezeptoren. Am weitesten im ENS verbreitet und untersucht sind dabei die µ-Opioidrezeptoren. Da Opioidrezeptoren u. a. auf solchen enterischen Nervenzellen exprimiert werden, die maßgeblich für die Steuerung der Darmwandmuskulatur und für die Steuerung der Drüsen im GIT verantwortlich sind, beeinflussen Opioide sowohl die gastrointestinale Motilität als auch die Sekretion.
Entstehung der opioidinduzierten Obstipation (OIC = opioid induced constipation)
Die Rolle von Opioiden bei der Steuerung bzw. Beeinträchtigung gastrointestinaler Funktionen ist klinisch von besonderer Bedeutung, wenn opioidhaltige Medikamente zur Schmerztherapie eingesetzt werden. Neben der gewünschten Schmerzlinderung, die über µ-Opioidrezeptoren im ZNS vermittelt wird, werden in der Peripherie gleichzeitig die gastrointestinalen Funktionen beeinträchtigt (1). Die wichtigste klinische Folge der Opioidwirkung am Darm ist dabei die opioidinduzierte Obstipation (OIC), die auf zwei wesentlichen Mechanismen beruht:
1. Hemmung des peristaltischen Reflexes
Im Vordergrund steht die Hemmung der peristaltischen Bewegungen und damit die Verlängerung der gastrointestinalen Passagezeit. Durch die längere Verweildauer im GIT wird dem Speisebrei durch Wasserresorption vermehrt Flüssigkeit entzogen, was zu trockenem und hartem Stuhl führt. Zusätzlich erhöht sich der Ruhetonus der GIT-Sphinkteren (z. B. unterer Ösophagussphinkter, Pylorus, Analsphinkter), was die GIT-Passagezeit wiederum verlängert.
2. Hemmung der gastrointestinalen Sekretion
Ebenfalls bedeutsam ist die durch Opioide verminderte Sekretion der Kopf- und Bauchspeicheldrüsen sowie die verminderte Sekretionsleistung von Magen, Dünn- und Dickdarm. Dadurch gelangt weniger Flüssigkeit nach intraluminal, was zur trockenen und harten Stuhlkonsistenz beiträgt.
Die OIC äußert sich durch typische Obstipationssymptome wie seltener, meist harter Stuhlgang, Notwendigkeit des starken Pressens und mühevolle, oft inkomplette Stuhlentleerung. Oft treten begleitend Völlegefühl, Bauchdruck/-schmerzen und Blähungen auf. Obstipationsbeschwerden können die Lebensqualität der Patienten ganz erheblich beeinträchtigen.
Die OIC ist die häufigste Komplikation der Opioidtherapie. Im Mittel ist jeder zweite mit Opioiden behandelte Patient betroffen. Die Häufigkeit variiert je nach untersuchtem Kollektiv zwischen 5 % und 95 % (2). Da die OIC auf einer systemischen Opioidwirkung beruht, spielen Unterschiede der Opioidsubstanzen und Applikationsarten keine Rolle. Eine Toleranzentwicklung wie bei anderen Opioidnebenwirkungen (z. B. Sedierung) besteht für die OIC in der Regel nicht.
Erschwerend kommt hinzu, dass viele Schmerzpatienten – insbesondere in der palliativen Situation – ein erhöhtes Obstipationsrisiko haben. Zu den ungünstigen Faktoren zählen verminderte körperliche Aktivität, reduzierter Allgemeinzustand, reduzierter Volumenstatus, höheres Lebensalter, weibliches Geschlecht, andere obstipationsfördernde Medikamente oder auch unmittelbare Erkrankungen/Beteiligung des Bauchraumes (z. B. Peritonealkarzinose). In Assoziation mit der S3-Leitlinie zur „Langzeitanwendung von Opioiden bei nicht tumorbedingten Schmerzen-LONTS“ ist eine Handlungsempfehlung zum Management der opioidinduzierten Obstipation erschienen:
http://www.dgss.org/fileadmin/pdf/LONTS_Praxiswerkzeug_08.pdf
Erfassung der opioidinduzierten Obstipation (OIC)
Zu Beginn jeder Opioidtherapie ist es wichtig, die Patienten im Rahmen der Aufklärung über das gesamte Nebenwirkungsspektrum der Opioide auch über das mögliche Auftreten einer OIC zu informieren und bereits prophylaktisch ein Makrogolpräparat mit zu verschreiben (s. u.). Zudem sollte man das Auftreten einer Obstipation während der Therapie frühzeitig erfassen. Dabei sollten regelmäßig Stuhlfrequenz, Stuhlkonsistenz und Beschwerden im Zusammenhang mit dem Stuhlgang abgefragt werden. Als Messinstrument bietet sich dafür zum Beispiel der für die OIC validierte Bowel Function Index (BFI) an. Dieser Index erfasst mittels einer numerischen Analogskala drei Bereiche:
(1) Leichtigkeit der Defäkation (NAS: „0 = einfach“ bis „100 = mit größter Schwierigkeit“),
(2) Gefühl der inkompletten Entleerung (NAS: „0 = überhaupt nicht“ bis „100 = sehr stark“),
(3) persönliche Einschätzung der Obstipation (NAS: „0 = überhaupt nicht“ bis „100 = sehr stark“). Der mittlere BFI entspricht dem Mittelwert der drei Variablen. Ein Wert < 28,8 gilt als normaler Stuhlgang. Je höher der Wert jedoch ansteigt, desto stärker ist die Obstipation (4). Der BFI wird oft als Messinstrument in klinischen Studien zur OIC verwendet. Dabei gelten Veränderungen von 12 Punktwerten als klinisch bedeutungsvoller Unterschied.
Therapie der opioidinduzierten Obstipation (OIC)
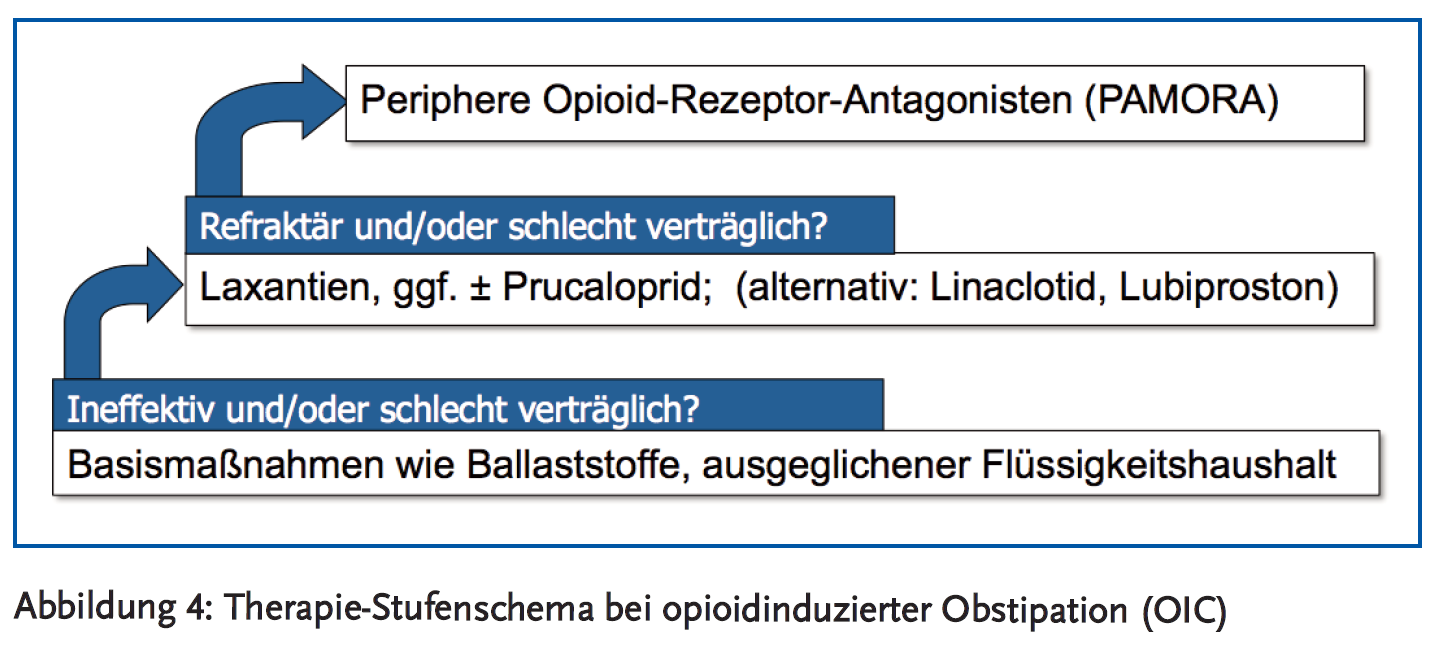
Das in der aktuellen S2k-Leitlinie Chronische Obstipation (2/2013) empfohlene Stufenschema sollte auch bei der OIC beachtet werden (5). Als Basis ist ein Versuch der Stuhlregulierung mit Ballaststoffen (vorzugsweise Quellstoffen) sinnvoll. Diese und weitere Basismaßnahmen (Vermeidung von Dehydratation und Inaktivität, Meidung weiterer obstipationsfördernder Medikamente) sind jedoch häufig nicht ausreichend effektiv. Quellstoffe werden aufgrund der gestörten Transportfunktion des Darmes teilweise auch schlecht vertragen. Als nächste Stufe kommen die klassischen Laxanzien zur Anwendung, wie Makrogol, Bisacodyl oder Natriumpicosulfat, deren Einsatz im klinischen Alltag etabliert ist. Allerdings gibt es zum spezifischen Einsatz von Laxanzien bei OIC nahezu keine Evidenz aus kontrollierten Placebo- oder Komparatorstudien (6). In einer einzigen randomisierten, doppelblinden, placebokontrollierten Studie konnte die Überlegenheit von Makrogol gegenüber Placebo bei der Behandlung einer Methadon-induzierten Obstipation gezeigt werden (7). Insofern ist auch Makrogol das bevorzugte Laxans, das Patienten auch bereits zu Therapiebeginn zusammen mit Opioiden als Begleitmedikation verschrieben werden sollte (neben Antiemetika für die ebenfalls häufig auftretende, sowohl peripher als auch zentral bedingte Übelkeit). Weitere kontrollierte Studien zu Laxanzien bei OIC wären zu wünschen, auch im direkten Vergleich mit neueren Therapieoptionen (s. u.).
Sind Laxanzien ineffektiv oder werden schlecht vertragen, kann der 5-HT4-Agonist Prucaloprid zum Einsatz kommen, sofern keine höhergradigen Stenosen im Gastrointestinaltrakt bestehen. Prucaloprid verstärkt über die präsynaptische Aktivierung von 5-HT4-Rezeptoren die Ausschüttung von Acetylcholin und somit den peristaltischen Reflex, wodurch direkt die Darmmotorik stimuliert wird. Für Prucaloprid wurde in einer Phase-II-Studie eine Wirksamkeit bei der OIC gezeigt (8). Die europäische Zulassung umfasst aktuell die laxanzienrefraktäre Obstipation bei Frauen und seit 2015 auch bei Männern (9).
Weitere Optionen mit eingeschränkter Verfügbarkeit in Deutschland
Auch weitere moderne medikamentöse Therapieoptionen für eine chronische Obstipation könnten für einen Einsatz bei der OIC sinnvoll sein, wenngleich diese Substanzen in Deutschland derzeit nur sehr eingeschränkt zur Verfügung stehen. Der Chlorid-Kanal-Aktivator Lubiproston und der Guanylat-Cyclase-C-Agonist Linaclotid induzieren jeweils eine Flüssigkeitssekretion in den Darm und sind bei chronischer Obstipation und obstipationsprädominantem Reizdarmsyndrom wirksam. Für Lubiproston wurden zudem gezielte Studien bei der OIC durchgeführt, die eine Wirksamkeit gegenüber Placebo zeigten (10). Die Substanz ist allerdings derzeit nicht in Deutschland zugelassen. Linaclotid wird aktuell in einer Phase-II-Studie bei der OIC untersucht (ClinicalTrials.gov, Identifier: NCT02270983). In Deutschland besteht für Linaclotid eine gültige EU-Zulassung für die Behandlung eines obstipationsprädominanten Reizdarmsyndroms. Da keine Studie mit adäquater Vergleichstherapie vorgelegt wurde, sah der Gemeinsame Bundesausschuss (G-BA) keinen Zusatznutzen. Aufgrund gescheiterter Preisverhandlungen wird das Medikament in Deutschland nicht mehr vermarktet.
Peripher wirksame µ-Opioidrezeptorantagonisten (peripherally-acting µ-opioid receptor antagonists, PAMORA) zielen direkt auf die Ursachen der OIC, nämlich die periphere µ-Opioidrezeptoraktivierung mit der daraus resultierenden Hemmung der Darmmotorik und -sekretion.
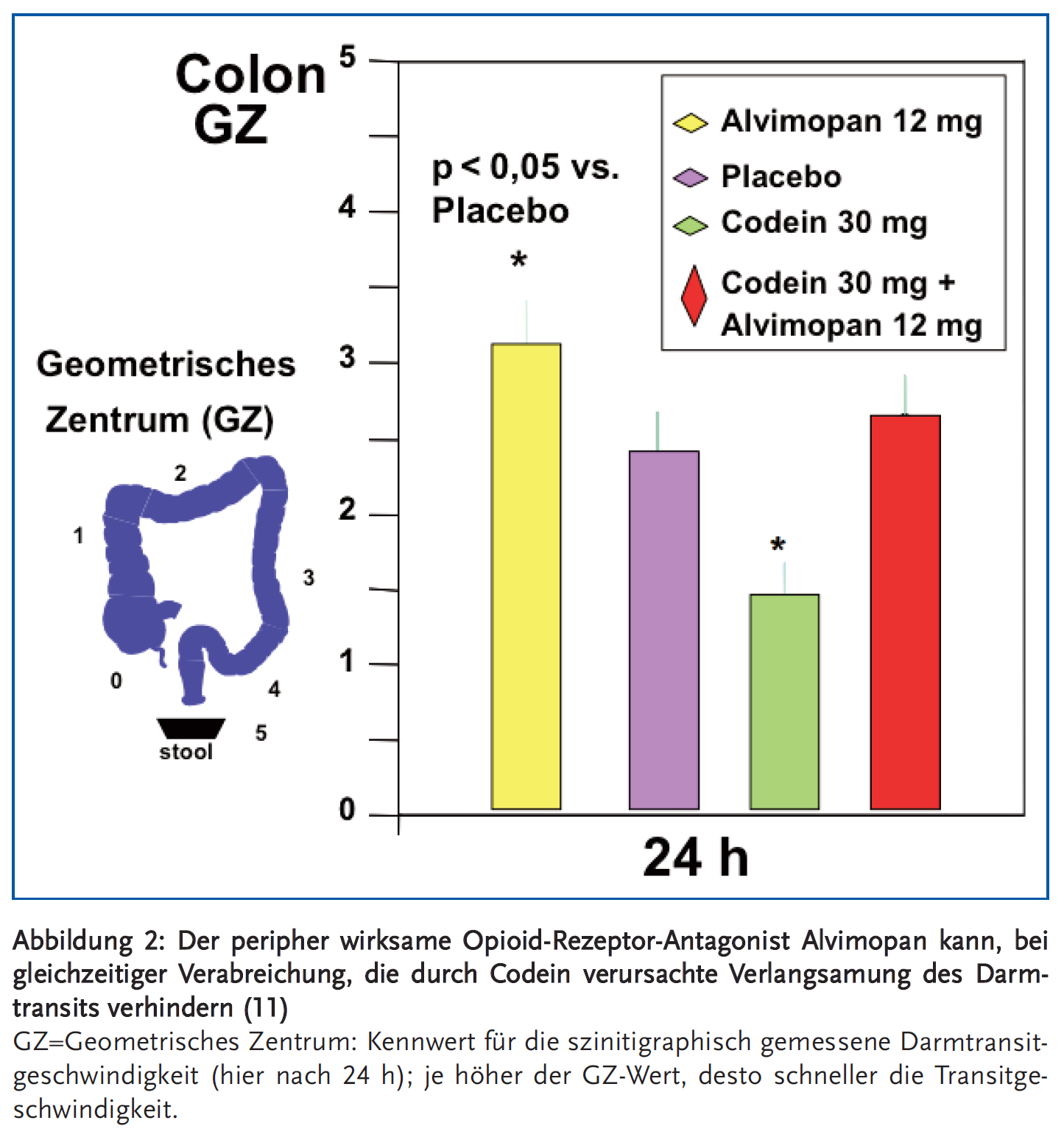
In einer Pharmakodynamikstudie an gesunden Probanden konnte gezeigt werden, dass eine Codein-induzierte Verlangsamung des Darmtransits bei gleichzeitiger Gabe des PAMORA Alvimopan verhindert werden konnte (Abbildung 2) (11).
Inzwischen wurden verschiedene PAMORA in klinischen Studien bei OIC (mit und ohne zugrunde liegender Tumorerkrankung) untersucht. Hierbei ist kritisch anzumerken, dass alle Studien die Wirksamkeit der PAMORA lediglich im Vergleich zu Placebo und nicht im Vergleich zu einer Komparatortherapie (z. B. Laxantien) getestet haben. Eine abschließende Bewertung des Stellenwertes ist daher derzeit nicht möglich. Eine Übersicht zu den verschiedenen Substanzen liefert Tabelle 1. Eine Metaanalyse aus dem Jahr 2013 konnte 14 randomisierte, kontrollierte Studien (RCT) an insgesamt 4101 Patienten analysieren (12). Dabei waren die PAMORA signifikant besser als Placebo in der Behandlung der OIC (RR für ein Therapieversagen: 0,69; 95 % Konfidenzintervall [CI] 0,63–0,75), während die analgetische Wirksamkeit der Opioidbehandlung nicht verändert war. Auch die untersuchten Einzelsubstanzen zeigten jeweils eine Überlegenheit gegenüber Placebo: Methylnaltrexon (6 RCT, 1610 Patienten, RR = 0,66; 95 % CI 0,54–0,84), Alvimopan (4 RCT, 1693 Patienten, RR = 0,71; 95 % CI 0,65–0,78) und orales Naloxon (4 RCT, 798 Patienten, RR = 0,64; 95 % CI 0,56–0,72). In der gepoolten Analyse waren die Gesamtzahl von unerwünschten Ereignissen sowie Durchfall und Bauchschmerzen signifikant häufiger bei den PAMORA im Vergleich zu Placebo.
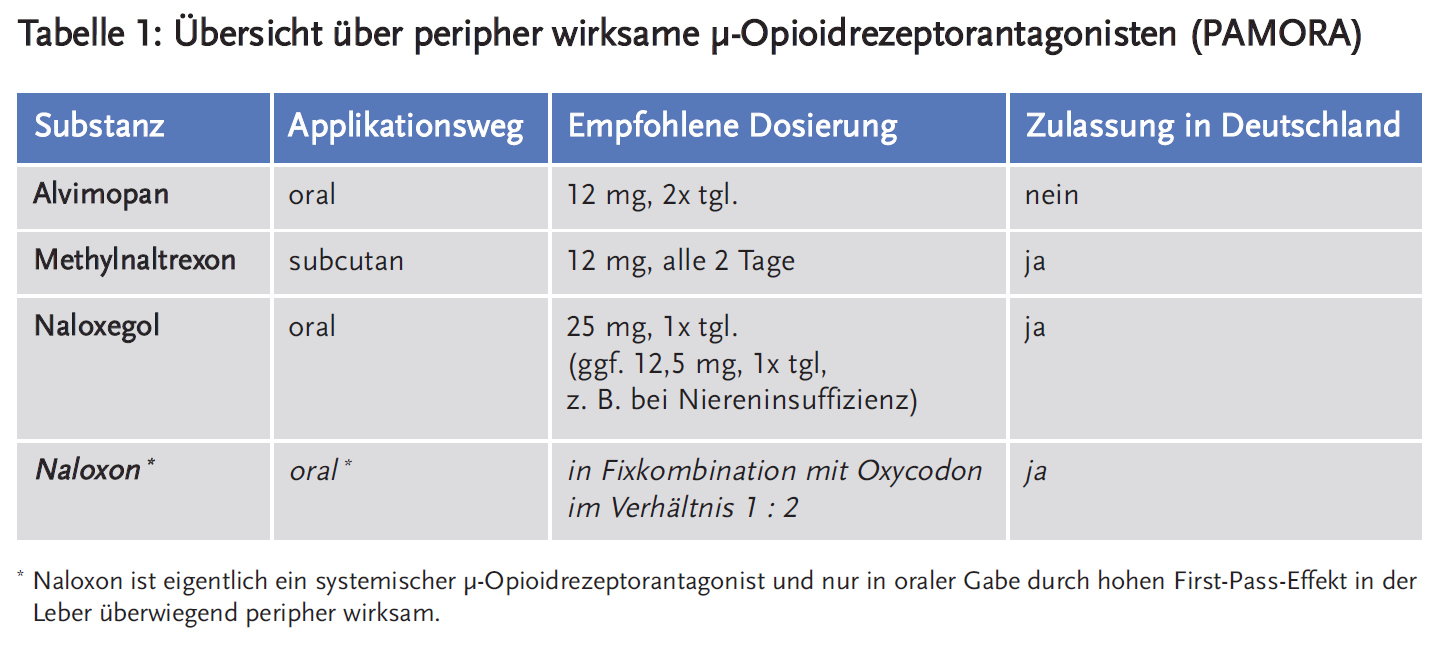
Naloxon ist im Gegensatz zu den anderen Substanzen eigentlich ein systemischer µ-Opioidrezeptorantagonist, der nur in oraler Gabe durch einen hohen First-Pass-Effekt in der Leber nahezu ausschließlich peripher wirksam ist. Hierfür ist jedoch eine ausreichende Leberfunktion erforderlich, sodass eine Anwendung kontraindiziert ist bei mittlerer und schwerer Leberfunktionsstörung. Naloxon ist in Deutschland als retardierte Zubereitung zudem nur in einer Fixkombination mit dem Opioid Oxycodon erhältlich (Targin®), wobei dabei die für Oxycodon sonst zulässige Tageshöchstdosis nicht erreicht wird. Vor diesem Hintergrund ist die Anwendbarkeit von retardiertem oralen Naloxon nur auf Untergruppen von Schmerzpatienten beschränkt.
Methylnaltrexon (Relistor®) ist in Deutschland zur Behandlung der OIC in der Palliativsituation zugelassen und als Subcutan-Injektion erhältlich. Bei Stenosen oder Verwachsungen (cave: Peritonealkarzinose) sollte man die Gefahr von möglichen intestinalen Perforationen bedenken, die am ehesten im Zusammenhang mit der starken, akuten Motilitätssteigerung beschrieben wurden. Für das subcutan applizierte Methylnaltrexon gibt es in höheren Dosierungen zudem aus einer Studie Hinweise, dass zur Schmerzlinderung der Bedarf an Opioiden steigt, möglicherweise aufgrund einer Beteiligung peripherer µ-Opioidrezeptoren an der analgetischen Wirkung der Opioide (13).
Weitere PAMORA mit eingeschränkter Verfügbarkeit in Deutschland
Für Alvimopan (Entereg®) gab es in einer Langzeitstudie einen Verdacht auf ein erhöhtes Risiko für kardiovaskuläre Ereignisse, insbesondere Herzinfarkte. Die Substanz ist derzeit nicht in Deutschland zugelassen. In den USA besteht eine Zulassung für die Kurzzeitbehandlung postoperativ (beim post-operativen Ileus).
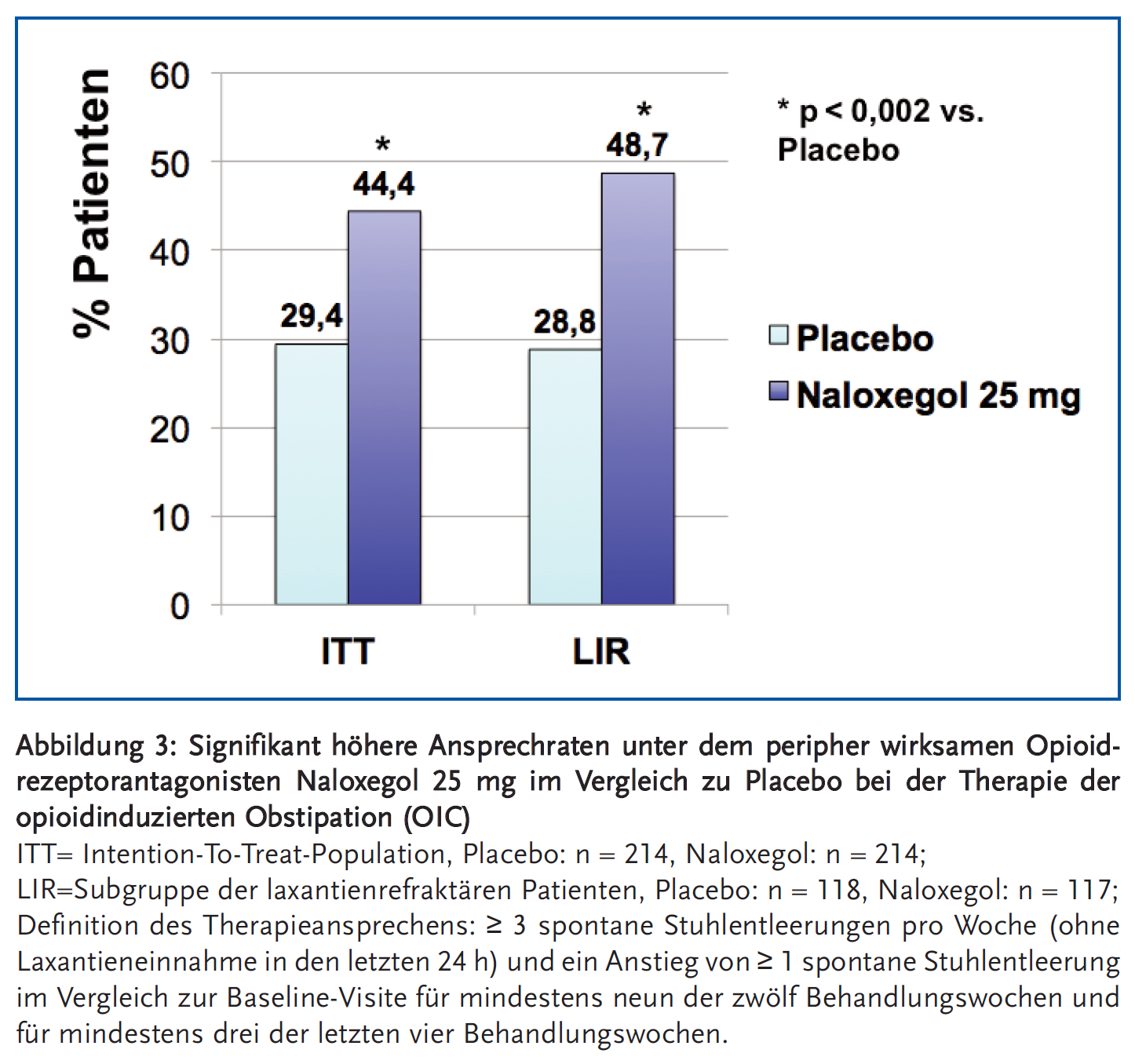
Naloxegol ist ein neuer PAMORA, der noch nicht von der o. g. Metaanalyse erfasst war und der vor Kurzem in der EU zugelassen worden ist zur Behandlung der OIC bei erwachsenen Patienten, die unzureichend auf Laxantien angesprochen haben. Zwei große Phase-III-Studien belegten eine überlegene Wirksamkeit von Naloxegol gegenüber Placebo ohne Verminderung der analgetischen Wirkung (14). Für die 25-mg-Dosierung ergab sich z. B. in der 04-Studie in der ITT-Population eine Ansprechrate von 44,4 % (RR für ein Therapieansprechen von 1,51; CI 1,17–1,95); p = 0,001) und in der Subgruppe der laxantienrefraktären Patienten (LIR-Gruppe) eine Ansprechrate von 48,7 % (RR für ein Therapieansprechen von 1,69; CI 1,21–2,37); p = 0,002) (Abbildung 3). Unerwünschte Wirkungen waren Durchfall (2,8 %) Bauchschmerzen (1,9 %) und Oberbauchschmerzen (1,9 %).
Für die klinische Anwendung der PAMORA muss der in den zuvor genannten Studien durchgeführte Placebovergleich allerdings als im Ansatz unzureichend bezeichnet werden. Zwar wurden in den Studien laxantienrefraktäre Subgruppen analysiert, aber ein direkter Wirksamkeitsvergleich im Sinne einer kontrollierten Komparatorstudie liegt bisher nicht vor. Somit ist derzeit nicht eindeutig belegt, ob PAMORA klinisch gegenüber den etablierten (wenngleich in dieser Anwendung kaum evidenzgestützten) und kostengünstigeren Laxantien in der Behandlung der OIC Vorteile bieten (bei deutlich höheren Kosten). Dies erklärt, warum trotz des pharmakologisch einleuchtenden Ansatzes PAMORA derzeit erst bei Versagen der konventionellen Laxantientherapie empfohlen werden können (vgl. Stufenschema in Abbildung 4) (5).
Fazit für die Praxis
µ-Opioidrezeptoren spielen eine wichtige Rolle bei der Regulation der Darmfunktion. Daher führt eine Schmerztherapie mit Opioiden häufig zu unerwünschten gastrointestinalen Wirkungen und insbesondere zu einer opioidinduzierten Obstipation (OIC).
Aufklärung der Patienten über die OIC sowie frühzeitige Erfassung und Behandlung sind besonders wichtig. Da Ballaststoffe allein in der Regel nicht ausreichen, sind Laxantien der Standard der OIC-Therapie und sollten zusammen mit der Verordnung der Morphine initiiert werden. Dabei wären Makrogolpräparate zu bevorzugen, aber ergänzend oder alternativ auch stimulierende Laxantien wie Bisacodyl oder Natriumpicosulfat (ggf. auch Antrachinone) einsetzbar. Das Prokinetikum Prucaloprid oder – bei Verfügbarkeit – die Sekretagoga Linaclotid oder Lubiproston wären weitere therapeutische Alternativen. Die neuen, peripher aktiven µ-Opioidrezeptorantagonisten (PAMORA) bieten im Ansatz erstmalig eine gezielte Therapie der OIC bei erhaltener analgetischer Wirksamkeit. Da die Wirksamkeit der PAMORA bei OIC bisher allerdings nur in placebokontrollierten Studien untersucht und nachgewiesen wurde, ist ein direkter Vorteil gegenüber einer konventionellen, kostengünstigeren Laxantientherapie nicht belegt. Daher ist der Einsatz von PAMORA erst bei laxantienrefraktären Fällen zu empfehlen. Für eine korrekte Bewertung der PAMORA sind direkt vergleichende Studien dringend zu fordern.
Interessenkonflikte
V. Andresen hat Vorträge und/oder Beratungstätigkeiten für folgende Firmen übernommen, deren
Produkte im Bereich der OIC zum Einsatz kommen könnten: Almirall, Astra, Boehringer, Falk, Mundipharma, Shire.
T. Wedel hat Vorträge und/oder Beratungstätigkeiten für folgende Firmen übernommen, deren Produkte im Bereich der OIC zum Einsatz kommen könnten: Astra, Shire.
Literatur
- Benyamin R, Trescot AM, Datta S et al.: Opioid complications and side effects. Pain Physician 2008; 11: S105-120.
- Pappagallo M: Incidence, prevalence, and management of opioid bowel dysfunction. Am J Surg 2001; 182: 11S-18S.
- Kalso E, Edwards JE, Moore RA et al.: Opioids in chronic non-cancer pain: systematic review of efficacy and safety. Pain 2004; 112: 372-380.
- Ueberall MA, Muller-Lissner S, Buschmann-Kramm C et al.: The Bowel Function Index for evaluating constipation in pain patients: definition of a reference range for a non-constipated population of pain patients. J Int Med Res 2011; 39: 41-50.
- Andresen V, Enck P, Frieling T et al.: S2k-Leitlinie Chronische Obstipation: Definition, Pathophysiologie, Diagnostik und Therapie. Z Gastroenterol 2013; 51: 651-672.
- Ruston T, Hunter K, Cummings G et al.: Efficacy and side-effect profiles of lactulose, docusate sodium, and sennosides compared to PEG in opioid-induced constipation: a systematic review. Can Oncol Nurs J 2013; 23: 236-246.
- Freedman MD, Schwartz HJ, Roby R et al.: Tolerance and efficacy of polyethylene glycol 3350/electrolyte solution versus lactulose in relieving opiate induced constipation: a double-blinded placebo-controlled trial. J Clin Pharmacol 1997; 37: 904-907.
- Sloots CE, Rykx A, Cools M et al.: Efficacy and safety of prucalopride in patients with chronic noncancer pain suffering from opioid-induced constipation. Dig Dis Sci 2010; 55: 2912-2921.
- Yiannakou Y, Piessevaux H, Bouchoucha M et al.: A randomized, double-blind, placebo-controlled, phase 3 trial to evaluate the efficacy, safety, and tolerability of prucalopride in men with chronic constipation. Am J Gastroenterol 2015; 110: 741-748.
- Jamal MM, Adams AB, Jansen JP et al.: A randomized, placebo-controlled trial of lubiprostone for opioid-induced constipation in chronic noncancer pain. Am J Gastroenterol 2015; 110: 725-732.
- Gonenne J, Camilleri M, Ferber I et al.: Effect of alvimopan and codeine on gastrointestinal transit: a randomized controlled study. Clin Gastroenterol Hepatol 2005; 3: 784-791.
- Ford AC, Brenner DM, Schoenfeld PS: Efficacy of pharmacological therapies for the treatment of opioid-induced constipation: systematic review and meta-analysis. Am J Gastroenterol 2013; 108: 1566-1574; quiz 1575.
- Jagla C, Martus P, Stein C: Peripheral opioid receptor blockade increases postoperative morphine demands – a randomized, double-blind, placebo-controlled trial. Pain 2014; 155: 2056-2062.
- Chey WD, Webster L, Sostek M et al.: Naloxegol for opioid-induced constipation in patients with noncancer pain. N Engl J Med 2014; 370: 2387-2396.
