Nebenwirkungen durch Medikationsfehler („Aus der UAW-Datenbank“)
Deutsches Ärzteblatt, Jg. 113, Heft 43, 28.10.2016
Unerwünschte Arzneimittelwirkungen werden oft auf das Arzneimittel als solches zurückgeführt. Jedoch können Nebenwirkungen durchaus nicht durch das Arzneimittel selbst, sondern durch Medikationsfehler verursacht sein. Nebenwirkungen durch Medikationsfehler haben in den letzten Jahren stärkere Beachtung gefunden. Die AkdÄ führt zurzeit ein vom Bundesministerium für Gesundheit (BMG) gefördertes Pilotprojekt zur Erfassung und Bewertung von Medikationsfehlern durch, um Ursachen und Risikofaktoren für Medikationsfehler besser zu erkennen und diese vermeiden zu können. Im Folgenden wird anhand von Fallbeispielen dargestellt, wie das Projekt zur Arzneimittelsicherheit beitragen soll und welche Medikationsfehler durch Ärzte an die AkdÄ gemeldet werden sollten.
Eine 80-jährige Patientin wurde in einer palliativen Situation mit Haloperidol behandelt. Fälschlicherweise erhielt sie täglich anstatt 5 mg Haloperidol-Injektionslösung intramuskulär 50 mg des Depotpräparats Haloperidoldecanoat. Wenige Wochen später verstarb die Patientin.
Das Antipsychotikum Haloperidol wird supportiv zu verschiedenen Therapien mit palliativer Zielsetzung (z. B. bei Krebserkrankungen als Antiemetikum) eingesetzt (1). Es steht aktuell in zwei verschiedenen intramuskulär applizierbaren Formulierungen zur Verfügung: unverestert als Haloperidol (2) oder als Dekansäureester (Haloperidoldecanoat) als Depotpräparat, das alle vier Wochen intramuskulär verabreicht wird (Einzeldosis gemäß Fachinformation: etwa 10- bis 15-Faches der oralen Tagesdosis) (3). Im vorliegenden Fall muss von einer erheblichen Überdosierung, am ehesten bedingt durch die Verwechslung der Arzneimittelbezeichnungen und damit der Formulierungen, ausgegangen werden. Es bleibt dabei unklar, ob der Tod der Patientin im ursächlichen Zusammenhang mit der Überdosierung von Haloperidol steht. Denkbar wäre beispielsweise, dass durch die Überdosierung eine letztlich fatal verlaufende tachykarde Herzrhythmusstörung begünstigt wurde (3).
Nach Auskunft des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM), dem dieser Fall gemeldet wurde, liegen weitere Fallberichte zu Verwechslungen verschiedener Haloperidol-Präparate vor. Offenbar ist Haloperidoldecanoat nicht eindeutig genug als Depotpräparat gekennzeichnet. Um das Risiko von Verwechslungen zu reduzieren, wurde mit dem Zulassungsinhaber eine Anpassung der Handelsnamen der Depotpräparate vereinbart. Zukünftig soll bereits aus den Arzneimittelbezeichnungen deutlicher hervorgehen, dass es sich um Depotpräparate handelt (= Haldol-Janssen Decanoat Depot 1 ml und Haldol-Janssen Decanoat Depot 3 ml).
Die gemeldeten Fallberichte und ihre Aufarbeitung haben so dazu beigetragen, die Behandlung mit parenteralem Haloperidol zukünftig sicherer zu machen.
Projekt zur Erfassung und Bewertung von Medikationsfehlern
Die Angaben zur Häufigkeit und zu Ursachen von Medikationsfehlern in der Literatur schwanken. In Deutschland gelten etwa drei Prozent der internistischen Notaufnahmen als nebenwirkungsbedingt, wovon wiederum etwa ein Fünftel auf Medikationsfehler zurückgeführt werden (4). Die geänderte europäische Pharmakovigilanzrichtlinie sieht vor, nun auch Medikationsfehler in den nationalen Pharmakovigilanzsystemen zu erfassen (5). Die AkdÄ führt daher im Auftrag des Bundesministeriums für Gesundheit ein Pilotprojekt zur Erfassung und Bewertung von Medikationsfehlern durch1. Unter anderem soll untersucht werden, ob mit dem bestehenden Spontanmeldesystem der AkdÄ auch Medikationsfehler erfasst werden können und ob sich aus der systematischen Auswertung Interventionen ableiten lassen, die die Sicherheit der Patienten erhöhen. Das Projekt wird in Kooperation mit dem Bundesinstitut für Arzneimittel und Medizinprodukte durchgeführt, das derzeit eine multizentrische Studie koordiniert, in der in mehreren deutschen zentralen Notaufnahmen neben anderen Zielen Ursachen und Risikofaktoren für Nebenwirkungen (darunter auch Medikationsfehler) analysiert werden sollen (6).
Was ist ein Medikationsfehler?
Unter einem Medikationsfehler versteht man ein (unbeabsichtigtes) Abweichen vom optimalen Medikationsprozess. Dieses kann zu einer Schädigung des Patienten führen, die grundsätzlich vermeidbar wäre (7). In der Abbildung 1 sind die einzelnen Schritte des Medikationsprozesses dargestellt.
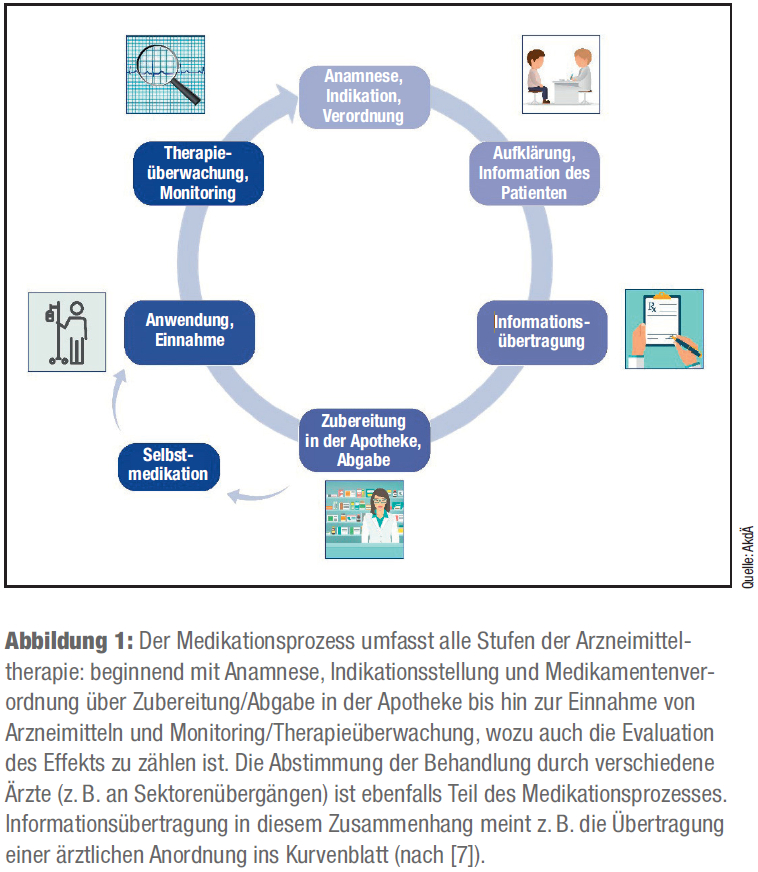
Ein Medikationsfehler kann bei jedem Schritt des Medikationsprozesses auftreten und durch jeden am Medikationsprozess Beteiligten (z. B. Arzt, Apotheker, Patient, Angehörige) verursacht werden (7).
Eine 38-jährige Patientin erhielt wegen Migräne bei einem Hausbesuch Dimenhydrinat intravenös. Während der Injektion kam es zu Schmerzen entlang des Venenverlaufs. Im Nachhinein fiel auf, dass versehentlich das Präparat für die intramuskuläre Gabe injiziert worden war. Der Hinweis „i.m.“ auf der Ampulle war im halbdunklen Schlafzimmer übersehen worden. Die Patientin entwickelte für zwei Tage eine schmerzhafte Phlebitis und erholte sich danach vollständig.
Auch in diesem Fall liegt eine Verwechslung von Arzneimitteln mit verschiedenen Arten der Anwendung zugrunde. Das H1-Antihistaminikum Dimenhydrinat steht unter anderem als intramuskuläre und als intravenöse Injektion zur Verfügung (8). Der meldende Kollege empfiehlt, dass diese unterschiedlichen Arzneimittel nicht unter einer identischen Hauptbezeichnung angeboten oder zumindest die Ampullenetiketten klar gekennzeichnet werden sollten.
Nach Auskunft des BfArM wurden auch in diesem Fall risikomindernde Maßnahmen mit dem Zulassungsinhaber diskutiert. Zukünftig soll die Produktkennzeichnung noch deutlicher auf die Art der Anwendung hinweisen.
Was soll gemeldet werden?
Im Projekt der AkdÄ werden Spontanmeldungen zu Medikationsfehlern erfasst, die zu einem Schaden beim Patienten geführt haben. Von besonderem Interesse sind Fallberichte, bei denen ein schwerwiegender Schaden aufgetreten ist:
Ein 76-jähriger Patient wurde wegen Vorhofflimmerns mit Phenprocoumon behandelt. Aktuell klagte er seit einigen Tagen über Kopfschmerzen sowie Müdigkeit und es fiel eine Makrohämaturie auf. In der kraniellen Computertomographie waren beidseits schmale subdurale Hämatome nachweisbar. Der INR-Wert lag bei >10, sodass eine Behandlung mit PPSB erfolgte. Eine neurochirurgische Intervention war nicht erforderlich.
Ursache für die erhöhte INR war eine Doppeleinnahme von Phenprocoumon: Die orale Antikoagulation war kurz zuvor auf ein Generikum umgestellt worden. Dieses hatte der Patient jedoch für ein zusätzliches Medikament gehalten und zusätzlich zum Originalpräparat eingenommen. Es bestand eine umfangreiche Begleitmedikation und es ist nicht bekannt, in welcher Form der Patient über die aktuelle Änderung der Medikation informiert wurde. Ein Medikationsplan könnte dazu beitragen, derartige Fehler zu vermeiden. Inzwischen wurde Phenprocoumon in die sogenannte Substitutionsausschlussliste (Arzneimittel-Richtlinie Anlage VII Teil B) aufgenommen (9). Das heißt, Phenprocoumon-haltige Arzneimittel dürfen nicht mehr beispielsweise auf Grund eines Rabattvertrages in der Apotheke ausgetauscht werden.
Auch Medikationsfehler, die lediglich das Potenzial für eine Schädigung des Patienten haben, sollten gemeldet werden. Gerade aus solchen Berichten können Konsequenzen abgeleitet werden, bevor ein Patient durch einen ähnlichen Fehler zu Schaden kommt:
Eine 18-jährige Patientin wurde zur Immunsuppression (genaue Indikation wird nicht angegeben) mit Tacrolimus (5 mg/d oral) behandelt. Zusätzlich wurde ihr geraten, ein Baldrian- und Johanniskraut-haltiges Präparat (Sedariston®) einzunehmen. Es ist nicht bekannt, ob Blutspiegelkontrollen von Tacrolimus vorgesehen waren. Die abgebende Apotheke befürchtete, dass eine Wechselwirkung zwischen beiden Arzneimitteln zum beschleunigten Abbau von Tacrolimus und somit zu einem niedrigeren, therapeutisch nicht ausreichend hohen Blutspiegel führen könnte und riet daher von der Einnahme des pflanzlichen Mittels ab. Ein mögliches Therapieversagen konnte so vermieden werden.
Das Immunsuppressivum Tacrolimus wird angewandt zur Prophylaxe und Behandlung von Transplantatabstoßungen. Es wird überwiegend durch das Enzym CYP3A4 in der Leber metabolisiert (10). Das nicht-rezeptpflichtige Sedariston® wird unterstützend eingesetzt bei leichten depressiven Störungen (11). Johanniskraut-haltige Arzneimittel können durch Induktion von CYP3A4 den Abbau von Tacrolimus beschleunigen (12). In den Fachinformationen beider Arzneimittel wird auf die mögliche Wechselwirkung hingewiesen (10;11).
Fazit
Durch die zentrale Erfassung, Bewertung und Analyse von Medikationsfehlern sollen Strategien zur Verbesserung der Arzneimitteltherapiesicherheit abgeleitet werden. Die AkdÄ entwickelt dafür ein Berichtssystem im Rahmen des Spontanmeldesystems für Nebenwirkungen.
Ärzte werden gebeten, auch Medikationsfehler zu berichten, vor allem Fälle, die zu einem schwerwiegenden Schaden beim Patienten geführt haben oder hätten führen können. Auf der Homepage der AkdÄ steht hierfür ein spezifischer (Berichtsbogen) zur Verfügung, der auch auf der letzten Seite dieser Ausgabe abgedruckt ist. Fallberichte können per Post, per Fax oder per E-Mail an die AkdÄ gesendet werden. Eine anonyme Meldung ist möglich.
Die Fallberichte werden vertraulich behandelt. Nach Erfassung und Codierung werden sie in pseudonymisierter Form (also ohne Weitergabe von Namen und Kontaktdaten der meldenden Kollegen) auf elektronischem Weg an die zuständige Bundesoberbehörde weitergeleitet, sodass sie auch für Auswertungen auf nationaler und internationaler Ebene zur Verfügung stehen.
Literatur
- Deutsche Krebsgesellschaft e. V. (DKG), Deutsche Krebshilfe e. V. (DKH), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. (AWMF): S3-Leitlinie „Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung“ (Langversion 1.1): http://www.awmf.org/uploads/tx_szleitlinien/128-001OLl_S3_Palliativmedizin_2015-07.pdfAWMF-Registernummer: 128/001OL; Berlin, Mai 2015. Zuletzt geprüft: 24. August 2016.
- Janssen-Cilag GmbH: Fachinformation „Haldol®-Janssen Injektionslösung 5 mg/ml“. Stand: September 2013.
- Janssen-Cilag GmbH: Fachinformation „Haldol®-Janssen Decanoat, –3 ml, Injektionslösung“. Stand: November 2014.
- Rottenkolber D, Schmiedl S, Rottenkolber M et al.: Adverse drug reactions in Germany: direct costs of internal medicine hospitalizations. Pharmacoepidemiol Drug Saf 2011; 20: 626–634.
- Richtlinie 2001/83/EG des Europäischen Parlaments und des Rates vom 6. November 2001 zur Schaffung eines Gemeinschaftskodexes für Humanarzneimittel. Zuletzt geändert durch Richtlinie 2012/26/EU des Europäischen Parlaments unddes Rates vom 25. Oktober 2012: http://eur-lex.europa.eu/legal-content/DE/TXT/PDF/?uri=CELEX:02001L0083-20121116&qid=1452170929657&from=DEAmtsblatt der Europäischen Gemeinschaften 2001; L 311: 67–128.
- Kaumanns K, Kayser C, Paeschke N et al.: Medikationsfehler im Fokus der Forschung und Pharmakovigilanz. Bulletin zur Arzneimittelsicherheit 2015; 6 (2): 27–35.
- Aly A-F: Definitionen zu Pharmakovigilanz und Arzneimitteltherapiesicherheit (AMTS). Arzneiverordnung in der Praxis (AVP) 2015; 42: 99–104.
- Klinge Pharma GmbH: Fachinformation „Vomex A® Injektionslösung“. Stand: Mai 2016.
- Bundesministerium für Gesundheit: Bekanntmachung eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VII – Regelungen zur Austauschbarkeit von Arzneimitteln (aut idem) – Bestimmung von Arzneimitteln, deren Ersetzung durch ein wirkstoffgleiches Arzneimittel ausgeschlossen ist (2. Tranche). Vom 21. April 2016: https://www.g-ba.de/informationen/beschluesse/2564/BAnz AT 2016: 01.07.2016 B2012.
- Astellas Pharma GmbH: Fachinformation „Prograf® Hartkapseln“. Stand: Juni 2015.
- Aristo Pharma GmbH: Fachinformation „Sedariston® Konzentrat Hartkapseln“. Stand: September 2014.
- Cassella-med GmbH & Co. KG: Fachinformation „Jarsin® 750 mg“. Stand: Februar 2015.
