Multiple aktinische Keratosen (Carcinomata in situ der Haut) nach langjähriger topischer Anwendung von Tacrolimus (Protopic®) (Aus der UAW-Datenbank)
Deutsches Ärzteblatt, Jg. 108, Heft 10, 11.03.2011
Tacrolimus ist ein Immunsuppressivum und gehört wie Ciclosporin und Pimecrolimus zur Gruppe der Calcineurin-Inhibitoren. Diese vermindern die Aktivierung von T-Zellen durch Zytokine und antigenpräsentierende Zellen sowie die Bildung von proinflammatorischen Zytokinen (u. a. Interleukin-2, Interferon gamma). Systemisch wird es zur Prophylaxe und Behandlung der Transplantatabstoßung bei Leber-, Nieren- oder Herztransplantatempfängern angewendet. Als topische Zubereitung (Protopic®) ist Tacrolimus zugelassen zur Behandlung des mittelschweren bis schweren atopischen Ekzems, wenn herkömmliche Therapien, wie z. B. topische Kortikosteroide, nicht ausreichend wirksam waren oder nicht vertragen wurden. Im Jahr 2009 waren die Verordnungen von entzündungshemmenden und juckreizstillenden Dermatika insgesamt rückläufig. Die einzige Ausnahme war Protopic®, das um 7,9 % häufiger verordnet wurde als 2008 (1).
Der AkdÄ wurde der Fall eines 43-jährigen Patienten berichtet, der seit seiner Kindheit an einem atopischen Ekzem (Neurodermitis) leidet. Zusätzlich besteht ein Asthma bronchiale, das mit Montelukast (Singulair®) sowie einem Inhalativum (Fluticason und Salmeterol, Viani®) bei Bedarf therapiert wird. Wegen der Neurodermitis erfolgte über Jahre eine topische Behandlung mit Kortikosteroiden, die zu einer Atrophie der betroffenen Hautareale geführt hat. Seit Anfang 2006 wendete der Patient Protopic® Salbe 0,03 % an. Zur Häufigkeit der Anwendung gibt es unterschiedliche Angaben. Während im Meldebogen eine Anwendung einmal täglich angegeben wird, wird in einem Krankenhausbericht eine Anwendung alle zwei Tage berichtet. Bei der Aufnahmeuntersuchung zu einer stationären Rehabilitation im September 2009 fallen münzgroße, schuppende, rötlich gefärbte, erhabene Hautareale an den Unterarmen dorsalseitig auf (siehe Abbildung). Eine histologische Untersuchung bestätigt den klinischen Verdacht auf multiple aktinische Keratosen. Die Behandlung mit Protopic® wird daraufhin auf Ecural® Fettcreme umgestellt (zunächst tägliche Anwendung, im Verlauf Reduktion auf zweimal wöchentlich) und eine Therapie der aktinischen Keratosen mit Imiquimod (Aldara® Creme) eingeleitet.
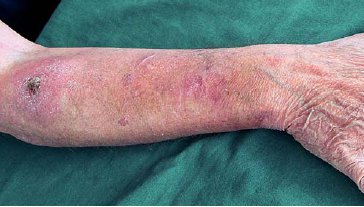
Hautatrophie und multiple aktinische Keratosen
bei einem 43-jährigen Patienten
Aktinische Keratosen sind auf die Epidermis begrenzte Neubildungen der Haut, die durch chronische Lichteinwirkung induziert werden. Die UV-Bestrahlung führt zu Veränderungen der DNS und zu einer verminderten Reparaturkapazität. Wenn die veränderten Zellen durch die Basalmembran in das Korium (Lederhaut) vordringen, hat der Übergang in ein invasives spinozelluläres Karzinom begonnen. Aktinische Keratosen werden daher als Präkanzerose oder Carcinoma in situ angesehen (2, 3). Als Risikofaktoren für die Entwicklung aktinischer Keratosen gelten vor allem berufliche Tätigkeiten mit hoher Sonnenlichtexposition, ein höheres Lebensalter (aufgrund der entsprechend kumulativ höheren Lichtexposition), ein heller Hauttyp sowie eine Immunsuppression (3).
Im vorliegenden Fall liegt bei dem betroffenen Patienten hinsichtlich Alter, Beruf (Verwaltungsfachangestellter) und Hauttyp (Lichttyp III, Mischtyp, mittlere Hautfarbe) kein auffälliges Risikoprofil für die Entwicklung aktinischer Keratosen vor. Daher kommt ein kausaler Zusammenhang mit der langjährigen Gabe des immunsuppressiv wirksamen Tacrolimus in Betracht. Hinsichtlich der unterschiedlichen Angaben zur Anwendungshäufigkeit besteht der Verdacht, dass der Patient höhere Dosen als empfohlen aufgetragen hat und so möglicherweise der immunsuppressive Effekt verstärkt wurde. Zur Erhaltungstherapie bei Erwachsenen wird in der Fachinformation empfohlen, Protopic® Salbe 0,1 % zweimal pro Woche einmal täglich auf üblicherweise betroffene Bereiche aufzubringen (4).
Die Food and Drug Administration hat 2005 vor dem Hintergrund von Einzelfallbeschreibungen, Tierversuchen und wegen des Wirkmechanismus von Calcineurin-Inhibitoren auf ein potenzielles Krebsrisiko von Tacrolimus und Pimecrolimus auch bei der topischen Anwendung hingewiesen und eine entsprechende Warnung in die Produktinformationen aufgenommen (5). Bislang hatte sich in Untersuchungen bei Menschen der Verdacht auf ein erhöhtes Krebsrisiko bei topischer Anwendung von Calcineurin-Inhibitoren nicht bestätigt (6-8). In der bislang größten retrospektiven Kohortenstudie zu dieser Frage, in der Daten von mehr als 950.000 Patienten mit atopischer Dermatitis einbezogen wurden, gab es jedoch ein signifikant erhöhtes Risiko für T-Zell-Lymphome unter Tacrolimus (Hazard Ratio [HR] 5,44; 95-%-Konfidenzintervall [CI] 2,51-11,79; p < 0,001) und tendenziell für Pimecrolimus (HR 2,32; CI 0,89-6,07; p = 0,086). Für andere Krebserkrankungen zeigte sich weder bei Tacrolimus- noch bei Pimecrolimus-Exponierten ein signifikant erhöhtes Risiko (9). Andererseits ist bei Verfügbarkeit der topischen Darreichungsformen seit etwa zehn Jahren die Beobachtungszeit für die Entwicklung von aktinischen Keratosen und spindelzellulären Karzinomen noch zu kurz.
Wegen eines wahrscheinlich erhöhten Risikos für das Auftreten von Lymphomen und eines nicht auszuschließenden erhöhten Risikos von Hautkrebserkrankungen im Zusammenhang mit topisch angewendetem Tacrolimus und Pimecrolimus sollten sich die Anwendung und die eingesetzten Dosierungen strikt an den zugelassenen Indikationen orientieren. Die beiden Substanzen sollten nur zur Zweitlinienbehandlung eingesetzt werden und eine Anwendung bei Kindern unter zwei Jahren sowie bei immungeschwächten Patienten muss vermieden werden. Während der Behandlung sollte die Haut nicht dem (natürlichen oder künstlichen) Sonnenlicht ausgesetzt werden. Bei längerfristiger Anwendung sind regelmäßige Untersuchungen auf suspekte Hautveränderungen empfohlen.
Bitte teilen Sie der AkdÄ alle beobachteten Nebenwirkungen (auch Verdachtsfälle) mit. Sie können dafür den Berichtsbogen verwenden, der regelmäßig im Deutschen Ärzteblatt abgedruckt wird oder über die Homepage der AkdÄ abrufbar ist. Es besteht auch die Möglichkeit, über www.akdae.de direkt online einen UAW-Verdachtsfall zu melden.
Literatur
- Schwabe U, Paffrath D (Hrsg.): Arzneiverordnungs-Report 2010. Heidelberg: Springer Medizin Verlag, 2010.
- Padilla RS, Sebastian S, Jiang Z et al.: Gene expression patterns of normal human skin, actinic keratosis, and squamous cell carcinoma: a spectrum of disease progression. Arch Dermatol 2010; 146: 288-93.
- Schwartz RA, Bridges TM, Butani AK, Ehrlich A: Actinic keratosis: an occupational and environmental disorder. J Eur Acad Dermatol Venereol 2008; 22: 606-15.
- Astellas Pharma Europe B.V.: Fachinformation "Protopic 0,03% Salbe". Stand: April 2009.
- FDA: Elidel (pimecrolimus) cream and Protopic (tacrolimus) ointmentPublic Health Advisory vom 10. März 2005. Zuletzt geprüft: 1. März 2011.
- Lerche CM, Philipsen PA, Poulsen T, Wulf HC: Topical pimecrolimus and tacrolimus do not accelerate photocarcinogenesis in hairless mice after UVA or simulated solar radiation. Exp Dermatol 2009; 18: 246-51.
- Ring J, Mohrenschlager M, Henkel V: The US FDA "black box" warning for topical calcineurin inhibitors: an ongoing controversy. Drug Saf 2008; 31: 185-98.
- Thaci D, Salgo R: Malignancy concerns of topical calcineurin inhibitors for atopic dermatitis: facts and controversies. Clin Dermatol 2010; 28: 52-6.
- Hui RL, Lide W, Chan J et al.: Association between exposure to topical tacrolimus or pimecrolimus and cancers. Ann Pharmacother 2009; 43: 1956-63.
