Agranulozytose mit neutropenem Fieber unter Nivolumab („Aus der UAW-Datenbank“)
Deutsches Ärzteblatt, Jg. 114, Heft 21, 26.05.2017
Nivolumab: Wirkmechanismus, zugelassene Indikationen und unerwünschte Wirkungen
Nivolumab ist ein monoklonaler Antikörper und gehört zur Gruppe der sogenannten Checkpoint-Inhibitoren. Es bindet an den Programmed-Cell-Death-1-Rezeptor (PD-1) und blockiert so die Interaktion mit den Liganden PD-L1 und PD-L2. Der PD-1-Rezeptor wird u. a. auf aktivierten T- und B-Zellen sowie auf natürlichen Killerzellen exprimiert. Er „bremst“ als negativer Regulator die T-Zellaktivität. Die Liganden PD-L1 und PD-L2 werden von antigenpräsentierenden Zellen sowie von Tumorzellen exprimiert. Der Tumor kann sich durch Bindung von PDL1/L2 an den PD-1-Rezeptor einer Immunreaktion entziehen. Nivolumab führt durch die Blockierung dieser Bindung zu einer Potenzierung der T-Zell-Reaktion einschließlich der Tumorabwehrreaktion (1;2).
Nivolumab ist derzeit zugelassen zur Behandlung von Patienten in fortgeschrittenen Stadien des malignen Melanoms, nicht-kleinzelligen Bronchialkarzinoms, Nierenzellkarzinoms und des klassischen Hodgkin-Lymphoms (2). Eine Reihe von Nebenwirkungen von Nivolumab erklärt sich durch die Induktion einer überschießenden Immunreaktion. Diese kann sich gegen verschiedene Organe und Gewebe richten und führt beispielsweise zur Pneumonitis, Myokarditis, Colitis, Hepatitis, Nephritis und/oder zu immunvermittelten Endokrinopathien (3;4).
Der AkdÄ wurde der Fall einer 62-jährigen Patientin berichtet, die wegen eines fortgeschrittenen nicht-kleinzelligen Bronchialkarzinoms (NSCLC) mit Nivolumab behandelt wurde und eine schwere Agranulozytose entwickelt hat.
Das Bronchialkarzinom war etwa zwei Jahre zuvor erstmalig diagnostiziert worden und zu diesem Zeitpunkt bereits in einem fortgeschrittenen, metastasierten Stadium (Ausgangsstadium cTx cN3 M1 G3). Die Patientin erhielt wegen Knochenmetastasen mehrere Bestrahlungstherapien verschiedener Skelettregionen sowie sechs Zyklen einer Chemotherapie mit Cisplatin und Pemetrexed. Angeschlossen wurde eine Erhaltungstherapie mit Erlotinib, einem Tyrosinkinasehemmer des epidermalen Wachstumsfaktorrezeptors vom Typ 1 (EGFR, auch bekannt als HER1) (5). Nach achtmonatiger Erhaltungstherapie war ein Progress der Erkrankung zu verzeichnen, sodass sechs Zyklen mit Docetaxel und Nintedanib verabreicht wurden und die Lendenwirbelsäule palliativ bestrahlt wurde. Nintedanib ist ein Angiokinaseinhibitor, der vaskuläre endotheliale Wachstumsfaktorrezeptoren (VEGFR 1–3), von Blutplättchen abgeleitete Wachstumsfaktorrezeptoren (PDGFR alpha und beta) und die Kinaseaktivität von Fibroblasten-Wachstumsfaktorrezeptoren (FGFR 1–3) blockiert. Nach der darauffolgenden Erhaltungstherapie mit Nintedanib zeigte sich sechs Monate später sowohl ein Progress in der Lunge als auch neu eine Lebermetastase. Es wurde ein Portkatheter implantiert und einmalig Nivolumab in einer Dosierung von 3 mg/kg Körpergewicht verabreicht. Als analgetische Komedikation erhielt die Patientin zu diesem Zeitpunkt täglich viermal 500 mg Metamizol sowie zweimal 150 mg Pregabalin. Beide Medikamente wurden bereits seit etwa zwei Jahren eingenommen.
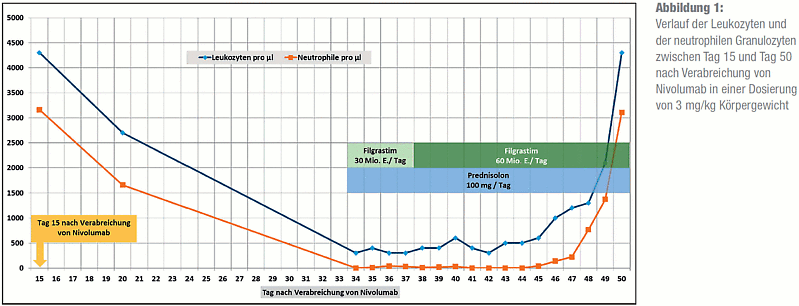
20 Tage nach der Nivolumab-Gabe war ein Abfall der vormals normwertigen Gesamtleukozyten auf 2700/μl zu verzeichnen. Nach weiteren 14 Tagen zeigte sich eine schwere Leukopenie von 300/μl mit Agranulozytose im Differenzialblutbild. Die Patientin hatte zu diesem Zeitpunkt hohes Fieber und eine ausgeprägte Stomatitis aphthosa. Sie wurde stationär aufgenommen und erhielt eine antibiotische Therapie mit Piperacillin/Sulbactam, die bei persistierendem Fieber durch Meropenem ersetzt und zuletzt um Vancomycin erweitert wurde. Zusätzlich erfolgte wegen Nachweis von HSV-1 im Rachenspülwasser eine antivirale Behandlung mit Aciclovir.
Zur Behandlung der Agranulozytose wurde Filgrastim verabreicht, zunächst 30 Mio. Einheiten pro Tag über 4 Tage gefolgt von 60 Mio. Einheiten pro Tag über weitere 12 Tage. Wegen des Verdachts auf ein immunvermitteltes Geschehen erhielt sie zusätzlich 100 mg Prednisolon pro Tag (entsprechend etwa 1,7 mg/kg) über 12 Tage, danach wurde schrittweise reduziert. Hierunter kam es zögerlich zu einem Anstieg der Leukozyten mit Normalisierung nach mehr als 14 Tagen (siehe Abbildung 1).
Nach einer stationären Behandlung über insgesamt fast vier Wochen konnte die Patientin in einem stabilen Allgemeinzustand in die ambulante Weiterbetreuung entlassen werden. Das wegen der schweren Agranulozytose zwischenzeitlich pausierte Metamizol wurde erneut verabreicht, ohne dass es zu einem Abfall der Leukozyten gekommen ist. Wegen des Verdachts auf eine durch Nivolumab ausgelöste Agranulozytose wurde geplant, die antitumoröse Behandlung mit wöchentlicher Gabe von Docetaxel fortzusetzen.
Bewertung des dargestellten Verdachtsfalls
Im dargestellten Fall kommt differenzialdiagnostisch als Ursache für die Agranulozytose die Komedikation mit Pregabalin und vor allem mit Metamizol in Betracht. In der Fachinformation von Pregabalin wird Neutropenie als gelegentlich auftretende Nebenwirkung (≥ 1/1 000, < 1/100) aufgeführt. In der Literatur findet sich jedoch nur ein Fallbericht einer Agranulozytose (definiert als Neutropenie mit einer Anzahl an Granulozyten < 500/μl) durch Pregabalin (6). Für Metamizol hingegen ist eine Agranulozytose eine gut bekannte Nebenwirkung (7). Ungewöhnlich wäre für beide Arzneimittel jedoch die lange Latenz von etwa zwei Jahren zwischen Beginn der Behandlung und dem Auftreten der Reaktion im dargestellten Fall. Durch die erneute Gabe von Metamizol ohne Abfall der Leukozyten („negatives Rechallenge“) kann dieses Arzneimittel als Ursache der Agranulozytose ausgeschlossen werden. Zusammenfassend ist die Agranulozytose „wahrscheinlich“ durch Nivolumab induziert worden, hierfür spricht auch das Ansprechen auf die immunsuppressive Behandlung mit Prednisolon.
Agranulozytosen unter Checkpoint-Inhibitoren in der Literatur und im Spontanmeldesystem
In den die Zulassung begründenden Studien zu Nivolumab sind keine Agranulozytosen beobachtet worden (8–11). Eine ähnliche Nebenwirkung wie im oben beschriebenen Fall bei einer 74-jährigen Patientin mit NSCLC wurde kürzlich publiziert (12). Auch in diesem Fall zeigte sich etwa vier Wochen nach Erstgabe von Nivolumab eine Agranulozytose, die auf intravenöses Immunglobulin nicht ansprach und sich erst 14 Tage nach Diagnosestellung unter intravenöser Verabreichung von Methylprednisolon (zuletzt in einer Dosierung von 3 mg/kg/Tag) normalisierte. Die Autoren des Fallberichts diskutieren, dass der Pathomechanismus der Reaktion nicht komplett verstanden ist, aber möglicherweise die T-Zell-Aktivierung durch Nivolumab eine Rolle spielt, die dann zur vermehrten Ausschüttung von Zytokinen durch T-Helferzellen und Aktivierung von zytotoxischen T-Zellen führt.
Das Paul-Ehrlich-Institut hat kürzlich im Bulletin zur Arzneimittelsicherheit über insgesamt zehn Spontanmeldungen von Agranulozytosen oder Panzytopenien unter den Checkpoint-Inhibitoren Nivolumab, Pembrolizumab und Ipilimumab berichtet und bewertet diese Fälle zum jetzigen Zeitpunkt als potenzielles Risikosignal (4). In der Nebenwirkungsdatenbank der europäischen Arzneimittelbehörde EMA sind aktuell unter Nivolumab etwa 7500 Verdachtsfälle von Nebenwirkungen erfasst, darunter wird zwölfmal über eine Agranulozytose berichtet (EudraVigilance, Stand 10.05.2017).
Zusammenfassung und Empfehlung der AkdÄ
Ein gut dokumentierter Fall, der an die AkdÄ berichtet wurde, ein weiterer publizierter Fall sowie international erfasste Spontanmeldungen können ein erster Hinweis dafür sein, dass Nivolumab eine Agranulozytose auslösen kann. In der Fachinformation wird bislang nur Neutropenie als sehr häufige Nebenwirkung (≥ 1/10) aufgeführt. Bei Auftreten einer Agranulozytose (Neutrophile < 500/μl) sollte eine Medikation mit Nivolumab als mögliche Ursache mit in Betracht gezogen werden. Dies gilt auch, wenn begleitend andere Arzneimittel eingenommen wurden, die mit einem Agranulozytoserisiko einhergehen. Es ist zu vermuten, dass Agranulozytosen unter Nivolumab eine immunvermittelte Nebenwirkung darstellen. Bei anderen immunvermittelten Nebenwirkungen unter Nivolumab wird die Gabe von Glukokortikosteroiden empfohlen (siehe Fachinformation). Neben dem Absetzen von Nivolumab, ggf. einer Isolierung und Gabe von Antiinfektiva und G-CSF ist daher auch eine Therapie mit Glukokortikosteroiden zu erwägen.
Fälle von Agranulozytosen oder Panzytopenien unter den Checkpoint-Inhibitoren Nivolumab, Pembrolizumab und Ipilimumab sollten im Rahmen des Spontanmeldesystems berichtet werden, um weitere Kenntnisse über dieses potenzielle Risikosignal sammeln zu können.
Literatur
- European Medicines Agency (EMA): Opdivo® – Nivolumab: European Public Assessment Report (EPAR) (Assessment Report): http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_- _Public_assessment_report/human/003985/WC500189767.pdf EMA/CHMP/76688/2015 Procedure No. EMEA/H/C/003985/0000. Stand: 23. April 2015.
- Bristol-Myers Squibb Pharma EEIG: Fachinformation „Opdivo® 10 mg/ml“. Stand: Januar 2017.
- Johnson DB, Balko JM, Compton ML et al.: Fulminant Myocarditis with Combination Immune Checkpoint Blockade. N Engl J Med 2016; 375: 1749–1755.
- Heymanns L, Mentzer D, Keller-Stanislawski B: Verdachtsfälle unerwünschter Reaktionen nach Checkpoint-Inhibitoren aus Deutschland. Bulletin zur Arzneimittelsicherheit 2016; 7 (4): 11–18.
- Roche Pharma AG: Fachinformation „Tarceva® 25 mg Filmtabletten, Tarceva® 100 mg Filmtabletten, Tarceva® 150 mg Filmtabletten“. Stand: Dezember 2017.
- Kino H, Suzuki H, Nakamura K et al.: Clostridium difficile infection induced by pregabalin-associated agranulocytosis. Intern Med 2014; 53: 2149–2152.
- Stammschulte T, Ludwig W-D, Muhlbauer B et al.: Metamizole (dipyrone)-associated agranulocytosis. An analysis of German spontaneous reports 1990–2012. Eur J Clin Pharmacol 2015; 71: 1129–1138.
- Robert C, Long GV, Brady B et al.: Nivolumab in previously untreated melanoma without BRAF mutation. N Engl J Med 2015; 372: 320–330.
- Motzer RJ, Escudier B, McDermott DF et al.: Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med 2015; 373: 1803–1813.
- Brahmer J, Reckamp KL, Baas P et al.: Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med 2015; 373: 123–135.
- Borghaei H, Paz-Ares L, Horn L et al.: Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med 2015; 373: 1627–1639.
- Tabchi S, Weng X, Blais N: Severe agranulocytosis in a patient with metastatic non-small-cell lung cancer treated with nivolumab. Lung Cancer 2016; 99: 123–126.
