Unerwünschte Wirkungen von DPP-4-Inhibitoren
Übersichtsarbeiten
Übersichtsarbeiten
Die aktuelle blutzuckersenkende Therapie des Typ-2-Diabetes mellitus orientiert sich nicht mehr an fixen HbA1c-Zielwerten, sondern definiert individualisierte Therapieziele, unter anderem unter Berücksichtigung des hier besonders wichtigen kardiovaskulären Risikoprofils. Im Instrumentarium der oralen antidiabetischen Therapie sind seit 2006 ubiquitär wirksame Dipeptidylpeptidase(DPP)-4-Inhibitoren (DPP4-I) verfügbar, deren Langzeit¬wirkungen allerdings bis dato unzureichend untersucht wurden. Hinsichtlich des Spektrums der unerwünschten Wirkungen fokussiert sich die Pharmakovigilanz derzeit auf das pankreatische System: Die Datenlage bezogen auf die akute Pankreatitis und das Pankreaskarzinom ist widersprüchlich, bei bestehendem Pankreatitis-Risiko, bestehenden Karzinomen und Lipase-Erhöhungen sollte allerdings auf eine DPP4-I-Therapie verzichtet respektive diese abgesetzt werden. Insgesamt scheint das Nutzen-Schaden-Verhältnis der Gliptine unklar: Ein kardiovaskulärer Nutzen ist nicht nachgewiesen und es besteht der Verdacht auf ein vermehrtes Auftreten von zur Hospitalisierung führender Herzinsuffizienz.
The current blood glucose lowering therapy of type 2 diabetes mellitus is no more based on fixed HbA1c thresholds but defines individualised therapeutic goals, amongst other things incorporating the especially important cardiovascular risk profile. Since 2006 the ubiquitous effective dipeptidyl peptidase(DPP)-4 inhibitors belong to the therapeutic armamentarium of oral antidiabetic agents, with until today inadequately investigated long-term effects. With regard to the range of adverse effects pharmacovigilance currently focuses on the pancreatic system: data on acute pancreatitis and pancreatic cancer are conflicting. However, with present risk for pancreatitis, present cancer und elevated lipase levels a DPP4-I therapy should not be initiated or should be stopped, respectively. Overall, the risk-benefit ratio of gliptins appears unclear: a cardiovascular benefit could not be established and an increased number of hospitalisations due to congestive heart failure is suspected.
Obwohl einige Daten bezüglich einer Reduktion mikrovaskulärer Komplikationen bei verbesserter langzeitglykämischer Kontrolle des Typ-2-Diabetes mellitus (T2DM) vorliegen, konnte eine solche Assoziation für makrovaskuläre Komplikationen, die bei diesen Patienten das Hauptmorbiditäts- und Mortalitätsrisiko darstellen, nicht nachgewiesen werden (1-4), weshalb heutzutage eine generelle „Treat to target“-Therapie im Sinne eines starren HbA1c-Zielwertes als überholt gilt. Dies war einer der Gründe für die 2008 publizierte Empfehlung der Food and Drug Administration (FDA) zur Evaluation des kardiovaskulären Risikos neuerer antidiabetischer Therapien in der Behandlung des T2DM (5-7). Diese schlägt vor, dass das obere Ende eines zweiseitigen 95-%-Konfidenzintervalls (95 % CI) des relativen Risikos kardiovaskulärer Ereignisse eines neuen Antidiabetikums im Vergleich zu einer Kontrollintervention geringer als 1,8 sein sollte (d. h. eine Steigerung um weniger als 80 %). Es soll mithin primär geprüft werden, ob neuere Antidiabetika keine negativen kardiovaskulären Auswirkungen haben, positive Effekte auf die entsprechenden Outcomes sind keine Voraussetzung.
Neben anderen Substanzen wurden auch die Dipeptidylpeptidase(DPP)-4-Inhibitoren (DPP4-I) oder „Gliptine“ in das jüngst eingeführte europäische, zusätzliche Pharmakovigilanz-Sicherheitsmonitoring aufgenommen, da sich nach deren Zulassung neue Sicherheitsaspekte wie z. B. Verdacht auf Pankreatitis und Herzinsuffizienz ergeben haben (8). In diesem Zusammenhang aufhorchen lässt auch der abrupte Abbruch weiterer Forschung an dem DPP4-I Dutogliptin ohne Angabe von Gründen (9).
Der Erstzulassungsverlauf maßgeblicher Gliptine verlief wie folgt: 2006 Sitagliptin (FDA), 2007 Vildigliptin (European Medicines Agency – EMA), 2009 Saxagliptin (FDA), 2011 Linagliptin (FDA), 2012 Anagliptin und Teneligliptin (beide Japan) und 2013 Alogliptin (FDA).
Wenn immer möglich, wurde auf neuere bzw. neueste Publikationen insbesondere systematischer Reviews Bezug genommen, wobei die Qualität der entsprechenden Publikationen im Rahmen dieses Beitrags nicht überprüft werden konnte, obwohl hier signifikante Unterschiede existieren (10).
Die DPP4-I verstärken die glukoseabhängige Insulinsekretion der pankreatischen β-Zellen durch Hemmung des DPP-4 vermittelten Abbaus endogen freigesetzter Inkretine (11;12). Zielhormon des Wirkmechanismus ist dabei das Inkretin GLP-1 (glucagon-like peptide 1), das partiell für die Verstärkung der glukoseabhängigen Insulinsekretion als Reaktion auf Nahrungsaufnahme (Inkretineffekt) verantwortlich ist. GLP-1 kann die insuffiziente Reaktion pankreatischer β-Zellen auf das Haupt-Inkretinhormon GIP (glucose-dependent insulinotropic polypeptide) kompensieren. Gegenwärtig existieren zwei Arten inkretinbasierter Therapien: GLP-1-Rezeptoragonisten stimulieren in pharmakologischen Dosen den GLP-1-Rezeptor, wohingegen DPP4-I den Abbau des endogen freigesetzten GLP-1 verhindern. Beide Substanzen reduzieren die Plasmaglukose, inhibieren die Glukagonfreisetzung und führen aufgrund des glukoseabhängigen Wirkmechanismus zu geringen Hypoglykämieraten.
Trotz des insgesamt vergleichbaren Wirkmechanismus weisen die DPP4-I relevante strukturelle Heterogenitäten auf, wie etwa unterschiedliche Pharmakokinetik und -dynamik, sowie differenzielle Selektivität für die mit DPP-4 strukturell verwandten Enzyme (u. a. DPP-8/9). Dies kann mit unterschiedlichen Profilen hinsichtlich erwünschter klinischer und unerwünschter Effekte assoziiert sein.
Die Halbwertszeit der bisher zugelassenen Gliptine rangiert zwischen ca. 2,5 Stunden (Vildagliptin, Saxagliptin, hier noch partiell aktive Metaboliten) und bis zu 120 Stunden (Linagliptin, hier besteht auch eine hohe Bindung an Plasmaproteine). Außer dem primär biliär eliminierten Linagliptin erfolgt die Ausscheidung aller anderen Gliptine vorwiegend renal. Die meist verwandten Dosierungen betragen einmal täglich 5 mg (Linagliptin, Saxagliptin), 25 mg (Alogliptin), 100 mg (Sitagliptin) und zweimal täglich 50 mg (Vildagliptin). Damit werden 70–80 % der DPP-4-Aktivität gehemmt und ein 1,5- bis 4-facher Anstieg der GLP-1-Spiegel erreicht. Die Gliptine werden mit Ausnahme des Saxagliptin (CYP3A4/5) nur gering metabolisiert (13).
Hinsichtlich der langfristigen HbA1c-Senkung ist anzumerken, dass während des zweiten Behandlungsjahres bei Gliptin-Langzeitstudien die ohnehin moderate metabolische Kontrolle um etwa 0,2 % schlechter wird (14).
DPP-4 wird ubiquitär auf den Zelloberflächen (T-Zellen, Makrophagen, Epithelialzellen, Endothelialzellen) im ganzen Körper exprimiert, inhibiert die verschiedensten Substrate und moduliert die Immunregulation, die Entzündungsreaktion sowie die neoplastische Transformation. Untersuchungen der Langzeiteffekte der Hemmung dieses Enzyms existieren bis auf wenige Endpunktstudien bis dato nicht.
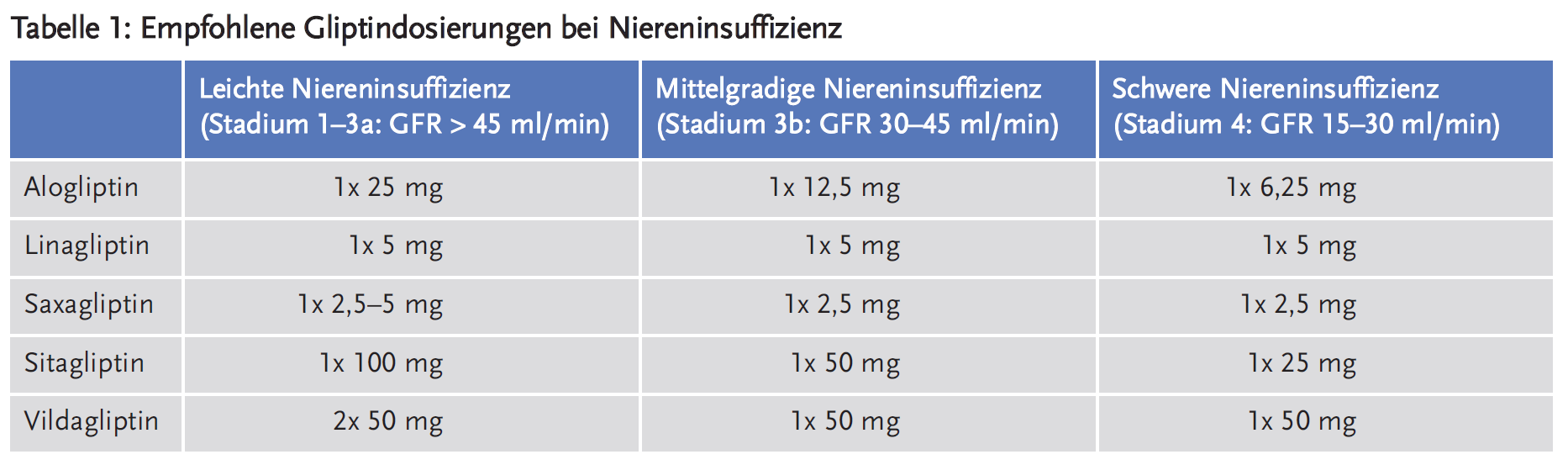
Die empfohlenen Dosierungen verschiedener Gliptine bei unterschiedlichen Graden der Niereninsuffizienz sind in Tabelle 1 zusammengefasst (15;16).
Eine Untersuchung einer taiwanesischen Versichertendatenbank der Sitagliptinmedikation bei 205 T2DM-Patienten nach akutem Myokardinfarkt und chronischer Nierenerkrankung evaluierte u. a. die kardiovaskuläre Gliptinsicherheit (Komposit aus Myokardinfarkt, ischämischer Apoplex und kardiovaskulärer Tod): Die HR lag bei 1,32 (95 % CI 0,97–1,79; p = 0,079) bei einem mittleren Follow-up von einem Jahr. Die Hospitalisierung aufgrund von Herzinsuffizienz unterschied sich nicht relevant, allerdings wurde ein höheres Risiko unter Sitagliptin für erneuten Myokardinfarkt und PTCA postuliert (17).
Eine retrospektive Analyse der Sitagliptingabe nach Nierentransplantation bei 22 Patienten mit neu aufgetretenem Diabetes und einjährigem Follow-up zeigte keine negativen Effekte auf die Nierenfunktion und Immunsuppression (18).
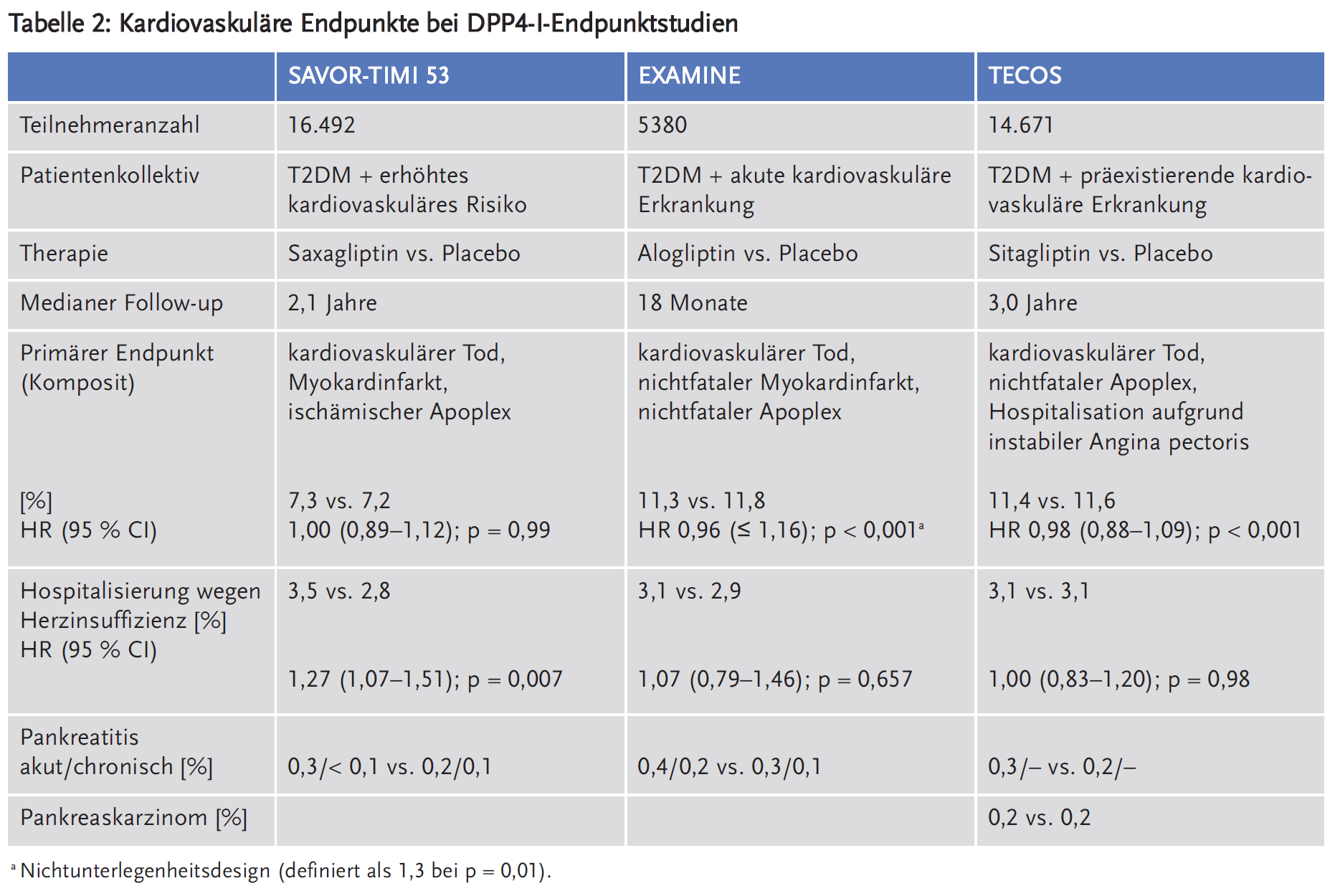
Bis dato wurden drei DPP4-I-Endpunktstudien publiziert: SAVOR-TIMI 53 (Saxagliptin Assessment of Vascular Outcomes Recorded in Patients with Diabetes Mellitus – Thrombolysis in Myocardial Infarction 53) (19;20), EXAMINE (Examination of Cardiovascular Outcomes with Alogliptin versus Standard of Care) (21;22) und TECOS (Trial Evaluating Cardiovascular Outcomes with Sitagliptin) (23). Anzumerken ist, dass hier Gliptine oder Placebo als zusätzliche Medikation zu einer oralen Antidiabetika-Standardtherapie gegeben wurden, d. h. es wurden überwiegend Kombinationstherapien miteinander verglichen. In Tabelle 2 werden die Hauptergebnisse bezüglich kardiovaskulärer Endpunkte inklusive Herzinsuffizienz wiedergegeben.
Eine weitere Studie mit Rekrutierungsbeginn Dezember 2010 und Komplettierung Dezember 2012 ist CAROLINA (CARdiovascular Outcome Trial of LINAgliptin Versus Glimepiride) (24), deren Studienende für 2018 antizipiert ist: 6051 Teilnehmer mit T2DM und erhöhtem kardiovaskulären Risiko wurden zu Linagliptin oder Glimepirid randomisiert. Der primäre Endpunkt ist ein Komposit aus kardiovaskulärem Tod, nichtfatalem Myokardinfarkt, nichtfatalem Apoplex oder Hospitalisierung aufgrund instabiler Angina pectoris und wird primär auf Nichtunterlegenheit (HR ≤ 1,3) getestet. Hospitalisierungen und Tod aufgrund von Herzinsuffizienz werden ebenfalls untersucht.
Eine jüngere Metaanalyse wies kein erhöhtes Infektionsrisiko unter DPP4-I nach. Eingeschlossen wurden 74 Studien bei T2DM mit mindestens zwölfwöchiger Dauer. Die Infektionsrisiken von Alogliptin, Linagliptin, Sitagliptin, Saxagliptin und Vildagliptin waren mit denen unter Placebo vergleichbar (25). Andererseits zeigte eine Analyse von Krankenversicherungsdaten aus Asien, dass der kurzfristige Gebrauch sowie auch höhere Gliptindosierungen mit einem erhöhten Risiko an Herpes-zoster-Infektionen assoziiert waren (26). Ein randomisierte kontrollierte Studie (RCT) mit Sitagliptin für bis zu 24 Wochen bei 20 nichtdiabetischen Personen mit HIV-Positivität wiederum erbrachte keinen Hinweis auf eine Reduktion der CD4+-T-Helferzellen (27). Eine japanische Fallkontrollstudie bei T2DM zeigt allerdings eine Assoziation zwischen DPP4-I und einem erhöhten Risiko für ein Wiederaufflammen polyarthritischer Gelenkbeschwerden (28). Eine Fallkontrollstudie untersuchte das Risiko von ambulant auftretenden Pneumonien unter mit Gliptinen behandelten 49.653 T2DM-Patienten (562 Hospitalisierungen wegen Pneumonie) und wies keine relevanten Differenzen im Vergleich zu anderen oralen Antidiabetika auf (29). Weiterhin existieren Fallberichte eines vermehrten Auftretens von Angioödemen einer Komedikation von Vildagliptin und Sitagliptin mit ACE-Inhibitoren/Angiotensin-Rezeptorenblockern (30;31).
Pankreatitis/Pankreaskarzinom: Die Frage der Assoziation zwischen der Einnahme verschiedener Antidiabetika und einer Pankreatitis datiert bis auf 1970 zurück. Dabei ist zu beachten, dass der Diabetes als solcher einen Risikofaktor für eine Pankreatitis darstellt und die medikamentenassoziierte Pankreatitis kein häufiges Phänomen ist, was eine adäquate Untersuchung erschwert. Weiterhin muss von einer langen Latenzzeit bei der Entstehung eines Pankreaskarzinoms ausgegangen werden (32;33). Insgesamt erscheint die Datenlage nicht eindeutig: Ein systematisches Review von Fallberichten, Observationsstudien, RCTs und Metaanalysen von RCTs beschäftigte sich mit der Frage der Assoziation von Gliptingabe mit Pankreatitis. Dabei ergab sich kein eindeutiges Bild einer Risikoerhöhung oder -erniedrigung (34). Ein weiteres systematisches Review mit vergleichbaren Inklusionen, das 55 RCTs mit 33.350 T2DM-Teilnehmern umfasste, evaluierte 37 Fälle von Pankreatitis und zeigte ein Odds Ratio bei DPP4-I von 1,06 (95 % CI 0,46–2,45), Subgruppenanalysen erbrachten keine relevanten differenziellen Effekte bezüglich der verschiedenen Substanzen (35). Eine jüngere Kohortenstudie aus Taiwan allerdings wies in Subgruppenanalysen die Assoziation eines erhöhten Pankreatitisrisikos bei Frauen und älteren Menschen mit Gliptineinnahme nach (36). Zumindest für eine Sitagliptineinnahme älterer Diabetiker konnten diese Befunde in einer kanadischen retrospektiven Kohortenstudie jedoch nicht bestätigt werden (37). Weiterhin konnte eine neuere Metaanalyse der Assoziation inkretinbasierter Therapien mit einer akuten Pankreatitis kein statistisch signifikantes Risiko nachweisen (38). Andererseits wies eine neuere Metaanalyse von RCTs inkretinbasierter Therapien, die die drei großen Endpunktstudien einschloss, ein Odds Ratio von 1,57 (95 % CI 1,09–2,26) zuungunsten der Inkretine nach (39).
Weiterhin zeigte eine komplexe Analyse der FDA-Datenbank von Berichten über unerwünschte Arzneimitteleffekte eine statistische Assoziation zwischen dem Gebrauch von DPP4-I und einem Pankreaskarzinom, ohne natürlich einen Kausalzusammenhang etablieren zu können (40). Bestätigt wurde dieser Befund durch eine retrospektive Analyse einer taiwanesischen Versichertendatenbank, die ebenfalls eine Assoziation zwischen Sitagliptineinnahme bei 71.137 Typ-2-Diabetikern und einem erhöhten Pankeaskarzinomrisiko etablierte (41).
Angesichts der derzeit unsicheren Datenlage sollte daher bis auf Weiteres aus Sicherheitsgründen bei Patienten mit bereits bestehender oder mit Risiko für eine Pankreatitis keine Gliptineinnahme erfolgen (32).
Es erfolgt eine Kurzdarstellung von relativ selten genannten unerwünschten Wirkungen, die mit DPP4-I assoziiert wurden:
Die Herzinsuffizienz ist eine wichtige primäre Todesursache weltweit. Einerseits weisen Menschen mit Herzinsuffizienz eine erhöhe Inzidenz an Diabetes mellitus auf und andererseits verschlechtert Diabetes mellitus als Komorbidität die Prognose der Herzinsuffizienz (50). Die Herzinsuffizienz aufgrund von Diabetes wird auch als „diabetische Kardiomyopathie“ bezeichnet und eine jüngere Kohortenstudie (CALIBER-Register) aus England deutete an, dass die Herzinsuffizienz und die pAVK die häufigsten initialen Manifestationen einer kardiovaskulären Erkrankung beim T2DM sind (52). Studien beim T2DM werden heutzutage zwar auch auf kardiovaskuläre Endpunkte ausgelegt, jedoch ist die Herzinsuffizienz nur selten ein primärer Endpunkt (53). Es ist fraglich, ob das heutzutage am häufigsten anzutreffende Design zum Monitoring der kardiovaskulären Sicherheit, die Nichtunterlegenheitsstudie, ausreicht, um die Ergebnisse dieser Untersuchungen auf den klinischen Alltag zu übertragen.
Wie die Ergebnisse einer Querschnittsuntersuchung zeigten, sind exzessive Aktivitäten zirkulierender DPP-4 mit einer subklinischen linksventrikulären systolischen und/oder diastolischen Dysfunktion assoziiert (54). DPP-4 gilt als ein Schlüsselenzym bezüglich der Modifikation von Brain Natriuretic Peptide (BNP; Herzinsuffizienzmarker). In einem Follow-up über sechs Monate wurden 164 hospitalisierte Patienten (darunter 63 mit T2DM), einem medianen Alter von 78 Jahren sowie akuter Herzinsuffizienz untersucht. Insgesamt 59 % wiesen eine linksventrikuläre systolische Dysfunktion auf. Diese Untersuchung zeigte, dass erhöhte DPP-4-Werte innerhalb von sechs Monaten nach Entlassung mit einer Dreifacherhöhung des Mortalitätsrisikos aufgrund von Herzinsuffizienz assoziiert waren (55).
Andererseits deuten sich Assoziationen eines erhöhten Risikos für Hospitalisierung infolge Herzinsuffizienz unter Gabe verschiedener DPP4-I aufgrund der Ergebnisse diverser Publikationen an (56). Dieses widersprüchliche Bild soll im Folgenden kurz skizziert werden:
Eine Metaanalyse von Linagliptin versus Placebo/aktivem Komparator von RCTs ≥ 12 Wochen Dauer bei Teilnehmern mit T2DM untersuchte ein Komposit aus kardiovaskulärem Tod, nichtfatalem Myokardinfarkt, nichtfatalem Apoplex und Hospitalisierung aufgrund instabiler Angina pectoris (18 Studien, 7746 Teilnehmer: HR 0,78 (95 % CI 0,55–1,22)). Weiterhin wurde Hospitalisierung aufgrund einer Herzinsuffizienz untersucht (acht Studien, 3314 Teilnehmer): HR 1,04 (95 % CI 0,43–2,47) (57).
Eine andere Metaanalyse untersuchte 84 RCTs ≥ 24 Wochen verschiedener DPP4-I und Herzinsuffizienz als gemessenem Outcome: Das RR einer akuten Herzinsuffizienz im Vergleich zu Placebo/aktivem Komparator war 1,19 (95 % CI 1,03–1,37); p = 0,015. Klare Differenzen zwischen den einzelnen Substanzen waren nicht sichtbar (58).
Eine weitere Metaanalyse (59) verschiedener Gliptine von insgesamt 94 Studien mit 85.224 T2DM-Teilnehmern (medianer Follow-up 29 Wochen) zeigte ein erhöhtes Risiko für neu aufgetretene Herzinsuffizienz nach längerer Gliptintherapie: HR 1,16 (95 % CI 1,01–1,33); p = 0,034.
Eine Metaanalyse von 40 Vildagliptin RCTs bei 17.446 T2DM-Teilnehmern und partiell erhöhtem Risiko für kardiovaskuläre Erkrankungen untersuchte den Komposit aus Myokardinfarkt, Apoplex und kardiovaskulärer Tod im Vergleich zu Placebo/aktivem Komparator: RR 0,82 (95 % CI 0,61–1,11). Bestätigte Herzinsuffizienzfälle (Hospitalisierungen oder neu aufgetreten) zeigten ein RR von 1,08 (95 % CI 0,68–1,70) (60).
Eine Analyse koreanischer Versicherungsdaten bei 935.519 Versicherten mit Diabetes und mittlerem Follow-up von 337 Tagen untersuchte Inzidenzraten für Hospitalisierung wegen Herzinsuffizienz mit den folgenden Ergebnissen (jeweils pro 100.000 Patientenjahre): 118 (Pioglitazon) vs. 106 (Sitagliptin) vs. 136 (Vildagliptin) mit einer HR von 1,85 (Pioglitazon), 2,00 (Sitagliptin) und 1,79 (Vildagliptin). Die Hinweise auf diese unerwünschten Effekte waren v. a. in den ersten 30 Tagen der Behandlung zu beobachten (61). Eine populationsbasierte Fallkontrollstudie administrativer Daten aus Italien mit 282.000 Versicherten, die mit Antidiabetika behandelt wurden, ermittelte 14.613 Hospitalisierungen wegen Herzinsuffizienz, darunter 7212 inzidente Fälle und 1727 Rehospitalisierungen. In dieser Untersuchung fand sich kein Hinweis auf ein erhöhtes Risiko an Herzinsuffizienz unter DPP4-I (62). Eine italienische retrospektive Studie an 127.555 T2DM Patienten unter Antidiabetika mit einem durchschnittlichen Follow-up von 2,6 Jahren zeigte die Assoziation eines reduzierten Risikos für Hospitalisierung wegen Herzinsuffizienz von DPP4-I im Vergleich zu Sulfonylharnstoffen (63). Eine Fallkontrollstudie US-amerikanischer Patienten mit Diabetes unter Sitagliptin untersuchte das Auftreten von Herzinsuffizienz innerhalb 30 Tage nach Hospitalisierung aufgrund eines akuten Koronarsyndroms. Sitagliptin musste innerhalb 90 Tage vor dem akuten Koronarsyndrom eingenommen werden. Sitagliptin war nicht mit einem erhöhten Risiko für den kombinierten Endpunkt Mortalitätsrisiko oder Herzinsuffizienz assoziiert (64).
Die ersten Signale eventueller Schädigungen des Pankreas durch Inkretinmimetika wurden der FDA im Zeitraum 2005 bis 2006 für das erste GLP1-Analogon Exenatid gemeldet (65) und wurden später mit praktisch allen inkretinbasierten Therapien (sowohl GLP1-Analoga als auch DPP4-Inhibitoren) assoziiert. Bei den GLP-1 basierten Therapien ist zu beachten, dass die physiologischen Wirkungen nur kurzwirkend erfolgen, während die Konsequenzen einer langwirksamen pharmakologischen Rezeptorstimulation weitgehend unbekannt sind. Dabei könnte die momentan im Fokus stehende akute Pankreatitis nur die Spitze eines Eisbergs darstellen: Bisher nur beschrieben, aber in Humanstudien anscheinend nicht systematisch erfasst sind Wirkungen auf den exokrinen Pankreas, subklinische Pankreasgang-Proliferationen und Gangmetaplasien, subklinische Pankreatitiden und damit assoziierte gesteigerte intrapankreatische Druckverhältnisse, die eine Prädisposition zum Pankreaskarzinom darstellen könnten (66-68). In diesem Zusammenhang ist anzumerken, dass auch eine Hypertriglyceridämie ein Risiko für eine akute Pankreatitis darstellt (69). Schließlich wurden in einer vor Kurzem publizierten Arbeit Hypothesen dargelegt, die eine Erklärung liefern, warum DPP4-I zu einem Wachstum und zu einer Metastasierung insbesondere vorhandener maligner Entitäten führen könnten (via Steigerung der endogenen Antioxidans-Abwehr der Zelle und damit herabgesetzter Tumorsuppressor-p53-Aktivität (70)).
Abschließend soll darauf hingewiesen werden, dass bei praktisch allen Dossierbewertungen des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) den DPP4-I in Gestalt von Linagliptin, Saxagliptin, Sitagliptin und Vildagliptin kein Zusatznutzen im Vergleich zu einer zweckmäßigen Vergleichstherapie attestiert wurde (71;72). Lediglich bei einer Sitagliptin-Metformin-Therapie wurde beim Therapieziel normnahe Blutzuckereinstellung (was kein akzeptiertes Therapieziel beim Typ-2-Diabetes mellitus darstellt) bei Männern ein beträchtlicher Zusatznutzen respektive bei Frauen ein Anhaltspunkt für einen Zusatznutzen festgestellt (73;74). Die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) konnte auf Basis der jeweilig gegenwärtigen Datenlage in keiner der zugelassenen Indikationen einen Zusatznutzen für DPP4-I gegenüber der jeweiligen zweckmäßigen Vergleichstherapie sehen (75-83).
Hinsichtlich der blutzuckersenkenden Therapie des Typ-2-Diabetes mellitus gilt eine generelle „Treat-to-target“-Vorgehensweise, etwa im Sinne eines HbA1c-Zielwertes von 6,5 %, als überholt. Vielmehr muss die metabolische „Kontrolle“ individualisiert werden, insbesondere bezüglich Alter bzw. antizipierte Restlebenszeit, Komedikationen und Komorbiditäten sowie bestehendem kardiovaskulärem Risikoprofil.
Sowohl das IQWiG als auch die AkdÄ sehen bei den untersuchten DPP-4-Inhibitoren (DPP4-I) für die praktisch relevante Therapie des Diabetes mellitus Typ 2 keinen Zusatznutzen.
DPP4-I wirken ubiquitär im Körper, was potenzielle Relevanz für erwünschte und unerwünschte Effekte beinhaltet. Die Langzeitwirkungen dieser physiologisch kurzwirksamen Substanzen sind bisher unzureichend untersucht, drei Endpunktstudien hatten eine mediane Nachbeobachtungszeit von 1,5 bis 3 Jahren.
Das DPP4-I-Infektions-/Entzündungsrisiko wird insgesamt als eher gering eingeschätzt. Die Evidenzsituation hinsichtlich der akuten Pankreatitis und des Pankreaskarzinoms ist widersprüchlich, erfordert aber auf jeden Fall eine erhöhte Vigilanz: DPP4-I sollten keinem Karzinompatienten (insbesondere Pankreaskarzinom, Schilddrüsenkarzinom, MEN-Syndrom Typ 2) verabreicht werden. Weiterhin solle eine DPP4-I-Therapie nicht erfolgen bei Pankreatitis-Anamnese, Gallenblasen-/Gallengangserkrankungen, erhöhtem Pankreatitis-Risiko (Familienanamnese, Alkoholabusus, erhöhte Triglyceride). Bei einer Lipase-Erhöhung (valideres Leitenzym als die Amylase) nach DPP4-I-Gabe sollte der DPP4-I aus Vorsichtsgründen abgesetzt werden.
Insgesamt besteht aufgrund des unklaren Nutzen-Schaden-Verhältnisses der DPP4-I kein Anlass, diese in die Breite der Versorgung von Patienten mit T2DM einzusetzen. Stattdessen sollten individuell abgewogene Einzelfallentscheidungen bezüglich dieser Therapieart erfolgen.
Ein Interessenkonflikt wird vom Autor verneint.