Sulfonylharnstoffe in der Therapie des Typ-2-Diabetes
Therapie aktuell
Therapie aktuell
Diabetes mellitus ist eine lebenslange Krankheit, die meist über Jahrzehnte eine medikamentöse Therapie erfordert. Bei einer solch langen Expositionszeit bedürfen auch geringe Nebenwirkungen, insbesondere hinsichtlich des Immunsystems, einer sorgfältigen Evaluation. Relevante Nebenwirkungen werden oft erst nach mehrjähriger Beobachtungszeit festgestellt, wie im Fall der Glitazone. Für Glibenclamid, Glipizid, Metformin und Humaninsulin liegen Endpunktstudien zur Verbesserung mikrovaskulärer und z. T. auch makrovaskulärer Komplikationen vor. Makrovaskuläre Endpunkte wurden auch durch Empagliflozin, Canagliflozin und Liraglutid vermindert.
Sulfonylharnstoffe sind für nicht übergewichtige Patienten mit Typ-2-Diabetes untersucht. Sie verbessern mikrovaskuläre Endpunkte genauso wie Insulin. Die HbA1c-Absenkung ist nach Therapiebeginn stärker als bei anderen oralen Antidiabetika und erfordert engmaschige Kontrollen und eine einschleichende Dosierung zur Vermeidung von Hypoglykämien. Hypoglykämien sind meist leicht und treten in einer Häufigkeit von 0,5–1,0 Ereignis pro Patient und Jahr auf. Die Gewichtszunahme findet vorwiegend innerhalb des ersten halben Jahres nach Therapiebeginn statt und überschreitet auch bei Langzeitstudien im Mittel nicht zwei Kilogramm. Endpunktstudien zur Kombination von Antidiabetika liegen bis heute nicht vor. Sulfonylharnstoffe haben weiterhin einen wichtigen Stellenwert in der Behandlung des Typ-2-Diabetes.
Diabetes mellitus is a life-long metabolic disease that mostly requires pharmaceutical drug therapy for decades. With such a long-lasting exposure even minor side effects, particularly with regard to the immune system, require careful evaluation. Clinically relevant side effects often are detected after years of observation, e. g. in the case of glitazones. For glibenclamide, glipizide, metformin and human insulin, endpoint studies are available for the improvement of microvascular and, at least in some of them, macrovascular complications.
Sulfonylureas have been studied in non-overweight patients with type 2 diabetes. They improve microvascular endpoints to the same extent as does insulin. The initial HbA1c lowering effect is stronger than that of other oral antidiabetics and, therefore, requires close-meshed controls and, if necessary, dose adaptation to avoid hypoglycemic episodes. Hypoglycemic episodes, in most cases, are mild and occur in a frequency of 0.5–1.0 event per patient per year. The increase in weight takes place predominantly within the first six months after initiation of therapy and does not exceed, in average, two kilograms even in long-term studies. Studies with patient-relevant endpoints on the combination of antidiabetic drugs are not yet available. Sulfonylureas stay an important antihyperglycemic agent.
Sulfonylharnstoffe (SH) gehören zu den ältesten oralen Antidiabetika. Die beiden ersten klinischen Studien mit SH wurden 1955/56 in der Deutschen Medizinischen Wochenschrift veröffentlicht (1;2). Danach stiegen SH zur meist verordneten Substanzgruppe in dieser Indikation auf. Erst vier Jahrzehnte später folgten dann die Belege zur Verbesserung klinischer Endpunkte in der UKPDS. Ein Cochrane-Review hilft, den Stellenwert der SH in der Therapie des Typ-2-Diabetes einzuordnen (3). Hinsichtlich der Verminderung mikrovaskulärer Komplikationen des Diabetes sind SH und Insulin gleich wirksam. Die beiden häufigsten Nebenwirkungen der Therapie mit SH oder Insulin sind Hypoglykämien und Gewichtszunahme.
Im Jahr 2014 wurden 7,7 % der Patienten mit Diabetes Typ 2 im DMP Nordrhein mit Glibenclamid behandelt (4). Das häufiger verordnete Glimepirid wird im DMP unter „sonstige orale Antidiabetika“ geführt, sodass die wirkliche Zahl der mit SH behandelten Patienten im DMP unklar bleibt. Die Verordnung von Sulfonylharnstoffen ist stetig rückläufig. Im Jahr 2014 wurden 287,4 Millionen Tagesdosen Sulfonylharnstoffe verschrieben, womit diese unter der Verordnungshäufigkeit der neuen oralen Antidiabetika lagen (336,4 Millionen verordnete Tagesdosen von Inkretinmimetika). An der Spitze der Verordnungen der oralen Antidiabetika stand Metformin mit 595,2 Millionen DDD (5). In den letzten Jahren hat sich die Palette der medikamentösen Diabetestherapie um viele Wirkstoffgruppen erweitert. Insbesondere mit der Einführung der inkretinbasierten Therapien wurden große Hoffnungen verbunden, und die Einschätzung des Stellenwertes der SH wurde kontroverser diskutiert (6;7). Die Bedenken beziehen sich insbesondere auf Hypoglykämien, Gewichtszunahme und kardiovaskuläre Nebenwirkungen. Zur Häufigkeit dieser Nebenwirkungen werden jedoch meist nur unklare Angaben gemacht, sodass die klinische Relevanz nicht beurteilt werden kann.
Der Wirkungsmechanismus der SH gilt als aufgeklärt. Sie binden an verschiedene Rezeptoren: den Sulfonylharnstoffrezeptor 1 (SUR1) an den Beta- und Alpha-Zellen im Pankreas, den GLP1 sezernierenden intestinalen L-Zellen und an Neuronen im Hypothalamus, der Substantia nigra, sowie an den Sulfonylharnstoffrezeptor 2 (SUR2) am Skelett- und Herzmuskel (SUR2A) sowie an der glatten Muskulatur (SUR2B). Die Bindung von SH an den SUR1-Rezeptor der Beta-Zellen führt über Membranpotenzialveränderung zur Ausschüttung von Insulin. Verschiedene SH binden unterschiedlich an diese SH-Rezeptoren. Die Untersuchungen zur Rezeptorbindung der verschiedenen SH wurden elektrophysiologisch an Membranpatches von Oozyten des Krallenfrosches Xenopus muelleri durchgeführt (8). Deshalb müssen Nutzen und Schaden eines jeden SH durch randomisierte kontrollierte Studien beim Menschen untersucht werden.
Glibenclamid und Gliclazid werden im DMP Diabetes Typ 2 und in der Nationalen Versorgungsleitlinie zu den Antidiabetika mit gesicherter günstiger Beeinflussung klinischer Endpunkte gezählt und in der Monotherapie bei Unverträglichkeit von Metformin empfohlen (9;10).
Wirkung auf den Glukosestoffwechsel
In der Monotherapie sind Sulfonylharnstoffe hinsichtlich HbA1c- bzw. Glukosesenkung genauso wirksam wie Metformin (11). Die HbA1c-Senkung hängt vom Ausgangswert und von der Diabetesdauer ab und wird mit 1–2 % angegeben (12). In einer jüngeren Untersuchung an asiatischen Patienten betrug die HbA1c-Senkung bei 304 Patienten nach fünf Jahren bei Metformin –0,6 % und bei Glipizid –0,5 % (13). Bei abnehmender Insulinreserve nimmt die Wirkung von SH zunehmend ab. Nach etwa zehn Jahren Behandlungsdauer sind SH meist nicht mehr ausreichend wirksam, sodass eine Kombination mit anderen oralen Antidiabetika oder ein Wechsel auf eine Insulintherapie notwendig werden. Eine Ausnahme sind Patienten mit Mutationen des Sulfonylharnstoffrezeptors SUR1 oder des inwardly rectifying potassium channels Kir6.2 (14). Die genetischen Defekte sind weitgehend aufgeklärt. Patienten mit HNF4A-MODY (MODY 3) und mit ABCC8-MODY-Diabetes (MODY 12) ohne Betazellerschöpfung können mit SH behandelt werden (15).
In Kombination mit Metformin sind SH ebenso wirksam wie DPP4- oder SGLT-2-Inhibitoren. In zwei 52-Wochen-Studien reduzierte Glipizid plus Metformin das HbA1c um 0,67 % bzw. 0,52 % im Vergleich zu 0,67 % unter Sitagliptin plus Metformin (1172 Patienten) (16) bzw. 0,52 % unter Dapagliflozin plus Metformin (814 Patienten) (17). In einer Zwei-Jahres-Studie mit 1552 Patienten war die HbA1c-Senkung mit Glimepirid plus Metformin mit –0,36 % stärker als unter Linaglitptin plus Metformin –0,16 % (1552 Patienten) (18).
Klinische Endpunkte
Alle oralen Antidiabetika senken Blutglukose und HbA1c. Aber nur für drei Substanzen, Glibenclamid, Glipizid und Metformin, liegt ein Nachweis zur Verbesserung der mikrovaskulären Endpunkte Retinopathie und Nephropathie aufgrund ihrer antidiabetischen Wirkung vor. Für das häufig verwendete Glimepirid gibt es bis heute keine Endpunktstudien.
In der United Kingdom Prospective Diabetes Study wurde 1998 erstmals für Patienten mit Diabetes mellitus Typ 2 ein klinisch relevanter Effekt gezeigt. In der zehn Jahre dauernden UKPDS (19) führte Glibenclamid in 5467 Personenjahren bei nicht adipösen Patienten zur Reduktion mikrovaskulärer Endpunkte um absolut 0,38 % pro 100 Patientenjahre. Die Variable „any diabetes-related end point“ wurde um 0,83 % pro 100 Patientenjahre gesenkt. Die relative Risikoreduktion betrug 34 % bzw. 18 %. Das mediane HbA1c über zehn Jahre war 7,2 %. Damit war Glibenclamid gleich effektiv wie Insulin, das eine Risikoreduktion mikrovaskulärer Endpunkte um absolut 0,36 % und relativ 30 % aufwies.
Dieses günstige Ergebnis blieb auch in den zehn Jahren Nachbeobachtung nach Ende der Hauptstudie erhalten (ARR 3,2 %). Die Senkung von Myokardinfarkt (ARR 2,8 %) und Mortalität (ARR 3,5 %) in der Insulin-SH-Gruppe wurde in dieser Beobachtungsphase erst nach 11–20 Jahren signifikant (20). Eine Metaanalyse zur Reduktion mikrovaskulär Ereignisse liegt wegen mangelnder Daten nicht vor (11).
Von den neuen Antidiabetika reduzierten das GLP1-Analogon Liraglutid (21) und die SGLT-2-Inhibitoren Empagliflozin (22) und Canagliflozin (23) in mehrjährigen RCTs bei Typ-2-Diabetikern mit erhöhtem kardiovaskulärem Risiko signifikant kardiovaskuläre Komplikationen um 0,5 bis 1,6 %. Liraglutid (24) und Empagliflozin (25) reduzierten zusätzlich das Fortschreiten einer Mikroalbuminurie bzw. Niereninsuffizienz um 1,5 bis 6,1 % in den gleichen Studien im Vergleich mit Standardtherapie-Kohorten.
Hypoglykämien
Insulin und insulinotrope orale Antidiabetika könnten Hypoglykämien hervorrufen. Das Risiko von Unterzuckerungen ist bei Insulintherapie doppelt (26) bis vierfach (27) höher als bei Therapie mit insulinotropen oralen Antidiabetika. In RCTs mit neueren oralen Antidiabetika haben in den Kontrollgruppen mit Sulfonylharnstoffen 30–40 % der Patienten mindestens eine, allerdings meist nicht schwere Unterzuckerung pro Jahr. Diese Zahlen führen zur Überschätzung des Risikos von Hypoglykämien, da hier nicht die Häufigkeit der Ereignisse berücksichtigt wird. Die absolute Häufigkeit der Hypoglykämie-Ereignisse ist gering. Sie beträgt pro Patientenjahr in zwei neueren Ein-Jahres-Studien 1,1 bei Glipizid plus Metformin vs. 0,09 bei Sitagliptin plus Metformin (16) und 0,4 bei Glipizid plus Metformin vs. 0,03 bei Dapagliflozin plus Metformin (17) sowie in einer Zwei-Jahres-Studie 0,5 bei Glimepirid plus Metformin vs. 0,025 bei Linaglitptin plus Metformin (18). Schwere Unterzuckerungen nach der Fremdhilfe-Definition treten bei 0,35 bis 2 % der Patienten unter Sulfonylharnstoffen auf (13;16-18). Unterzuckerungen traten am häufigsten in den ersten drei Monaten auf, wenn in der Titrierungsphase das HbA1c in der Sulfonylharnstoffgruppe deutlicher absank als in der Vergleichsgruppe (Abbildung 1). Dabei ist zu berücksichtigen, dass in all diesen Untersuchungen das Ausgangs-HbA1c schon deutlich unter 8 % lag, sodass die Patienten von der Intensivierung der antidiabetischen Therapie kaum einen Nutzen zur Verminderung mikro- oder makrovaskulärer Endpunkte erwarten konnten.
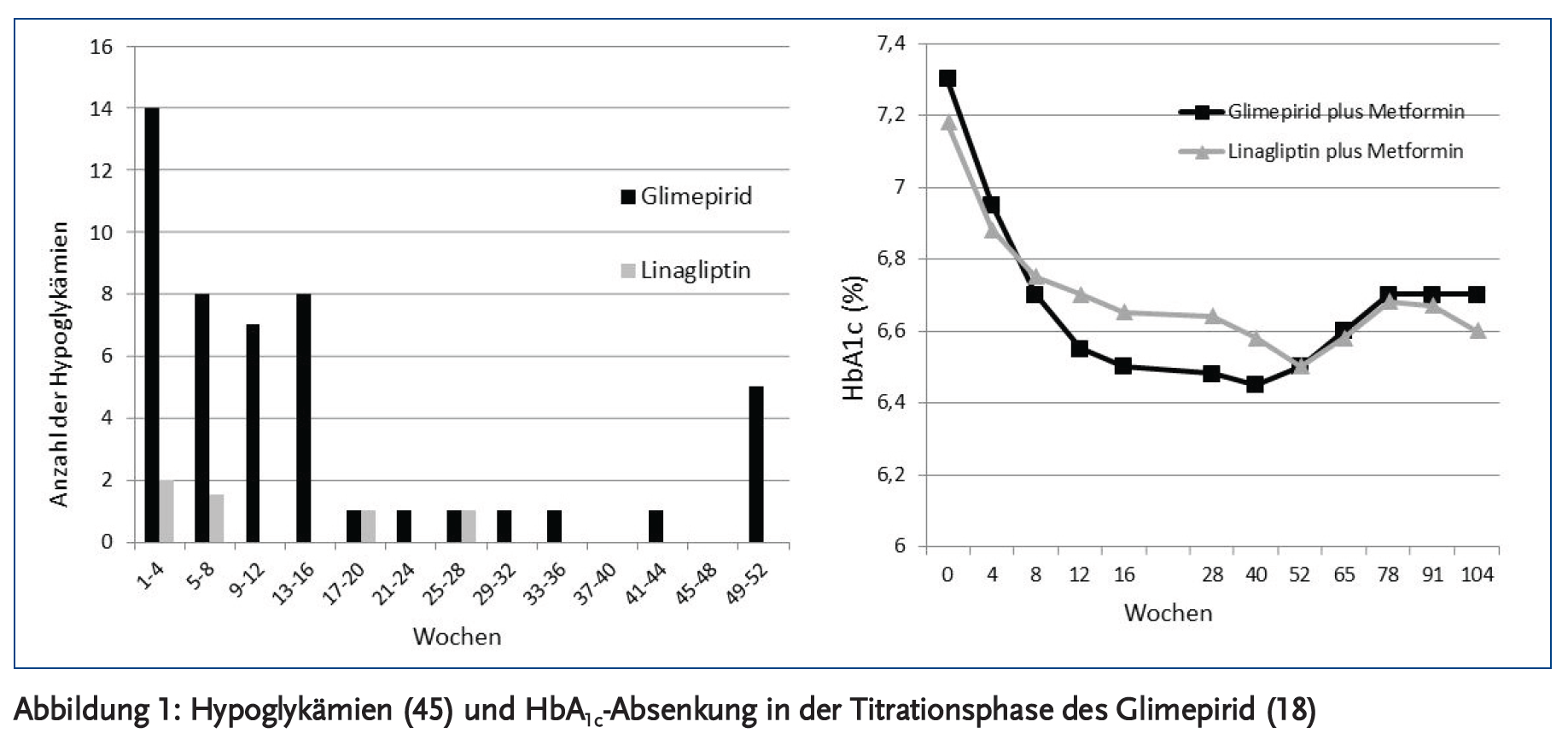
Schwere Unterzuckerungen bei Patienten mit Diabetes Typ 2 haben in Deutschland durch zunehmende Intensivierung der Diabetestherapie zugenommen (28;29). Dabei wird die Untersuchung von Holstein et al. oft unvollständig und damit irreführend zitiert. Eine signifikante Zunahme schwerer Unterzuckerungen war nur bei Patienten mit intensivierter Insulintherapie nachweisbar und nicht bei Patienten mit SH-Therapie. Auch hatten die Patienten mit schwerer Hypoglykämie 2007–2010 mit 6,4 % ein deutlich niedrigeres HbA1c (DCCT adjustiert) als 1997–2000 mit 7,7 %. Ein ähnliches Ergebnis zeigt die Analyse von AOK-Versicherten mit Diabetes Typ 2 (29). Schwere Unterzuckerungen durch Sulfonylharnstoffe waren in einem Fünf-Jahres-Zeitraum rückläufig, während schwere Unterzuckerungen durch eine intensive Therapie mit zwei Analoginsulinen signifikant zunahmen. Im Gegensatz zum Typ-1-Diabetes lassen sich schwere Unterzuckerungen beim Diabetes Typ 2 durch Patientenschulung nicht vermindern.
Risikofaktoren für schwere Unterzuckerungen unter SH sind niedrige HbA1c-Werte und Niereninsuffizienz (30;31). Zu berücksichtigen ist auch, dass Hypoglykämien durch Arzneimittelwechselwirkungen ausgelöst werden können. Aktuelle Daten weisen auf Interaktionen von Vitamin-K-Antagonisten wie Warfarin (32) sowie Antibiotika wie Clarithromycin, Levofloxacin, Sulfamethoxazol-Trimethoprim, Metronidazol und Ciprofloxacin (33) mit Sulfonylharnstoffen hin. Dadurch kann sich das Hypoglykämierisiko erhöhen. Hier sind häufigere Kontrollen nötig, damit die Dosis rechtzeitig reduziert wird oder niedrig dosierte SH abgesetzt werden können. Eine wichtige Maßnahme zur Vermeidung von Unterzuckerungen ist die Pausierung von SH bei permanenter postprandialer Harnzuckerfreiheit und postprandialer Blutglukose unter 11 mmol/l (200 mg/dl) oder bei einem HbA1c im unteren Zielbereich. Ein ähnliches Vorgehen ist bei Insulintherapie schon lange selbstverständlich. Eine Glukoseselbstkontrolle wäre deshalb hier wünschenswert, auch wenn zur Reduktion von Hypoglykämien durch Glukoseselbstkontrolle keine Studiendaten vorliegen. Sollte die Blutglukose postprandial unter 10 mmol/l (180 mg/dl) liegen oder die Harnglukose permanent negativ sein, liegt das HbA1c in der Nähe einer Normoglykämie (34). Auf eine potenzielle Überbehandlung älterer Patienten mit Diabetes Typ 2 mit erhöhtem Risiko von Unterzuckerungen wurde in letzter Zeit hingewiesen (35-37). Bei guter Patientenschulung in Deutschland hatten im DMP Nordrhein 2014 0,6 % der Patienten mindestens eine schwere Unterzuckerung (die Häufigkeit war bei Insulintherapie 2,5 % und bei oralen Antidiabetika generell 0,3 %) (4).
Gewichtszunahme
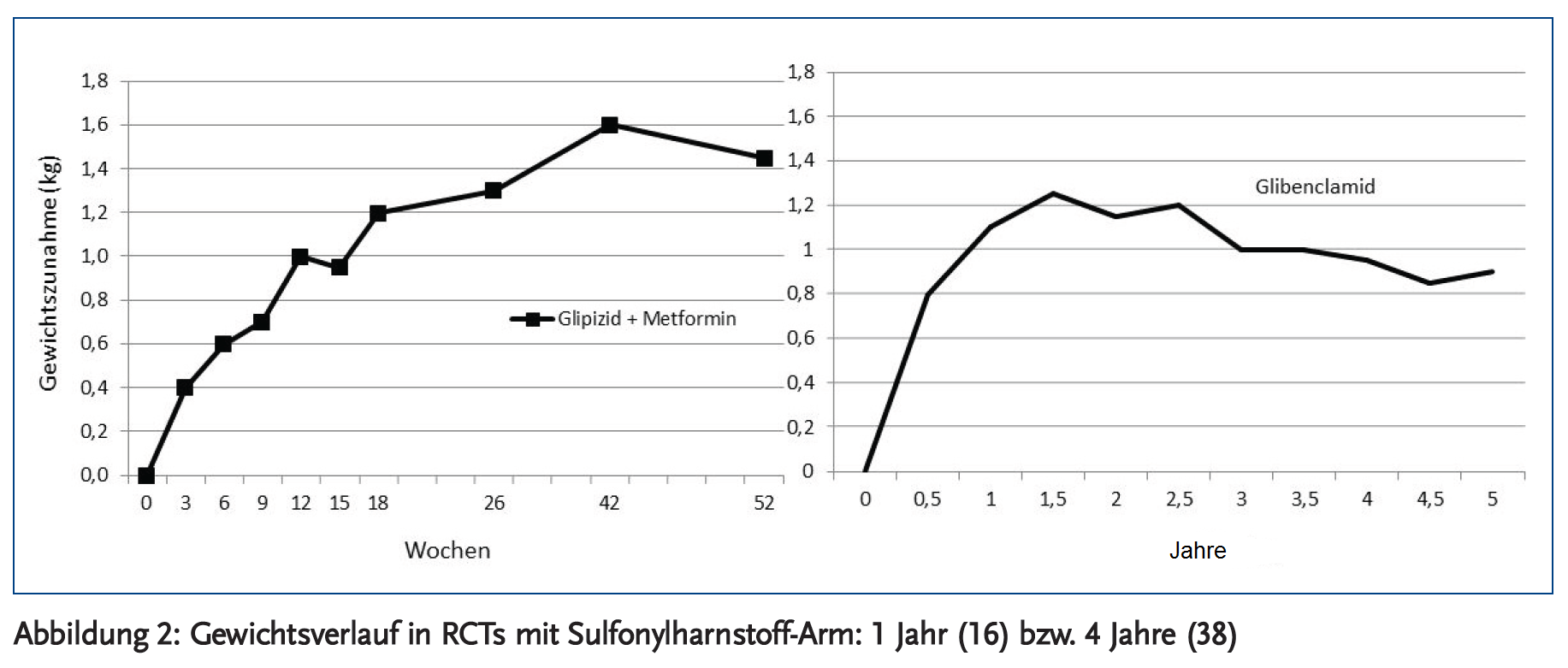
Einzelne Patienten können durch antidiabetische Behandlung deutlich an Gewicht zunehmen. Das absolute Ausmaß der Gewichtszunahme wird meist überschätzt. Die Gewichtszunahme durch Sulfonylharnstoffe findet meist im ersten halben Jahr nach Beginn der Therapie statt und erreicht dann ein Plateau. Die Gewichtszunahme in RCTs lag immer unter 2 kg, unabhängig davon, ob die Untersuchung ein, fünf oder zehn Jahre dauerte (Abbildung 2). In neueren Studien betrug die Gewichtszunahme 1,1 kg bzw. 1,4 kg bei Glipizid plus Metformin nach einem Jahr (16;17) und 1,3 kg bei Glimepirid plus Metformin nach zwei Jahren (18), sowie 0,9 kg unter Glipizid nach fünf Jahren (13). Eine ähnlich geringe Gewichtszunahme durch Glipizid wurde in der vier Jahre währenden ADOPT-Studie mit 0,2 kg pro Jahr registriert (38). In der längsten Untersuchung war die Gewichtszunahme nach zehn Jahren unter Glibenclamid um 1,7 kg höher als unter Placebo (19). In der gleichen Studie betrug die Gewichtszunahme durch Insulintherapie 4 kg. Für die Bewertung von Gewichtsveränderungen gilt, dass Schwankungen bis zu 3 % des Körpergewichtes als Gewichtserhaltung gelten (39). Dies sind 2 kg bei einem Körpergewicht von 70 kg. Alle in den o. g. Studien beschriebenen Gewichtsveränderungen liegen innerhalb dieser Grenzen und sind damit klinisch nicht relevant. Häufig wird die Gewichtsdifferenz zu einem Vergleichspräparat angeben und nicht zu Placebo. Das führt zu einer Überschätzung der Gewichtszunahme. In einer Metaanalyse zur oralen Monotherapie beträgt die Differenz zwischen Metformin und SH der zweiten Generation 3,7 kg (11).
Kardiovaskuläre Komplikationen
Extrapankreatische Effekte der SH können über SUR2-Rezeptoren an Myokard und Muskeln entstehen, sind aber auch über SUR1-Rezeptoren der endokrinen Darmzellen oder im ZNS möglich (8;40). Frühere Hinweise auf Verminderung der kardialen Ischämietoleranz durch SH bestätigten sich in der UKPDS nicht. Herzkranke Diabetespatienten wurden in die Studie nicht eingeschlossen. In einer Metaanalyse randomisierter kontrollierter Studien (11) traten bei Behandlung mit SH der 2. Generation sogar weniger nichttödliche kardiovaskuläre Nebenwirkungen auf als bei Metformin. Kardiovaskuläre Mortalität und Gesamtmortalität waren unter SH nicht erhöht. Dieses unerwartete Ergebnis ist durch die Aufnahme der ADOPT-Studie in die Metaanalyse bedingt. In dieser sehr sorgfältigen, prospektiven Untersuchung von Metformin, Rosiglitazon und Glibenclamid jeweils als Monotherapie über eine mediane Dauer von vier Jahren betrug die Häufigkeit kardiovaskulärer Ereignisse 2,8 % unter Glyburide (= Glibenclamid), 4 % unter Metformin und 4,3 % unter Rosiglitazon, vorwiegend bedingt durch die Häufigkeit von Herzinsuffizienz mit 0,6 %, 1,3 % bzw. 1,5 % (38). Im auffälligen Gegensatz dazu steht die irreführende Metaanalyse von Forst et al. (41), nach der Patienten mit SH eine erhöhte Gesamt- und kardiovaskuläre Mortalität aufwiesen. Die zugrunde gelegten Daten stammen aber aus Beobachtungsstudien. Hier ist davon auszugehen, dass bei fehlender Randomisierung und Verblindung Patienten mit SH häufiger andere ungünstige Faktoren wie höheres Alter, höheren Blutdruck, häufigeres Zigarettenrauchen oder niedrigeren Sozialstatus aufwiesen als die Patienten mit der Vergleichstherapie.
Ein erhöhtes Mortalitätsrisiko bei der Kombination von Glibenclamid und Metformin bleibt bis heute Gegenstand von Kontroversen. Allerdings weist eine Kohortenstudie mit sorgfältiger Berücksichtigung von Störgrößen nicht auf ein erhöhtes kardiovaskuläres Risiko hin (42). Die Kombination Metformin plus SH war in dieser Analyse weniger gefährlich als die Kombination Metformin plus Insulin. Auch die italienische TOSCA.IT-Studie, eine randomisierte prospektive Studie zu kardiovaskulären Komplikationen bei Zweifachkombination oraler Antidiabetika zeigte bei der Zugabe von Sulfonylharnstoffen im Vergleich zu Pioglitazon bei Versagen der Metformin-Monotherapie keinen Unterschied in kardiovaskulären Ereignissen (43). Noch mehrSicherheit dazu soll 2020 die GRADE-Studie zu den Zweifachkombinationen Metformin plus Glimepirid oder Sitagliptin oder Liraglutid oder Glargin bringen (44).
In der Praxis sollten nur Sulfonylharnstoffe der zweiten Generation verwendet werden. Die in Deutschland mit weitem Abstand am häufigsten verwendeten Substanzen aus dieser Gruppe sind Glibenclamid und Glimeprid. Nachdem nur zu Glibenclamid eine randomisierte Studie mit klinischen Endpunkten vorliegt, sollte diese Substanz das Mittel der Wahl sein. Die Behauptung, dass unter Glimepirid weniger Hypoglykämien auftreten, ist durch aussagekräftige randomisierte Studien nicht belegt.
Für die Therapie gelten folgende Grundsätze:
U. A. Müller erhielt keine persönlichen Honorare und hatte keine Beratertätigkeit von/für pharmazeutische Unternehmen; klinische Studien/Forschungsförderung: Fresenius Medical Care, Roche Diagnostics, Medpace, Hämopharm, Pfizer. Ein Interessenkonflikt wird von K. Farker, W. Kerner und B. Mühlbauer verneint.