Medikamentöse Therapie bei Motilitätsstörungen von Ösophagus und Magen
Das aktuelle Thema
Das aktuelle Thema
Schwere Motilitätsstörungen von Ösophagus und Magen bewirken eine erhebliche Einschränkung der Lebensqualität und teils auch eine erhöhte Sterblichkeit. Voraussetzung für eine Therapie ist eine adäquate Diagnostik, weil die unspezifische Symptomatik keine sichere Unterscheidung zwischen stark verminderter oder gesteigerter, aber unkoordinierter kontraktiler Aktivität erlaubt. Verfügbare Prokinetika haben am Ösophagus allenfalls einen geringen Effekt. Sie können deshalb bei hypotensiven Ösophagusmotilitätsstörungen nicht generell empfohlen werden. Glattmuskelrelaxantien lindern bei einem Teil der Patienten mit hypertensiven Ösophagusmotilitätsstörungen einschließlich Achalasie die Beschwerden; Studienlage und Verträglichkeit der Therapie sind hier aber unbefriedigend. Am besten belegt für den diffusen Ösophagusspasmus ist die endoskopische Injektion von Botulinumtoxin in den distalen Ösophagus. Diese kommt bei ausgewählten Patienten mit Achalasie ebenfalls in Frage. Die Standardtherapie der Achalasie ist die pneumatische Dilatation oder die Heller’sche Myotomie (mit Semifundoplikatio). Wenn diätetische Maßnahmen nicht genügen, werden auch Magenentleerungsstörungen ergänzend medikamentös behandelt. Beim Dumping-Syndrom sind Somatostatinanaloga besonders effektiv, aber teuer und nebenwirkungsreich. Zur Behandlung der Gastroparese kommen unterschiedliche, prokinetisch wirksame Substanzen in Frage (Metoclopramid, Domperidon, Erythromycin und Prucaloprid). Diese Medikamente sind in dieser Indikation aber nicht zugelassen oder die Zulassung wurde zurückgezogen mangels Daten zur Langzeittherapie. Diese Einschätzung der Datenlage ist sachlich richtig, vernachlässigt aber vollständig, dass es keine Therapiealternativen gibt und stellt Ärzte und Patienten vor rechtliche und finanzielle Probleme.
Severe motility disorders of the oesophagus and stomach cause considerable restriction of the quality of life and contribute to increased mortality. Precondition for therapy is an adequate diagnostic work-up, because the unspecific symptoms permit no clear differentiation between decreased or increased, but uncoordinated motility. Available prokinetic drugs have, at most, low efficiency in the oesophagus. Therefore, they cannot be recommended for hypotensive motility disorders in general. Relaxants of smooth muscle relieve symptoms only in part of the patients with hypertensive motility disorders including achalasia; however, study evidence and tolerance of the therapy are dissatisfactory. The best evidence available for diffuse oesophageal spasm is for endoscopic injection of botulinum toxin into the distal oesophagus. This is also a possible treatment for selected patients with achalasia. The standard therapy of achalasia is pneumatic dilatation or Heller myotomy (with fundoplication). If dietary measures are not enough, gastric emptying disturbances can be treated by drugs. For dumping syndrome somatostatin analogues are especially effective, but expensive and have numerous side effects. For the treatment of gastroparesis different prokinetic drugs are available (metoclopramide, domperidon, erythromycin and prucalopride). However, these drugs do not have a marketing authorisation in this indication or the marketing authorisation was withdrawn in the absence of long-term data. This assessment of available data is formally correct, however, it neglects completely that there are no therapeutic alternatives condemning doctors and patients to legal and financial problems.
Schwere chronische Motilitätsstörungen von Ösophagus und Magen gehen nicht nur mit einer erheblichen Beeinträchtigung der Lebensqualität einher, sie erhöhen teilweise auch die Mortalität oder sind nur unter Nutzung invasiver therapeutischer Maßnahmen behandelbar (1). Dies betrifft zum Beispiel Patienten mit Gastroparese, die eine signifikant erhöhte Sterblichkeit aufweisen, unabhängig von anderen Parametern (2), und in schweren Fällen oral nicht ernährt werden können.
Auch bei weniger dramatischen individuellen Verläufen wird die Therapie wesentlich dadurch erschwert, dass es kaum wirksame Prokinetika gibt und dass zudem aktuell kein einziges in Deutschland für die Behandlung von Motilitätsstörungen des Ösophagus oder des Magens zugelassen ist (Tabelle 1).
Im Folgenden werden die in Frage kommenden Krankheitsbilder dargestellt und die jeweils verfügbaren direkt oder indirekt motilitätswirksamen Medikamente. Die Angabe von Effektstärken zu den medikamentösen Interventionen fehlt entgegen den Gepflogenheiten dieses Journals, weil es sich um seltene Krankheitsbilder handelt und die verfügbaren Studien oft zu klein oder anderweitig methodisch ungeeignet sind, diese Parameter zu erfassen.
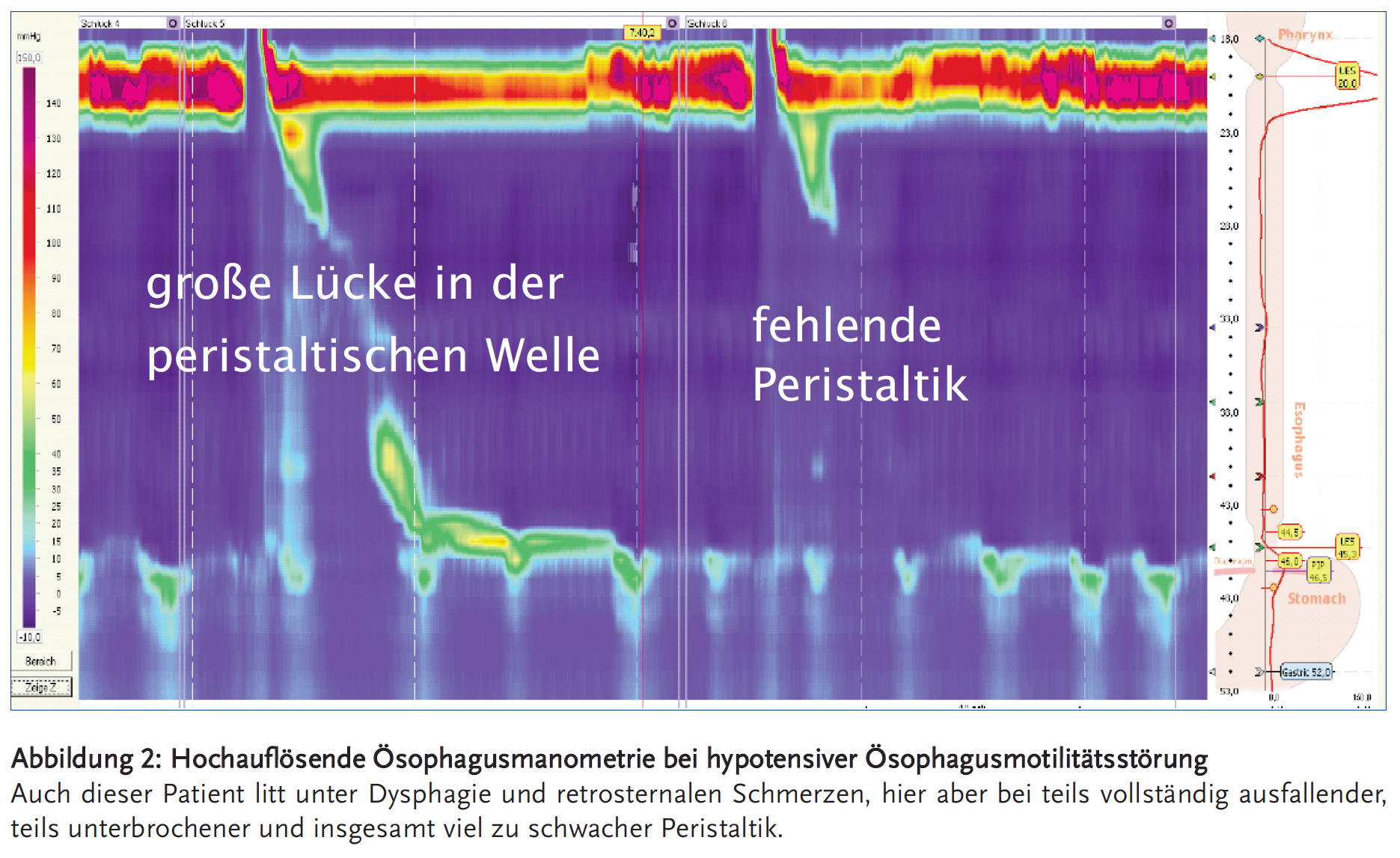
Dysphagie ist das Leitsymptom sowohl von hypertensiven als auch von hypotensiven Motilitätsstörungen des Ösophagus. Retrosternale Schmerzen treten bevorzugt bei gesteigerter Kontraktilität auf, schließen aber eine pathologisch verminderte Kon¬traktionskraft keinesfalls aus. Hieraus wird deutlich, dass eine sinnvolle therapeutische Strategie die korrekte Diagnose der Motilitätsstörung voraussetzt, die mit Hilfe moderner Verfahren wie der hochauflösenden Ösophagusmanometrie (high resolution manometry, HRM) möglich ist (Abbildungen 1 und 2).
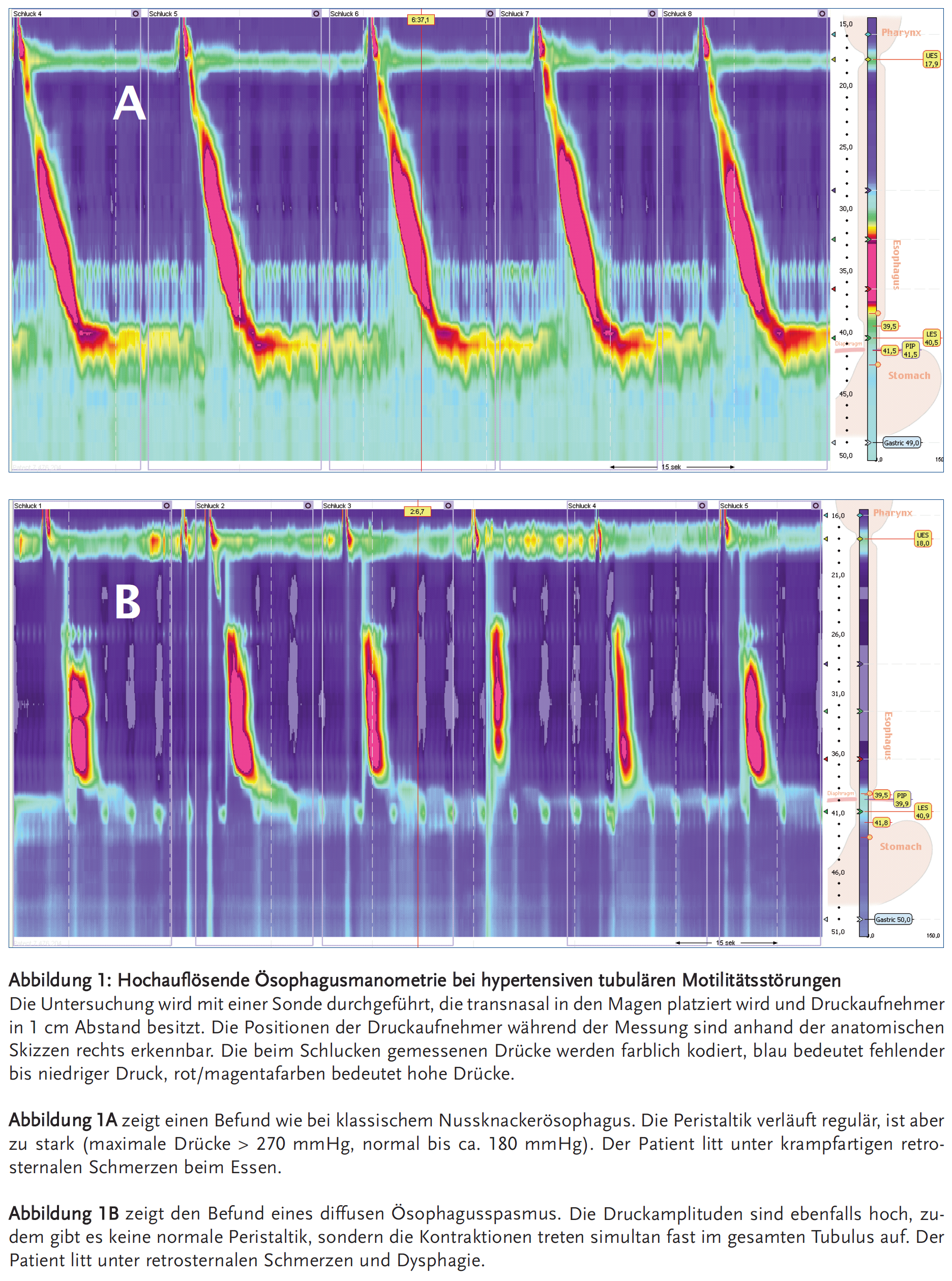
Hypertensive Ösophagusmotilitätsstörungen
Zu den hypertensiven Motilitätsstörungen des tubulären Ösophagus gehören nach klassischer Einteilung der Nussknackerösophagus und der diffuse Ösophagusspasmus (3). Bei ersterem finden sich vor allem im distalen Ösophagus stark hypertensive Kontraktionen bei aber regulärer Peristaltik (Abbildung 1A), bei letzterem ist auch die Propagation der Kontraktionen gestört (Abbildung 1B). Legt man die für die HRM neu entwickelte Chicago-Klassifikation zugrunde (4), ist der diffuse Ösophagusspasmus ähnlich definiert, und es gibt eine Grenze für die Kontraktionsstärke, bei deren Überschreitung mit oder ohne zusätzliche Störung der Propagation praktisch immer Symptome zu erwarten sind („Jackhammer“-Ösophagus).
Hypertensive Ösophagusmotilitätsstörungen können säureinduziert bei Refluxerkrankung auftreten (5). Bei Patienten mit pathologischem Reflux ist deshalb zunächst eine effektive Säuresuppression mittels Protonenpumpeninhibitor(PPI)-Therapie sinnvoll, auch wenn deren Effekt auf Motilitätsmuster und Symptomatik nicht systematisch untersucht wurde.
Hypertensive Ösophagusmotilitätsstörungen können außerdem mit Glattmuskelrelaxantien therapiert werden, die Studienlage hierzu ist aber ebenfalls sehr dürftig und der zu erwartende Effekt limitiert: Pfefferminzöl (5 Tropfen auf 10 ml Wasser) verbesserte in einer kleinen Studie an Patienten mit diffusem Ösophagusspasmus innerhalb von zehn Minuten nach Applikation die Kontraktionsparameter messbar. Bei zwei von zehn Patienten kam es auch zum Sistieren der Beschwerden (6). Größere und placebokontrollierte Studien fehlen. Wegen der geringen Wahrscheinlichkeit von Nebenwirkungen kann ein Therapieversuch trotzdem sinnvoll sein. Kalziumantagonisten und Nitrate reduzieren den Tonus im Bereich des unteren Ösophagussphinkters sowie die Amplitude tubulärer Kontraktionen ebenfalls messbar. Einzelne kleine Studien konnten aber nur mäßige klinische Effekte zeigen und lassen keine eindeutige Aussage bezüglich der zu bevorzugenden Substanz zu. Ein mögliches therapeutisches Regime besteht in der Gabe von bis zu 4 x 90 mg Diltiazem pro Tag (7). Außerdem wird die Therapie häufig durch das Auftreten von kardiovaskulären Nebenwirkungen limitiert.
Der am besten untersuchte medikamentöse Therapieansatz bei hypertensiven Ösophagusmotilitätsstörungen ist die endoskopische Injektion von Botulinumtoxin (BTX). Hier zeigt zumindest eine placebokontrollierte Studie, dass diese Therapie (8 x 12,5 U BTX verteilt auf vier Quadranten bei 2 cm und 7 cm oberhalb des ösophagogastralen Übergangs) zu einer signifikanten klinischen Besserung führt (8). Ein wichtiger Nachteil dieser Therapie besteht darin, dass die Wirkdauer bei den meisten Patienten auf etwa drei Monate bis drei Jahre begrenzt ist.
Hypotensive Ösophagusmotilitätsstörungen
Besonders schwere hypotensive Ösophagusmotilitätsstörungen bis zur Amotilität treten typischerweise bei systemischer Sklerose auf. Bei den meisten Patienten mit hypotensiven Ösophagusmotilitätsstörungen findet sich aber keine Assoziation mit rheumatologischen oder anderen Systemerkrankungen. Neben Dysphagie begünstigen hypotensive Ösophagusmotilitätsstörungen auch Refluxbeschwerden durch eine verminderte ösophageale Clearance.
Verfügbare Prokinetika haben am Ösophagus allenfalls einen geringen Effekt. Mehrere Studien bei Refluxpatienten zeigen, dass Domperidon und Metoclopramid den Tonus im Bereich des unteren Ösophagussphinkters steigern, aber allenfalls einen geringen Effekt auf die tubuläre Motilität haben. Prucaloprid vermindert die Säurebelastung im distalen, tubulären Ösophagus bei Gesunden deutlich (9). Dies beruht aber auf einer beschleunigten Magenentleerung mit Abtransport der Säure, nicht auf einer gesteigerten tubulären Kontraktilität. Zudem besserte der neue 5-HT4-Agonist Revexeprid in placebokontrollierten Studien an Patienten mit PPI-refraktären Refluxbeschwerden die Symptomatik nicht signifikant (10;11). Die Effekte auf die Ösophagusmotilität wurden aber nicht gemessen. Bei dysphagischen Beschwerden, die auf einer hypotensiven Motilitätsstörung beruhen, kann somit eine generelle Gabe von Prokinetika nicht empfohlen werden. Stattdessen sind Allgemeinmaßnahmen anzuraten wie das ausgiebige Kauen fester Nahrung bzw. die Verabreichung von flüssiger Zusatzkost bei aufrechtem Oberkörper, weil der Transport von Flüssigkeiten durch den Ösophagus leichter erfolgt als der von festen Boli und wesentlich durch hydrostatische Kräfte mitbedingt wird. Bei anhaltenden Beschwerden kann im Einzelfall ein zeitlich begrenzter Therapieversuch mit Prokinetika erwogen werden.
Achalasie
Bei der Achalasie ist die schluckreflektorische Relaxation des unteren Ösophagussphinkters (UÖS) gestört bis aufgehoben, außerdem findet sich keine normale tubuläre Peristaltik. Aus internistischer Sicht gilt die pneumatische Dilatation des UÖS als Therapie der Wahl, in therapierefraktären Fällen die Heller’scher Myotomie. Als weitere invasive Therapiemaßnahme wird die perorale endoskopische Myotomie (POEM) zunehmend etabliert (12). Die Gabe von Kalziumantagonisten oder Nitraten als Glattmuskelrelaxantien kann bei Kontraindikationen gegenüber invasiven Therapien probatorisch erfolgen. Zu den medikamentösen Therapieansätzen gibt es aber auch bei diesem Krankheitsbild nur kleine Studien mit mäßigen Erfolgsraten (13). Die endoskopische Injektion von BTX in den UÖS wiederum erzielt kurzfristig ähnlich hohe Erfolgsraten wie die pneumatische Dilatation, der Langzeitverlauf ist aber deutlich schlechter. Meist kommt es innerhalb von ca. drei Monaten bis zu drei Jahren zum Rezidiv. Eine erneute Behandlung kann erfolgen, jedoch mit reduzierten Erfolgsaussichten. Deshalb sollte dieses Verfahren nur ausnahmsweise bei sehr alten oder Hochrisikopatienten eingesetzt werden (14).
Die Gastroparese einerseits und das Dumping-Syndrom andererseits sind Erkrankungen, deren Symptome durch eine ausgeprägte Störung der Magenentleerung verursacht werden.
Die Gastroparese wird allgemein definiert als funktionelle, klinisch relevante Verzögerung der Magenentleerung ohne ursächliche mechanische Obstruktion. Wichtige Ursachen sind Diabetes mellitus und Operationen mit unumgänglicher oder akzidenteller Verletzung des Nervus vagus, vielfach tritt die Gastroparese aber auch idiopathisch, also ohne erkennbare Ursache auf.
Das Dumping-Syndrom tritt meist nach Operationen am Magen auf und wird durch abdominelle Beschwerden, Kreislaufsymptome und/oder Zeichen der Blutzuckerdysregulation in Assoziation mit einer beschleunigten, sturzartigen Magenentleerung charakterisiert. Diese kann abdominelle Beschwerden auslösen. Beim Früh-Dumping kommt es darüber hinaus durch die überstürzte Magenentleerung von hyperosmolarem Chymus in den Dünndarm zum Flüssigkeitseinstrom aus der Zirkulation und zur symptomatischen Hypovolämie kurz nach Nahrungsaufnahme. Auch durch Überdehnung des Dünndarms ausgelöste Reflexe und die gestörte Freisetzung intestinaler Peptidhormone mit postprandialer Vasodilatation sollen zur Symptomatik beitragen.
Beim Spät-Dumping führt die überstürzte Magenentleerung schnell resorbierbarer Kohlenhydrate initial zu einem starken Blutzuckeranstieg, welcher eine starke Insulinaus-schüttung induziert mit konsekutiver Hypoglykämie, die hauptsächlich für die Symptomatik der Patienten verantwortlich ist. Dem mehrschrittigen Pathomechanismus entsprechend treten die Symptome mit zeitlicher Verzögerung auf. Sehr häufig finden sich kein reines Früh- oder Spät-Dumping, sondern Mischformen.
Die abdominelle Symptomatik mit Schmerzen, Völlegefühl, Übelkeit und auch Erbrechen ähnelt sich bei beschleunigter und verzögerter Magenentleerung sehr, sodass auch hier vor Therapieeinleitung eine dezidierte Diagnostik erfolgen sollte. Die Basis der Therapie für beide Störungen bilden adäquate diätetische Maßnahmen. Diese allein führen allerdings selten zu einer ausreichenden klinischen Besserung, sondern müssen durch die unten genannten medikamentösen Therapien ergänzt werden, die sämtlich nur für andere Indikationen zugelassen sind. Bei schwer betroffenen Patienten ist teils auch dann keine ausreichende orale Nahrungszufuhr möglich, sodass eine enterale oder parenterale Ernährung erforderlich wird. Zuvor sollten operative Therapieoptionen evaluiert werden, nämlich die Implantation eines gastralen Neurostimulators bei Gastroparese oder Umwandlungsoperationen bei postoperativem Dumping-Syndrom (z. B. Billroth II zu Billroth I). Hierzu ist teils die Zusammenarbeit mit spezialisierten Zentren erforderlich.
Pectin- und Guar-Präparate (Guarkernmehl) können als Verdickungsmittel die Viskosität des Mageninhalts erhöhen und dadurch die Magenentleerung verzögern. Allerdings sind hierfür hohe Mengen erforderlich (5−15 g Guarkernmehl pro Mahlzeit), die schlecht bekömmlich sowie wenig schmackhaft sind (15;16).
Acarbose hemmt das Bürstensaumenzym Glucoamylase und reduziert dadurch die Kohlenhydratresorption. Die Gabe von 3 x 50−100 mg Acarbose pro Tag kann nach den Daten kleinerer Studien die Symptomatik eines Spät-Dumping-Syndroms bessern (16), führt durch die Induktion einer Kohlenhydratmalabsorption häufig aber zu abdominellen Beschwerden.
Somatostatin-Analoga sind besonders wirksam in der Therapie des Dumping-Syndroms, weil sie mehrere Pathomechanismen positiv beeinflussen: Somatostatin verzögert Magenentleerung und Dünndarmtransit, vermindert die Freisetzung von gastrointestinalen Peptidhormonen und von Insulin und reduziert die postprandiale Vasodilatation. Die subkutane Applikation von 3 x 100 µg Octreotid pro Tag führte dementsprechend auch im Langzeitverlauf zu einer deutlichen Symptomlinderung (17), der Tagesbedarf kann deutlich unterschiedlich sein (3 x 25 µg bis 3 x 200 µg) (18). Als Alternative zum kurzwirksamen Octreotid steht langwirksames Octreotid LAR zur Verfügung (1 x pro Monat (10–)20 mg i.m.) (19). Die wichtigsten Nebenwirkungen sind Schmerzen an der Injektionsstelle, die Bildung von Gallensteinen und Steatorrhoe. Ein weiterer Nachteil besteht in den erheblichen Kosten der Therapie.
Diazoxid reduziert die Kalzium-induzierte Insulinfreisetzung und wurde im Einzelfall in einer Dosis von 3 x 100−150 mg pro Tag erfolgreich bei Spät-Dumping Syndrom eingesetzt (16), hat aber eine Vielzahl möglicher Nebenwirkungen einschließlich neurologischer, hämatologischer und nephrologischer Störungen.
Patienten mit Gastroparese sollten primär diätetisch beraten werden. Sinnvoll ist eine Verteilung der Nahrung auf mehrere (vier bis sechs) kleine Mahlzeiten und eine sogenannte „small particle diet“ (Wahl von breiig-flüssigen Lebensmitteln oder solchen, die mit der Gabel zerdrückt werden können) (20) mit niedrigem Fettgehalt (21). Wenn diese Maßnahmen nicht genügen, sollten bei Gastroparese Prokinetika und ggf. Antiemetika eingesetzt werden, um die Magenentleerung zu verbessern und Übelkeit zu lindern. Für die Behandlung von Übelkeit bei gastrointestinalen Motilitätsstörungen unterscheiden sich die Behandlungsempfehlungen nicht wesentlich von anderen Formen der Übelkeit. Zur prokinetischen Therapie sind in Deutschland die folgenden Substanzen verfügbar, die allerdings sämtlich nur für andere Indikationen zugelassen sind:
Metoclopramid (MCP) ist ein Dopamin-2-Rezeptor-Antagonist und 5-HT4-Rezeptor-Agonist. Die Substanz ist Blut-Hirn-Schranken-gängig und hat sowohl prokinetische als auch antiemetische Eigenschaften. Ein positiver Effekt auf die Symptome der Gastroparese wurde gezeigt mit Minderung des Symptomscores um etwa 40 % (22;23). Domperidon ist ebenfalls ein Dopamin-2-Rezeptor-Antagonist und bei Gastroparese mindestens gleich effektiv (22;23), aber nicht Blut-Hirn-Schranken-gängig. Beide Substanzen unterliegen einer Tachyphylaxie. Unserer Erfahrung nach kann die Wirksamkeit durch wechselnde Gabe der Präparate im Zwei-Wochen-Rhythmus verlängert werden. Domperidon und MCP waren in Deutschland für die Behandlung der Gastroparese zugelassen und wurden deshalb bevorzugt eingesetzt. Die Zulassung für diese Indikation wurde aber jeweils 2014 zurückgenommen. Unter Metoclopramid können schwere extrapyramidal motorische Störungen auftreten, z. B. tardive Dyskinesie, Akathisie oder medikamentös induziertes Parkinson-Syndrom. Das Risiko für eine tardive Dyskinesie bei Langzeittherapie wurde früher mit 1−10 % angenommen, scheint neuen Daten zufolge aber unter 1 % zu liegen (24). Die zuständigen Behörden (EMA und BfArM) haben dennoch festgestellt, dass die „vorliegenden Daten […] eine klinisch signifikante Wirksamkeit [...] in den Anwendungsgebieten, welche eine langfristige Anwendung erfordern („gastrointestinale Motilitätsstörungen, einschließlich Gastroparese“)“ nicht „untermauern“:
http://www.bfarm.de/SharedDocs/Risikoinformationen/Pharmakovigilanz/DE/RV_STP/m-r/metoclopramid.html
Domperidon führt sehr viel seltener, wenn überhaupt zu extrapyramidal-motorischen Nebenwirkungen, wirkt aber QT-Zeit verlängernd und ist deswegen proarrhythmogen. Basierend auf den verfügbaren Daten stellt das BfArM auch hier fest, „dass die Wirksamkeit von Domperidon zur Besserung der Symptome Übelkeit und Erbrechen erwiesen ist, nicht jedoch für andere Indikationen“ und limitiert den Einsatz generell auf höchstens 30 mg pro Tag für längstens sieben Tage:
http://www.bfarm.de/SharedDocs/Risikoinformationen/Pharmakovigilanz/DE/RHB/2014/rhb-domperidon.html
Weder für Metoclopramid noch für Domperidon gibt es kontrollierte Langzeitstudien bei Gastroparese. Insofern ist der Langzeiteffekt tatsächlich nicht belegt. Allerdings wurde ebenso wenig gezeigt, dass eine langfristige Therapie (ggf. mit kalkulierten Pausen/Wechsel) ineffektiv ist. Außerdem vernachlässigen die Beschlüsse von EMA und BfArM vollständig, dass es überhaupt keine zugelassenen medikamentösen Therapiealternativen bei Gastroparese gibt. Dies wirft für behandelnde Ärzte und Patienten erhebliche rechtliche und finanzielle Probleme auf und kann zudem viel mehr Menschen betreffen, als bislang angenommen wurde. Neue Studien zeigen nämlich, dass fast 2 % der Bevölkerung Symptome aufweisen, die auf eine verzögerte Magenentleerung schließen lassen (25).
Erythromycin ist ein Motilin-Rezeptor-Agonist. Die Substanz wirkt prokinetisch und beschleu-nigt die Magenentleerung durch eine starke Steigerung der antralen Motilität (26). Hierfür sind sehr viel niedrigere Dosen erforderlich, als für die antibiotische Therapie, nämlich 50–100 mg bei i.v.-Gabe bzw. 250 mg oral kurz vor den Mahlzeiten. Allerdings vermindert Erythromycin gleichzeitig die Relaxationsfähigkeit des Magenfundus. Hierdurch können Symptome wie Völlegefühl und Übelkeit verstärkt werden. Dies erklärt vermutlich, weshalb es nur bei einem Teil der Patienten zu einer Besserung der Symptomatik kommt (27). Außerdem ist Erythromycin wegen seiner antibiotischen Wirkung nicht gut für die Langzeittherapie der Magenentleerungsstörung geeignet, und der Effekt auf die Magenentleerung unterliegt einer starken Tachyphylaxie. Zudem wird es in dieser Indikation ggf. off label eingesetzt. Zu bedenken ist auch die potenzielle proarrythmogene Wirkung von Erythromycin.
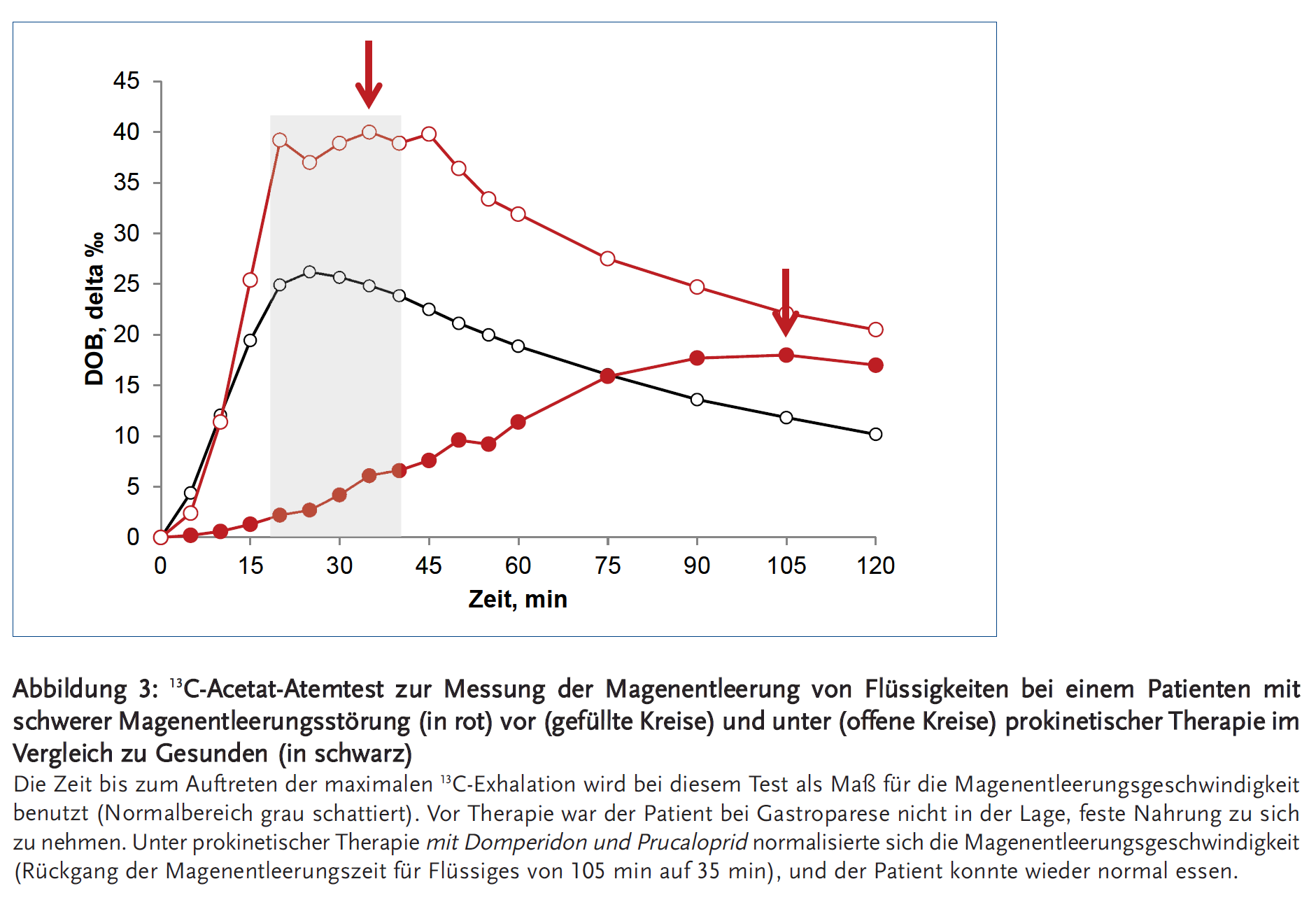
Prucaloprid ist im Gegensatz zu Cisaprid, das wegen kardialer Nebenwirkungen vom Markt genommen wurde, ein selektiver 5-HT4-Rezeptor-Agonist. Die Affinität zu kardialen Kaliumkanälen ist 20-fach geringer als bei Cisaprid, sodass kardiale Nebenwirkungen äußerst selten vorkommen (28). Zahlreiche Studien belegen die prokinetische Wirkung von Prucaloprid am Kolon mit Erhöhung der Stuhlfrequenz und deutlicher Symptombesserung bei schwerer chronischer Obstipation (29). Bislang war Prucaloprid nur zur Behandlung der Obstipation bei Frauen zugelassen, sofern diese auf Laxantien nicht ansprechen oder die Laxantientherapie nicht vertragen. Mittlerweile wurde bei Männern eine gleich gute Wirksamkeit gezeigt (30) und die Zulassung ebenfalls erteilt. Abhängig vom Alter und von der Nierenfunktion wird eine Dosis von (1–)2 mg pro Tag empfohlen, bis zu 4 mg pro Tag wurden in Studien gegeben bei guter Verträglichkeit (28). Schwerwiegende Nebenwirkungen sind bei Prucaloprid bisher insgesamt nicht bekannt (31). Die häufigsten unerwünschten Wirkungen sind Kopfschmerzen, Schwindel, Übelkeit, Erbrechen, Bauchschmerzen und Diarrhö, die bei den weitaus meisten Patienten nach dem ersten Behandlungstag abklingen. Hierüber muss der Patient vor Einnahme informiert werden. Die Wirkung des Präparates auf die Magenentleerung ist noch unzureichend untersucht, es konnte aber gezeigt werden, dass Prucaloprid auch die Magenentleerung bei Patienten mit verzögertem Kolontransit beschleunigt (32). Bei Gesunden wurde ebenfalls eine deutliche Beschleunigung der Magenentleerung gegenüber Placebo gezeigt, allerdings mit der erhöhten Dosis von 4 mg (9). Beim probatorischen Einsatz bei Patienten, die auf andere Prokinetika nicht ansprechen, lassen sich im Einzelfall gute Effekte auf die Magenentleerung (Abbildung 3) und die Symptomatik erzielen (33), es handelt sich aber ggf. wiederum um einen off label use.
Sowohl neue 5-HT4-Agonisten als auch Motilin-Agonisten und Medikamente, die andere Wirkmechanismen haben, zum Beispiel an Ghrelin-Rezeptoren angreifen, befinden sich in der klinischen Entwicklung oder sind teils in anderen Ländern verfügbar, werden in Deutschland voraussichtlich in absehbarer Zeit aber nicht zugelassen.
Das pflanzliche Mischpräparat STW 5 ist nicht für die Gastroparese, wohl aber für die funktionelle Dyspepsie zugelassen, bei der gastrale Motilitätsstörungen zur Symptomatik beitragen können. Im Tierversuch und bei Gesunden scheint es die gastrale Motilität regionenspezifisch zu beeinflussen, nämlich eine Relaxation des Fundus bei gesteigerter Kontraktilität im Antrum zu bewirken (34;35). Es könnte bei einem Teil der Patienten mit dyspeptischen Symptomen und weniger ausgeprägter Verzögerung der Magenentleerung symptomlindernd sein, beschleunigt die Magenentleerung beim Menschen aber nicht (35;36).
Während schwere Motilitätsstörungen des Ösophagus eher selten sind, werden Entleerungsstörungen des Magens mit zunehmender Häufigkeit beobachtet (bei bis zu 2 % der Bevölkerung). Beide können schwerwiegende Ernährungsstörungen zur Folge haben. Im Kontrast zu diesem klinischen Bedarf ist die medikamentöse Therapie der Motilitätsstörungen des oberen Gastrointestinaltraktes eingeschränkt wirksam, nicht zulassungskonform („off-label-use”) bzw. aufgrund von Nutzen-Risiken-Erwägungen der Zulassungsbehörden nicht mehr zulässig oder in Deutschland nicht verfügbar. In absehbarer Zukunft wird sich an dieser Situation zumindest in Deutschland nichts ändern.
Die Autorin hat in den vergangenen drei Jahren für Vortragstätigkeiten, Beratertätigkeiten oder die Teilnahme an klinischen Studien persönlich oder für ihre Forschungstätigkeit Gelder von folgenden Firmen erhalten: Abbott, Abbvie, Almirall, Aptalis, Astra Zeneca, Falk, Given Imaging, Lilly, Mundipharma, Norgine, Shire, Standard Instruments, Steigerwald.