Difelikefalin (Kapruvia®) ▼ – frühe Nutzenbewertung
Neue Arzneimittel
Neue Arzneimittel
Dieser Artikel wurde am 24. April 2023 vorab online veröffentlicht.
Difelikefalin ist ein selektiver κ(Kappa)-Opioidrezeptor-Agonist. Aufgrund seiner hohen Wasserlöslichkeit weist Difelikefalin nur eine geringe ZNS-Gängigkeit auf. Difelikefalin aktiviert in erster Linie periphere κ-Opioidrezeptoren in sensorischen Neuronen, Immunzellen und Keratinozyten der Haut. Hierdurch soll das Gleichgewicht zwischen κ- und µ-Opioidrezeptor-Aktivierung wiederhergestellt werden. Zudem werden antiinflammatorische Effekte diskutiert.
Der Gemeinsame Bundesausschuss (G-BA) legte die folgende Fragestellung fest und definierte dazu die zweckmäßige Vergleichstherapie (ZVT):
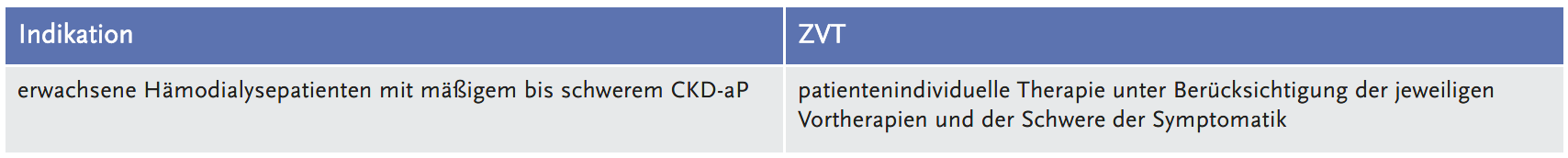
Vorgelegte Evidenz
Vom pharmazeutischen Unternehmer (pU) wurden die randomisierten, kontrollierten Schwesterstudien KALM-1 (1) und KALM-2 (2) vorgelegt. Die Studien schlossen insgesamt 851 Patienten mit terminaler Niereninsuffizienz ein, die trotz adäquater, mindestens dreimal wöchentlicher Hämodialyse unter mäßigem bis schwerem CKD-aP litten. Die Patienten erhielten im Verhältnis 1:1 intravenös Difelikefalin oder Placebo zum Ende jeder Dialyse. Die randomisierte Behandlungsphase dauerte in beiden Studien zwölf Wochen. Die Intensität des Pruritus wurde mittels Worst Itching Intensity Numeric Rating Scale (WI-NRS) erfasst, die von 0 (kein Juckreiz) bis 10 (schlimmstmöglicher Juckreiz) reicht.
Primärer Endpunkt der Studien war der Anteil der Patienten mit einer Verbesserung um ≥ 3 Punkte des wöchentlichen WI-NRS-Durchschnittscores in Woche 12. Der primäre Endpunkt wurde von mehr Patienten unter Difelikefalin erreicht, wobei der Behandlungsunterschied im Vergleich zu Placebo nur in der Studie KALM-1 (43 % vs. 27 %; p < 0,001), nicht aber in der Studie KALM-2 (40 % vs. 30 %; p = 0,092) signifikant war. In der gepoolten Analyse betrug die absolute Risikoreduktion (ARR) 12 %, d. h. jeder neunte Patient profitierte von Difelikefalin hinsichtlich des primären Endpunktes.
In der gepoolten Analyse von KALM-1 und KALM-2 traten unerwünschte Ereignisse (UE) signifikant häufiger unter Difelikefalin auf als unter Placebo (68 % vs. 62 %). Auffällig ist eine numerische Häufung neurologisch-psychiatrischer Erkrankungen unter Difelikefalin (Schwindelgefühle, Somnolenz, Veränderung des Gemüts- und kognitiven Zustands), die nach Einschätzung der europäischen Arzneimittel-Agentur (EMA) am ehesten auf eine zentrale Wirkung von Difelikefalin zurückzuführen ist.
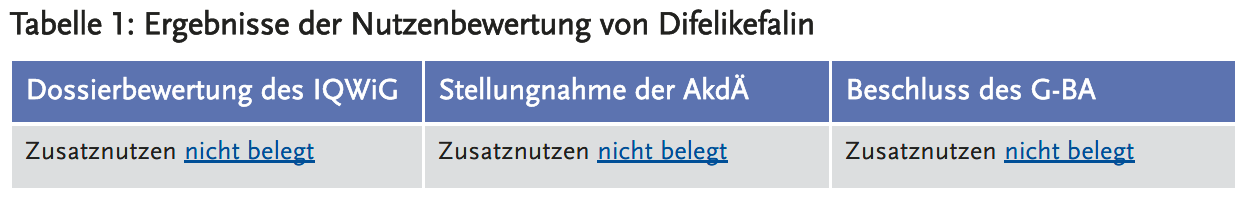
Dossierbewertung des IQWiG
Aus Sicht des IQWiG (3) legt der pU keine geeigneten Studien zur Nutzenbewertung vor:
Stellungnahme der AkdÄ
Die AkdÄ (4) schließt sich der Einschätzung des IQWiG an:
Beschluss des G-BA
Die Umsetzung der ZVT wird durch den G-BA (6) nicht diskutiert. Nach Einschätzung des G-BA sind die vorgelegten Studien KALM-1 und KALM-2 bereits aufgrund ihrer lediglich zwölfwöchigen randomisierten Studienphase ungeeignet für die frühe Nutzenbewertung einer chronischen Erkrankung. Da keine geeigneten Studiendaten vorgelegt wurden, ist der Zusatznutzen laut Beschluss des G-BA nicht belegt.
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.