Alirocumab (Praluent®) (frühe Nutzenbewertung)
Neue Arzneimittel
Neue Arzneimittel
„Neue Arzneimittel“ ist eine Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu neu zugelassenen Arzneimitteln/neu zugelassenen Indikationen. Ziel ist es, den Ärzten eine Information zu neu zugelassenen Arzneimitteln bei Markteinführung und nach der frühen Nutzenbewertung des Gemeinsamen Bundesausschusses (G-BA) (§ 35a Absatz 1 SGB V) zeitnah zur Verfügung zu stellen. „Neue Arzneimittel“ enthält Informationen zu Indikation und Bewertung sowie zu klinischen Studien und unerwünschten Arzneimittelwirkungen neu zugelassener Arzneimittel/neu zugelassener Indikationen in der Europäischen Union (EU). Diese basieren auf den Angaben des Europäischen Öffentlichen Bewertungsberichts (EPAR) der Europäischen Arzneimittel-Agentur (EMA) und weiteren zur Markteinführung vorliegenden Daten aus klinischen Studien. Nach dem Verfahren zur frühen Nutzenbewertung wird der Zusatznutzen eines neuen Arzneimittels und seine therapeutische Bedeutung auf der Basis der Dossierbewertung des IQWiG, der Stellungnahme der AkdÄ zur Nutzenbewertung und des Beschlusses des G-BA zur Nutzenbewertung dargestellt.
Alirocumab ist ein Vertreter der Wirkstoffklasse der PCSK9-Hemmer. Bei der PCSK9-Hemmung handelt es sich um ein neues pharmakologisches Wirkprinzip. Genetische Studien haben gezeigt, dass inaktivierende Mutationen im PCSK9-Gen mit niedrigem LDL-C und einer geringen Inzidenz der koronaren Herzkrankheit assoziiert sind. PCSK9-Hemmer fördern den Abbau von LDL-Cholesterin in der Leber. Das Enzym PCSK9 bindet anstelle von LDL-Cholesterin an die LDL-Rezeptoren der Leberzellen und führt zu einem Abbau der Rezeptoren. Dadurch steigt der Cholesterinspiegel im Blut. Alirocumab blockiert das Enzym, die Zahl der LDL-Rezeptoren steigt und die Cholesterinwerte sinken.
Alirocumab ist zugelassen begleitend zu einer Diät zur Behandlung bei Erwachsenen mit primärer Hypercholesterinämie (heterozygote familiäre und nicht familiäre) oder gemischter Dyslipidämie:
Im Rahmen der Bewertung des Zusatznutzens hat der G-BA in seiner Festlegung der zweckmäßigen Vergleichstherapie zwischen verschiedenen Patientengruppen unterschieden. Für die Bewertung ergaben sich hieraus drei Fragestellungen (siehe Tabelle 1).
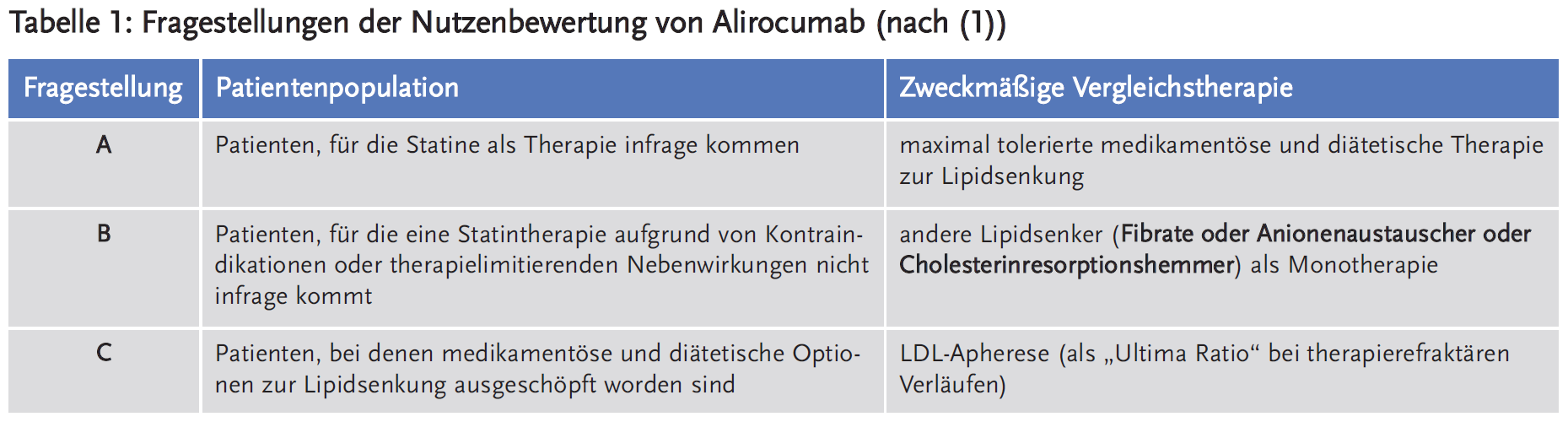
Die AkdÄ (2) sieht wie das IQWiG (1) für Alirocumab anhand der vorgelegten Studienergebnisse keinen Nachweis für einen patientenrelevanten Zusatznutzen, auch nicht bezüglich der vom G-BA vorgegebenen und definierten Fragestellungen:
Die AkdÄ kommt daher in ihrer Stellungnahme zu dem Schluss, dass ein Zusatznutzen von Alirocumab derzeit nicht belegt ist. Des Weiteren empfiehlt die AkdÄ eine Neubewertung der Datenlage frühestens nach Ablauf eines Jahres, wenn klinische Studien vorliegen (ODYSSEY Outcomes), die verwertbare Ergebnisse für Alirocumab in einzelnen Anwendungsgebieten liefern könnten.
Der G-BA sieht in seinem Beschluss vom 04.05.2016 ebenfalls für alle drei Fragestellungen keinen Zusatznutzen für Alirocumab (3):
a) Ausmaß und Wahrscheinlichkeit des Zusatznutzens von Alirocumab gegenüber der zweckmäßigen Vergleichstherapie für Patienten, bei denen medikamentöse und diätische Optionen zur Lipidsenkung nicht ausgeschöpft worden sind und für die Statine infrage kommen: Ein Zusatznutzen ist nicht belegt.
b) Ausmaß und Wahrscheinlichkeit des Zusatznutzens von Alirocumab gegenüber der zweckmäßigen Vergleichstherapie für Patienten, bei denen medikamentöse und diätische Optionen zur Lipidsenkung nicht ausgeschöpft worden sind und für die eine Statintherapie aufgrund von Kontraindikationen oder therapielimitierenden Nebenwirkungen nicht infrage kommt: Ein Zusatznutzen ist nicht belegt.
c) Ausmaß und Wahrscheinlichkeit des Zusatznutzens von Alirocumab gegenüber der zweckmäßigen Vergleichstherapie für Patienten, bei denen medikamentöse und diätische Optionen zur Lipidsenkung ausgeschöpft worden sind: Ein Zusatznutzen ist nicht belegt.
* Dieses Arzneimittel unterliegt einer ▶ zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.
Der Artikel wurde am 8. Juni 2016 vorab online veröffentlicht.