Studiendaten zu klinischen Fragestellungen
Profitieren Patientinnen und Patienten ohne kardiovaskuläre Vorerkrankung von einer Statintherapie?
Insgesamt liegen ausreichende Studiendaten vor, um Nutzen und Risiken einer Statintherapie bei Patientinnen und Patienten ohne kardiovaskuläre Vorerkrankung zu beurteilen. Es gibt allerdings wenig Studiendaten zu älteren Personen (> 75 Jahre). Außerdem sind für seltene unerwünschte Ereignisse (z. B. hämorrhagischer Schlaganfall) keine separaten Daten für die Primärprävention verfügbar.
- Mehr zur Evidenzbasis:
Bei Abschluss der systematischen Literaturrecherche für die 1. Auflage des Leitfadens stellte der Review der U.S. Preventive Services Task Force (USPSTF) (20) von 2016 die umfassendste Arbeit zu Statinen in der kardiovaskulären Primärprävention dar. Er analysierte 19 RCTs (n = 71.344) mit einer durchschnittlichen Dauer von vier Jahren. In der 2. Version des Leitfadens werden auch die Ergebnisse des 2022 aktualisierten USPSTF-Reviews diskutiert (22 RCTs, n = 90.624, durchschnittliche Dauer 3,3 Jahre) (18). Im Vergleich zum USPSTF-Report von 2016 berücksichtigt der aktuelle Review drei neue Studien: die Studie TRACE RA (21), die 2019 publiziert wurde, und die beiden älteren Studien PROSPER (22) und ALLHAT-LLT (23) aus dem Jahr 2002, für die laut USPSTF erst 2022 separate Daten zur Primärprävention vorlagen. Die Quellen der neuen, ausschließlich primärpräventiven Studiendaten von PROSPER und ALLHAT-LLT werden im USPSTF-Report nicht angegeben.
Laut Protokoll sollten in den USPSTF-Report nur Studien einbezogen werden, bei denen weniger als 10 % der Patienten kardiovaskulär vorerkrankt waren. Es ist unklar, weshalb die USPSTF dennoch sowohl 2016 als auch 2022 die Studie ASCOT-LLA (24) berücksichtigte, bei der 18 % der Patienten zu Studienbeginn eine manifeste atherosklerotische kardiovaskuläre Erkrankung (ASCVD) aufwiesen: Zwar konnten Patienten mit koronarer Herzerkrankung an der Studie ASCOTT-LLA nicht teilnehmen, Patienten mit anderen kardiovaskulären Erkrankungen wie pAVK oder TIA/Schlaganfall wurden jedoch sogar gezielt eingeschlossen.
Im Leitfaden wird deshalb auch der Cochrane-Review von 2013 (25) (18 RCTs, n = 56.934) diskutiert, der die Studie ASCOT-LLA aufgrund ihres relevanten Anteils kardiovaskulär vorerkrankter Patienten ausschloss. Zudem berücksichtigte der Cochrane-Review im Unterschied zur USPSTF eine Subgruppe der Studie MRC/BHF Heart Protection (Patienten mit Diabetes mellitus ohne KHK, n = 3982) (26). Die Aussagekraft des Cochrane-Reviews ist dadurch eingeschränkt, dass er die 2016 publizierte Studie HOPE-3 (27) nicht einbeziehen konnte und auch keine Berücksichtigung der primärpräventiven Teilpopulationen aus ALLHAT-LLT und PROSPER möglich war. Zudem bestehen Unstimmigkeiten bezüglich der kardiovaskulären Ereignisraten zwischen Primärpublikationen und Metaanalyse (siehe auch: relative Risikoreduktion und absolute Risikoreduktion).
Weitere Reviews bieten Zusatzinformationen zu besonderen Aspekten: In die Nutzen-Risiko-Abwägung fließt die Time-to-Benefit ein (28). Für die Subgruppe der älteren Patienten werden zwei Reviews herangezogen, die nur Studien mit Patienten über 65 Jahren einschlossen (29;30). Die Metaanalyse von de Vries et al. (31) und die Analyse der Cholesterol Treatment Trialists' (CTT) Collaboration von 2008 (32) konzentrierten sich auf Patienten mit Diabetes mellitus. Zwei weitere CTT-Analysen untersuchten, ob das kardiovaskuläre Ausgangsrisiko (33) oder das Patientenalter (34) die Wirksamkeit der Statintherapie beeinflussen. Die Analyse unerwünschter Wirkungen wird ergänzt durch den Review von Cai et al. (35), der auch Studien mit sehr kurzer Dauer und einem größeren Anteil kardiovaskulär vorerkrankter Patienten einschloss. Bei der Bewertung des Diabetesrisikos unter Statinen werden die Metaanalysen von NICE (4) und Thakker et al. (36) berücksichtigt. Eine 2022 publizierte Individualdatenanalyse untersucht die Häufigkeit von Muskelbeschwerden unter Statinen (19). Für seltene unerwünschte Ereignisse wie Rhabdomyolysen und hämorrhagische Schlaganfälle werden die CTT-Analysen herangezogen, deren Datenbasis sowohl Patienten der Primär- als auch der Sekundärprävention umfasst (37).
Die CTT-Analyse von 2019 schloss insgesamt 186.854 Patienten ein, darunter 82.730 Patienten der Primärprävention. Nur 8 % der Patienten ohne manifeste ASCVD (n = 6449) waren älter als 75 Jahre (34). Diese bislang in Studien unterrepräsentierte Patientengruppe wird in dem aktuell laufenden RCT STAREE (A Study of Statins for Reducing Events in the Elderly) untersucht: 18.000 Patienten über 70 Jahren ohne manifeste kardiovaskuläre Erkrankung werden entweder zu Atorvastatin 40 mg oder Placebo randomisiert. Erste Studienergebnisse sind 2025 zu erwarten (38).
Mit Ausnahme der CTT-Analysen wurden alle Reviews in der AMSTAR-Bewertung als methodisch hochwertig eingestuft (AMSTAR II > 10 von 16 Punkten). Die methodisch moderate Qualität der CTT-Analysen ergibt sich aus der nicht nachvollziehbar dokumentierten Literaturrecherche und -selektion sowie der fehlenden Qualitätsbeurteilung der Primärstudien (siehe Extraktionstabellen auf der AkdÄ-Website).
- Mehr zu den Charakteristika der untersuchten Patienten:
Das Durchschnittsalter lag in den 2016 durch die USPSTF (20) eingeschlossenen RCTs zwischen 51 und 66 Jahren. Der USPSTF-Report von 2022 (18) schloss darüber hinaus mit der Studie PROSPER (22) auch eine ältere Patientengruppe mit einem Durchschnittsalter von 75 Jahren ein. Überwiegend wurden in den Studien Patienten untersucht, die mindestens einen klassischen Risikofaktor für eine Atherosklerose aufwiesen (Dyslipidämie, Hypertonie, Diabetes mellitus). Zwei Studien fokussierten auf Laborparameter, bei denen noch nicht abschließend geklärt ist, ob sie unabhängige kardiovaskuläre Risikofaktoren darstellen (erhöhte CRP-Werte (39), Mikroalbuminurie (40)). Drei Studien untersuchten asymptomatische Patienten mit sonographisch nachgewiesener Atherosklerose der A. carotis (METEOR (41), CAIUS (42), ACAPS (43)) und eine Studie Patienten mit einer Aortenstenose (ASTRONOMER (44)). In die Studie TRACE RA (21) wurden nur Patienten mit rheumatoider Arthritis eingeschlossen, bei denen kein Diabetes mellitus bekannt war. Die CTT-Analysen berücksichtigten auf Individualdatenbasis auch Studiendaten zu Patienten ohne atherosklerotische kardiovaskuläre Erkrankung (ASCVD), aber mit Dialyse (AURORA (45)) bzw. Herzinsuffizienz (GISSI-HF (46)). Insgesamt schlossen die Primärstudien eine sehr heterogene Patientengruppe ein.
- Mehr zur relativen Risikoreduktion:
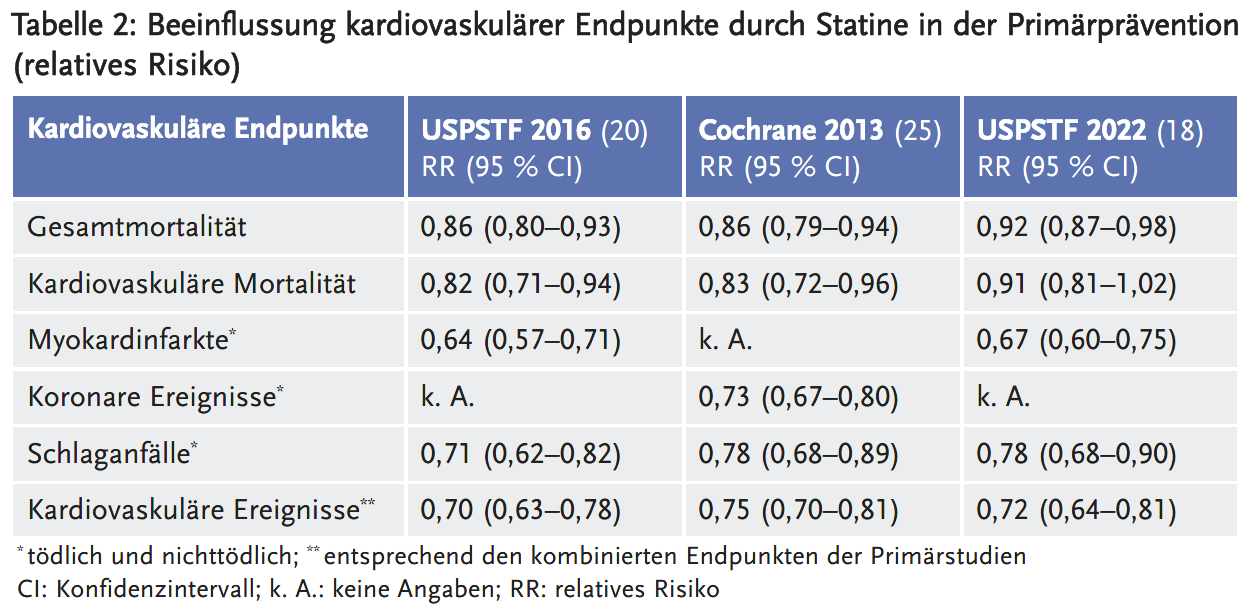
Der Cochrane-Review (25) und der USPSTF-Report von 2016 (20) kamen zu weitgehend übereinstimmenden Ergebnissen bei der gepoolten relativen Risikoreduktion von Gesamtmortalität, kardiovaskulärer Mortalität und Schlaganfällen.
Der Cochrane-Review untersuchte nicht die Häufigkeit von Myokardinfarkten, sondern den kombinierten Endpunkt „koronare Ereignisse“, in den neben Myokardinfarkten auch das Auftreten instabiler Angina pectoris einfließt. Für den Endpunkt koronare Ereignisse fand der Cochrane-Review eine etwas geringere relative Risikoreduktion als die USPSTF für Myokardinfarkte (siehe Tabelle 2).
Es bestehen Unstimmigkeiten zwischen der Metaanalyse von Cochrane und der Primärpublikation der Studie WOSCOPS (47). Der Cochrane-Review gab beispielsweise die Gesamtmortalität deutlich höher an als in der Primärpublikation (Primärpublikation: 3,3 % vs. 4,1 %, Cochrane: 18,7 % vs. 20,5 %). Dies entspricht einer fälschlich erhöhten Angabe der Mortalität um den Faktor 5,7 im Statin-Arm und um den Faktor 5 im Kontrollarm. Hierdurch floss die Studie WOSCOPS mit einer zu niedrigen relativen Risikoreduktion in die Cochrane-Analyse ein (Primärpublikation: RR 0,78; Cochrane: RR 0,90). Der Extraktionsfehler wirkt sich nicht relevant auf die gepoolten Daten zur relativen Risikoreduktion aus, beeinflusst jedoch merklich das Ausmaß der absoluten Risikoreduktion (siehe auch: absolute Risikoreduktion).
Im Vergleich zu 2016 findet der USPSTF-Report von 2022 (18) eine geringere relative Risikoreduktion hinsichtlich der Gesamtmortalität, der kardiovaskulären Mortalität und der Schlaganfälle. Insbesondere sieht der aktuelle USPSTF-Report nur noch eine numerische Reduktion der kardiovaskulären Mortalität. Die neu publizierte Studie TRACE RA (21) hatte aufgrund ihrer geringen Ereigniszahl nur ein sehr geringes Gewicht in der Metaanalyse der USPSTF (< 2 %). Einen relevanten Einfluss auf das Gesamtergebnis der Metaanalyse hatten dagegen die beiden großen Studie PROSPER (22) und ALLHAT-LLT (23), die 20 Jahre nach ihrer Publikation erstmalig berücksichtigt wurden, weil für sie laut USPSTF zuvor keine separaten Daten zur Primärprävention vorlagen.
In der Studie ALLHAT-LLT beeinflusste die Statintherapie weder die Gesamtmortalität (RR 1,00; 95 % CI 0,89–1,11) noch die kardiovaskuläre Mortalität (RR 1,00; 95 % CI 0,84–1,19), in der Studie PROSPER war die Gesamtsterblichkeit unter Statinen sogar numerisch erhöht (RR 1,07; 95 % CI 0,86–1,35; keine Daten zur kardiovaskulären Mortalität). Hinsichtlich des Risikos für Schlaganfälle fand die Studie ALLHAT-LLT lediglich eine geringe numerische Risikoreduktion (RR 0,93; 95 % CI 0,76–1,13), die Studie PROSPER ein numerisch erhöhtes Risiko (RR 1,03; 95 % CI 0,73–1,45).
Laut USPSTF ist der fehlende Nutzenbeleg in ALLHAT-LLT am ehesten durch die offene Studiendurchführung mit einem hohen Cross-over (29 %) vom Usual-Care-Arm zur Statintherapie bedingt. Die numerische Risikoerhöhung in der Studie PROSPER ist vermutlich durch die untersuchte Population erklärbar: Die Studie PROSPER schloss lediglich Patienten über 70 Jahren ein. Subgruppenanalysen anderer Studien zeigten konsistent zu PROSPER, dass die primärpräventive Gabe von Statinen bei älteren Patienten die Mortalität kaum senkt oder sogar negativ beeinflusst. (siehe auch: ältere Patienten ohne kardiovaskuläre Vorerkrankung). Aus Sicht der AkdÄ ist davon auszugehen, dass bei Patienten < 70 Jahren das Ausmaß der relativen Risikoreduktion im aktuellen USPSTF-Report unterschätzt wird und sich eher in einem Bereich bewegt, der zwischen den 2016 und 2022 ermittelten Werten liegt.
- Mehr zur Beeinflussung der relativen Risikoreduktion durch kardiovaskuläre Risikofaktoren:
Obwohl die Studien zur Primärprävention klinisch sehr unterschiedliche Patientengruppen einschlossen, besteht bei dem Cochrane-Review (25) und den USPSTF-Reports (18;20) kein Hinweis auf Heterogenität bezüglich der relativen Risikoreduktion durch Statine.
Die Baseline-Lipidwerte beeinflussten die relative Risikoreduktion weder in den Sensitivitätsanalysen der USPSTF noch in den Subgruppenanalysen der Primärstudien signifikant (18). Zur gleichen Einschätzung kamen die CTT-Analysen auf Individualdatenbasis (p für Trend = 0,2) (37).
Auch das Vorliegen eines Diabetes mellitus scheint nicht das Ausmaß der relativen Risikoreduktion zu beeinflussen: De Vries et al. (31) untersuchten in ihrer Metaanalyse die Wirksamkeit von Statinen bei Patienten mit Diabetes mellitus ohne manifeste atherosklerotische kardiovaskuläre Erkrankung (ASCVD). Sie berücksichtigten nur Studien (CARDS (48) bzw. Subgruppenanalysen (ASCOT-LLA (49), ASPEN (50), HPS (51)) mit einer Dauer von mindestens zwei Jahren und doppelblindem Design. Die durch de Vries et al. gepoolten Daten zeigten eine ähnliche relative Risikoreduktion kardiovaskulärer Ereignisse wie in der durch die USPSTF untersuchten primärpräventiven Gesamtpopulation (de Vries: RR 0,75; 95 % CI 0,67–0,85; USPSTF: RR 0,70; 95 % CI 0,63–0,78). Beide Reviews übernahmen für ihre Analyse die kombinierten Endpunkte der Primärstudien. Diese waren überwiegend sehr weit gefasst und schlossen beispielsweise stille Myokardinfarkte, instabile Angina pectoris und reversible neurologische Defizite ein.
Auch bei einzelnen kardiovaskulären Endpunkten kamen de Vries et al. zu sehr ähnlichen Ergebnissen wie die USPSTF-Reports und der Cochrane-Review für die primärpräventive Gesamtpopulation (Myokardinfarkte: RR 0,70; 95 % CI 0,54–0,90; Schlaganfälle: RR 0,69; 95 % CI 0,51–0,92; Gesamtmortalität: RR 0,84; 95 % CI 0,65–1,09). De Vries et al. konnten für die Endpunkte „Myokardinfarkte“ und „Schlaganfälle“ jedoch lediglich drei Studien (48-50) berücksichtigen, für die Analyse der Gesamtmortalität sogar nur zwei Studien (48;50). Das nicht signifikante Ergebnis von de Vries et al. hinsichtlich der Gesamtmortalität ist daher am ehesten durch die zu geringe Datenbasis (n = 4743) erklärbar.
Die CTT-Analyse von 2008 (32) fand bei Patienten mit und ohne Diabetes mellitus ebenfalls eine ähnliche relative Risikoreduktion für kardiovaskuläre Ereignisse, wobei sie nur RCTs bis 2004 einschloss. Auf Individualdatenbasis wurde die kardiovaskuläre Ereignisrate von Patienten ohne manifeste ASCVD untersucht, bei denen ein Diabetes mellitus bekannt (n = 11.730) bzw. nicht bekannt war (n = 28.723). Statine reduzierten in beiden Patientengruppen das relative Risiko für schwere kardiovaskuläre Ereignisse (nichttödlicher Myokardinfarkt, kardiovaskulärer Tod, koronare Revaskularisation, Schlaganfall) um etwa 25 % pro 1 mmol/l (39 mg/dl) LDL-C-Senkung (ohne Diabetes mellitus: RR 0,78; 95 % CI 0,71–0,85; mit Diabetes mellitus: RR 0,73; 95 % CI 0,66–0,82).
Bezüglich des allgemeinen kardiovaskulären Ausgangsrisikos sind die Ergebnisse der CTT-Analyse (33) heterogen. Das Ausgangsrisiko beeinflusste nicht die relative Risikoreduktion von Gesamtmortalität und kardiovaskulärer Mortalität. Die relative Reduktion kardiovaskulärer Ereignisse fiel dagegen bei niedrigerem Ausgangsrisiko deutlicher aus (p für Trend = 0,003). So wurden beispielsweise schwere vaskuläre Ereignisse (nichttödlicher Myokardinfarkt, kardiovaskulärer Tod, koronare Revaskularisation, Schlaganfall) bei einem geschätzten 5-Jahres-Risiko von 5–10 % relativ um 34 % reduziert, bei einem hohen Ausgangsrisiko von mehr als 20 % dagegen nur noch um relativ 19 %.
Patienten mit Dialyse profitierten in Studien nicht oder nur minimal von einer Statintherapie (45;52). Daten zur Primärprävention bei Dialysepatienten liegen nur aus der Studie AURORA vor (45), bei der 60 % (n = 1668) der eingeschlossenen Patienten keine kardiovaskuläre Vorerkrankung aufwiesen. Rosuvastatin 10 mg beeinflusste in der Gesamtpopulation von AURORA den kombinierten primären Endpunkt (kardiovaskulärer Tod, nichttödlicher Myokardinfarkt, nichttödlicher Schlaganfall) nur minimal numerisch (9,2 % vs. 9,5 %), bei Patienten ohne manifeste ASCVD war die Ereignisrate in beiden Armen nahezu gleich (6,9% vs. 7,0 %) (45).
Auch für Patienten mit Herzinsuffizienz ist ein Nutzen der Statintherapie durch Studien nicht belegt. In der Studie GISSI-HF (46) (n = 4631, Dauer 3,9 Jahre) war bei 60 % der Patienten die Herzinsuffizienz nichtischämisch bedingt. Überwiegend (90 %) lag eine HFrEF mit einer LVEF < 40 % vor. Rosuvastatin 10 mg beeinflusste den primären Endpunkt (Tod jeder Ursache oder Hospitalisierung aufgrund kardiovaskulärer Ursachen) weder in der Gesamtpopulation der Studie (57 % vs. 56 %) noch in der Subgruppe der Patienten mit nichtischämischer Herzinsuffizienz (52 % vs. 51 %). Auch die Gesamtmortalität war unter Rosuvastatin unverändert (Gesamtpopulation: 28,8 % vs. 28,1 %; keine Subgruppenanalyse vorliegend).
- Mehr zu älteren Patienten ohne kardiovaskuläre Vorerkrankung:
Laut USPSTF (18;20) wurde in den Subgruppenanalysen der Primärstudien kein eindeutiger Einfluss des Alters auf die relative Risikoreduktion gefunden. Allerdings zeigte sich in einer Post-hoc-Analyse der Studie ALLHAT-LLT (53) ein deutliches Signal für eine reduzierte Wirksamkeit von Statinen bei Patienten ≥ 75 Jahren (n = 726): Statine reduzierten zwar die Häufigkeit von Myokardinfarkten bei Patienten ≥ 75 Jahren ähnlich stark wie in der Gesamtpopulation (HR 0,70), führten aber zu einer numerisch erhöhten Gesamtsterblichkeit (HR 1,34; 95 % CI 0,98–1,84) und einem numerisch höheren Risiko für Schlaganfälle (RR 1,10; 95 % CI 0,64–1,88). Bei Patienten von 65 bis 74 Jahren (n = 2140) war in der Subgruppenanalyse die Gesamtsterblichkeit unter Statinen numerisch ebenfalls erhöht, das Signal für eine Übersterblichkeit war jedoch schwächer (HR 1,08; 95 % CI 0,85–1,37).
Unter Einbezug der Daten aus ALLHAT-LLT fand die Metaanalyse von Ponce et al. (30) (8 RCTs, n = 21.681) eine nicht signifikante Reduktion der Gesamtmortalität bei Patienten ≥ 65 Jahren, die numerisch deutlich geringer war als in der bei USPSTF und Cochrane (25) untersuchten primärpräventiven Gesamtpopulation (RR 0,95; 95 % CI 0,84–1,07 vs. RR 0,86; 95 % CI 0,79–0,94 bzw. 0,80–0,93). Die Metaanalyse von Zhai et al. (29) (4 RCTs, n = 14.821) kam – ebenfalls unter Einbezug der Studie ALLHAT-LLT – zum gleichen Ergebnis wie Ponce et al. (Gesamtmortalität bei Patienten ≥ 65 Jahren unter Statinen: OR 0,94; 95 % CI 0,76–1,16). Noch deutlicher war die reduzierte Statinwirksamkeit bezüglich der kardiovaskulären Mortalität: Beide Reviews fanden keinen – auch keinen numerischen – Effekt auf die kardiovaskuläre Mortalität bei Patienten ≥ 65 Jahren ohne manifeste atherosklerotische kardiovaskuläre Erkrankung (ASCVD) (RR 1,01; 95 % CI 0,83–1,24 (30) bzw. OR 1,00; 95 % CI 0,81–1,24 (29)).
Die Ergebnisse von Ponce et al. und Zhai et al. werden gestützt durch eine Metaanalyse der CTT auf Basis von Individualdaten (34). Für die Primärprävention wurden die Daten von 82.730 Patienten aus 23 verschiedenen RCTs berücksichtigt und die jährliche Rate schwerer vaskulärer Ereignisse (nichttödlicher Myokardinfarkt, kardiovaskulärer Tod, koronare Revaskularisation, Schlaganfall) unter Statin bzw. Placebo ermittelt. In der Primärprävention reduzierten Statine bei Patienten über 75 Jahren die jährliche Ereignisrate nur um 0,1 % (2,7 % vs. 2,8 %). Die relative Risikoreduktion pro 1 mmol/l (39 mg/dl) LDL-C-Senkung war nicht signifikant (RR 0,92; 95 CI 0,73–1,16). Auch für Patienten über 70 Jahren ist ein Nutzen der primärpräventiven Statintherapie nicht gesichert (jährliche Rate schwerer vaskulärer Ereignisse: 2,1 % vs. 2,4 %; RR 0,84; 95 % CI 0,70–1,01). Dieser Trend zur altersabhängig reduzierten Wirksamkeit zeigte sich nur im primärpräventiven Setting, nicht bei Patienten mit manifester ASCVD.
Die absolute Risikoreduktion ist abhängig von dem individuellen Ausgangsrisiko für kardiovaskuläre Ereignisse. In den vorliegenden Studien war die absolute Risikoreduktion über alle Altersgruppen gering: Bei einer medianen Behandlungsdauer von vier Jahren sank das Risiko für einen Myokardinfarkt um 0,8 % und für einen Schlaganfall um 0,4 %. Die Wahrscheinlichkeit zu sterben wurde um 0,4 % reduziert.
- Mehr zur absoluten Risikoreduktion:
Obwohl der Cochrane-Review (25) und der USPSTF-Report von 2016 (20) zu sehr ähnlichen Ergebnissen bezüglich der relativen Risikoreduktion kamen, schätzte der Cochrane-Review die absolute Risikoreduktion der Gesamtmortalität, der kardiovaskulären Mortalität und der Häufigkeit von Schlaganfällen etwas höher ein als die USPSTF. Der Cochrane-Review untersuchte nicht die Häufigkeit von Myokardinfarkten, sondern den kombinierten Endpunkt „koronare Ereignisse“, in den neben Myokardinfarkten auch das Auftreten instabiler Angina pectoris einfloss. Für den Endpunkt koronare Ereignisse fand der Cochrane-Review ebenfalls eine höhere absolute Risikoreduktion als die USPSTF für Myokardinfarkte (siehe Tabelle 3).
Die größere absolute Risikoreduktion im Cochrane-Review ergibt sich aus der in beiden Studienarmen höheren gepoolten Ereignisrate. So war beispielsweise die Sterblichkeit in den durch das Cochrane-Review eingeschlossenen Studien insgesamt höher als im USPSTF-Review (4,8 % vs. 3,3 %). Die höhere Gesamtmortalität bei Cochrane erscheint wesentlich mitbedingt durch eine zu hohe Angabe der Mortalitätsrate für die Studie WOSCOPS (47) (Gesamtmortalität in der Primärpublikation: 241/6595 = 3,7 %; Gesamtmortalität in der Metaanalyse von Cochrane: 1293/6595 = 19,6 %). Ähnliche Unstimmigkeiten bezüglich Primärpublikation und Metaanalyse liegen im Cochrane-Review auch für andere Endpunkte der Studie WOSCOPS vor (z. B. kardiovaskuläre Mortalität, koronare Ereignisse, Schlaganfall). Es ist deshalb anzunehmen, dass im Cochrane-Review die ARR überschätzt und die NNT entsprechend unterschätzt wird.
Der USPSTF-Report von 2022 (18) fand eine geringere relative Risikoreduktion hinsichtlich der Gesamtmortalität, der kardiovaskulären Mortalität und der Schlaganfälle als der USPSTF-Review von 2016. In Bezug auf die absolute Risikoreduktion unterscheiden sich die Ergebnisse von 2016 und 2022 jedoch nicht relevant. Dies beruht auf der im Report 2022 höheren gepoolten Ereignisrate, welche durch die 2022 neu berücksichtigten Studien ALLHAT-LLT (23) und PROSPER (22) bedingt ist. In ALLHAT-LLT und PROSPER verstarben im Kontrollarm deutlich mehr Personen als in den anderen Studien (ALLHAT-LLT: 12,3 %, PROSPER: 8,2 %, übrige Studien 0 bis 5,8 %) und auch die Rate kardiovaskulärer Ereignisse, beispielsweise von Schlaganfällen, lag höher (ALLHAT-LLT: 4,3 %, PROSPER: 3,7 %, übrige Studien 0 bis 3,1 %). Am ehesten ist dies erklärbar durch das höhere Durchschnittsalter der eingeschlossenen Patienten (ALLHAT-LLT: 66 Jahre, PROSPER: 75 Jahre, übrige Studien 52 bis 66 Jahre) sowie das vergleichsweise lange Follow-up der Studie ALLHAT-LLT (4,8 Jahre vs. durchschnittlich 3,3 Jahre).
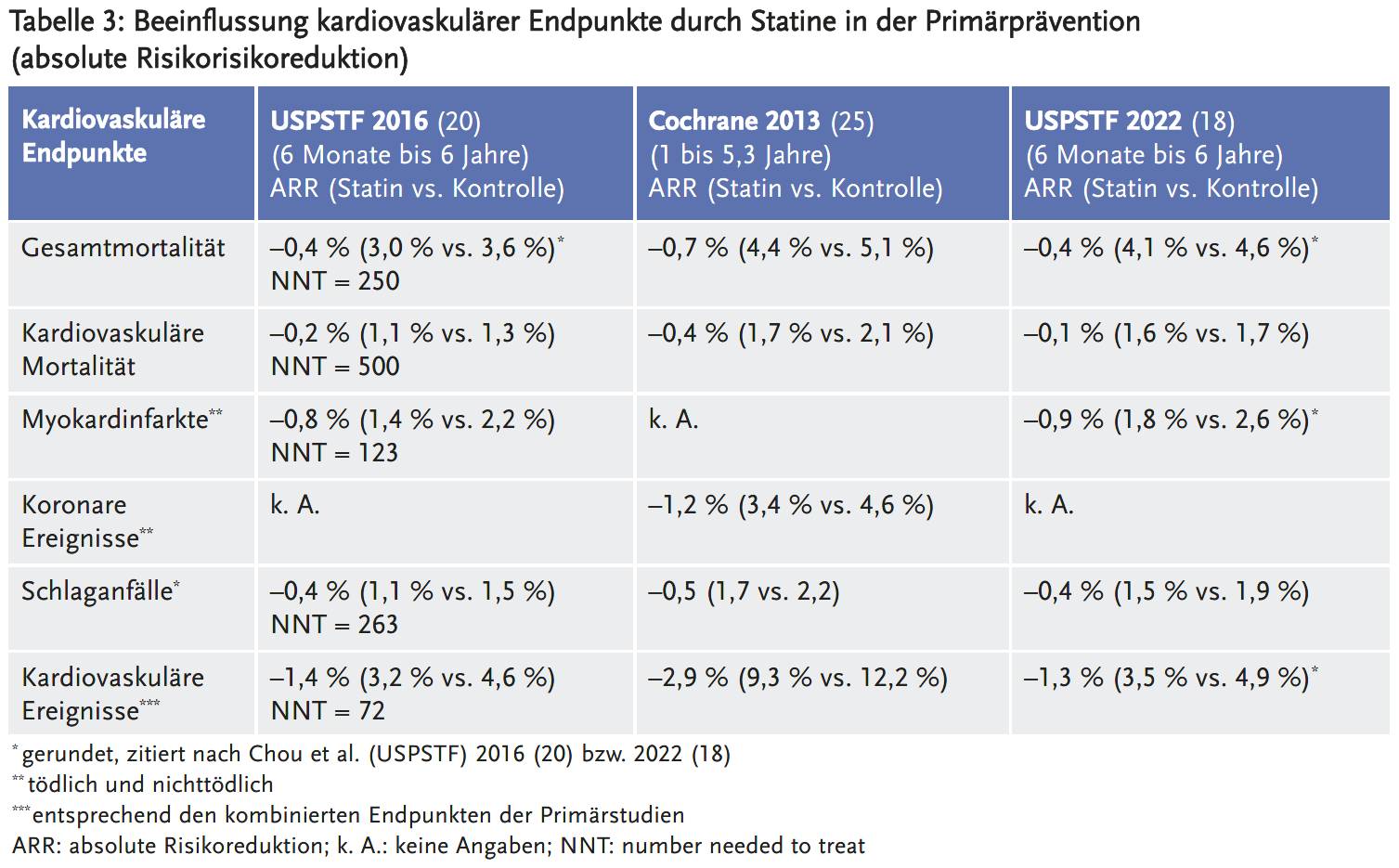
Die Angaben in Tabelle 3 sind Durchschnittswerte von Patienten mit sehr unterschiedlichen kardiovaskulären Risikofaktoren. Insgesamt lagen die jährlichen kardiovaskulären Ereignisraten – mit oder ohne Diabetes mellitus – in der Primärprävention deutlich niedriger als in der Sekundärprävention (1,5 % vs. 4,9 %) mit entsprechend geringer zu erwartenden absoluten Risikoreduktionen (34). Je nach individuellem Ausgangsrisiko variierte die absolute Risikoreduktion innerhalb der Primärprävention deutlich (siehe auch: Klinische Überlegungen zur Therapieinitierung). In den durch die USPSTF eingeschlossenen Primärstudien reichte beispielsweise die NNT für die Verhinderung eines Todesfalls von 47 bis 294 (20).
Patienten mit rheumatoider Arthritis hatten in der Studie TRACE RA (21) eine geringe kardiovaskuläre Ereignisrate (0,7 %/ Jahr), sodass die Studie vorzeitig nach einem medianen Follow-up von 2,5 Jahren abgebrochen wurde. Auch eine große dänische Kohortenstudie fand in der Primärprävention kein stark erhöhtes absolutes Risiko bei Patienten mit rheumatoider Arthritis (kardiovaskuläre Ereignisrate: 1 %/ Jahr) (54). Entsprechend dem niedrigen Ausgangsrisiko wurde in der Studie TRACE RA nur eine sehr geringe absolute Risikoreduktion durch Statine erreicht: Der weitgefasste primäre Endpunkt (kardiovaskulärer Tod, Myokardinfarkt, Schlaganfall, TIA, arterielle Revaskularisation) wurde nicht signifikant um 0,8 % reduziert (2,4 % vs. 1,6 %), entsprechend einer absoluten Risikoreduktion von 0,3 %/ Jahr (55).
- Mehr zu Patienten mit Diabetes mellitus:
Die CTT-Analyse von 2008 (32) untersuchte auf Basis individueller Patientendaten die kardiovaskuläre Ereignisrate (nichttödlicher Myokardinfarkt, kardiovaskulärer Tod, koronare Revaskularisation, Schlaganfall) von Patienten ohne manifeste atherosklerotische kardiovaskuläre Erkrankung (ASCVD), bei denen ein Diabetes mellitus bekannt (n = 11.730) bzw. nicht bekannt war (n = 28.723). Patienten mit Diabetes ohne manifeste ASCVD hatten eine höhere kardiovaskuläre Ereignisrate als Patienten, bei denen weder ein Diabetes mellitus noch eine kardiovaskuläre Vorerkrankung bekannt war (Patienten mit vs. ohne Diabetes mellitus: 11,8 % vs. 8,3 % bei einer medianen Studiendauer von 4,3 Jahren). Bei gleicher relativer Risikoreduktion war entsprechend die absolute Risikoreduktion bei Patienten mit Diabetes mellitus etwas höher als bei Patienten ohne Diabetes mellitus (2,6 % vs. 1,6 % über eine mediane Studiendauer von 4,3 Jahren). Diese Ergebnisse stimmen überein mit der Metaanalyse von de Vries et al., die vier Studien zur primärpräventiven Statintherapie bei Patienten mit Diabetes mellitus poolte: De Vries et al. fanden eine absolute Risikoreduktion kardiovaskulärer Ereignisse von 2,8 % bei einer medianen Studiendauer von 3,9 Jahren (Statin vs. Placebo: 8,5 % vs. 11,3 %) (31).
- Mehr zur Time-to-benefit:
Die Metaanalyse von Yourman et al. (28) errechnete bei ausgewählten RCTs (> 1000 Teilnehmer, Durchschnittsalter > 55 Jahre, moderate oder hohe methodische Qualität; 8 RCTs, n = 65.383) aus dem Cochrane- (25) und USPSTF-Review (20) die Time-to-Benefit von Statinen, d. h. die Zeitspanne bis zur Verhinderung eines schwerwiegenden kardiovaskulären Ereignisses (MACE). Dabei übernahmen Yourman et al. die Definitionen aus den Primärstudien. Alle Studien schlossen unter „MACE“ Myokardinfarkte und kardiovaskuläre Todesfälle ein, die Hälfte der Studien zusätzlich auch Angina pectoris und koronare Revaskularisationen.
Die Ereigniszeitanalyse von Yourman et al. weist darauf hin, dass der Nutzen der Statintherapie mit längerer Nachbeobachtungszeit stetig zunimmt. So wurden nach einem Jahr 0,3 MACE pro 100 behandelter Patienten verhindert; dieser Wert stieg nach drei Jahren Statintherapie auf 1,3 MACE pro 100 Patienten an. Um bei 100 Patienten 1 MACE zu verhindern, müssen diese laut Yourman et al. 2,5 Jahre mit Statinen behandelt werden. Dieses Ergebnis gilt nur für Patienten, die älter als 55 Jahre alt sind. Jüngere Patienten haben im Durchschnitt ein geringeres kardiovaskuläres Risiko. Bei Patienten < 55 Jahre ist deshalb von einer längeren Time-to-Benefit auszugehen.
- Mehr zu Risiken von Statinen:
Schwerwiegende unerwünschte Ereignisse traten unter Statinen nicht gehäuft auf (RR 0,97; 95 % CI 0,93–1,01). Auch kam es nicht häufiger zu Therapieabbrüchen aufgrund von unerwünschten Ereignissen (18). Kein Review fand ein erhöhtes Risiko für Krebserkrankungen (18;20;25;37).
Muskelschmerzen waren in den Reviews von USPSTF (18) (9 RCTs, n = 46.388) und Cochrane (25) (9 RCTs, n = 37.939) unter Statinen numerisch geringfügig gehäuft. Auffallend ist dabei, dass in den überwiegend doppelblinden RCTs Muskelschmerzen auch unter Placebo von etwa jedem 11. Patienten beklagt wurden (USPSTF: 7,9 % vs.7,2 %; Cochrane: 9,5 % vs. 9,2 %). Cai et al. (35) unterschieden zwischen subjektiv berichteten Muskelschmerzen und Myopathien mit nachgewiesenem relevantem Anstieg der CK, zumeist in den Primärstudien definiert als CK-Anstieg > 5 x ULN. Unter Einschluss von deutlich mehr RCTs als bei Cochrane und USPSTF fanden Cai et al. (21 RCTs, n = 65.304) eine geringe, aber signifikante Häufung von Muskelschmerzen (9,60 % vs. 9,51 %; OR 1,06; 95 % CI 1,01–1,13), entsprechend 15 zusätzlichen Fällen von Muskelschmerzen pro 10.000 Patienten, die ein Jahr lang mit Statinen behandelt wurden. Auf Basis individueller Patientendaten berücksichtigte eine Analyse der CTT nicht nur den Term „Myalgie“, sondern auch die Begriffe „Wadenschmerz, Muskelkrämpfe, muskulo-skelettale Schmerzen und Muskelschwäche“. In der gepoolten Analyse von 16 RCTs (n = 95.890) trat im ersten Behandlungsjahr ein zusätzlicher Fall solcher Muskelbeschwerden bei 100 Patienten mit moderat dosierten Statinen auf (moderat dosierte Statine vs. Placebo: 18 % vs. 17 %, RR 1,07; 95 % CI 1,03–1,10). Der weitaus überwiegende Anteil der Muskelbeschwerden (94 %) war somit nicht durch die Statintherapie verursacht (siehe auch: Klinische Überlegungen zur Statinintoleranz (Primärprävention)). Im weiteren Studienverlauf klagten Patienten unter moderat dosierten Statinen nicht mehr häufiger über Muskelbeschwerden als unter Placebo (5,2 % vs. 5,4 %; RR 0,98; 95 % CI 0,95–1,02) (56).
In der Metaanalyse von Cai et al. traten Myopathien unter Statinen nicht gehäuft auf (25 RCTs, n = 65.304; OR 0,88; 95 % CI 0,62–1,24) (35). Rhabdomyolysen waren in der Primärprävention sehr selten und unter Statinen nicht signifikant gehäuft (8 RCTs, n = 59.672; Statin vs. Kontrolle: 4 vs. 2 Fälle) (18). Bei Berücksichtigung einer größeren Datenbasis sowohl der Primär- als auch der Sekundärprävention (21 RCTs, n = 129.526) traten Rhabdomyolysen unter Statinen signifikant und dosisabhängig gehäuft, aber sehr selten auf: Bei einer fünfjährigen Statintherapie ist laut CTT mit einer zusätzlichen Rhabdomyolyse pro 10.000 Patienten zu rechnen (37).
Die Studienlage zur Neuentwicklung von Diabetes mellitus Typ 2 unter Statinen in der Primärprävention ist inkonsistent, da verschiedene Reviews unter Einschluss jeweils unterschiedlicher Primärstudien zu divergierenden Ergebnissen kamen. Der Cochrane-Review berücksichtigte lediglich zwei RCTs (AFCAPS/TexCAPS (57) und JUPITER (39)) und sah – dominiert durch die Studie JUPITER – ein signifikant erhöhtes Risiko für die Entwicklung eines Diabetes mellitus Typ 2 (25). Es ist unklar, weshalb der Cochrane-Review keine weiteren Studien berücksichtigte. Die Metaanalyse von NICE fand unter Einschluss von fünf RCTs ebenfalls ein signifikant erhöhtes Diabetesrisiko bei Patienten ohne manifeste atherosklerotische kardiovaskuläre Erkrankung (ASCVD) (4,2 % vs. 3,7 %; RR 1,12; 95 % CI 1,02–1,22; I² = 39 %). Eine ähnlich starke relative Risikoerhöhung bestand unter Einbezug von fünf Studien der Sekundärprävention (4,7 % vs. 4,3 %; RR 1,09; 95 % CI 1,03–1,17; I² = 35 %) (4). Zum gleichen Ergebnis wie NICE kamen Thakker et al., die in ihre Metaanalyse sowohl RCTs der Primär- als auch der Sekundärprävention einschlossen (18 RCTs, n = 163.039) (36). Laut Thakker et al. besteht unter Statinen im Vergleich zu Placebo eine relative Risikoerhöhung von 12 %, einen Diabetes mellitus zu entwickeln (OR 1,12; 95 % CI 1,05–1,21; I² = 36 %) (36).
Bei einer von NICE und Thakker et al. abweichenden Studienauswahl fanden die Reviews von USPSTF (sechs RCTs) (18;20) und Cai et al. (neun RCTs) (35) kein signifikant erhöhtes Diabetesrisikos unter Statinen. Allerdings bestand in beiden Reviews eine relevante Heterogenität der eingeschlossenen Studien (I² = 50 %). Ein möglicher Grund für die beobachtete Heterogenität sind die unterschiedlichen Methoden der Primärstudien, neu aufgetretene Fälle von Diabetes mellitus zu diagnostizieren. So hatte beispielsweise die Studie WOSCOPS (47), die einen protektiven Effekt von Statinen zeigte, besonders stringente Diagnosekriterien: Sie forderte den zweimaligen Nachweis eines Nüchtern-Blutzuckers > 126 mg/dl mit einem Anstieg von mindestens 36 mg/dl im Vergleich zum Ausgangswert bei Studienbeginn. Dagegen basierten bei der Studie JUPITER, die im Rahmen der Primärprävention als einzige Einzelstudie ein signifikant erhöhtes Diabetesrisiko feststellte, neudiagnostizierte Diabetesfälle auf einer nicht näher definierten ärztlichen Diagnose. Zudem könnte das Diabetesrisiko durch die Statinintensität beeinflusst sein: Subgruppenanalysen von NICE zeigten ein ansteigendes Risiko bei zunehmender Statinintensität (niedrige Statinintensität: RR 1,05; moderate Statinintensität: RR 1,11; hohe Statinintensität: RR 1,25) (4). Konsistent hierzu setzte die Studie JUPITER als einzige Einzelstudie mit Rosuvastatin 20 mg ein Statin in hoher Dosierung ein (siehe auch:Risiken einer Hochdosis-Statintherapie).
Es liegt keine Metaanalyse zur Häufigkeit von hämorrhagischen Schlaganfällen unter Statinen in der Primärprävention vor. Die CTT (37) fand für eine gemischte Population aus Primär- und Sekundärprävention eine numerische Risikoerhöhung von 15 % (188 vs. 163 Fälle; RR 1,15; 95 % CI 0,87–1,51). Unter Einbezug der Studien SPARCL (58) und CORONA (59), für die keine Individualdaten verfügbar waren, ergab sich eine signifikante Risikoerhöhung um 21 % pro 1 mmol/l LDL-C-Reduktion (RR 1,21; 95 % CI 1,05–1,41; p = 0,01). Dieses Ergebnis ist allerdings nicht direkt auf die Primärprävention übertragbar, da in die Studie SPARCL nur Patienten mit Zustand nach Schlaganfall oder TIA eingeschlossen wurden. Für Patienten ohne kardiovaskuläre Vorerkrankung ist laut CTT-Analyse höchstens mit einigen wenigen zusätzlichen hämorrhagischen Schlaganfällen pro 10.000 behandelter Patienten zu rechnen.
Der Review der USPSTF (10 RCTs, n = 44.936) fand keinen signifikanten Anstieg von Leberfunktionsstörungen unter Statinen (RR 0,94; 95 % CI 0,78–1,13), definiert als Transaminasenanstieg entsprechend den jeweiligen Grenzwerten der Primärstudien (zumeist ALT-Anstieg ≥ 3-fach des oberen Normwertes) (18). Cai et al. berichteten dagegen über ein signifikant erhöhtes Risiko für Leberfunktionsstörungen (21 RCTs, n = 54.803). Die relative Risikoerhöhung um ein Drittel (RR 1,33; 95 % CI 1,12–1,58) entspricht drei zusätzlichen Fällen pro 1000 Patienten über eine Behandlungsdauer von vier Jahren (35). Aus Sicht der AkdÄ ist die klinische Relevanz asymptomatischer Transaminasenanstiege gering. Schwerwiegende Leberfunktionsstörungen wurden nur sehr selten berichtet (18).
- Mehr zu Risiko-Algorithmen:
DEGAM-Leitlinie (2) und ESC-Leitlinie (3) stimmen weitgehend darin überein, in welchen Situationen eine Risikokalkulation in der Primärprävention sinnvoll ist: bei Erstvorstellung eines Patienten mit klassischen kardiovaskulären Risikofaktoren (positive Familienanamnese, Rauchen, Hypertonus, Diabetes mellitus, Adipositas, erhöhte Lipidwerte) oder anlässlich einer allgemeinen Gesundheitsuntersuchung bei älteren Patienten (DEGAM: Frauen > 60 Jahre, Männer > 55 Jahre). Eine Verlaufskontrolle sollte abhängig vom kardiovaskulären Risikoprofil im Abstand von zwei bis fünf Jahren erfolgen.
Die Aussagekraft aller zur Verfügung stehender Scores ist eingeschränkt durch die vereinfachte Erfassung der Risikofaktoren (z. B. keine Berücksichtigung der Dauer des Rauchstopps) und die Nichtberücksichtigung von Komorbiditäten, die das kardiovaskuläre Risiko ebenfalls erhöhen (z. B. rheumatoide Arthritis oder obstruktive Schlafapnoe). Zudem können die Scores nicht angewendet werden für Patienten mit gesicherter familiärer Hypercholesterinämie.
Die Leitlinie der DEGAM empfiehlt für die hausärztliche Versorgungsebene die Nutzung von arriba (absolute und relative Risikoreduktion: individuelle Beratung in der Allgemeinpraxis) (60). Der arriba-Algorithmus basiert auf der amerikanischen Framinghamkohorte, wurde jedoch mit Hilfe epidemiologischer Daten für Deutschland adaptiert. Unter Berücksichtigung von insgesamt neun kardiovaskulären Risikofaktoren schätzt arriba das individuelle Risiko ein, innerhalb von zehn Jahren einen Herzinfarkt oder Schlaganfall zu erleiden. Sofern ein Diabetes mellitus Typ 2 vorliegt, fließt die Blutzucker-Einstellung – operationalisiert als mittlerer HbA1c der vergangenen zwölf Monate – in die Risikokalkulation mit ein.
Die ESC-Guideline empfiehlt zur kardiovaskulären Risikoabschätzung die Nutzung von SCORE2 (Systematic Coronary Risk Estimation 2) bzw. SCORE2-OP (SCORE2-Older Persons, für Patienten > 70 Jahre) (61). SCORE2 basiert auf 45 europäischen Studien mit über 600.000 Teilnehmern. Für unterschiedliche Länder sind angepasste Risikokalkulationen verfügbar. Im Unterschied zu arriba wird in die Risikoprognose auch die kardiovaskuläre Mortalität einbezogen. SCORE2 berücksichtigt fünf Risikofaktoren (Alter, Geschlecht, Blutdruck, Non-HDL-Cholesterin, Raucherstatus). Die Familienanamnese und eine Therapie mit Antihypertensiva fließen somit nicht in die Risikokalkulation ein. SCORE2 ist für Patienten mit Diabetes mellitus nicht anwendbar. Das kardiovaskuläre Risiko von Patienten mit Diabetes mellitus wird in der ESC-Leitlinie immer mindestens als „moderat“ eingestuft, bei einer Diabetesdauer > 10 Jahre oder weiteren kardiovaskulären Risikofaktoren als „hoch“, bei Endorganschäden sogar als „sehr hoch“.
- Mehr zur Interventionsschwelle:
Die Arzneimittelrichtlinie definiert ein hohes kardiovaskuläres Risiko als „über 20 % Ereignisrate/10 Jahre auf der Basis der zur Verfügung stehenden Risikokalkulatoren“ (62). Patienten mit Diabetes mellitus gelten in der Arzneimittelrichtlinie – im Unterschied zu kardiovaskulär vorerkrankten Patienten – nicht per se als Hochrisikogruppe. Die Risikokalkulation mit arriba bildet deshalb die Arzneimittelrichtlinie besser ab als SCORE2.
Ausnahmen von der Verordnungsbeschränkung sind laut Arzneimittelrichtlinie in „medizinisch begründeten Einzelfällen“ möglich (62). Diese Einzelfälle betreffen laut DEGAM-Leitlinie (2) Patienten mit einem kardiovaskulären Risiko von 10–20 %/10 Jahre, wenn diese ein deutlich erhöhtes Risiko im Vergleich zu gleichaltrigen Patienten aufweisen. Die ESC-Leitlinie (3) spricht dagegen eine generelle Behandlungsempfehlung bei einem geschätzten 10-Jahres-Risiko von > 7,5 % (Patienten < 50 Jahre) bzw. > 10 % (Patienten 50–69 Jahre) aus und empfiehlt die Prüfung einer lipidsenkenden Therapie bei einem geschätzten 10-Jahres-Risiko von > 2,5 % (Patienten < 50 Jahre) bzw. > 5 % (Patienten 50–69 Jahre).
Je niedriger die Interventionsschwelle gesetzt wird, desto geringer ist der zu erwartende Nutzen der Statintherapie: Geht man davon aus, dass Statine kardiovaskuläre Ereignisse um relativ 30 % reduzieren (20), so kann ein Patient von einer zehnjährigen Statintherapie eine absolute Risikoreduktion von 6 % erwarten, wenn sein Ausgangsrisiko bei 20 %/10 Jahren liegt (20 % x 0,3): Das Risiko, ein kardiovaskuläres Ereignis in den folgenden zehn Jahren zu erleiden, sinkt bei diesem Patienten durch die Statintherapie von 20 % auf 14 %. Hat der Patient dagegen ein kardiovaskuläres Risiko von lediglich 5 %/10 Jahre, liegt der erwartbare Nutzen einer zehnjährigen Statintherapie bei einer absoluten Risikoreduktion von 1,5 % (5 % x 0,3; absolutes Risiko ohne Statine 5 % vs. 3,5 % mit Statinen).
- Mehr zum Vorgehen bei Muskelbeschwerden unter Statinen:
Schwere unerwünschte Wirkungen, die einen Abbruch der Statintherapie erfordern, sind selten. Dazu gehören insbesondere Leberschädigungen und Myopathien mit Kreatinkinase (CK)-Erhöhung > 5 ULN bis hin zu Rhabdomyolysen (siehe auch: Risiken von Statinen). Sehr viel häufiger kommt es zum Behandlungsabbruch aufgrund Statin-assoziierter Muskelschmerzen (SAMS) ohne relevante CK-Erhöhung.
Werden irrtümlich Statine als kausal für die Muskelbeschwerden angenommen, verhindert dies erstens eine adäquate Therapie der zugrundeliegenden Ursache und schränkt zweitens unnötig eine effektive kardiovaskuläre Prävention ein. Bei Statin-assoziierten Muskelschmerzen sollte deshalb auch an andere Ursachen der Muskelbeschwerden (z. B. Polymyalgia rheumatica) sowie behandelbare Risikofaktoren für SAMS (z. B. Hypothyreose) gedacht werden. Außerdem ist die Medikation auf Wechselwirkungen zu überprüfen, die das Risiko für SAMS erhöhen (z. B. Makrolidantibiotika) (63-65).
Laut Fachinformationen soll bei Muskelbeschwerden unter Statintherapie die CK als Marker für eine Muskelschädigung bestimmt werden. Bei CK-Erhöhung > 5 ULN ist das Statin zu pausieren, andernfalls kann die Therapie zunächst fortgeführt werden, wobei eine Dosisreduktion und/oder der Wechsel auf ein anderes Statin zu erwägen ist. Bei nicht tolerierbaren Muskelbeschwerden wird auch bei normaler bzw. geringgradig erhöhter CK die Therapie zunächst pausiert und erst nach Abklingen der Beschwerden in der niedrigsten Dosierung wiederaufgenommen (siehe beispielsweise (66)). Die Therapiefortführung setzt voraus, dass aus Sicht des Patienten der Nutzen die möglichen unerwünschten Wirkungen überwiegt. Muskelbeschwerden sollten deshalb auch Anlass für eine erneute, gemeinsam mit dem Patienten vorgenommene Abschätzung des Nutzen-Risiko-Verhältnisses der Statintherapie sein (64).
Ein kausaler Zusammenhang zwischen Muskelbeschwerden und Statintherapie wird allgemein angenommen, wenn sich die Beschwerden in der Therapiepause bessern und bei erneuter Exposition wieder auftreten. Allerdings zeigen Studien, dass diese zeitliche Assoziation nicht beweisend für einen kausalen Zusammenhang ist: Die doppelblinde Studie SAMSON (67) untersuchte 60 Patienten, die Statine in der klinischen Versorgung aufgrund von Muskelbeschwerden abgesetzt hatten. Die Patienten wurden über ein Jahr hinweg zu zwölf Sequenzen einer jeweils einmonatigen Behandlung mit Atorvastatin 20 mg, der Gabe von Placebo oder einer Behandlungspause (leere Medikamentenbox) randomisiert. Die Stärke der Muskelbeschwerden wurde täglich auf einer Skala von 0 (nicht vorhanden) bis 100 (unerträglich) durch die Patienten dokumentiert. Die durchschnittliche Beschwerdestärke unterschied sich nicht signifikant zwischen den Studienphasen mit Statintherapie und den Phasen mit Placebokontrolle (Intensität der Beschwerden: 16 vs. 15), war jedoch in beiden „Tablettenphasen“ signifikant höher als während der Behandlungspause (Intensität der Beschwerden: 8). Auf Individualdatenbasis ergab sich kein Unterschied zwischen Statin und Placebo hinsichtlich des Symptombeginns bei Start der Tabletteneinnahme oder der Symptombesserung bei Beendigung der Tabletteneinnahme.
In der klinischen Versorgung lässt sich ein Nocebo-Effekt auch durch wiederholte Therapiepausen und Re-Expositionen nicht ausschließen. Mehrmalige Therapieversuche eröffnen jedoch die Möglichkeit, eine individuell akzeptable Statindosierung zu finden. Expertengruppen empfehlen weitgehend übereinstimmend, bei SAMS die Verträglichkeit von mindestens zwei Wirkstoffen zu erproben, wobei mindestens einmal die niedrigste Dosierung eingesetzt werden sollte (5;63). Sofern eine niedrige Statindosis vertragen wird, kann eine vorsichtige Dosissteigerung versucht werden, wobei der zu erwartende Benefit kritisch gegen das Risiko eines erneuten Behandlungsabbruchs aufgrund von Beschwerden abzuwägen ist.
Fazit für die Praxis
Patientinnen und Patienten profitieren umso stärker von einer Statintherapie, je höher ihr Risiko für kardiovaskuläre Ereignisse ist. In der Primärprävention sind Risiko-Algorithmen hilfreich für die Einschätzung des kardiovaskulären Risikos. Die meisten Patientinnen und Patienten können eine relative Risikoreduktion kardiovaskulärer Ereignisse von etwa 30 % durch Statine erwarten. Bei einem hohen Ausgangsrisiko von 20 %/10 Jahre entspricht dies einer absoluten Risikoreduktion von 6 % durch eine zehnjährige Statintherapie. Bei Herzinsuffizienz oder einer terminalen Niereninsuffizienz ist ein Nutzen der Statintherapie jedoch nicht belegt. Auch bei älteren Menschen (≥ 75 Jahren) ohne kardiovaskuläre Vorerkrankung ist es unsicher, ob sie von Statinen profitieren.
Muskelbeschwerden sind häufig berichtete Symptome unter Statinen, aber zumeist nicht durch Statine verursacht. Im ersten Behandlungsjahr ist bei moderat dosierten Statinen pro 100 behandelter Personen mit einem zusätzlichen Fall von Muskelbeschwerden zu rechnen, der ursächlich auf die Statintherapie zurückgeführt werden kann. Im weiteren Behandlungsverlauf besteht kein erhöhtes Risiko für Muskelbeschwerden. Aus Sicht der AkdÄ setzt die Diagnose einer „Statinintoleranz“ voraus, dass mindestens zwei verschiedene Statine auch in niedriger Dosierung nicht vertragen wurden.
Schwerwiegende Nebenwirkungen der Statintherapie (hämorrhagische Schlaganfälle, Diabetes mellitus Typ 2 oder schwere Leberfunktionsstörungen) sind selten. Für Personen unter 75 Jahren ohne Herzinsuffizienz oder Dialyse, die ein hohes kardiovaskuläres Risiko haben, überwiegt der Nutzen einer Statintherapie deutlich die seltenen schwerwiegenden Risiken.
Profitieren Patientinnen und Patienten ohne kardiovaskuläre Vorerkrankung von einer Intensivierung der Statintherapie?
- Mehr zur Intensivierung der Statintherapie durch fixe Dosissteigerung:
Zwei RCTs untersuchten verschiedene Statindosierungen bei Patienten ohne manifeste atherosklerotische kardiovaskuläre Erkrankung (ASCVD): Bone et al. (68) (n = 626, Follow-up 52 Wochen) verglichen verschiedene Dosierungen von Atorvastatin (10 mg, 20 mg, 40 mg, 80 mg) bei postmenopausalen Frauen, Muldoon et al. (69) (n = 189, Follow-up 6 Monate) eine niedrige Simvastatin-Dosis (10 mg) mit einer moderaten Simvastatin-Dosis (40 mg). Primärer Endpunkt waren Auswirkungen der Statintherapie auf den Knochenstoffwechsel (68) bzw. die neurokognitive Funktion (69) der Patienten. Beide RCTs erlauben aufgrund der geringen Teilnehmerzahlen keine Aussagen über kardiovaskuläre Endpunkte.
Ein indirekter Vergleich verschiedener Statinintensitäten (niedrige Dosis: 3 RCTs, moderate Dosis: 10 RCTs, hohe Dosis: 3 RCTs) zeigte keine Überlegenheit der intensivierten Therapie. Das Ausmaß der Mortalitätsreduktion unterschied sich nicht zwischen niedriger (RR 0,72), moderater (RR 0,88) oder hoher Statinintensität (RR 0,80). Auch die absolute Risikoreduktion war sehr ähnlich (0,44 % bei hoher Dosis, 0,55 % bei niedriger/moderater Dosis). Bezüglich anderer kardiovaskulärer Endpunkte war kein indirekter Vergleich möglich, da zu wenige Daten aus RCTs mit niedriger und hoher Statinintensität vorlagen (20).
Die CTT-Analysen (37;70) wichten die relative Risikoreduktion kardiovaskulärer Ereignisse pro 1 mmol/l absoluter LDL-C-Senkung ein Jahr nach Randomisierung. Darauf basierend sieht die CTT eine proportionale Assoziation zwischen der Höhe der absoluten LDL-C-Senkung und dem Ausmaß der relativen kardiovaskulären Risikoreduktion: Je größer die absolute LDL-C-Senkung ist, desto stärker ist laut CTT die relative Risikoreduktion für kardiovaskuläre Ereignisse. Dabei reduziert laut CTT eine LDL-C-Senkung um 1 mmol/l das relative Risiko für kardiovaskuläre Ereignisse um 23 %. Zuverlässige Aussagen zur Primärprävention lassen sich aus der CTT-Analyse nicht ableiten, da Studien zur Primär- und Sekundärprävention zusammengefasst werden. Zudem erscheint die behauptete Assoziation inkonsistent, wenn die relevanten harten Endpunkte des kombinierten Endpunktes betrachtet und die absoluten Risikoreduktionen berücksichtigt werden: Eine stärkere LDL-C-Senkung war bei Byrne et al. assoziiert mit einer höheren relativen Reduktion der Gesamtmortalität und einer höheren relativen und absoluten Reduktion von Schlaganfällen, aber nicht mit einer höheren absoluten Reduktion der Gesamtmortalität oder einer höheren relativen und absoluten Reduktion von Myokardinfarkten (71).
- Mehr zur Intensivierung durch Titration entsprechend LDL-C-Zielwerten:
Es gibt keinen RCT, der in der Primärprävention eine zielwertgesteuerte Statintherapie mit Statinen in fester Dosis vergleicht. Der RCT EMPATHY (72) (PROBE-Design, Follow-up 37 Monate) untersuchte zwei unterschiedliche Zielwertstrategien bei japanischen Patienten mit diabetischer Retinopathie ohne klinisch manifeste KHK. Bei Randomisierung lag der LDL-C-Wert in beiden Gruppen im Mittel bei 106 mg/dl. Im Studienverlauf sollte die Statintherapie individuell so angepasst werden, dass entweder der LDL-C-Wert weiterhin zwischen 100–120 mg/dl lag (n = 2524) oder eine Absenkung auf < 70 mg/dl erreicht wurde (n = 2518). Zu Studienbeginn erhielten die Patienten überwiegend niedrig bis sehr niedrig dosierte Statine, bei 43 % der Patienten erfolgte sogar keinerlei lipidsenkende Therapie. In der Gruppe mit einem LDL-C-Zielwert < 70 mg/dl erfolgte eine Dosissteigerung auf eine niedrige bis moderate Intensität (z. B. Steigerung der durchschnittlichen Atorvastatin-Dosis von 8 mg auf 13 mg). Nach drei Jahren lag der LDL-C-Wert unter der intensivierten Statintherapie bei 77 mg/dl (vs. 104 mg/dl in der Vergleichsgruppe), erreichte also nicht den Zielwert von < 70 mg/dl. Der primäre, sehr weit gefasste Endpunkt umfasste nichttödliche und tödliche renale (Dialyse, Kreatinin-Verdopplung) und vaskuläre Ereignisse (kardiale, zerebrale und periphere Gefäßereignisse). Zwischen den Studienarmen bestand kein signifikanter Unterschied (LDL-C-Zielwert < 70 mg/dl vs. LDL-C-Zielwert 100–120 mg/dl: 5,1 % vs. 6,1 %, HR 0,84; 95 % CI 0,67–1,07; p = 0,15). Auch die Gesamtsterblichkeit unterschied sich nicht (1,6 % vs. 1,3 %).
Drei RCTs verglichen eine zielwertgesteuerte Titration von Statinen gegen Placebo. Die erlaubte Titration beschränkte sich auf eine Verdopplung der initialen, niedrigen Statindosis (Lovastatin 20 mg (43;57) oder Pravastatin 10 mg (73)), wenn die LDL-C-Zielwerte von 90–110 mg/dl (43) bzw. < 110 mg/dl (57) nicht erreicht wurden oder das Gesamtcholesterin über 220 mg/dl lag (73). Die Dosistitration war nur in der Studie MEGA über die gesamte Behandlungsdauer hinweg erlaubt, in den Studien AFCAPS/ TexCAPS und ACAPS sollte die Titration nach 3 bzw. 4,5 Monaten abgeschlossen sein. Ein indirekter Vergleich (20) zwischen diesen RCTs und 16 anderen RCTs mit Statin-Fixdosen zeigte eine ähnlich starke Reduktion kardiovaskulärer Ereignisse im Rahmen der Primärprävention (zielwertgesteuerte Titration vs. Fixdosis: Gesamtmortalität RR 0,78 vs. RR 0,86; kardiovaskuläre Mortalität RR 0,61 vs. RR 0,71; Myokardinfarkte RR 0,60 vs. RR 0,64).
Die ESC-Guideline (3) begründet ihre Zielwertstrategie mit der CTT-Analyse von 2010, nach welcher eine proportionale Assoziation zwischen der Stärke der absoluten LDL-C-Senkung und dem Ausmaß der relativen kardiovaskulären Risikoreduktion besteht (37). Allerdings wird diese Assoziation laut CTT nicht beeinflusst durch die Ausgangshöhe des LDL-C-Wertes. Wenn die absolute LDL-C-Senkung relevant ist, aber nicht der Ausgangswert des LDL-C, spricht dies gegen eine Assoziation zwischen dem unter Statintherapie erreichten LDL-C-Wert und der relativen Risikoreduktion: Die gleiche relative Risikoreduktion vaskulärer Ereignisse würde erreicht, wenn das LDL-C um 1 mmol/l auf einen Wert von 1 mmol/l (ausgehend von 2 mmol/l) oder auf 2 mmol/l (ausgehend von 3 mmol/l) gesenkt wird. Die Befunde der CTT-Analyse 2010 erscheinen deshalb mit der Rationale einer Zielwertstrategie („the lower the better“) nicht gut vereinbar. Wie oben erläutert, kann aus Sicht der AkdÄ aus der CTT-Analyse auch kein Nutzen einer primärpräventiven Hochdosistherapie abgeleitet werden. (siehe auch: Intensivierung der Statintherapie durch fixe Dosissteigerung).
Fazit für die Praxis
Es ist nicht belegt, dass Patientinnen und Patienten in der Primärprävention von einer Hochdosistherapie oder einer Titration nach bestimmten LDL-C-Zielwerten profitieren.
Profitieren Patientinnen und Patienten mit kardiovaskulärer Erkrankung von einer Intensivierung der Statintherapie?
- Mehr zur Evidenzbasis:
Sechs RCTs (n = 41612) untersuchten, ob eine Hochdosis-Statintherapie im Vergleich zu einer weniger intensiven Statintherapie das Risiko für kardiovaskuläre Ereignisse reduziert (PROVE IT (74), IDEAL (75), TNT (76), A to Z (77), SEARCH (78) sowie eine Studie von Im et al. (79)). Als Hochdosistherapie wurden Atorvastatin in einer Dosierung von 40–80 mg (74-76;79) oder Simvastatin 80 mg (77;78) eingesetzt. Fünf RCTs verglichen die Hochdosistherapie mit einer moderaten Dosis (Simvastatin 20 mg, Pravastatin 40 mg oder Atorvastatin 10 mg) (74-78), nur ein RCT mit einer niedrigen Statindosis (Pravastatin 20 mg) (79). Die Studiendauer betrug zwischen einem Jahr (79) und 6,7 Jahren (78).
Die RCTs untersuchten ausschließlich Patienten mit klinisch manifester KHK. Bei den meisten Patienten (87 %) war ein Myokardinfarkt bekannt. In zwei RCTs wurden Patienten innerhalb der ersten Woche nach einem akuten Koronarereignis (74;77) eingeschlossen, in den vier anderen RCTs musste der Myokardinfarkt mindestens drei Monate zurückliegen. Die eingeschlossenen Patienten waren durchschnittlich etwa 60 Jahre alt und überwiegend männlich (> 75 %). Der LDL-C-Wert lag bei Randomisierung im Mittel zwischen 97 mg/dl (80) und 121 mg/dl (75).
Die CTT-Analyse von Baigent et al. (37) berücksichtigte in einer geplanten Subanalyse zur Hochdosis-Statintherapie alle oben beschriebenen RCTs mit Ausnahme der 2017 publizierten Studie von Im et al. (79). Da die CTT keine Aussage zur Gesamtmortalität trifft und ihre methodische Qualität allenfalls moderat ist (AMSTAR II 7/16, siehe Extraktionstabellen auf der AkdÄ-Website), diskutiert der Leitfaden zusätzlich die Metaanalyse von NICE (4). Auch NICE konnte die Studie von Im et al. aufgrund ihres Publikationsdatums nicht einschließen. NICE berücksichtigte jedoch zusätzlich noch klinische Ereignisse der Studie SAGE (81), die von der CTT aufgrund ihrer Größe (n = 891) ausgeschlossen wurde. Primärer Endpunkt der Studie SAGE waren keine klinischen Ereignisse, sondern ST-Senkungen im Langzeit-EKG. Im Leitfaden wird deshalb auf eine Extraktion der Studie verzichtet.
Abweichend von der Klassifikation der ACC/AHA (6) betrachtet NICE Pravastatin 40 mg als niedrige Statindosis. NICE untersuchte die beiden Studien, die Pravastatin 40 mg als Vergleichstherapie einsetzen (74;81), in einer separaten Metaanalyse als „Hochdosis vs. niedrige Dosis“. Die NICE-Analyse „Hochdosis vs. moderate Dosis“ umfasst deshalb vier Studien (75-78) und enthält im Unterschied zur CTT-Analyse nicht die Studie PROVE IT (74).
Weitere Metaanalysen schlossen auch Studien ein, in denen zwar verschieden intensive Statintherapien verglichen wurden, aber kein spezifischer Vergleich zwischen Hochdosis und moderater/niedrig dosierter Statintherapie erfolgte. Die Analysen von Wang et al. (82) und Toyota et al. (83) berücksichtigten die japanische Studie REAL-CAD (84), die bei Patienten mit KHK (n = 12413, Dauer 3,9 Jahre) zwei unterschiedliche Dosierungen von Pitavastatin (1 mg vs. 4 mg) untersuchte. Sowohl Pitavastatin 1 mg als auch Pitavastatin 4 mg sind Statindosierungen moderater Intensität, die zu einer durchschnittlichen relativen LDL-C-Reduktion von 30–49 % führen (5;6;85).
Koskinas et al. (86) bezogen die Studie Post-CABG (87) (n = 1351, Dauer 4,3 Jahre) ein, obgleich diese keine Statin-Fixdosen, sondern zwei unterschiedliche Titrationsstrategien verglich (LDL-C Zielwert 60–85 mg/dl vs. LDL-C Zielwert 130–140 mg/dl). Hierfür wurde sehr niedrig (2,5–5 mg) bzw. moderat (40–80 mg) dosiertes Lovastatin eingesetzt und dieses bei Nichterreichen der LDL-C-Zielwerte mit Colestyramin kombiniert. Die Studien REAL-CAD und Post-CABG untersuchten somit nicht die hier interessierende Fragestellung. Die Metaanalysen von Wang et al., Toyota et al. und Koskinas et al. werden deshalb nur ergänzend zu den Arbeiten der CTT und von NICE in die Diskussion mit einbezogen.
- Mehr zur Wirksamkeit einer Hochdosis-Statintherapie:
Die Metaanalysen von NICE (4) und der CTT-Collaboration (37) kamen zu sehr ähnlichen Ergebnissen bezüglich der relativen Risikoreduktion. Die Daten zur absoluten Risikoreduktion sind nicht direkt vergleichbar, da die CTT die Ereignisse pro Jahr angibt, während NICE sich auf die gesamte Studiendauer bezieht. Bei einer durchschnittlichen Behandlungsdauer von etwa fünf Jahren in den bei NICE eingeschlossenen Studien ergeben sich jedoch weitgehend übereinstimmende Ergebnisse.
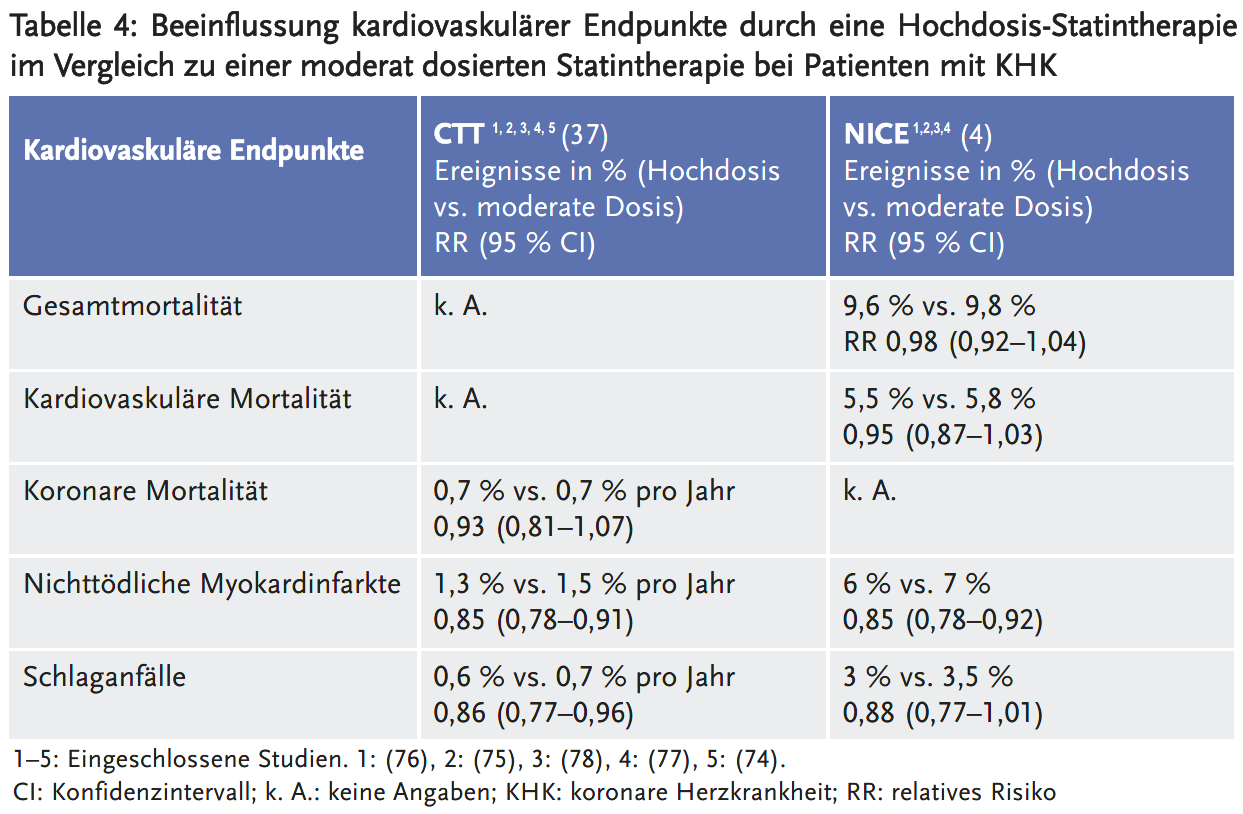
Die Gesamtmortalität und die kardiovaskuläre Mortalität bzw. koronare Mortalität wurden durch eine Hochdosistherapie im Vergleich zu einer moderaten Statindosis nicht beeinflusst. In einer separaten Analyse untersuchte NICE die Studien PROVE IT (74) und SAGE (81), in der die Vergleichsgruppen Pravastatin 40 mg erhielten. Hier zeigte sich eine signifikante Reduktion der Gesamtmortalität durch die Hochdosistherapie (2 % vs. 3,3 %; RR 0,61; 95 % CI 0,43–0,86). Allerdings wurde die Aussagesicherheit dieses Ergebnisses von NICE als niedrig beurteilt. Auch das IQWiG schätzte aufgrund methodischer Mängel die Studienergebnisse von PROVE IT als „nicht ausreichend valide bzw. robust“ ein (88). Da die kardiovaskuläre Mortalität in den beiden RCTs nicht signifikant gesenkt wurde (1,1 % vs. 1,6 %; RR 0,68; 95 % CI 0,42–1,11), erscheint die gezeigte Reduktion der Gesamtmortalität am ehesten zufallsbedingt.
Unter Einschluss der Studie Post-CABG kommt die Metaanalyse von Koskinas et al. (86) bezüglich der Gesamtmortalität und kardiovaskulären Mortalität zu einem nicht signifikanten und damit ähnlichen Ergebnis wie die CTT und NICE. Die Analysen von Wang et al. (82) und Toyota et al. (83) sehen dagegen bei Berücksichtigung der ausschließlich in Japan durchgeführten Studie REAL-CAD (84) eine signifikante Reduktion der Gesamtmortalität. Wie oben erläutert, untersuchte die Studie REAL-CAD keine Hochdosistherapie, sondern zwei Pitavastatin-Dosierungen moderater Intensität. Unabhängig davon, dass die Studie REAL-CAD für die hier interessierende Fragestellung ungeeignet ist, erscheint die gezeigte Reduktion der Gesamtmortalität – auch aus Sicht der Studienautoren – am ehesten zufallsbedingt: Die Studie REAL-CAD war nicht darauf ausgelegt, Mortalitätsunterschiede nachzuweisen, und sie wurde aufgrund der unerwartet niedrigen Ereignisrate deutlich früher als geplant abgebrochen (nach 600 statt geplant 1033 Ereignissen aus kardiovaskulärem Tod, Herzinfarkt, Schlaganfall und instabiler Angina). Zudem ist es wenig plausibel, dass die höhere Pitavastatin-Dosis signifikant die Gesamtmortalität beeinflusste, aber keinen signifikanten Einfluss auf die kardiovaskuläre Mortalität nahm.
Sowohl die CTT als auch NICE fanden eine signifikante Reduktion von nichttödlichen Myokardinfarkten. Das Ausmaß dieses Effekts ist gering und bei Abwägung gegen den potenziellen Schaden – wie beispielsweise auch NICE schreibt – möglicherweise klinisch nicht relevant (NNT 500 pro Behandlungsjahr). Die sehr geringe Reduktion nichttödlicher Schlaganfälle ist in der CTT-Analyse signifikant, in der Analyse von NICE wird – bei vergleichbarem relativen Behandlungsunterschied – keine Signifikanz erreicht (NNT 1000 pro Behandlungsjahr). Bezüglich der Reduktion von nichttödlichen Myokardinfarkten und Schlaganfällen kommen die Metaanalysen von Wang et al. (82), Toyota et al. (83) und Koskinas et al. (86) zu ähnlichen relativen Risikoreduktionen wie NICE und CTT.
Die Studie von Im et al. (79) wurde aufgrund ihres Publikationsdatums in keine der Metaanalysen eingeschlossen. Diese ausschließlich in Korea durchgeführte Studie verglich eine Hochdosis-Therapie (Atorvastatin 40 mg) mit einer niedrig dosierten Statintherapie (Pravastatin 20 mg) bei Patienten mit chronischer KHK (n = 2000), die vor durchschnittlich zwölf Monaten eine PCI mit Implantation eines DES erhalten hatten. Überwiegend erfolgte die PCI aufgrund einer stabilen Angina pectoris Symptomatik, nur bei 13 % aufgrund eines Myokardinfarktes. Der primäre, sehr weitgefasste Endpunkt mit acht Komponenten bezog kardiovaskuläre und renale Ereignisse ein. Unter der Hochdosistherapie ereigneten sich innerhalb des Beobachtungszeitraums von einem Jahr signifikant weniger Ereignisse des primären Endpunktes (25 vs. 40; RR 0,58; 95 % CI 0,36–0,92), wobei ein relevanter Anteil davon auf Revaskularisationen entfiel (11 vs. 17). Aus den wenigen Todesfällen (5 vs. 8) und Myokardinfarkten (2 vs. 9) lassen sich keine belastbaren Aussagen zur Wirksamkeit der Hochdosistherapie ableiten.
- Mehr zu Patienten mit Dialyse oder Herzinsuffizienz:
In den vorliegenden Studien waren Patienten mit fortgeschrittener Niereninsuffizienz (Kreatinin > 2 mg/dl) ausgeschlossen. Es nahmen nur sehr wenige Patienten mit Herzinsuffizienz teil (5–8 %). Subgruppenanalysen zu diesen Patienten sind nicht verfügbar. In Studien, die gezielt Dialysepatienten untersuchten, profitierten diese gegenüber Placebo nicht von einer Statintherapie (Rosuvastatin 10 mg/d (45) bzw. Atorvastatin 20 mg/d (52)). Auch bei Patienten mit stabiler KHK und Herzinsuffizienz wurde bislang kein Nutzen einer Statintherapie gezeigt (Rosuvastatin 10 mg/d (46;59)). Trotzdem empfiehlt die NVL KHK (5) bei Neuauftreten einer Herzinsuffizienz eine Fortsetzung der Statintherapie, insbesondere in zeitlicher Nähe zu akuten koronaren Ereignissen, da nach Einschätzung der Autoren nicht ausreichend untersucht ist, wie sich die Beendigung einer etablierten Statintherapie auf den Krankheitsverlauf auswirkt. Aus Sicht der AkdÄ ist bei Patienten mit KHK und Herzinsuffizienz aufgrund des nicht belegten Nutzens allenfalls eine moderat dosierte Statintherapie indiziert.
- Mehr zu Risiken einer Hochdosis-Statintherapie:
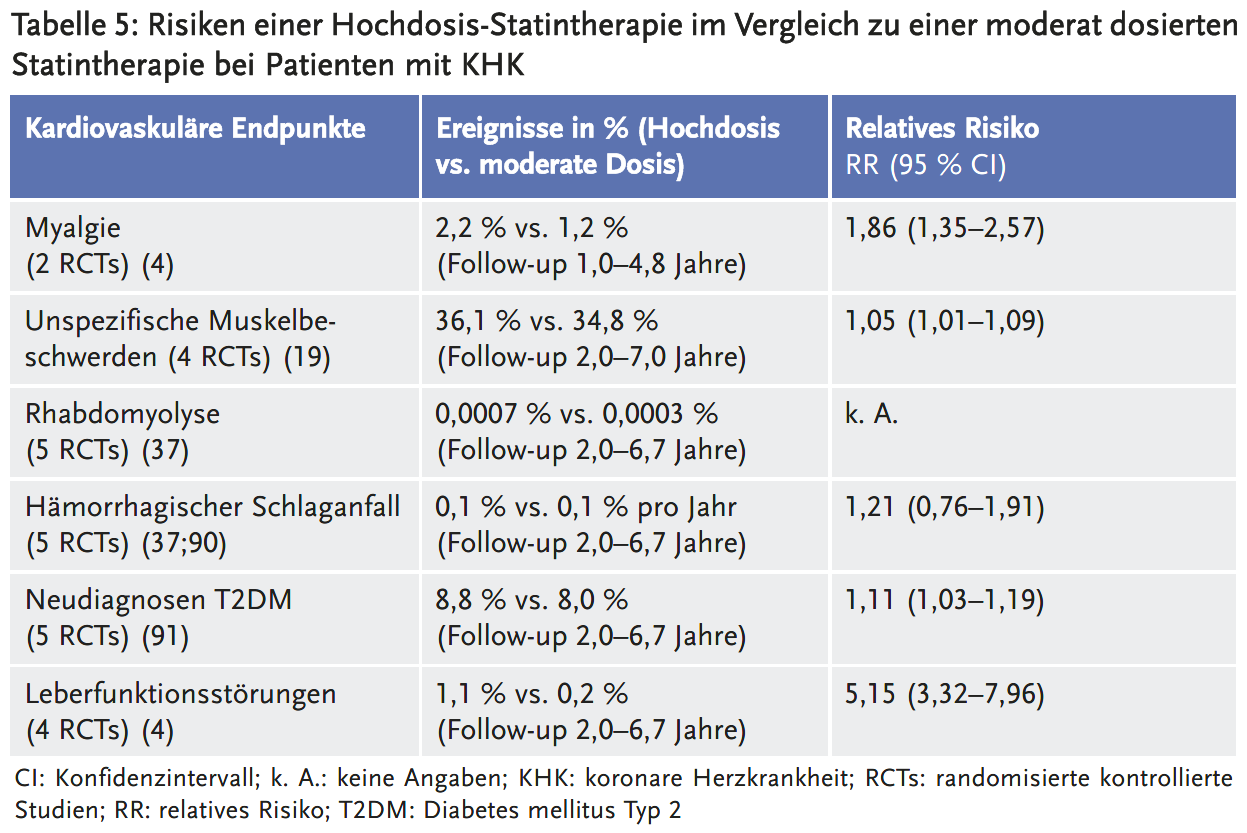
In der gepoolten Analyse von zwei doppelblinden RCTs (IDEAL (75), Schmermund et al. (89)) zeigte sich bei NICE ein signifikant erhöhtes Risiko für Muskelschmerzen unter einer Hochdosis- im Vergleich zu einer moderat dosierten Statintherapie (2,2 % vs. 1,2 %; RR 1,86; 95 % CI 1,35–2,57, NNH 100) (4). Die CTT (19) untersuchte auf Individualdatenbasis unspezifische Muskelbeschwerden (muskuläre oder muskuloskelettale Schmerzen, Gliederschmerzen, Muskelkrämpfe oder Muskelschwäche). Bei von NICE abweichender Studienauswahl (PROVE IT (74), TNT (76), A to Z (77) und SEARCH (78)) fand die CTT-Analyse ebenfalls eine signifikante Risikoerhöhung für Muskelbeschwerden (36,1 % vs. 34,8 %; RR 1,05; 95 % CI 1,01–1,09, NNH 76). Unter einer Hochdosistherapie bestand dabei im Unterschied zu einer moderat dosierten Statintherapie auch nach dem ersten Behandlungsjahr ein gering, aber signifikant erhöhtes Risiko für Muskelbeschwerden (21,8 % vs. 20,8 %; RR 1,06; 95 % CI 1,00–1,12) (56). Drei Einzelstudien gaben an, ob Muskelbeschwerden zu einem häufigeren Behandlungsabbruch führten: In zwei Einzelstudien (74;77) bestanden unter Atorvastatin 80 mg bzw. Simvastatin 80 mg ähnliche Abbruchraten wegen Muskelbeschwerden wie in der Kontrollgruppe, während in einer anderen Einzelstudie (75) die Hochdosistherapie mit Atorvastatin 80 mg signifikant häufiger aufgrund von Muskelbeschwerden abgesetzt wurde (2,2 % vs. 1,1 %).
Die Definitionen einer Rhabdomyolyse unterschieden sich in den Primärstudien. So wurden beispielsweise in der Studie TNT (76) auch CK-Erhöhungen > 10-fach ULN ohne Muskelbeschwerden als Rhabdomyolyse bezeichnet, während in der Studie SEARCH (78) für die Diagnose einer Rhabdomyolyse eine CK-Erhöhung > 40-fach ULN und Endorganschäden vorliegen mussten. Je nach zu Grunde gelegter Definition schwankt die Häufigkeit von Rhabdomyolysen unter einer Hochdosistherapie zwischen 12 und 19 pro 20.000 Patienten und unter einer niedriger dosierten Statintherapie zwischen vier und sechs pro 20.000 Patienten. Dies entspricht etwa vier zusätzlichen Rhabdomyolysen pro 10.000 Patienten unter einer Hochdosistherapie. Die deutlich höheren Angaben bei NICE (53 vs. 13 Fälle) sind anhand der Primärpublikationen nicht nachvollziehbar. Rhabdomyolysen traten vor allem unter Simvastatin 80 mg gehäuft auf. Auch CK-Erhöhungen > 10-fach ULN waren unter Simvastatin 80 mg stark gehäuft (53 vs. 2 Fälle in der Studie SEARCH) (78). Unter Atorvastatin 80 mg waren Rhabdomyolysen nicht häufiger als in der Kontrollgruppe.
Hämorrhagische Schlaganfälle waren numerisch geringfügig gehäuft unter der Hochdosistherapie (69/19829 vs. 57/19783) (37;90). In den eingeschlossenen Studien wurden Patienten mit manifester KHK untersucht, bei denen nur selten (5–8 %) zerebrovaskuläre Begleiterkrankungen vorlagen. Die Übertragbarkeit auf zerebrovaskulär vorerkrankte Patienten ist unklar.
Unter einer Hochdosistherapie wurde signifikant häufiger ein Diabetes mellitus neu diagnostiziert (RR 1,11; 95 % CI 1,03–1,19). Die Primärpublikationen machen keine Angaben zu den Diagnosekriterien. Die absolute Risikoerhöhung war mit 0,8 % über eine durchschnittliche Behandlungsdauer von knapp fünf Jahren gering (NNH 125) (91).
Leberfunktionsstörungen, definiert als Transaminasenanstieg ≥ 3-fach des oberen Normwertes, traten unter hochdosierten Statinen häufiger auf als unter einer moderaten Statintherapie (NNH 111). Klinisch relevante, schwerwiegende Leberfunktionsstörungen wurden nur sehr selten berichtet.
- Mehr zur zielwertgesteuerten Statintherapie:
Die Studien TST (Treat-stroke-to-target) (93) und HIJ-PROPER (94) sind offen durchgeführte RCTs mit einem PROBE-Design (Prospective Randomized Open, Blinded End-point Design), d. h. bei ihnen erfolgte keine Verblindung von Patienten und Studienärzten, aber eine verblindete Beurteilung der Endpunkte. Die ereignisgesteuerte Studie TST wurde ohne medizinische Begründung aufgrund unzureichender Finanzierung seitens des Sponsors vorzeitig beendet (nach 277 statt wie geplant nach 385 Ereignissen).
An der Studie TST nahmen Patienten mit kürzlich erlittenem ischämischem Insult (86 %) oder TIA (14 %) teil (n = 2860, Follow-up 3,5 Jahre). Die Randomisierung erfolgte im Median sechs Tage nach dem Indexereignis. Bei 17 % der Patienten war zusätzlich eine KHK bekannt. Die japanische Studie HIJ-PROPER schloss Patienten mit akutem Koronarereignis innerhalb von 72 Stunden nach ihrer stationären Aufnahme ein (n = 1734, Follow-up 3,9 Jahre). In beiden Studien lag der LDL-C-Wert bei Randomisierung im Mittel bei 135 mg/dl und sollte in der Interventionsgruppe auf < 70 mg/dl gesenkt werden. In den Kontrollgruppen wurden LDL-C-Werte von 90–110 mg/dl (93) bzw. von 90–100 mg/dl (94) angestrebt.
Zum Erreichen der LDL-C-Zielwerte konnten in der Studie TST alle Statine sowie Ezetimib eingesetzt werden. Im Studienverlauf erhielten im Interventionsarm mehr Patienten eine Hochdosis-Therapie oder eine Kombination mit Ezetimib als im Kontrollarm (Hochdosis: 24 % vs. 9 %, Ezetimib: 34 % vs. 6 %) (95). Es liegen keine Subgruppenanalysen zu Patienten vor, die eine alleinige Steigerung der Statindosis erhielten. In der Studie HIJ-Proper war als Statin lediglich Pitavastatin in einer Dosierung von 1–4 mg zur Titration erlaubt, die Interventionsgruppe erhielt zudem eine fixe Dosis von Ezetimib 10 mg. Die Pitavastatin-Dosis unterschied sich im Studienverlauf nicht relevant zwischen Interventions- und Kontrollgruppe (2 mg vs. 2,4 mg). Die Studie HIJ-Proper untersucht somit in erster Linie die Add-on-Gabe von Ezetimib bei moderat dosierter Statintherapie und weniger unterschiedlich titrierte Statintherapien.
In der Studie TST umfasste der primäre kombinierte Endpunkt zerebrale (nicht-fataler ischämischer Insult oder Insult unklarer Genese) und kardiovaskuläre Ereignisse (kardiovaskulärer Tod, nicht-fataler Myokardinfarkt, ungeplante koronare Revaskularisation). Die Interventionsgruppe (LDL-C-Zielwert < 70 mg/dl) erreichte den primäreren Endpunkt signifikant seltener als die Kontrollgruppe (LDL-C-Zielwert 90–110 mg/dl). Die absolute Risikoreduktion über 3,5 Jahre betrug 2,4 % (8,5 % vs. 10,9 %), entsprechend einer NNT von 42. Die Gesamtmortalität und die Einzelkomponenten des primären Endpunktes wurden nicht signifikant beeinflusst. Hämorrhagische Schlaganfälle und neudiagnostizierte Fälle von T2DM traten unter der Strategie, die niedrigere Zielwerte anstrebte, numerisch gehäuft auf. Die Ergebnissicherheit der Studie TST wird durch den vorzeitigen Studienabbruch bei gleichzeitig grenzwertiger Signifikanz (p = 0,04) des primären Endpunktes wesentlich gemindert.
Die Studie HIJ-Proper untersuchte einen ähnlichen kombinierten primären Endpunkt wie die Studie TST. Es bestand kein signifikanter Unterschied zwischen Interventions- und Kontrollgruppe (32,8 % vs. 36,9 %; HR 0,89; 95 % CI 0,76–1,04). Auch die Gesamtmortalität wurde nicht signifikant beeinflusst.
Aufgrund ihres Designs kann aus den Studien HIJ-PROPER und TST weder abgeleitet werden, ob eine zielwertgesteuerte Statintherapie einer festen Statindosis überlegen ist, noch ob eine intensivere Statintitration effektiver ist als eine weniger intensive Statintitration: Die Studien erreichten die niedrigeren LDL-C-Zielwerte der Interventionsgruppen teilweise (TST) (93) oder überwiegend (HIJ-PROPER) (94) durch die zusätzliche Gabe von Ezetimib. Für die inkonsistenten Ergebnisse der beiden Studien – signifikante Ergebnisse für den primären Endpunkt bei TST, nicht aber für einen ähnlichen primären Endpunkt bei HIJ-Proper – sind verschiedene Erklärungsansätze denkbar: Die positiven Studienergebnisse von TST könnten 1. bedingt sein durch die geringere LDL-C-Senkung in der Kontrollgruppe bzw. den konsekutiv größeren Behandlungsunterschied hinsichtlich der LDL-C Senkung zwischen den Studienarmen (TST: 31 mg/dl, HIJ-PROPER: 20 mg/dl), 2. auf der bei TST häufiger eingesetzten Hochdosis-Statintherapie beruhen oder 3. wesentlich durch den vorzeitigen Studienabbruch von TST beeinflusst sein.
- Klinische Überlegungen zur Auswahl des Statins
Als Hochdosis-Statine stehen Atorvastatin 40–80 mg, Rosuvastatin 20–40 mg und Simvastatin 80 mg zur Verfügung. Unter Simvastatin 80 mg besteht ein deutlich höheres Risiko für Muskelbeschwerden und Rhabdomyolysen als unter den beiden anderen Hochdosis-Statinen (66). Es gibt keine Daten aus randomisierten Studien, die hochdosiertes Rosuvastatin bei Patienten mit manifester atherosklerotischer kardiovaskulärer Erkrankung (ASCVD) untersuchen. Die beste Evidenz für Patienten mit KHK und das beste Nutzen-Risiko-Verhältnis für die Hochdosis-Statintherapie liegen somit für Atorvastatin 80 mg vor.
- Klinische Überlegungen zur Statinintoleranz (Sekundärprävention)
Statine – insbesondere hochdosierte Statine – erhöhen geringfügig das Risiko für Muskelbeschwerden, der weitaus überwiegende Anteil der Beschwerden hat aber andere Ursachen als die Statintherapie (siehe auch: Risiken einer Hochdosis-Statintherapie). Nach Ausschluss einer Muskelschädigung (Kreatinkinase > 5-fach des oberen Grenzwertes) ermöglichen eine Dosisreduktion und/oder ein Wechsel auf ein anderes Statin häufig die Fortführung der Statintherapie (siehe auch: Klinische Überlegungen zur Statinintoleranz (Primärprävention)). Sofern eine niedrige Statindosis vertragen wird, kann eine vorsichtige Dosissteigerung versucht werden, wobei der zu erwartende Benefit kritisch gegen das Risiko eines erneuten Behandlungsabbruchs aufgrund von Beschwerden unter einer Hochdosis abzuwägen ist. Aus Sicht der AkdÄ setzt die Diagnose einer „Statinintoleranz“ voraus, dass mindestens zwei verschiedene Statine auch in niedriger Dosierung nicht vertragen wurden.
1 Die 2023 publizierte südkoreanische Studie LODESTAR (92) verglich bei Patienten mit manifester koronarer Herzerkrankung eine Zielwertstrategie (LDL-C-Zielbereich 50–70 mg/dl) mit einer Hochdosis-Statintherapie. Neben Statinen wurde in beiden Studienarmen auch Ezetimib eingesetzt. Die Zielwertstrategie erwies sich innerhalb von drei Jahren hinsichtlich des primären kombinierten Endpunktes (Todesfälle, Herzinfarkte, Schlaganfälle, koronare Revaskularisationen) als nicht unterlegen. Bei der nächsten Überarbeitung des Leitfadens soll die Literaturrecherche systematisch aktualisiert werden. In diesem Rahmen ist auch eine kritische Wertung und Einordnung der Studie LODESTAR geplant.
Fazit für die Praxis
Statine in moderater Dosierung senkten bei Patientinnen und Patienten mit manifester KHK die Sterblichkeit und reduzierten das Risiko für Myokardinfarkte und Schlaganfälle (5). Es ist nicht belegt, dass eine zielwertgesteuerte Statintherapie wirksamer ist als eine feste Statindosis. Die Sterblichkeit unterschied sich nicht zwischen einer Hochdosistherapie und einer moderaten Statindosis. Eine Steigerung der Statindosis senkte geringfügig das Risiko für nichttödliche Myokardinfarkte: Um einen zusätzlichen Myokardinfarkt zu verhindern, mussten 100 Personen über fünf Jahre eine Hochdosistherapie statt einer moderaten Statindosis erhalten.
Diesem Nutzen steht ein erhöhtes Risiko für die Entwicklung eines Diabetes mellitus Typ 2 gegenüber (eine zusätzliche Neudiagnose bei 125 Personen). Zudem traten gehäuft Muskelbeschwerden und Leberfunktionsstörungen auf. Aus Sicht der AkdÄ sind Nutzen und Risiken einer Hochdosistherapie gemeinsam mit den Patientinnen und Patienten individuell abzuwägen. Ein Nutzen der Hochdosistherapie mit Statinen ist lediglich bei manifester KHK ohne begleitende Herzinsuffizienz oder fortgeschrittene Nierenfunktionsstörung gesichert. Für Patientinnen und Patienten mit anderen kardiovaskulären Erkrankungen – beispielsweise mit pAVK oder nach ischämischem Schlaganfall – liegen keine Daten aus randomisierten Studien für eine Steigerung der Statindosis vor.
Profitieren Patientinnen und Patienten mit KHK von der zusätzlichen Gabe von Ezetimib, wenn sie bereits Statine erhalten?
- Mehr zur Evidenzbasis:
Die randomisierte, doppelblinde Studie IMPROVE-IT (97) schloss von 2005 bis 2010 Patienten ein, bei denen ein akutes Koronarsyndrom (STEMI 29 %, NSTEMI 47 %, instabile AP 24 %) maximal zehn Tage zurück lag (n = 18144). Es nahmen überwiegend Männer teil (76 %). Das Durchschnittsalter lag bei 64 Jahren. Die Patienten erhielten zusätzlich zu einer Basistherapie mit Simvastatin 40 mg entweder Ezetimib 10 mg oder Placebo. Lag der LDL-C-Wert unter der Studienmedikation bei mehr als 79 mg/dl, erfolgte bis 2011 eine Dosissteigerung auf Simvastatin 80 mg. Ab 2011 wurde Simvastatin wieder auf 40 mg reduziert, sofern die höhere Dosis nicht schon länger als ein Jahr eingenommen wurde. In der Kontrollgruppe wurde Simvastatin deutlich häufiger erhöht als unter Ezetimib (27 % vs. 6 %). Der durchschnittliche LDL-C-Wert sank von 94 mg/dl auf 53 mg/dl in der Interventionsgruppe und auf 70 mg/dl in der Kontrollgruppe.
Zwei weitere RCTs verglichen eine Kombinationstherapie aus Simvastatin und Ezetimib gegen Placebo bei Patienten mit chronischer Nierenerkrankung (SHARP, n = 9279, Dauer 4,9 Jahre) (98) bzw. bei Patienten mit asymptomatischer Aortenstenose (SEAS, n = 1873, Dauer 4,3 Jahre) (99). Dieses Studiendesign ermöglicht es nicht, die Effektivität von Ezetimib als Monotherapie oder als Add-on-Therapie zu Statinen zu beurteilen.
2 Die 2022 publizierte südkoreanische Studie RACING (96) verglich bei Patienten mit manifester koronarer Herzerkrankung eine Hochdosis-Statintherapie mit einer Kombinationstherapie aus moderat dosiertem Statin plus Ezetimib. Die Kombinationstherapie mit Ezetimib erwies sich innerhalb von drei Jahren hinsichtlich des primären kombinierten Endpunktes (kardiovaskuläre Todesfälle, nichttödliche Schlaganfälle, koronare oder periphere Revaskularisationen und stationäre Aufnehmen wegen kardiovaskulärer Ereignisse) als nicht unterlegen. Bei der nächsten Überarbeitung des Leitfadens soll die Literaturrecherche systematisch aktualisiert werden. In diesem Rahmen ist auch eine kritische Wertung und Einordnung der Studie RACING geplant.
- Mehr zur Wirksamkeit von Ezetimib:
Der primäre kombinierte Endpunkt (Hospitalisierung wegen instabiler Angina, Myokardinfarkt, koronare Revaskularisation, Apoplex oder kardiovaskuläre Mortalität) trat unter Ezetimib signifikant seltener auf als unter Placebo. Die absolute Risikoreduktion war mit 2,0 % über eine Beobachtungsdauer von sieben Jahren gering. Der Effekt beruhte vor allem auf einer Reduktion nichttödlicher Myokardinfarkte (ARR 1,6 % über sieben Jahre, NNT 63), zu denen auch isolierte Enzymanstiege nach koronaren Revaskularisationen zählten. Diese isolierten Enzymanstiege gelten nach aktueller Definition als Infarkte, besitzen prognostisch jedoch eine geringe Relevanz. Es ist unklar, welchen prozentualen Anteil die isolierten Enzymanstiege an der Gesamtzahl der Myokardinfarkte ausmachten. Die zusätzliche Gabe von Ezetimib hatte keinen Einfluss auf die Gesamtmortalität oder die kardiovaskuläre Mortalität (97).
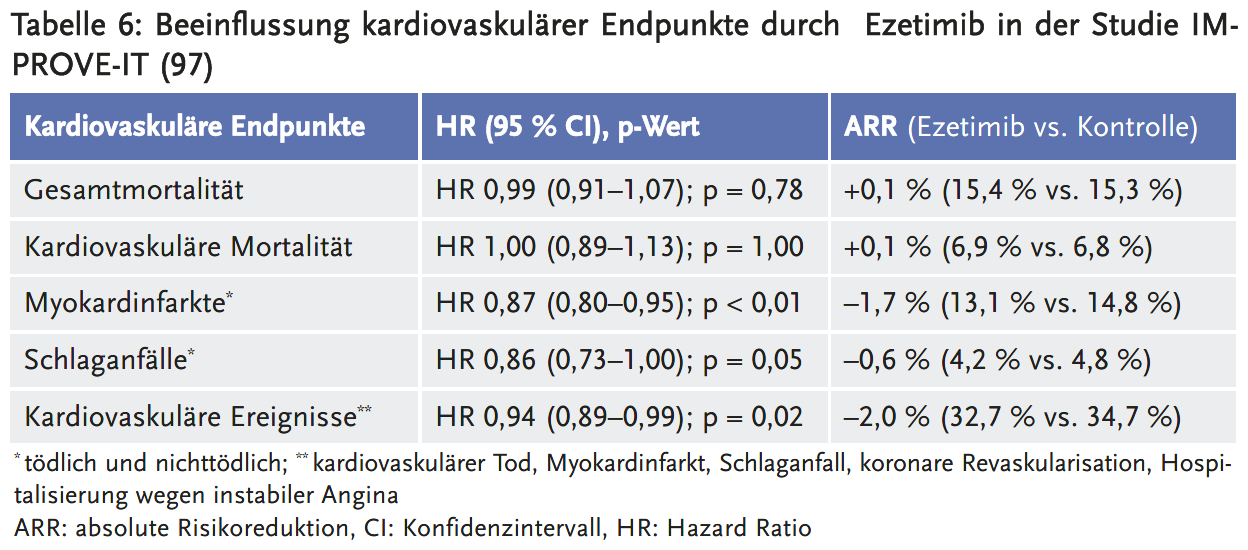
- Mehr zu Subgruppenanalysen der Studie IMPROVE-IT:
In Subgruppenanalysen (100) waren ein Alter ≥ 75 Jahre und ein anamnestisch bekannter Diabetes mellitus signifikante Effektmodifikatoren für den primären Endpunkt. Diese methodisch als belastbar zu bewertende Subgruppenergebnisse zeigten einen Effekt nur bei Patienten im Alter ≥ 75 Jahre oder mit bekanntem Diabetes, der gegenüber den Ergebnissen für das Gesamtkollektiv vergleichsweise deutlich ausfiel (siehe Tabelle 7).
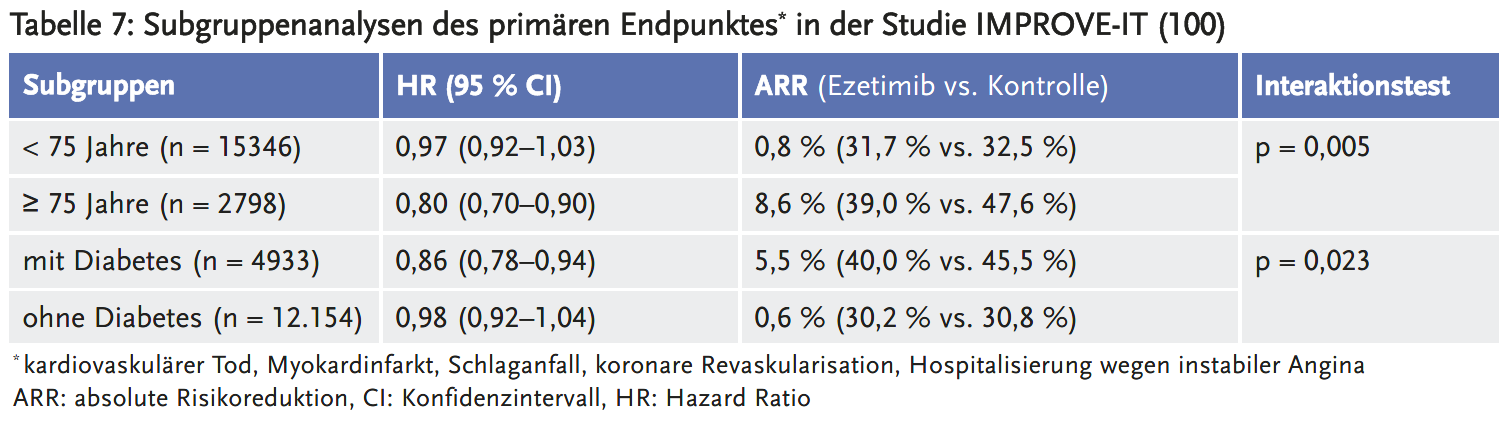
- Mehr zu Risiken von Ezetimib:
Sowohl unter Ezetimib als auch unter Placebo wurde die Studienmedikation häufig abgebrochen (42 %). Die Abbruchraten aufgrund unerwünschter Ereignisse unterschieden sich nicht zwischen den Studienarmen. Auch Leberwerterhöhungen und Myopathien traten im Ezetimib-Arm nicht gehäuft auf. Allerdings wurde Simvastatin in der Kontrollgruppe häufiger auf 80 mg erhöht als in der Interventionsgruppe (27 % vs. 6 %) (97). Unter einer Hochdosistherapie mit Statinen besteht ein erhöhtes Risiko für Leberfunktionsstörungen und Muskelbeschwerden im Vergleich zu einer moderaten Statindosis (4) (siehe auch: Risiken einer Hochdosis-Statintherapie). Dies gilt insbesondere für Simvastatin. Eine Simvastatindosis von 80 mg wird deshalb nur noch in Ausnahmenfällen empfohlen (66). Es ist anzunehmen, dass in der Kontrollgruppe aufgrund der häufigeren Gabe von Simvastatin 80 mg die Rate an Muskelbeschwerden und Leberwerterhöhungen höher lag als bei üblichen Simvastatin-Dosierungen. Deshalb kann nicht ausgeschlossen werden, dass durch die unterschiedlichen Dosierungen von Simvastatin eine unter Ezetimib erhöhte Rate an unerwünschten Ereignissen nicht sichtbar wurde.
Fazit für die Praxis
Bei Patientinnen und Patienten mit akutem Koronarsyndrom senkte Ezetimib, zusätzlich zu einer moderaten Statindosis gegeben, die Häufigkeit von nichttödlichen Herzinfarkten. Der Effekt war jedoch gering (absolute Risikoreduktion von 1,6 % über eine Behandlungsdauer von sieben Jahren). Am ehesten und deutlichsten profitieren ältere Menschen (≥ 75 Jahre) und Personen mit Diabetes. Die Sterblichkeit wurde nicht beeinflusst.
Es liegen keine Daten dazu vor, ob Patientinnen und Patienten mit einer Statinhochdosis von einer zusätzlichen Ezetimib-Gabe profitieren. Auch der Nutzen von Ezetimib als Monotherapie, beispielsweise bei Statinunverträglichkeit, lässt sich mangels Daten nicht beurteilen.
Profitieren Patientinnen und Patienten mit kardiovaskulärer Erkrankung von PCSK9-Hemmern 1.) zusätzlich zu einer maximal verträglichen Statintherapie und 2.) zusätzlich zu einer maximal verträglichen Statintherapie in Kombination mit Ezetimib?
- Mehr zur Evidenzbasis:
An der Studie ODYSEEY OUTCOMES (101) nahmen nur Patienten nach akutem Koronarsyndrom teil (n = 18.924, Dauer 2,8 Jahre). Die Studie FOURIER (102) schloss überwiegend (80 %) Patienten nach Myokardinfarkt ein, untersuchte aber auch Patienten nach ischämischem Schlaganfall und mit pAVK (n = 27.564, Dauer 2,2 Jahre). Das Indexereignis lag in der Studie FOURIER länger zurück als in der Studie ODYSSEY OUTCOMES (median drei Jahre vs. drei Monate vor Randomisierung). In beiden Studien waren die meisten Patienten männlich (75 %) und durchschnittlich etwa 60 Jahre alt. Der LDL-C-Wert lag in beiden Studien zu Beginn im Median bei 92 mg/dl.
In beiden RCTs erhielten nahezu alle Patienten eine Statintherapie in mindestens moderater Dosis. Eine Hochdosistherapie erfolgte in der Studie ODYSSEY OUTCOMES häufiger als in der Studie FOURIER (89 % vs. 70 %). Aufgrund der geringen Anzahl statinintoleranter Patienten (nur in der Studie ODYSSEY OUTCOMES, n = 460) lässt sich die Effektivität von PCSK9-Hemmern bei Statinintoleranz nicht beurteilen. Nur selten wurde zusätzlich zu Statinen Ezetimib gegeben (FOURIER: 5 %, ODYSSEY OUTCOMES: 3 %).
Zwei Studien prüften als primären Endpunkt die kognitive Funktion von Patienten unter PCSK9-Hemmern: EBBINGHAUS (103), eine Substudie zu FOURIER (Evolocumab, n = 1204, Dauer 19 Monate), und eine eigenständige Studie von Janik et al. (104) (Alirocumab, n = 2086, Dauer 24 Monate). Beide Studien maßen die kognitive Funktion mittels CANTAB (Cambridge Neuropsychological Test Automated Battery). Patienten mit vorbestehenden kognitiven Einschränkungen, z. B. einer beginnenden Demenz, waren von der Teilnahme ausgeschlossen.
- Mehr zur Wirksamkeit von PCSK9-Hemmern:
Unter beiden PCSK9-Hemmern traten weniger Myokardinfarkte und ischämische Schlaganfälle auf. Das Ausmaß des Effekts ist mit 1,2 % (FOURIER (102)) bzw. 1,0 % (ODYSSEY OUTCOMES (101)) bei Myokardinfarkten und 0,4 % bei Schlaganfällen gering. In der Studie FOURIER unterschieden sich die kardiovaskuläre Mortalität und Gesamtmortalität zwischen den Studienarmen nicht, in der Studie ODYSSEY OUTCOMES waren die kardiovaskuläre Mortalität und Gesamtmortalität unter PCSK9-Hermmen rein numerisch geringfügig niedriger (0,6 % bzw. 0,4 %).
Eine statistisch signifikante Reduktion ist nur für Myokardinfarkte und ischämische Schlaganfälle in der Studie FOURIER nachgewiesen. In der Studie ODYSSEY OUTCOMES war keine statistisch valide Beurteilung der meisten kardiovaskulären Einzelendpunkte möglich: Im hierarchischen Analyseplan der Studie ODYSSEY OUTCOMES lag der Endpunkt „Tod durch KHK“ vor der statistischen Prüfung der Endpunkte Myokardinfarkt, ischämische Schlaganfälle, kardiovaskuläre Mortalität und Gesamtmortalität. Für multiples Testen war nicht adjustiert worden. Da in beiden Studienarmen ähnlich viele Patienten an KHK verstarben (2,2 % vs. 2,3 %), können das Konfidenzintervall und der p-Wert der nachfolgenden Endpunkte in der Studie ODYSSEY OUTCOMES nicht valide analysiert werden.
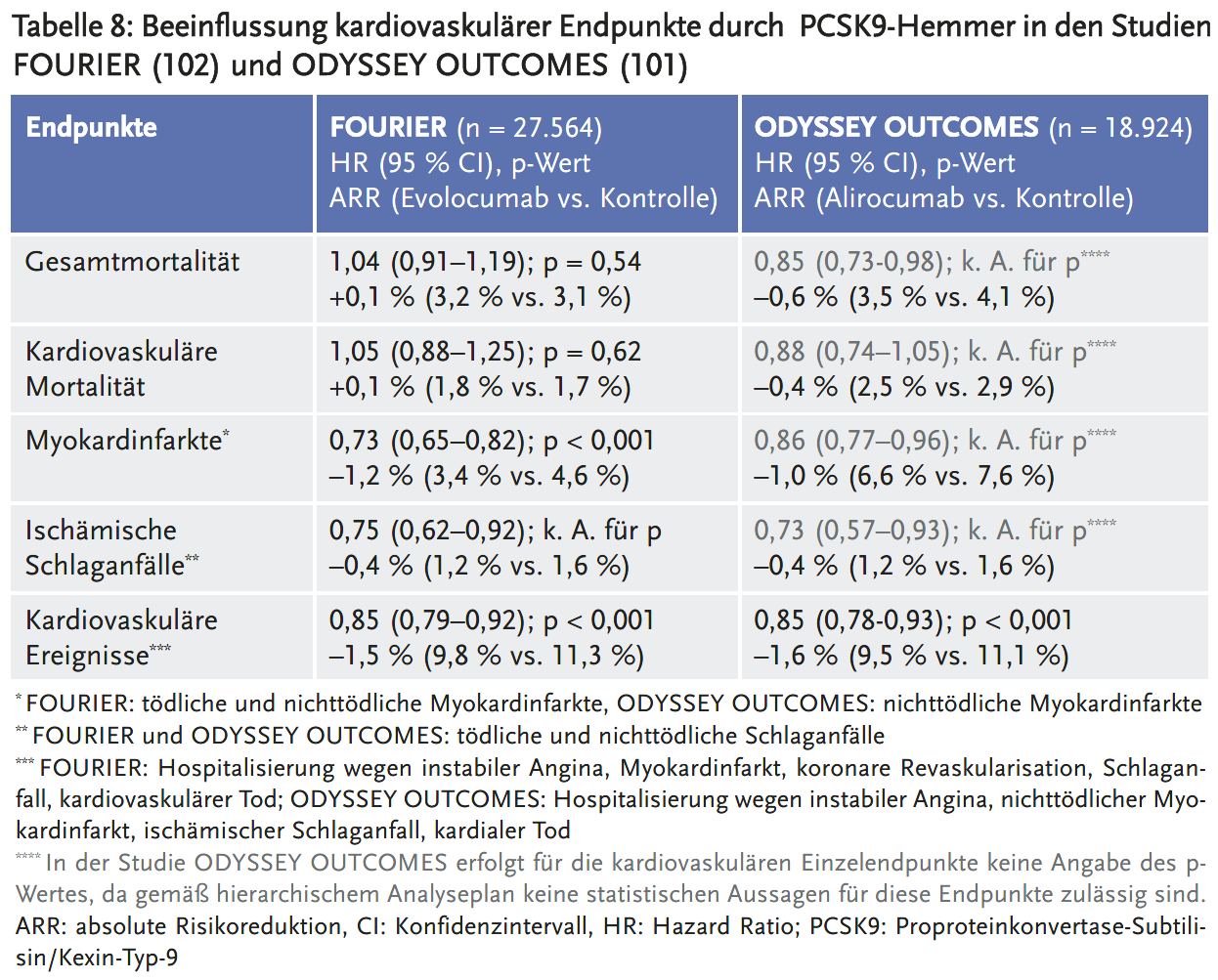
- Mehr zu Subgruppenanalysen der Studien FOURIER und ODYSSEY-OUTCOMES:
Die Effektivität von Evolocumab in der stratifizierten Subgruppe europäischer Patienten (63 % der Gesamtpopulation) ist unsicher: Der primäre Endpunkt wurde in Europa nur grenzwertig signifikant (HR 0,91; 95 % CI 0,83–1,00), der wichtigste und weniger für Verzerrungen anfällige sekundäre Endpunkt (kardiovaskulärer Tod, Myokardinfarkt und Schlaganfall) nicht signifikant beeinflusst (HR 0,90; 95 % CI 0,80–1,01). Die regionalen Unterschiede waren bezüglich des sekundären Endpunktes signifikant (p für Interaktion: 0,012) (105). In der ODYSSEY-Studie liegen keine Subgruppenanalysen zu Gesamteuropa vor. In der Subgruppe westeuropäischer Patienten (n = 4175) bestand – bei allerdings negativen Interaktionstests – keine signifikante Effektivität von Alirocumab (HR 0,90; 95 % CI 0,74–1,09) und numerisch eine Tendenz zur höheren Gesamtmortalität (HR 1,21; 95 % CI 0,79–1,86) (106).
In der Studie ODYSSEY OUTCOMES weisen Subgruppenanalysen darauf hin, dass nur Patienten mit einem LDL-C-Ausgangswert ≥ 100 mg/dl von Alirocumab profitierten. Der Interaktionstest war sowohl für die Gesamtzahl kardiovaskulärer Ereignisse als auch für schwere kardiovaskuläre Ereignisse und für die kardiovaskuläre Mortalität signifikant. Auffällig ist insbesondere ein gegensätzlich gerichteter Effektschätzer bezüglich der kardiovaskulären Mortalität (LDL-C < 100 mg vs. ≥ 100 mg/dl: HR 1,03 vs. 0,70) (107). Für die Studie FOURIER liegen Subgruppenanalysen zum LDL-C-Ausgangswert nur mit einer Einteilung in Quartilen und in die Gruppen < 85 mg/dl vs. ≥ 85 mg/dl vor. Bei dieser Einteilung finden sich keine positiven Interaktionstests (105;108).
Die Effektivität von Alirocumab und Evolocumab scheint nicht beeinflusst zu sein von der Intensität der begleitenden Statintherapie (105;106). Subgruppenanalysen zu Patienten, die als lipidsenkende Begleittherapie sowohl Ezetimib als auch Statine erhielten, liegen nur für die Studie FOURIER vor. Die relative und absolute Risikoreduktion durch Evolocumab war bei gleichzeitiger Gabe von Ezetimib geringer als in der Gesamtpopulation (primärer Endpunkt: ARR 0,2 %; HR 0,98; 95 % CI 0,74–1,31), die Effektmodifikation war jedoch nicht signifikant. Eine sichere Beurteilung von PCSK9-Hemmern als Add-on-Therapie zu Statinen und Ezetimib ist aufgrund der kleinen Patientenzahl (n = 1440) nicht möglich (105).
- Mehr zu Risiken von PCSK9-Hemmern:
In den Studien FOURIER (102) und ODYSSEY OUTCOMES (101) war die Gesamtzahl unerwünschter Ereignisse unter PCSK9-Hemmern nicht erhöht. Es gibt keine Hinweise auf gehäufte Neudiagnosen von Diabetes mellitus oder Leberwerterhöhungen.
In beiden Studien traten Injektionsreaktionen unter PCSK9-Hemmern häufiger auf als unter Placebo (FOURIER: 2,1 % vs. 1,6 %; ODYSSEY OUTCOMES: 3,8 % vs. 2,1 %). Die Injektionsreaktionen verliefen überwiegend mild. In der Studie FOURIER brachen in beiden Armen 0,1 % der Patienten die Studienmedikation aufgrund von Injektionsreaktionen ab. In der Studie ODYSSEY OUTCOMES führten Injektionsreaktionen unter Alirocumab selten, aber vermehrt zum Abbruch (0,3 % vs. 0,03 %).
In der Studie ODYSSEY LONGTERM klagten signifikant mehr Patienten unter Alirocumab über Muskelschmerzen (5,4 % vs. 2,9 %, p = 0,006) (109). In der Studie ODYSSEY OUTCOMES traten Muskel-, Gelenk- oder Skelettschmerzen unter Alirocumab jedoch nicht vermehrt auf (110). Auch unter Evolocumab wurde in der Studie FOURIER nicht gehäuft über Muskelschmerzen berichtet.
Die bei der Studie ODYSSEY LONGTERM aufgetretene numerische Häufung neurokognitiver Störungen (1,2 % vs. 0,5 %) bestätigte sich nicht in den Studien FOURIER und ODYSSEY OUTCOMES. Die Substudie EBBINGHAUS (103) und die separate Studie von Janik et al. (104) untersuchten als primären Endpunkt die Funktion des visuell-räumlichen Arbeitsgedächtnisses, operationalisiert mittels „Strategy Index“ im CANTAB (Cambridge Neuropsychological Test Automated Battery). Der erreichte Score unterschied sich im Gesamtkollektiv der beiden Studien nicht zwischen Interventions- und Kontrollarm. In der Studie EBBINGHAUS bestand jedoch ein signifikanter Unterschied der Wirkung von Evolocumab je nach LDL-C-Ausgangswert: Evolocumab beeinflusste bei Patienten mit einem Ausgangs-LDL-C < 85 mg/dl den primären Endpunkt negativ, bei einem Ausgangs-LDL-C ≥ 85 mg/dl positiv (p für Interaktion = 0,01). Eine ähnliche, allerdings nicht signifikante Effektmodifikation bestand bei den sekundären Endpunkten „Global Composite Score“ und „Between Errors“ (111). Für die Studie von Jannik et al. liegen keine Subgruppenanalysen nach LDL-C-Ausgangswert vor. Nach Einschätzung der AkdÄ sind die Studiendauern mit 19 Monaten (EBBINGHAUS) bzw. 24 Monaten (Janik et al.) zu kurz, um unerwünschte kognitive Ereignisse durch eine langjährige LDL-C-Senkung mit PCSK9-Hemmern sicher auszuschließen.
Fazit für die Praxis
Bei Patientinnen und Patienten mit symptomatischen kardiovaskulären Erkrankungen, die Statine in moderater oder hoher Dosis erhalten, senkte die zusätzliche Gabe von PCSK9-Hemmern die Häufigkeit von Myokardinfarkten und ischämischen Schlaganfällen. Der Effekt war gering (Reduktion von Myokardinfarkten um absolut 1,0–1,2 % und von ischämischen Schlaganfällen um absolut 0,4 % über eine Behandlungsdauer von etwa 2,5 Jahren). Die meisten Daten liegen für Patientinnen und Patienten nach akutem Koronarsyndrom vor. Es gibt Hinweise, dass Menschen in Europa und Personen mit einem LDL-C-Ausgangswert < 100 mg/dl weniger von PCSK9-Hemmern profitieren. Die bisherigen Studien belegen nicht, dass PCSK9-Hemmer die Gesamtsterblichkeit oder die kardiovaskuläre Sterblichkeit verringern.
Es liegen keine ausreichenden Daten vor, um die Wirksamkeit von PCSK9-Hemmern bei Statinintoleranz oder bei einer vorbestehenden Kombinationstherapie aus Ezetimib und Statinen zu beurteilen.
Profitieren Patientinnen und Patienten mit kardiovaskulärer Erkrankung von Bempedoinsäure, wenn sie bereits eine maximal verträgliche Statintherapie erhalten?
- Mehr zur Evidenzbasis:
Die randomisierte, doppelblinde Studie CLEAR Outcomes (15) (n = 13.970, Dauer 3,4 Jahre) verglich die einmal tägliche Gabe von Bempedoinsäure 180 mg mit Placebo. Die Studie schloss Patienten ein, die keine Statine oder nur Statine in sehr niedriger Dosis (z. B. weniger als 10 mg Atorvastatin oder Simvastatin) einnahmen, weil sie anamnestisch mindestens ein Statin nicht vertragen hatten. Hierfür reichte eine von den Patienten selbst berichtete Unverträglichkeit eines ersten Statins jeglicher Dosis bei fehlender Bereitschaft, ein zweites auszuprobieren. Bei etwa jedem fünftem Patienten war nach Unverträglichkeit des ersten Statins kein Therapieversuch mit einem zweiten Statin unternommen worden (112). Es ist unklar, ob bei allen Patienten eine Dosisreduktion auf eine niedrigere Dosis versucht worden war. Entsprechend dem Studienprotokoll von CLEAR Outcomes (113) galt die untersuchte Patientengruppe als „statinintolerant“. Diese sehr weitgefasste Definition der Statinintoleranz entspricht nicht der üblichen Verwendung des Begriffs (siehe auch: Klinische Überlegungen zur Statintintoleranz (Primärprävention)).
Die Studie CLEAR Outcomes untersuchte sowohl Patienten mit hohem kardiovaskulärem Risiko (30 %) als auch mit manifester kardiovaskulärer Vorerkrankung (insgesamt 70 %, dabei 51 % KHK, 12 % pAVK, 15 % ischämischer Schlaganfall oder hochgradige Carotisstenose). Akute Koronarereignisse mussten mindestens drei Monate zurückliegen. Patienten mit erhöhten Leberwerten (ALT oder AST ≥ 2 ULN) oder einer eGFR < 30 ml/min/1,73 m² konnten an der Studie nicht teilnehmen. Männer und Frauen wurden annähernd gleich häufig eingeschlossen. Das Durchschnittsalter betrug 66 Jahre. Bei Studienbeginn lag der LDL-C-Wert im Mittel bei 139 mg/dl. Knapp ein Viertel der eingeschlossenen Patienten erhielt Statine in sehr niedriger Dosis. Obgleich andere lipidsenkende Therapien laut Studienprotokoll erlaubt waren, wurden Ezetimib (12 %) und Fibrate (5 %) nur selten und PCSK9-Hemmer fast überhaupt nicht (0,6 %) eingesetzt. Im Studienverlauf erfolgte eine Intensivierung der lipidsenkenden Begleittherapie in der Kontrollgruppe häufiger als unter Bempedoinsäure (16 % vs. 9 %). Es liegen keine Angaben dazu vor, welche Lipidsenker hierfür eingesetzt wurden.
Für die Kombinationstherapie von Bempedoinsäure mit moderat- bis hochdosierten Statinen liegen nur Daten aus deutlich kleineren Studien vor, die als primären Endpunkt die LDL-C-Senkung prüften. Zwei randomisierte, placebokontrollierte Studien (CLEAR Wisdom, n = 779 (114) und CLEAR Harmony, n = 2230 (115)) untersuchten Bempedoinsäure bei Patienten mit manifester kardiovaskulärer Erkrankung, deren LDL-C-Wert trotz maximal verträglicher Statintherapie bei > 70 mg/dl lag. Die Mehrzahl der Patienten erhielt eine moderat- bis hochdosierte Statintherapie (CLEAR Wisdom: 85 %, CLEAR Harmony: 94 %). Die Studiendauer betrug jeweils 52 Wochen. Ein weiterer RCT (116) verglich in vier Studienarmen Bempedoinsäure mit Ezetemib, mit der Fixkombination aus Bempedoinsäure und Ezetimib sowie mit Placebo (12 Wochen, n = 301). Die eingeschlossenen Patienten wiesen ein hohes kardiovaskuläres Risiko, aber keine manifeste Erkrankung auf. Auch hier sollte zusätzlich eine maximal verträgliche Statintherapie erfolgen.
- Mehr zur LDL-C-Senkung durch Bempedoinsäure:
In den Studien CLEAR Harmony (115) und CLEAR Wisdom (114) senkte Bempedoinsäure als Add-on-Therapie zu Statinen das LDL-C nach zwölf Wochen um etwa 16 %. Dies entspricht wahrscheinlich einer geringeren LDL-C senkenden Wirkung als durch Ezetimib (116). Bei Patienten ohne Statintherapie oder mit niedrig dosierten Statinen zeigte sich eine stärkere LDL-C senkende Wirkung von Bempedoinsäure: In der Studie CLEAR Outcomes (15) wurde das LDL-C um etwa 22 % reduziert. In Subgruppenanalysen der Studien CLEAR Serenity (117) und CLEAR Tranquility (118) war die LDL-C senkende Wirkung von Bempedoinsäure signifikant stärker ausgeprägt bei Patienten ohne jegliche Statintherapie als bei Patienten mit niedrig bis sehr niedrig dosierten Statinen (–27 % vs. –10 %, p für Interaktion: 0,032) (119). Die europäische Arzneimittelagentur geht davon aus, dass bei begleitender Statintherapie die LDL-C senkende Wirkung von Bempedoinsäure abgeschwächt ist, weil die beiden Wirkstoffe auf ähnliche Weise die Cholesterinbildung hemmen (119).
- Mehr zur Wirksamkeit von Bempedoinsäure:
Bempedoinsäure hatte in der Studie CLEAR Outcomes (15) bei Patienten, die keine Statine oder nur Statine in sehr niedriger Dosis einnahmen, keinen Einfluss auf die Gesamtmortalität oder die kardiovaskuläre Mortalität. Kardiovaskuläre Ereignisse (kardiovaskulärer Tod, nicht-tödlicher Myokardinfarkt, nichttödlicher Schlaganfall, koronare Revaskularisation) traten unter Bempedoinsäure signifikant seltener auf. Die absolute Risikoreduktion war mit 1,6 % über 3,4 Jahre gering (NNT 63). Bempedoinsäure beeinflusste in erster Linie die Häufigkeit von Revaskularisationen und nichttödlichen Herzinfarkten. Die Gesamtzahl an Schlaganfällen (ischämisch oder hämorrhagisch) war unter Bempedoinsäure nicht signifikant reduziert. (siehe Tabelle 9) Hämorrhagische Schlaganfälle traten selten, jedoch signifikant gehäuft unter Bempedoinsäure auf (0,3 % vs. 0,1 %; HR 2,21; 95 % CI 1,01–4,85) (112).
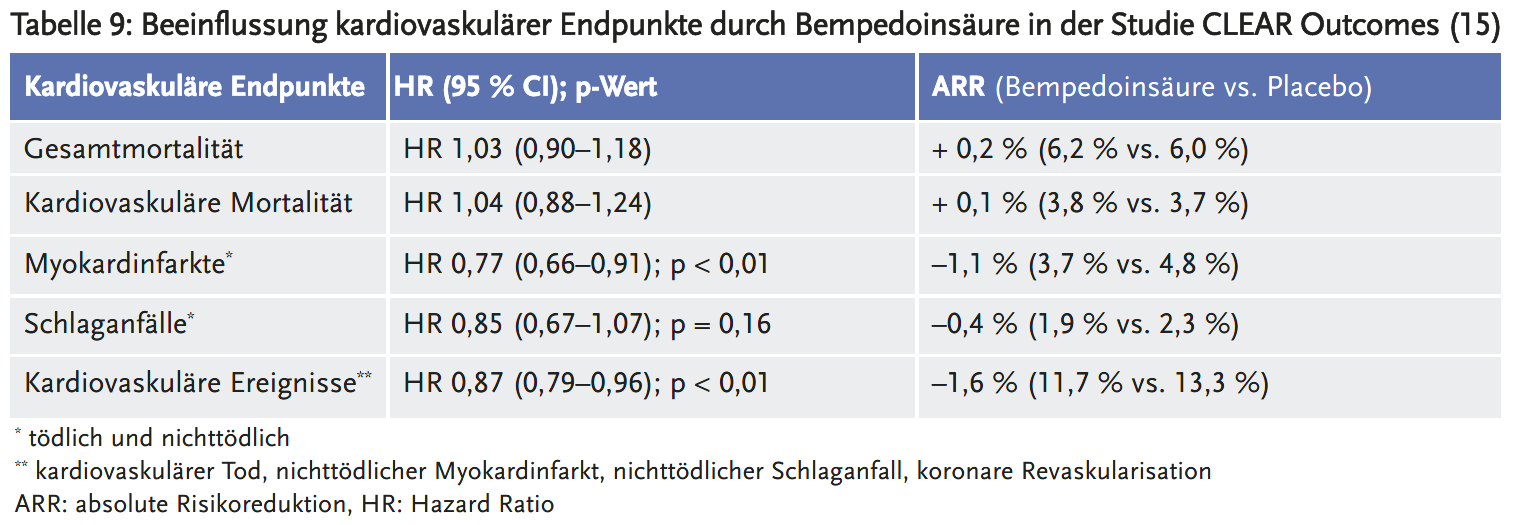
In einer präspezifizierten Subgruppenanalyse zeigte sich eine signifikant geringere Wirksamkeit von Bempedoinsäure bei Patienten mit kardiovaskulärer Vorerkrankung im Vergleich zu Patienten der Primärprävention (p für Interaktion: 0,03): Bei kardiovaskulär vorerkrankten Patienten hatte Bempedoinsäure keinen signifikanten Einfluss auf erneute Gefäßereignisse (14,5 % vs. 15,7 %; HR 0,91; 95 % CI 0,82–1,01). Es liegen keine Informationen dazu vor, ob die verringerte Wirksamkeit alle Patientengruppen – Patienten mit KHK, pAVK und zerebrovaskulären Erkrankungen – gleichermaßen betraf. Nicht signifikante Effektmodifikationen zeigten sich außerdem bezüglich des BMI (p für Interaktion: 0,06) und der Region (p für Interaktion im Gruppenvergleich von 5 Regionen: 0,17). In Subgruppenanalysen profitierten nur Patienten mit einem BMI ≥ 30 kg/m² und Patienten außerhalb von Europa. In Osteuropa hatte Bempedoinsäure nahezu keinen Einfluss auf die Krankheitslast (HR 0,96; 95 % CI 0,82–1,11), in Westeuropa bestand sogar ein numerisch erhöhtes Risiko für kardiovaskuläre Ereignisse unter Bempedoinsäure (HR 1,04; 95 % CI 0,81–1,34). Um diese Effektmodifikation besser einordnen zu können, wäre aus Sicht der AkdÄ ein Vergleich zwischen Westeuropa oder Gesamteuropa und dem Rest der Welt erforderlich. Für die Subgruppenanalyse mit vs. ohne gleichzeitige Ezetimib-Behandlung wurde kein p-Wert für die Interaktion angegeben. Als Add-on zu Ezetimib scheint der Effekt von Bempedoinsäure auf kardiovaskuläre Endpunkte minimal zu sein (Bempedoinsäure vs. Placebo: 15,8 % vs. 16,6 %; HR 0,94; 95 % CI 0,74–1,20).
Es gibt keine ausreichenden Studiendaten zur Kombinationstherapie von Bempedoinsäure mit Statinen in moderater bis hoher Dosierung, da die Studien CLEAR Harmony (115) und CLEAR Wisdom (114) nicht ausreichend gepowert sind, um signifikante Unterschiede bezüglich der Mortalität oder Morbidität nachweisen zu können. In der gepoolten Analyse der Studien CLEAR Harmony und CLEAR Wisdom waren die Gesamtmortalität und die kardiovaskuläre Mortalität unter Bempedoinsäure nicht gesenkt, sondern numerisch sogar erhöht (Gesamtmortalität: 1,0 % vs. 0,4 %; RR 1,38; 95 % CI 0,47–4,03; kardiovaskuläre Mortalität: 0,5 % vs. 0,3 %; RR 1,17; 95 % CI 0,35–3,88). Nichttödliche Herzinfarkte wurden grenzwertig signifikant reduziert (1,2 % vs. 2,2 %; RR 0,56; 95 % CI 0,32–1,00) (119).
- Mehr zu Risiken von Bempedoinsäure:
In der Studie CLEAR Outcomes (15) war Bempedoinsäure bei Patienten, die keine Statine oder nur Statine in sehr niedriger Dosis einnahmen, überwiegend gut verträglich. Schwerwiegende unerwünschte Ereignisse traten unter Bempedoinsäure nicht gehäuft auf. Auch Studienabbrüche aufgrund unerwünschter Ereignisse waren in beiden Studienarmen gleich häufig. Die Anzahl neudiagnostizierter Fälle von Diabetes mellitus war unter Bempedoinsäure nicht erhöht. Unter Bempedoinsäure bestand jedoch eine signifikante Häufung von renalen Ereignissen, Gicht und Gallensteinen (siehe Tabelle 10). Entsprechend zeigte sich im Labor häufiger eine Hyperurikämie (10,9 % vs. 5,6 %) und ein stärkerer Anstieg des Kreatinin-Werts (nach 6 Monaten: 0,05 mg/dl vs. 0,01 mg/dl). Außerdem bestand eine Häufung von Transaminasenerhöhungen > 3 x ULN. Es ist unklar, wie viele Patienten klinisch relevante, symptomatische Leber- oder Nierenfunktionsstörungen entwickelten. In den Studien CLEAR Serenity (117) und CLEAR Tranquility (118) (zusammen n = 613) war eine Häufung von Anämien aufgefallen (0,7 % vs. 0 %), die ebenfalls in den gepoolten Daten aus CLEAR Harmony (115) und CLEAR Wisdom (114) bestand (119) (siehe Tabelle 10). In der Publikation der Studie CLEAR Outcomes finden sich keine Angaben zu neu aufgetretenen Anämien bzw. Veränderungen des Hämoglobin-Werts.
Es liegen deutlich weniger Studiendaten zur Kombinationstherapie von Bempedoinsäure mit Statinen in moderater bis hoher Dosierung vor. Insgesamt entspricht das Nebenwirkungsspektrum in dieser Indikation der Gabe von Bempedoinsäure bei Statinintoleranz. Allerdings scheint die Kombinationstherapie vermehrt zu muskulären Beschwerden zu führen. Außerdem war die Abbruchrate unter der Kombinationstherapie höher als unter einer Statinmonotherapie (119) (siehe Tabelle 10). Pharmakokinetische Studien zeigten, dass Bempedoinsäure die Statinexposition erhöht. Nach Einschätzung der europäischen Arzneimittelagentur ist die erhöhte Statinexposition wahrscheinlich der Hauptgrund für die erhöhte Inzidenz von Muskelerkrankungen, die in der Kombination von Bempedoinsäure mit Statinen beobachtet wurde (119). Da Bempedoinsäure die Exposition von Simvastatin besonders stark erhöht, sollte die Simvastatindosis im Allgemeinen nicht mehr als 20 mg/Tag, in Ausnahmefällen maximal 40 mg/ Tag betragen (120).

Fazit für die Praxis
Bempedoinsäure reduzierte bei Menschen mit hohem kardiovaskulärem Risiko, die keine andere lipidsenkende Therapie erhielten, geringfügig das Risiko für Myokardinfarkte: Erhielten 91 Personen mit hohem kardiovaskulärem Risiko über durchschnittlich 3,4 Jahre Bempedoinsäure, so wurde ein Myokardinfarkt verhindert. Im Unterschied zu Statinen senkte Bempedoinsäure nicht die Sterblichkeit und beeinflusste nicht signifikant das Risiko für Schlaganfälle. Unter Bempedoinsäure bestand ein erhöhtes Risiko für Gicht, Gallensteine und renale Ereignisse, bei gleichzeitiger Statintherapie auch für muskuläre Beschwerden.
Aufgrund fehlender Studiendaten ist es unklar, ob Bempedoinsäure kardiovaskuläre Ereignisse verhindert, wenn es zusätzlich zu mindestens niedrig dosierten Statinen oder zusätzlich zu Ezetimib gegeben wird.
Bei Muskelbeschwerden unter Statinen sollte darüber aufgeklärt werden, welches Nutzen-Risiko-Verhältnis unter Bempedoinsäure zu erwarten ist im Vergleich zu einem erneuten Therapieversuch mit (niedrig dosierten) Statinen. Aus Sicht der AkdÄ setzt die Diagnose einer „Statinintoleranz“ voraus, dass mindestens zwei verschiedene Statine auch in niedriger Dosierung nicht vertragen wurden (siehe auch: Klinische Überlegungen zur Statinintoleranz (Primärprävention)).
