Erratum Heft 2/2023
Rubrik: In eigener Sache
Im Beitrag „Zulassungserweiterung für Dupilumab“ auf Seite 88–90 im Heft 2/2023 ist uns ein Fehler unterlaufen. Die in Tabelle 1 dargestellten zugelassenen Indikationen beziehen sich auf Dupilumab 200 und 300 mg. Allerdings ist Dupilumab 300 mg auch für drei weitere Indikationen zugelassen, die wir nicht dargestellt hatten: chronische Rhinosinusitis mit Nasenpolypen, Prurigo nodularis und eosinophile Ösophagitis.
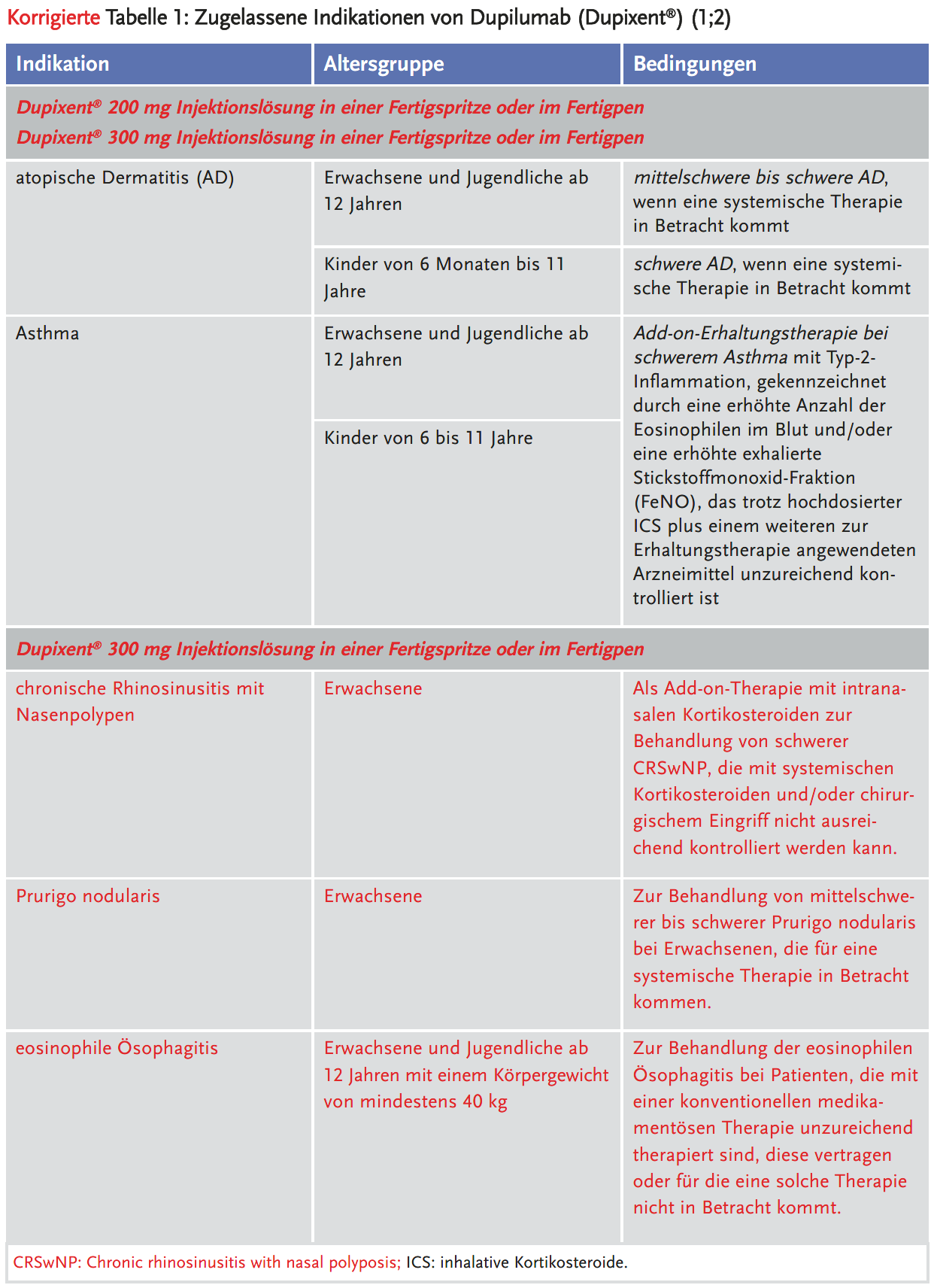
Weiterhin wies uns der Zulassungsinhaber von Dupixent® Sanofi Aventis Deutschland darauf hin, dass er den Satz „Das ist irreführend, da Dupilumab in dieser Altersgruppe nur bei schwerer AD zugelassen ist“, nicht nachvollziehen könne. Er schrieb uns dazu: „Die Texte der Fachinformation und die Darstellungen basieren auf Absprachen mit der EMA zu den Ergebnissen der gesamten Studie als auch der für die europäische Zulassung relevanten Subgruppen. Die Texte sind als möglichst objektive und sachlich-korrekte Darstellung der Ergebnisse formuliert.“
Dass die Texte der Fachinformationen im Rahmen der Zulassung mit der Europäischen Arzneimittel-Agentur (EMA) abgestimmt werden, ist allgemein bekannt und wurde von uns in keiner Weise ifFrage gestellt. Es ist aber auch allgemein bekannt, dass die Texte der Fachinformationen nicht besonders leserfreundlich und übersichtlich gestaltet sind (3).
In die Studie AD-1539 wurden 162 Patienten im Alter von 6 Monaten bis 5 Jahren mit mittelschwerer bis schwerer AD (ITT-Population), definiert als ein Wert von ≥ 3 gemäß IGA (Skala von 0 bis 4), ein Wert ≥ 16 gemäß EASI (Skala von 0 bis 72) und einer betroffenen Körperoberfläche (BSA) von mindestens ≥ 10 %, untersucht. Von diesen 162 Patienten hatten 125 Patienten eine schwere AD, definiert durch einen Wert von 4 gemäß IGA. 37 Patienten wiesen eine mittelschwere AD auf und entsprachen daher nicht der Population, die von der Zulassung umfasst wird: zur Behandlung von schwerer atopischer Dermatitis bei Kindern von 6 Monaten bis 11 Jahre (4). Im EPAR werden auch die Ergebnisse zur Subpopulation der Patienten mit schwerer AD dargestellt (4), sodass bei Interesse diese nachvollzogen werden können. In der Fachinformation werden allerdings in einer Tabelle die Wirksamkeitsergebnisse der Studie AD-1539 erst zum Gesamtanalyse-Datensatz (Patienten mit mittelschwerer und schwerer AD, Full Analysis Set, FAS) angegeben und direkt daneben in derselben Tabelle die relevanteren Ergebnisse zur Subpopulation mit schwerer AD (1;2).
Wir haben in keiner Weise die Wirksamkeit von Dupilumab bei Kindern im Alter von 6 Monaten bis 5 Jahren mit schwerer AD angezweifelt oder eine negative Bewertung vorgenommen. Die FAS-Ergebnisse sind nummerisch höher und könnten daher den Eindruck einer besseren Wirksamkeit erwecken, als dies anhand der Ergebnisse der zulassungskonformen Subpopulation abzuleiten ist. Das kann aus unserer Sicht durchaus irreführend sein, insbesondere in einer Fachinformation, die 29 Seiten umfasst und Daten aus 17 klinischen Studien zu fünf verschiedenen Indikationen präsentiert.
Literatur
- Sanofi-Aventis Deutschland GmbH: Fachinformation „Dupixent® 200 mg Injektionslösung in einer Fertigspritze, Dupixent® 200 mg Injektionslösung im Fertigpen“. Stand: März 2023.
- Sanofi-Aventis Deutschland GmbH: Fachinformation „Dupixent® 300 mg Injektionslösung in einer Fertigspritze, Dupixent® 300 mg Injektionslösung im Fertigpen“. Stand: April 2023.
- Bericht der Kommission an das europäische Parlament und den Rat gemäß Artikel 59 Absatz 4 der Richtlinie 2001/83/EG des Europäischen Parlaments und des Rates vom 6. November 2001 zur Schaffung eines Gemeinschaftskodexes für Humanarzneimittel (COM(2017) 135 final: https://dip.bundestag.de/vorgang/bericht-der-kommission-an-das-europäische-parlament-und-den-rat/81350 (letzter Zugriff: 16. Oktober 2023). Brüssel, 22. März 2017.
- European Medicines Agency: Assessment Report: Dupixent: https://www.ema.europa.eu/en/documents/assessment-report/dupixent-epar-public-assessment-report_en.pdf (letzter Zugriff: 1. September 2023). London, 20. Juli 2017.

