OTC-Arzneimittel: Verschreibungspflichtige Packungsgrößen können wirtschaftlich sein
Rubrik: Was uns sonst noch auffiel
Einige Arzneimittel sind in identischer Dosierung/Wirkstärke und mit gleichem oder sehr ähnlichem Anwendungsgebiet sowohl als verschreibungspflichtige Präparate (Rx-Arzneimittel) als auch als rezeptfreie OTC-Arzneimittel verfügbar (Tabelle 1).
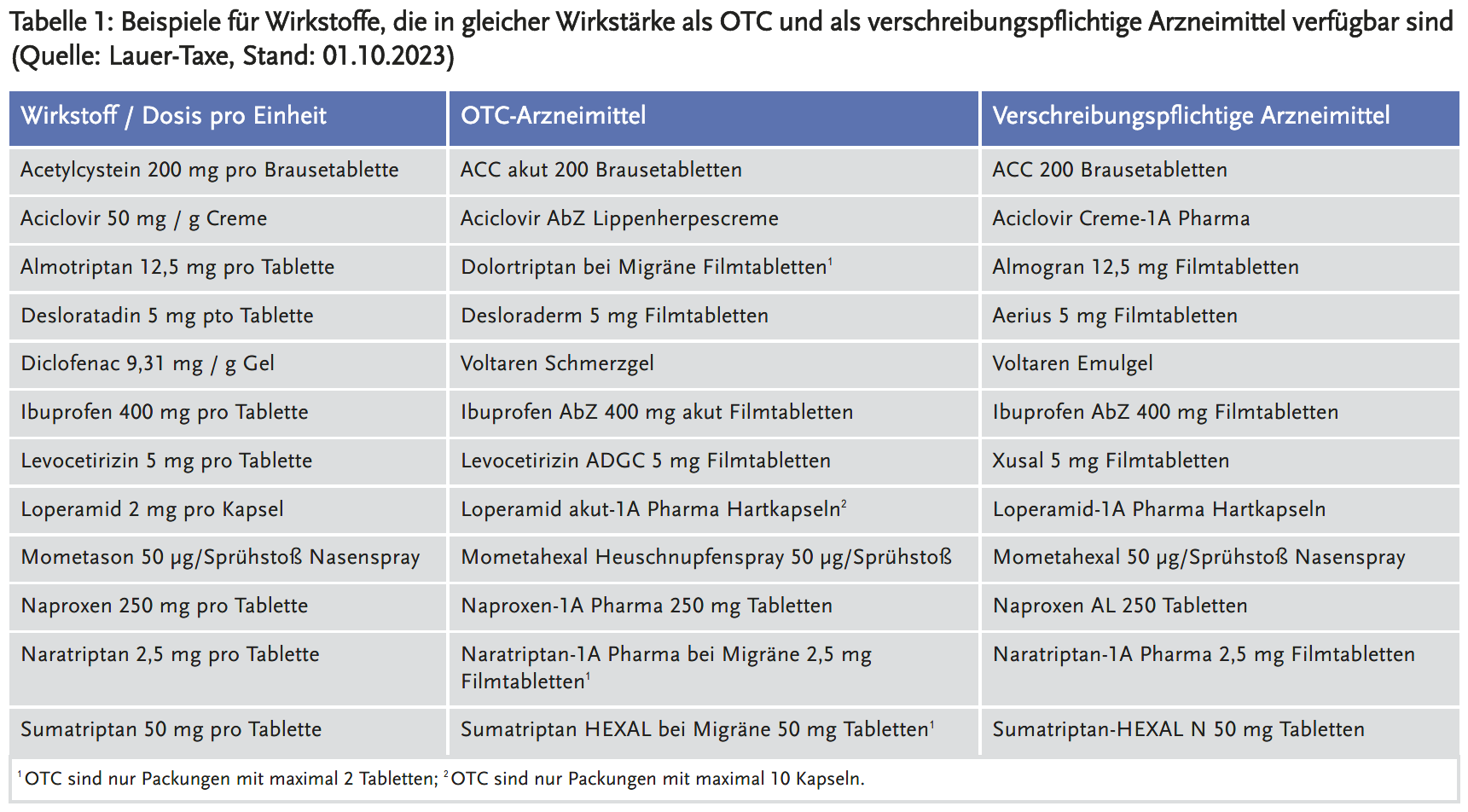
Obwohl die Zusammensetzung identisch ist, können sich die zugelassenen Anwendungsgebiete der OTC- und der Rx-Arzneimittel unterscheiden. In der Regel sind die apothekenpflichtigen Varianten bei akuten Beschwerden zugelassen, die verschreibungspflichtigen jedoch bei chronischen Erkrankungen oder in erweiterten Indikationsgebieten. So sind die Rx-Mometason-Nasensprays bereits für Kinder ab 3 Jahre zugelassen, während die OTC-Präparate nur für Erwachsene zugelassen sind, sofern die Erstdiagnose der saisonalen allergischen Rhinitis durch einen Arzt erfolgt ist (1, 2). Das verschreibungspflichtige Voltaren Emulgel ist im Gegensatz zum Voltaren Schmerzgel (OTC) zusätzlich bei Thrombophlebitis superficialis zugelassen (3, 4). OTC-Arzneimittel mit Acetylcystein (ACC) sind nur zur Verflüssigung des Schleims und Erleichterung des Abhustens bei erkältungsbedingter Bronchitis zugelassen (5). Die Rx-Präparate hingegen sind indiziert zur sekretolytischen Therapie bei akuten und chronischen bronchopulmonalen Erkrankungen, die mit einer Störung von Schleimbildung und -transport einhergehen wie z. B. COPD (6).
OTC-Arzneimittel sind apothekenpflichtige, nicht verschreibungspflichtige Arzneimittel. Sie sind von der Versorgung nach § 31 SGB V grundsätzlich ausgeschlossen und können somit nicht zu Lasten der gesetzlichen Krankenversicherung verordnet werden (Ausnahme: Anlage I der Arzneimittel-Richtlinie (AM-RL) sowie als Begleitmedikation gemäß Fachinformation und zur Behandlung von Nebenwirkungen von Rx-Arzneimitteln (§ 12 AM-RL)). Ob Ärztinnen und Ärzte verschreibungspflichtige Arzneimittel verordnen dürfen, wenn von dem gleichen Wirkstoff auch OTC-Präparate im Handel sind, ist eine Frage der Wirtschaftlichkeitsgebots. Sind therapeutisch vergleichbare Wirkstoffe erhältlich, die das gleiche Anwendungsgebiet haben, ist die Ärztin bzw. der Arzt gehalten, das apothekenpflichtige Arzneimittel zu empfehlen und nicht das verschreibungspflichtige zu verordnen. Dazu heißt es derzeit in §12 Abs. 11 der AM-RL (7):
„Die behandelnde Ärztin oder der behandelnde Arzt soll nicht verschreibungspflichtige Arzneimittel zulasten des Versicherten verordnen, wenn sie zur Behandlung einer Erkrankung medizinisch notwendig, zweckmäßig und ausreichend sind. Die Verordnung eines verschreibungspflichtigen Arzneimittels kann unwirtschaftlich sein.“
Und in § 9, Abs. 2 Satz 1 der AM-RL (7):
„Stehen zum Erreichen eines Therapieziels mehrere gleichwertige Behandlungsstrategien zur Verfügung, soll die nach Tagestherapiekosten und Gesamtbehandlungsdauer wirtschaftlichste Alternative gewählt werden.“
Daraus resultiert, dass die Verordnung von verschreibungspflichtigen Arzneimitteln, zu denen OTC-Arzneimittel verfügbar sind, als unwirtschaftlich angesehen wird. Die gesetzlichen Krankenkassen haben in der Vergangenheit in solchen Fällen häufig Regressanträge gegenüber Ärztinnen und Ärzten gestellt (8).
Nun hat der Gemeinsame Bundesausschuss (G-BA) in seiner Sitzung am 21. September 2023 beschlossen, den § 12 Abs. 11 der AM-RL zu ändern, indem folgender Satz angefügt wird (9):
„Ist bei Arzneimitteln mit gleichem Wirkstoff, gleicher Wirkstärke und identischem Anwendungsgebiet eine ausreichende Versorgung durch nicht verschreibungspflichtige Packungsgrößen nicht gewährleistet, kann die Verordnung verschreibungspflichtiger Packungsgrößen wirtschaftlich sein.“
Der neue Passus hebt hervor, dass Ärztinnen und Ärzte nicht immer auf die OTC-Variante verweisen müssen. Er stellt klar: Wenn es für eine ausreichende Versorgung erforderlich ist, können rezeptpflichtige Packungsgrößen wirtschaftlich sein. Die Änderung tritt nach rechtlicher Prüfung durch das Bundesministerium für Gesundheit und Veröffentlichung im Bundesanzeiger in Kraft.
Anlass für die klarstellende Regelung ist, dass einige Triptane sowohl als nicht verschreibungspflichtige als auch als verschreibungspflichtige Arzneimittel erhältlich sind, die sich allein in der Anzahl der Tabletten unterscheiden, nicht aber im Wirkstoff, in der Wirkstärke oder dem Anwendungsgebiet. Arzneimittel mit Triptanen in einer nicht verschreibungspflichtigen kleinen Packungsgröße (2 Tabletten) können bei gelegentlich auftretenden Migräneattacken einmalig und möglichst früh in der Attacke eingenommen werden. Für die Behandlung von häufig auftretenden Migräneattacken sind OTC-Triptane jedoch ungeeignet, da die Tablettenmenge für den Bedarf der an Migräne leidenden Person nicht ausreicht. Die fehlende Eignung der nicht verschreibungspflichtigen Packungsgrößen für die Behandlung von mehrmals im Monat auftretenden Migräneattacken ergibt sich auch aus Warnhinweisen zur Einnahme der Triptane in den Fachinformationen, die unter anderem auf eine notwendige ärztliche Untersuchung bei dieser Häufigkeit von Attacken hinweisen. Somit ist eine Verordnung von Triptan-haltigen Arzneimitteln in verschreibungspflichtigen Packungsgrößen trotz Verfügbarkeit von nicht verschreibungspflichtigen Packungsgrößen in den Fällen nicht unwirtschaftlich, in denen Migräneattacken mehrmals pro Monat auftreten. Bei Verordnung verschreibungspflichtiger Packungsgrößen von Triptan-haltigen Arzneimitteln, die auch als sogenannte OTC-Präparate erhältlich sind, sollte die behandelnde Ärztin oder der behandelnde Arzt die Häufigkeit der Migräneattacken in der Patientenakte dokumentieren. Hierzu kann auch ein Schmerztagebuch herangezogen werden (10).
Fazit für die Praxis
Manche Wirkstoffe sind sowohl als nicht verschreibungspflichtige als auch als verschreibungspflichtige Arzneimittel erhältlich, die sich nicht im Wirkstoff, in der Wirkstärke oder dem Anwendungsgebiet unterscheiden. Nach der AM-RL sind Ärztinnen und Ärzte gehalten, das apothekenpflichtige OTC-Arzneimittel zu empfehlen und nicht das verschreibungspflichtige zu verordnen. Wenn es für eine ausreichende Versorgung erforderlich ist, können rezeptpflichtige Packungsgrößen wirtschaftlich sein. Dies ist zum Beispiel bei Triptan-haltigen Arzneimitteln der Fall. Bei Verordnung dieser in verschreibungspflichtigen Packungsgrößen sollte die Häufigkeit der Migräneattacken in der Patientenakte dokumentiert werden, zum Beispiel anhand eines Schmerztagebuchs.
Literatur
- Hexal AG. Fachinformation „MometaHEXAL® 50 Mikrogramm/Sprühstoß Nasenspray, Suspension; Oktober 2019.
- Hexal AG. Fachinformation „MometaHEXAL® Heuschnupfenspray; September 2020.
- GlaxoSmithKline Consumer Healthcare GmbH & Co. KG. Fachinformation „Voltaren Emulgel 1,16 % Gel“; Juni 2022.
- GlaxoSmithKline Consumer Healthcare GmbH & Co. KG. Fachinformation „Voltaren Schmerzgel 11,6 mg/g Gel“; Juni 2022.
- Hexal AG. Fachinformation „ACC® akut Hustenlöser“; April 2023.
- Hexal AG. Fachinformation „ACC® 200 mg Brausetabletten, ACC® long, 600 mg Brausetabletten“; August 2019.
- Gemeinsamer Bundesausschuss. Richtlinie über die Verordnung von Arzneimitteln in der vertragsärztlichen Versorgung – AM-RL. Berlin, 19.09.2023. Verfügbar unter: https://www.g-ba.de/downloads/62-492-3242/AM-RL-2023-03-28_iK-2023-09-19_AT-18-09-2023-B3.pdf.
- Heyde I, Peters H, Dicheva S, Fuchs D. ACC und Co: keine Erstattung bei Apothekenpflicht? DAZ 2011; 151(40):114.
- Gemeinsamer Bundesausschuss. Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie: § 12 Absatz 11. Berlin, 21. September 2023. Verfügbar unter: https://www.g-ba.de/downloads/39-261-6181/2023-09-21_AM-RL_Paragraf-12_Absatz-11_Aenderung.pdf.
- Gemeinsamer Bundesausschuss. Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie: § 12 Absatz 11. Berlin, 21. September 2023. Verfügbar unter: https://www.g-ba.de/downloads/40-268-9793/2023-09-21_AM-RL_Paragraf-12_Absatz-11_Aenderung_TrG.pdf.
Interessenkonflikte
Die Autorin gibt an, keine Interessenkonflikte zu haben.
