Semaglutid (Wegovy®) ▼ – neue Indikation
Rubrik: Neue Arzneimittel
Dieser Artikel wurde am 27. September 2023 vorab online veröffentlicht.
„Neue Arzneimittel“ ist eine Information der AkdÄ zu neu zugelassenen Arzneimitteln oder neu zugelassenen Indikationen bei Markteinführung und zu Arzneimitteln nach der frühen Nutzenbewertung durch den G-BA (§ 35a Absatz 1 SGB V). Ziel ist es, Ärztinnen und Ärzten zeitnah unabhängige und transparente Informationen zu diesen Arzneimitteln zur Verfügung zu stellen. Weitere Informationen dazu: https://www.akdae.de/arzneimitteltherapie/na.
Zugelassene Indikation und Wirkmechanismus
Wegovy® (Semaglutid) ist zugelassen zur Gewichtsregulierung, ergänzend zu einer kalorienreduzierten Ernährung und verstärkten körperlichen Aktivität,
- bei Erwachsenen mit Adipositas (Ausgangs-Body-Mass-Index (BMI) ≥ 30 kg/m²)
- bei Erwachsenen mit Übergewicht (BMI von ≥ 27 kg/m² bis < 30 kg/m²) und mindestens einer gewichtsbedingten Begleiterkrankung
- bei Jugendlichen ab 12 Jahren mit Adipositas (gemäß geschlechts- und altersspezifischen Wachstumstabellen) und einem Körpergewicht über 60 kg.
Semaglutid wirkt als GLP(Glucagon-like Peptide)-1-Rezeptoragonist. Durch Stimulation der Insulinsekretion und Hemmung der Glucagonsekretion senkt es glukoseabhängig den Blutzuckerspiegel. Außerdem verlangsamt Semaglutid die Magenentleerung und verstärkt hierdurch das Sättigungsgefühl. Auf zentralnervöser Ebene soll Semaglutid die Kontrolle über das Essverhalten erhöhen und Heißhungerattacken reduzieren.
Markteinführung
Wegovy® (Semaglutid) wurde im Januar 2022 zugelassen zur Gewichtsregulierung und ist seit 15. Juli 2023 auf dem deutschen Markt verfügbar. Semaglutid ist außerdem bereits seit 2018 zugelassen zur Behandlung des Diabetes mellitus Typ 2 (T2DM). In dieser Indikation ist es in Deutschland unter dem Handelsnamen Ozempic® auf dem Markt. Wegovy® ist im Unterschied zu Ozempic® auch in den Dosen von 1,7 mg und 2,4 mg verfügbar. Wegovy® kann nicht zu Lasten der gesetzlichen Krankenkassen verordnet werden, da es als sogenanntes Lifestyle-Arzneimittel eingeordnet wurde (1).
Bewertung
Semaglutid ist zur Gewichtsregulierung in einer Dosis von 2,4 mg/Woche zugelassen. In Kombination mit Lebensstilinterventionen sank unter dieser Zieldosis das Körpergewicht um durchschnittlich 15 % (ohne T2DM) bzw. 10 % (mit T2DM). Im Kontrollarm wurde durch die Lebensstilinterventionen eine prozentuale Gewichtsreduktion von 2–6 % erreicht. Der Gewichtsverlust bei Jugendlichen war dem von Erwachsenen vergleichbar. Eine klinisch bedeutsame Verbesserung der Lebensqualität ist durch die Zulassungsstudien nicht belegt.
Ein relevanter Anteil der Studienteilnehmerinnen und Studienteilnehmer sprach nicht oder nur minimal auf Semaglutid an, insbesondere Personen mit T2DM (Gewichtsreduktion < 5 % bei 31 % der Teilnehmerinnen/Teilnehmer) und Jugendliche (BMI-Reduktion < 5 % bei 24 % der Teilnehmerinnen/Teilnehmer). Bei Respondern wird ein Plateau nach etwa einem Jahr erreicht. Aktuell liegen Studiendaten über eine Behandlungsdauer von zwei Jahren vor. Diese zeigen bei fortgesetzter Therapie einen stabilen Gewichtsverlauf. Nach Absetzen von Semaglutid ist mit einer erneuten Gewichtszunahme zu rechnen.
Der Blutdruck sowie der Lipid- und Glukosestoffwechsel wurden durch Semaglutid günstig beeinflusst, das Ausmaß war jedoch gering. Bei Personen ohne T2DM erscheint am ehesten die Blutdrucksenkung klinisch relevant (Behandlungsunterschied Semaglutid/Placebo: systolischer Blutdruck –4 mmHg, HbA1c –0,2 %, LDL-C (Low-density-Lipoprotein Cholesterin) –3 %). Bei Patientinnen und Patienten mit T2DM unterschied sich die HbA1c-Senkung nicht zwischen Semaglutid 1,0 mg und Semaglutid 2,4 mg; Blutdruck und LDL-C wurden im Vergleich zu Placebo nicht signifikant beeinflusst.
Es ist derzeit unklar, ob und in welchem Ausmaß Semaglutid bei adipösen und übergewichtigen Menschen Folgeerkrankungen verhindern kann. Die abgeschlossene, aber noch nicht publizierte Studie SELECT (2, 3) schloss im Unterschied zu den vorausgegangenen Studien adipöse Erwachsene ohne T2DM ein, die an einer manifesten kardiovaskulären Erkrankung litten. Die Pressemitteilung des pharmazeutischen Unternehmers berichtete über eine relative Risikoreduktion von 20 % des kombinierten Endpunktes aus kardiovaskulärem Tod, Myokardinfarkt und Schlaganfall (4). Eine kritische Bewertung von Semaglutid in dieser Indikation ist erst bei Vorliegen der vollständigen Studiendaten möglich. Auch wenn sich ein patientenrelevanter Nutzen für kardiovaskulär vorerkrankte, adipöse Patientinnen und Patienten bestätigen sollte, bliebe weiterhin unklar, welchen Nutzen – über die reine Gewichtsreduktion hinaus – Semaglutid bei adipösen und übergewichtigen Menschen in der Primärprävention hat.
Unter Semaglutid traten sehr häufig gastrointestinale Beschwerden auf. Schwere Nebenwirkungen wie Pankreatitis und Cholelithiasis waren selten, aber vermehrt unter Semaglutid. Bei Patientinnen und Patienten mit T2DM kam es unter Semaglutid auch ohne begleitende Therapie mit Insulin oder Sulfonylharnstoffen zu Hypoglykämien. Aktuell liegen nur sehr begrenzte Daten zu einer Langzeitanwendung von Semaglutid in einer Dosis von 2,4 mg vor (2 Jahre, 152 Teilnehmerinnen/Teilnehmer im Semaglutid-Arm). Insbesondere bei Jugendlichen lassen sich die unerwünschten Folgen einer Langzeittherapie nicht abschätzen. Semaglutid kann deshalb aus Sicht der AkdÄ für Jugendliche derzeit nicht empfohlen werden.
Semaglutid gilt in der Indikation „Gewichtsregulierung“ (Wegovy®) als Lifestyle-Arzneimittel und wird als solches nicht von den gesetzlichen Krankenkassen erstattet. Die Jahrestherapiekosten für Wegovy® sind mit knapp 4000 Euro sehr hoch und liegen nochmals deutlich über den Kosten für Semaglutid als Antidiabetikum (Ozempic®). Sollten sich Erwachsene nach kritischer Aufklärung für Semaglutid zur Gewichtsreduktion entscheiden, ist eine regelmäßige Überprüfung des Nutzen-Risiko-Verhältnisses erforderlich.
Wirksamkeit in den Zulassungsstudien
Das STEP(Semaglutide Treatment Effect in People with Obesity)-Studienprogramm untersucht die Veränderung des Körpergewichts unter Semaglutid in doppelblinden, randomisierten, placebokontrollierten Phase-III-Studien. Die meisten Daten liegen zu einer Behandlungsdauer über 68 Wochen vor. In die STEP-Studien 1–5 (5–9) wurden vor allem Erwachsene mit Adipositas (BMI ≥ 30 kg/m²) eingeschlossen. Bei einem BMI zwischen 27 und 30 kg/m² musste zusätzlich eine gewichtsbedingte Begleiterkrankung vorliegen, zum Beispiel eine Fettstoffwechselstörung oder ein Hypertonus. Die Studie STEP 2 untersuchte adipöse und übergewichtige Erwachsene mit T2DM. In den übrigen STEP-Studien waren Erwachsene mit T2DM ausgeschlossen. Das Durchschnittsalter lag bei 46 Jahren bei Teilnehmern ohne T2DM und bei 55 Jahren bei Teilnehmern mit T2DM. An der Studie STEP TEENS (10) konnten adipöse und übergewichtige Jugendliche (≥ 12 bis < 18 Jahre) mit und ohne T2DM teilnehmen (n = 201, 68 Wochen). Bis auf einen Teilnehmer waren alle eingeschlossenen Jugendlichen adipös und nur wenige (4 %) litten an T2DM.
Semaglutid bzw. Placebo wurden beginnend mit einer Dosis von 0,25 mg einmal wöchentlich subkutan verabreicht. Alle vier Wochen wurde die Dosis erhöht (0,25 mg >> 0,5 mg >> 1,0 mg >> 1,7 mg >> 2,4 mg), bis nach 16 Wochen die Erhaltungsdosis von 2,4 mg erreicht war oder nicht akzeptable Nebenwirkungen auftraten. Begleitend zur Studienmedikation erhielten alle Teilnehmer eine Beratung zu einer kalorienreduzierten Diät und verstärkten körperlichen Aktivität, entweder vierwöchentlich durch geschultes Personal (STEP 1,2,4,5) oder im Rahmen einer intensiven Verhaltenstherapie (STEP 3). Bei Jugendlichen erfolgte eine initial zwei-, dann vierwöchige Lebensstilberatung, die besonders auf eine stärkere körperliche Aktivität zielte (60 min körperliche Aktivität/Tag in moderater bis hoher Intensität).
Insgesamt wurden 3376 Erwachsene über 68 Wochen 2:1 zu Semaglutid 2,4 mg (n = 2114) oder Placebo (n = 1262) randomisiert. Bei Teilnehmern mit T2DM (STEP 2) wurde außerdem eine niedrigere Semaglutid-Dosis von 1 mg/Woche untersucht (n = 403). Die placebokontrollierte Absetzstudie STEP 4 verglich den Behandlungsstopp nach 20 Wochen mit einer über 68 Wochen fortgesetzten Therapie. Daten zu einer längeren Behandlungsdauer (104 Wochen) liegen aus der Studie STEP 5 vor, die allerdings nur 304 Teilnehmer umfasste.
Bei Erwachsenen und Jugendlichen ohne T2DM reduzierte sich unter Semaglutid das durchschnittliche Körpergewicht prozentual um 15 %, entsprechend einer absoluten durchschnittlichen Gewichtsreduktion von 15 kg (STEP 1, STEP TEENS). Die begleitend durchgeführten Lebensstilinterventionen führten im Kontrollarm lediglich zu einer minimalen Gewichtsreduktion bei Erwachsenen (–2 %), bei Jugendlichen stieg das Körpergewicht trotz dieser Interventionen sogar weiter an (+3 %). Es erscheint wenig überraschend, dass für die meisten Teilnehmer monatliche Beratungen nicht ausreichten, um die empfohlenen Lebensstiländerungen umzusetzen. Durch eine intensive Verhaltenstherapie (30 Interventionen in 68 Wochen), kombiniert mit der initialen Bereitstellung niedrigkalorischer Mahlzeiten (1000–1200 kcal/Tag), wurde in der Studie STEP 3 unter Placebo immerhin ein prozentualer Gewichtsverlust von 6 % erreicht. Der Behandlungsunterschied zwischen Placebo und Semaglutid war mit 10 % ähnlich groß wie in der Studie STEP 1 (siehe Tabelle 1).
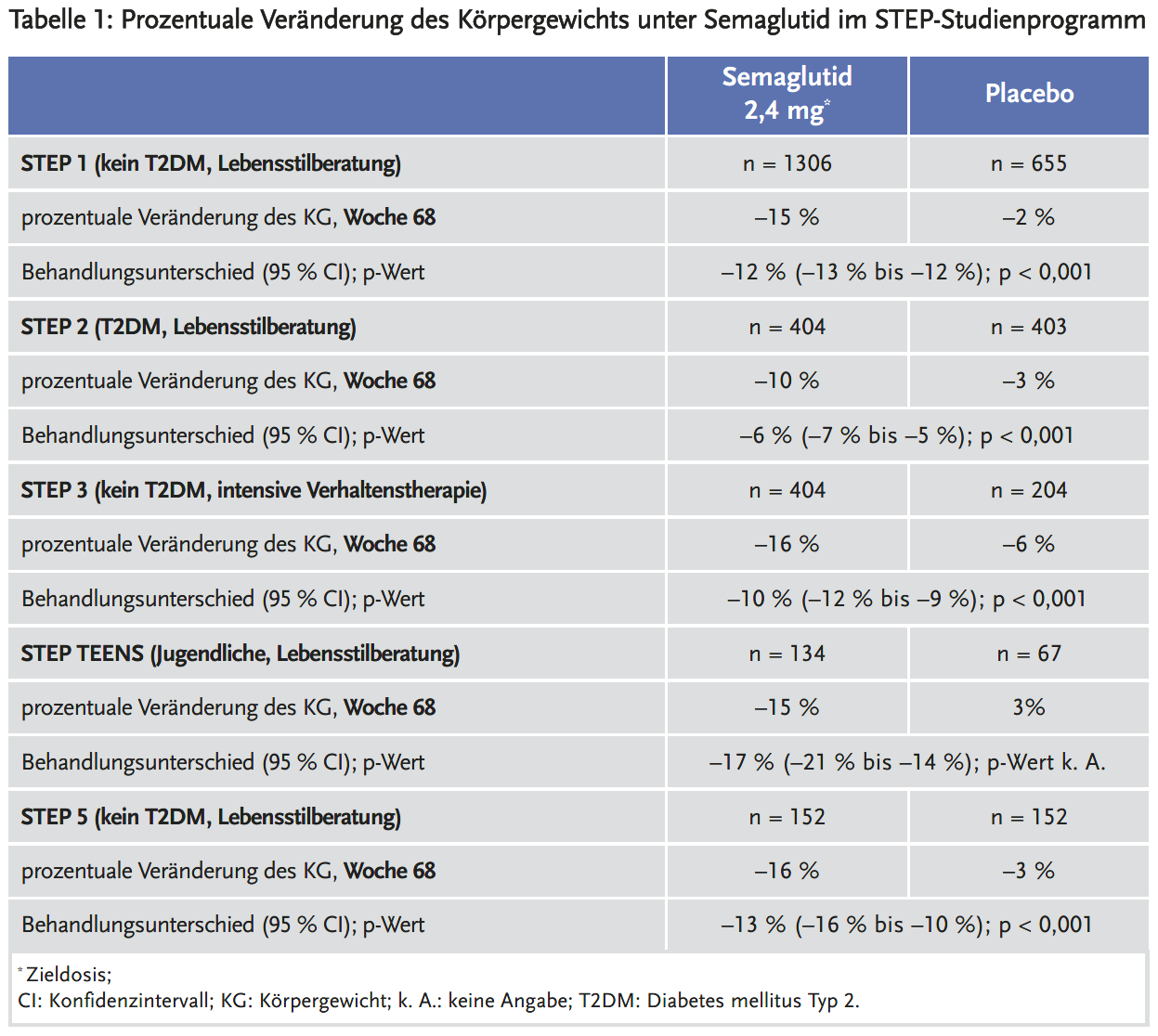
Die Teilnehmer der Studie STEP 2 profitierten von Semaglutid hinsichtlich ihrer Gewichtsreduktion weniger als die Teilnehmer anderer Studien (siehe Tabelle 1). Neben dem Vorliegen eines T2DM könnte dies laut EMA (Europäische Arzneimittel-Agentur) auch auf den höheren Männeranteil in der Studie STEP 2 zurückzuführen sein (Männeranteil STEP 2: 49 %, STEP 1: 26 %). Subgruppenanalysen der Studien STEP 1 und STEP 2 weisen auf eine geringere Gewichtsreduktion unter Semaglutid bei Männern hin. Die unterschiedliche Wirksamkeit lässt sich laut EMA nicht vollständig durch den durchschnittlich geringeren BMI bei Frauen und die damit einhergehende höhere Exposition erklären. Es ist unklar, warum sich in der Studie STEP 3 keine Geschlechterdifferenz zeigte.
Die EMA definiert ein fehlendes Ansprechen auf Semaglutid als eine Gewichtsreduktion von < 5 % bei Erwachsenen bzw. als eine Abnahme des BMI von < 5 % bei Jugendlichen. Dieser Definition folgend sprach jeder siebte Erwachsene ohne T2DM (STEP 1, 3), jeder vierte adipöse Jugendliche (STEP TEENS) und jeder dritte Erwachsene mit T2DM (STEP 2) nicht auf Semaglutid an. Aus Sicht der AkdÄ liegt ein klinisch relevanter Gewichtsverlust, insbesondere hinsichtlich Adipositas-assoziierter Folgeerkrankungen, erst bei einer Reduktion von mindestens 10 % des Ausgangsgewichts vor. Dieses Ziel wurde unter Semaglutid von gut einem Viertel der Erwachsenen ohne T2DM und von mehr als der Hälfte der Erwachsenen mit T2DM nicht erreicht. Bei adipösen Jugendlichen blieb der erreichte Gewichtsverlust bei 38 % der Teilnehmer unter 10 % des Ausgangsgewichts.
In der Absetzstudie STEP 4 erhielten zunächst alle Studienteilnehmer (n = 902) eine Auftitrierung von Semaglutid bis zur Zieldosis von 2,4 mg bzw. bis zur maximal verträglichen Dosis. In Woche 20 wurden diejenigen Teilnehmer, die die Zieldosis von Semaglutid erreicht hatten (n = 803), entweder zu Placebo oder zu einer Therapiefortsetzung mit Semaglutid randomisiert. In den folgenden 48 Wochen reduzierte sich unter Semaglutid das Körpergewicht weiter (–8 %), während sich unter Placebo das Gewicht wieder dem Ausgangsgewicht annäherte (Ausgangsgewicht 107 kg, nach 20 Wochen Semaglutid 95 kg, nach 48 Wochen Placebo 101 kg). Es ist somit davon auszugehen, dass eine anhaltende Gewichtsreduktion nur durch eine fortgesetzte Therapie mit Semaglutid möglich ist. Bislang liegen aus der Studie STEP 5 Daten über zwei Jahre vor, die eine stabile Gewichtsreduktion unter Semaglutid zeigen. Dabei erreichte die Gewichtsreduktion nach 52 Wochen ein Plateau (Gewichtsreduktion in Woche 52 –16 %, in Woche 104 unverändert –16 %).
Die Lebensqualität wurde mittels SF-36 (Short Form Health Survey) und IWQOL-Lite-CT (Impact of Weight on Quality of Life Clinical Trials) erhoben. Der Ausgangswert des SF-36 lag in den STEP-Studien bei 50–52 und entsprach somit der durchschnittlichen Lebensqualität der Bevölkerung in den USA. Bei begleitender intensiver Verhaltenstherapie (STEP 3) gaben die Teilnehmer des Kontrollarms im Studienverlauf eine ähnliche Verbesserung der Lebensqualität an wie unter Semaglutid. In den Studien STEP 1 und 2 war der Behandlungsunterschied zwischen den Studienarmen signifikant, aber mit zwei Punkten aus Sicht der AkdÄ klinisch nicht relevant. Im IQQOL-Lite-CT stellt laut EMA ein Anstieg um ≥ 14,6 Punkte eine klinisch relevante Verbesserung dar. Der Behandlungsunterschied lag mit 5 (STEP 2) bzw. 9 Punkten (STEP 1) deutlich unter diesem Schwellenwert.
Verschiedene kardiovaskuläre Risikofaktoren wurden als sekundäre Endpunkte untersucht. Das LDL-C sank signifikant um 3–5 % bei Teilnehmern ohne T2DM (STEP 1, 3) und lediglich numerisch um 1 % bei Teilnehmern mit T2DM (STEP 2). Die Studienteilnehmer hatten bereits initial niedrige LDL-C-Werte (STEP 1,3: 110 mg/dl; STEP 2: 90 mg/dl). Die geringe bis minimale LDL-C Senkung unter Semaglutid erscheint klinisch irrelevant.
Der systolische und diastolische Blutdruck sank bei Teilnehmern ohne T2DM (STEP 1,3) bis Woche 68 unter Semaglutid signifikant stärker als unter Placebo (systolisch: –6 mmHg vs. –2 mmHg, diastolisch: –3 mmHg vs. –1 mmHg). Dieser Effekt hielt in der Studie STEP 5 über zwei Jahre an. Bei Teilnehmern mit T2DM (STEP 2) war die Blutdrucksenkung unter Semaglutid geringer (systolisch: –4 mmHg, diastolisch: –2 mmHg) und unterschied sich nicht signifikant vom Kontrollarm. Die durchschnittlichen Blutdruckwerte lagen in allen STEP-Studien bereits zu Studienbeginn im Zielbereich (STEP 1: 126/80 mmHg, STEP 2: 130/80 mmHg, STEP 3: 124/80 mmHg). Von klinischer Relevanz wäre eine verbesserte Blutdruckeinstellung bei Teilnehmern mit vorbestehendem Hypertonus. Subgruppenanalysen hierzu fehlen, die höhere Absetzrate antihypertensiver Medikation unter Semaglutid (STEP 5: 26 % vs. 8 %) spricht jedoch dafür, dass auch Teilnehmer mit Hypertonus von Semaglutid hinsichtlich ihrer Blutdruckeinstellung profitierten.
Der HbA1c-Wert sank bei Teilnehmern ohne T2DM (STEP 1,3) unter Semaglutid geringfügig stärker als unter Placebo (Semaglutid vs. Placebo, Woche 68: –0,5 % vs. –0,3 %). Die Studienautoren geben an, dass hierdurch nach 68 Wochen bei deutlich mehr initial prädiabetischen Teilnehmern eine normoglykämische Stoffwechsellage erreicht werden konnte (STEP 1: 84 % vs. 48 %, STEP 3: 90 % vs. 55 %). Die Langzeitstudie STEP 5 kommt zu ähnlichen Ergebnissen. Die STEP-Studien übernahmen die Kriterien der American Diabetes Association (ADA) (11), nach welchen ein Prädiabetes bereits bei einem HbA1c ab 5,7 % oder einem Nüchternglukosewert ab 100 mg/dl vorliegt. Die AkdÄ und die DEGAM (Deutsche Gesellschaft für Allgemeinmedizin) präferieren die WHO-Grenzwerte (12) mit einer Nüchternglukoseschwelle von 110 mg/dl, da die Anwendung der ADA-Kriterien zu einem starken Anstieg der Prävalenz von „Prädiabetes“ führt (siehe Nationale Versorgungsleitlinie Diabetes mellitus, Anhang 9 (13)). Aus Sicht der AkdÄ ist unklar, ob die durch Semaglutid verhinderte „prädiabetische“ Stoffwechsellage relevant das kardiovaskuläre Risiko beeinflusst.
Bei Teilnehmern mit T2DM (STEP 2) fiel die HbA1c-Senkung unter Semaglutid erwartungsgemäß deutlicher aus, da Semaglutid glukoseabhängig die Insulinsekretion stimuliert und die Glucagonsekretion hemmt. Dabei unterschied sich die HbA1c-Senkung nicht relevant zwischen der höheren, zur Gewichtsregulierung zugelassenen Dosis von 2,4 mg und der zur Blutzuckereinstellung gebräuchlichen Dosis von 1,0 mg (Semaglutid 2,4 mg vs. Semaglutid 1,0 mg vs. Placebo, Woche 68: –1,6 % vs. –1,5 % vs. –0,4 %). Ein zusätzlicher Nutzen der höheren Semaglutid-Dosis hinsichtlich der Blutzuckerkontrolle ist somit nicht belegt.
Ausgewählte Nebenwirkungen
Gastrointestinale Störungen waren sehr häufig (Semaglutid vs. Placebo: 73 % vs. 47 %). Die Prävalenz von Übelkeit, Durchfall und Erbrechen nahm nach 20 Wochen Therapie allmählich ab, blieb jedoch deutlich häufiger als unter Placebo. Die Prävalenz von Obstipation war über den Studienverlauf konstant hoch bei 10 %. Weitere häufige, unter Semaglutid vermehrt aufgetretene unerwünschte Ereignisse waren Kopfschmerzen, Schwindel, Fatigue und Alopezie. Unter Semaglutid traten selten, aber gehäuft Fälle von Pankreatitis (0,2 % vs. < 0,1 %) sowie von Cholelithiasis (1,6 % vs. 1,1 %) auf. Das Nebenwirkungsspektrum war bei Erwachsenen und Jugendlichen vergleichbar, allerdings trat eine Cholelithiasis bei Jugendlichen häufiger auf (Semaglutid vs. Placebo: 3,8 % vs. 0).
Ausgewählte Warnhinweise/Kontraindikationen/Interaktionen
- Laut Fachinformation (14) soll Semaglutid bei Jugendlichen abgesetzt werden, wenn ihr BMI nach 12-wöchiger Therapie mit Semaglutid in der maximal verträglichen Dosis um weniger als 5 % gesunken ist. Dieses fehlende Ansprechen betraf in der Studie STEP TEENS etwa jeden vierten Jugendlichen. Bei Erwachsenen wurde keine Absetzregel in die Fachinformation aufgenommen, da etwa die Hälfte der Studienteilnehmer, die bis Woche 20 Non-Responder waren, bei einer fortgesetzten Therapie mit Semaglutid einen Gewichtsverlust > 5 % erreichten. Insbesondere bei Patienten mit T2DM ist jedoch mit einem relevanten Anteil an dauerhaften Non-Respondern zu rechnen. Aus Sicht der AkdÄ sollte spätestens nach 68 Wochen Semaglutid abgesetzt werden, wenn kein Gewichtsverlust > 5 % erreicht wurde. Außerdem ist nach Einschätzung der AkdÄ das Nutzen-Risiko-Verhältnis kritisch zu überdenken, wenn der Gewichtsverlust unter 10 % bleibt.
- Semaglutid führte häufig zu gastrointestinalen Nebenwirkungen. Der Flüssigkeitsverlust durch Erbrechen und Durchfall kann in seltenen Fällen zu einer Verschlechterung der Nierenfunktion führen. Insbesondere ältere Patienten und Patienten mit Begleiterkrankungen sollten darauf hingewiesen werden, dass bei Erbrechen und Durchfall die Trinkmenge erhöht und gegebenenfalls die Begleitmedikation (zum Beispiel Diuretika) pausiert oder reduziert werden muss.
- Bei Studienteilnehmern ohne T2DM waren Hypoglykämien selten und nicht gehäuft unter Semaglutid. Bei Patienten mit T2DM ist unter Semaglutid jedoch vermehrt mit Hypoglykämien zu rechnen (STEP 2: 6,2 % vs. 2,5 %). Diese können auch bei Patienten auftreten, die keine Sulfonylharnstoffe oder Insulin erhalten. Patienten mit Insulintherapie konnten an der Studie STEP 2 nicht teilnehmen. Es liegen deshalb keine Daten zur Kombination aus Semaglutid 2,4 mg mit Insulin vor. Insbesondere in der Einstellungsphase ist der Blutzucker engmaschig zu überwachen und die Dosis des Insulins und der Sulfonylharnstoffe anzupassen.
- Bei Personen mit T2DM traten unter Semaglutid 2,4 mg vermehrt Fälle einer diabetischen Retinopathie auf (4,0 % vs. 2,7 %) auf. Unter der geringeren Semaglutid-Dosis von 1 mg zeigte sich kein erhöhtes Risiko für die Entwicklung einer diabetischen Retinopathie. Es gibt jedoch Hinweise aus einer früheren Studie (SUSTAIN-6 (15)), dass bei Patienten mit vorbestehender Retinopathie bereits unter Semaglutid 1 mg vermehrt Komplikationen auftreten. Das Nutzen-Risiko-Verhältnis von Semaglutid in der Dosis von 2,4 mg ist deshalb bei vorbestehender diabetischer Retinopathie besonders kritisch abzuwägen.
- In den STEP-Studien traten psychiatrische Störungen oder Suizidalität unter Semaglutid nicht gehäuft auf. Allerdings waren Patienten mit mindestens mittelgradiger depressiver Symptomatik oder einem Suizidversuch in der Vorgeschichte von den Studien ausgeschlossen. Die EMA überprüft derzeit anhand von Spontanberichten das Risiko von Suizidalität unter GLP-1-Agonisten (16).
Dosierung und Kosten

Weiterführende Informationen
Semaglutid (Wegovy®) wurde in Anlage II (Lifestyle-Arzneimittel) der Arzneimittel-Richtlinie aufgenommen und ist damit nicht von der gesetzlichen Krankenversicherung erstattungsfähig. Eine Bewertung des Zusatznutzens anhand der frühen Nutzenbewertung nach § 35a SGB V erfolgt deshalb nicht.
Quelle: Europäischer Öffentlicher Beurteilungsbericht (EPAR) Wegovy®, erschienen am 10. März 2022 und 9. Juni 2023. Die vorliegende Information erhebt keinen Anspruch auf Vollständigkeit. Für die Richtigkeit der angegebenen Dosierungen kann keine Gewähr übernommen werden.
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.
Literatur
- Gemeinsamer Bundesausschuss. Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage II (Lifestyle Arzneimittel) – Ergänzung Semaglutid. Berlin; 8.8.2023. Verfügbar unter: https://www.g-ba.de/downloads/40-268-9702/2023-08-08_AM-RL-II_SN_Ergaenzung-Semaglutid_TrG.pdf.
- Ryan DH, Lingvay I, Colhoun HM, Deanfield J, Emerson SS, Kahn SE et al. Semaglutide Effects on Cardiovascular Outcomes in People With Overweight or Obesity (SELECT) rationale and design. Am Heart J 2020; 229:61–9. doi: 10.1016/j.ahj.2020.07.008.
- Lingvay I, Brown-Frandsen K, Colhoun HM, Deanfield J, Emerson SS, Esbjerg S et al. Semaglutide for cardiovascular event reduction in people with overweight or obesity: SELECT study baseline characteristics. Obesity (Silver Spring) 2023; 31(1):111–22.
- Novo Nordisk. Company announcement: Semaglutide 2.4 mg reduces the risk of major adverse cardiovascular events by 20 % in adults with overweight or obesity in the SELECT trial; 8.8.2023. Verfügbar unter: https://www.novonordisk.com/news-and-media/news-and-ir-materials/news-details.html?id=166301.
- Garvey WT, Batterham RL, Bhatta M, Buscemi S, Christensen LN, Frias JP et al. Two-year effects of semaglutide in adults with overweight or obesity: the STEP 5 trial. Nat Med 2022; 28(10):2083–91. doi: 10.1038/s41591-022-02026-4.
- Rubino D, Abrahamsson N, Davies M, Hesse D, Greenway FL, Jensen C et al. Effect of Continued Weekly Subcutaneous Semaglutide vs Placebo on Weight Loss Maintenance in Adults With Overweight or Obesity: The STEP 4 Randomized Clinical Trial. JAMA 2021; 325(14):1414–25. doi: 10.1001/jama.2021.3224.
- Wadden TA, Bailey TS, Billings LK, Davies M, Frias JP, Koroleva A et al. Effect of Subcutaneous Semaglutide vs Placebo as an Adjunct to Intensive Behavioral Therapy on Body Weight in Adults With Overweight or Obesity: The STEP 3 Randomized Clinical Trial. JAMA 2021; 325(14):1403–13. doi: 10.1001/jama.2021.1831.
- Davies M, Færch L, Jeppesen OK, Pakseresht A, Pedersen SD, Perreault L et al. Semaglutide 2·4 mg once a week in adults with overweight or obesity, and type 2 diabetes (STEP 2): a randomised, double-blind, double-dummy, placebo-controlled, phase 3 trial. Lancet (London, England) 2021; 397(10278):971–84. doi: 10.1016/S0140-6736(21)00213-0.
- Wilding JPH, Batterham RL, Calanna S, Davies M, van Gaal LF, Lingvay I et al. Once-Weekly Semaglutide in Adults with Overweight or Obesity. N Engl J Med 2021; 384(11):989–1002. doi: 10.1056/NEJMoa2032183.
- Weghuber D, Barrett T, Barrientos-Pérez M, Gies I, Hesse D, Jeppesen OK et al. Once-Weekly Semaglutide in Adolescents with Obesity. N Engl J Med 2022; 387(24):2245–57. doi: 10.1056/NEJMoa2208601.
- American Diabetes Association. 2. Classification and Diagnosis of Diabetes. Diabetes Care 2017; 40(Suppl 1):S11-S24. doi: 10.2337/dc17-S005.
- International Diabetes Federation. IDF Diabetes Atlas – Tenth edition; 2021. Verfügbar unter: https://diabetesatlas.org/.
- Bundesärztekammer, Kassenärztliche Bundesvereinigung, Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften. Nationale Versorgungsleitlinie Typ-2-Diabetes – Langfassung; Version 3.0; AWMF-Register-Nr. nvl-001; DOI: 10.6101/AZQ/000503; 15.5.2023. Verfügbar unter: https://www.leitlinien.de/themen/diabetes.
- Novo Nordisk. Fachinformation "Wegovy® 0,25 mg / 0,5 mg / 1 mg / 1,7 mg / 2,4 mg Injektionslösung im Fertigpen", Wegovy® 0,5 mg / 1 mg / 1,7 mg / 2,4 mg FlexTouch® Injektionslösung im Fertigpen"; April 2023.
- Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jódar E, Leiter LA et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med 2016; 375(19):1834–44. doi: 10.1056/NEJMoa1607141.
- European Medicines Agency. EMA statement on ongoing review of GLP-1 receptor agonists; 11.7.2023. Verfügbar unter: https://www.ema.europa.eu/en/news/ema-statement-ongoing-review-glp-1-receptor-agonists.
