Akute Schädigungen der Leber durch Arzneimittel, pflanzliche Heil- und Nahrungsergänzungsmittel
Rubrik: Übersichtsarbeiten
Weiterer Autor: Dr. med. Ulrich Rosien, Hamburg
Vermutet man einen akuten Leberschaden durch die Gabe eines Arzneimittels, so pausiert man dieses, wartet die Normalisierung der Leberwerte ab und exponiert den Patienten neu mit diesem Arzneimittel, um den Verdacht zu bestätigen. Natürlich vergisst man dann auch nicht die Meldung der unerwünschten Arzneimittelwirkung an die AkdÄ (https://www.akdae.de/arzneimittelsicherheit/uaw-meldung).
So einfach und eindeutig ist es leider selten. Oft ist der vermutete Zusammenhang zwischen Arzneimittelgabe und Leberschädigung zeitlich nicht eindeutig und/oder eine Besserung der Leberwerte nach Absetzen des Medikamentes lässt auf sich warten. Welche konkurrierenden Ursachen soll man ausschließen, welche Rolle spielen pflanzliche Heilmittel oder Nahrungsergänzungsmittel (herbal and dietary supplements, HDS)? Eine praktisch orientierte Leitlinie wurde zu diesem Thema von der American Association for the Study of Liver Diseases Practice Guidelines Committee veröffentlicht (1).
Ein prominentes Beispiel für Leberschädigung durch pflanzliche Arzneimittel ist in Deutschland der Fall Iberogast®. Aufgrund der Lebertoxizität von Schöllkraut wurde bereits 2008 allen Phytopharmaka mit einer Tagesdosis von mehr als 2,5 mg Chelidonium-Gesamtalkaloiden die Zulassung entzogen. Alle Präparate mit einer niedrigeren Tages-Gesamtdosis, zu denen der 9-Kräuter-Extrakt Iberogast® gehört, mussten in die Produktinformation Warnhinweise zur Lebertoxizität aufnehmen. Dies erfolgte bei Iberogast® aufgrund des Widerstands des Zulassungsinhabers erst zehn Jahre später, nachdem 2018 Fälle von Leberschädigungen im Zusammenhang mit der Anwendung von Iberogast (einschließlich eines Leberversagens mit Lebertransplantation und letalem Ausgang) bekannt geworden waren (Quellen: https://www.bfarm.de/SharedDocs/Risikoinformationen/Pharmakovigilanz/DE/RV_STP/s-z/schoellkraut.html & Rosien U (2018). Iberogast® verursacht potenziell lebensbedrohliche Leberschäden: Endlich werden Warnhinweise in der Fach- und Gebrauchsinformation durch Bayer umgesetzt. Arzneiverordnung in der Praxis. 47. 1-5.)
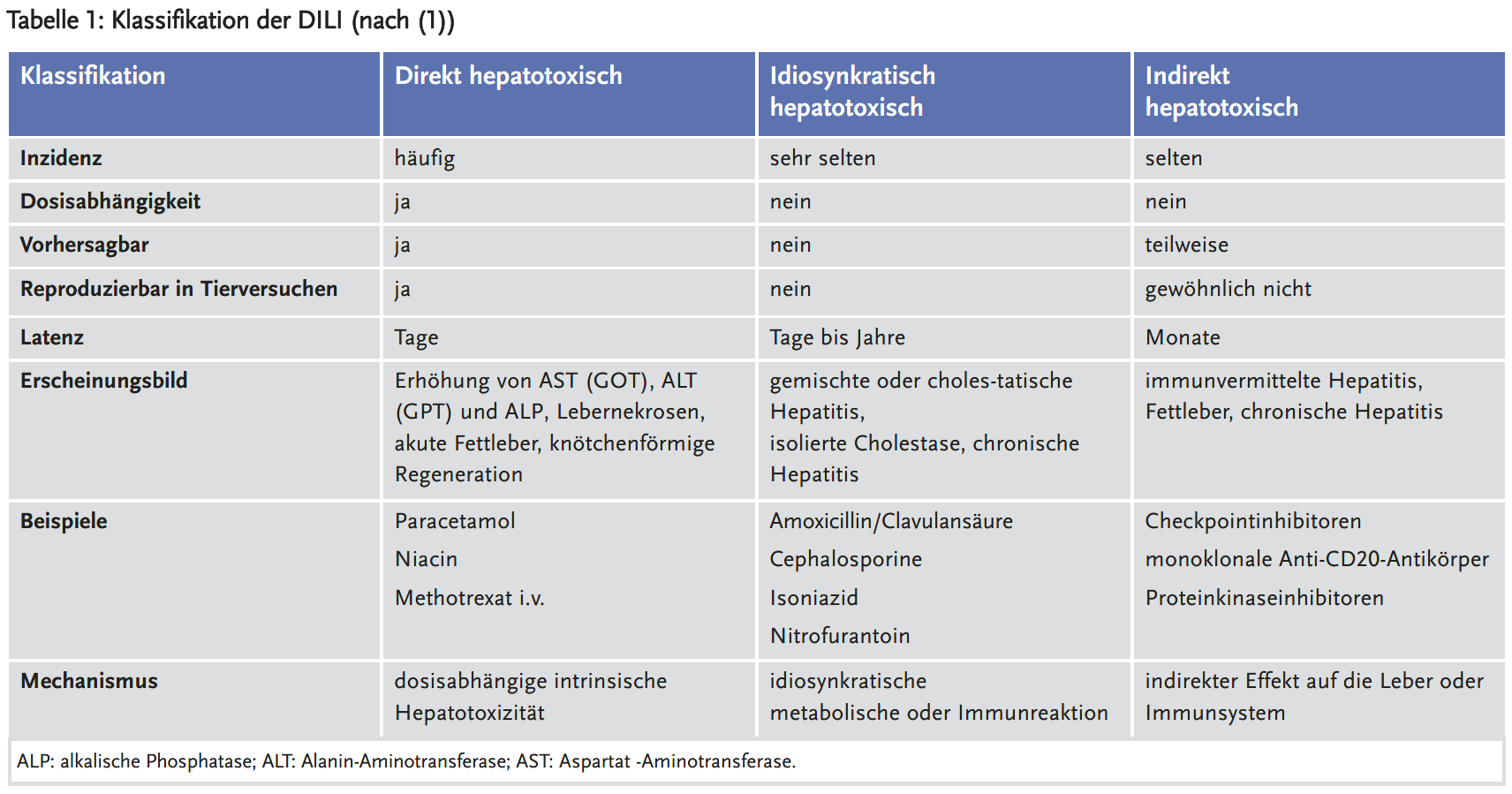
Akute Leberschädigung durch Medikamente (DILI, drug induced liver injury)
Die akute Leberschädigung kann entweder direkt (dosisabhängig und vorhersehbar, z. B. durch Paracetamol) oder idiosynkratisch (dosisunabhängig und unvorhersehbar) ausgelöst werden. Ein dritter möglicher Mechanismus ist die indirekte akute Leberschädigung. Ein Medikament aktiviert das Immunsystem des Patienten und führt dann mit einer gewissen Latenz zu einem Leberschaden (z. B. durch Checkpoint-Inhibitoren). Die idiosynkratische DILI ist selten: 14–19 pro 100.000 Einwohner pro Jahr.
Leberschädigung durch Paracetamol
In den USA werden auf Paracetamol etwa 100.000 Anrufe bei Giftzentralen, 50.000 Besuche in der Notaufnahme und 5000 Tote pro Jahr zurückgeführt. Paracetamol ist dosisabhängig hepatotoxisch in der zwei- bis dreifachen Menge der therapeutischen Dosis. Absichtlich oder auch unabsichtlich – durch Mehreinnahme wegen nicht ausreichender Wirksamkeit – kann es zu schweren Leberschäden führen. Die Toxizität wird verstärkt durch Fasten, Mangelernährung, Alkohol und andere Arzneimittel, die das Cytochrom-P450-System induzieren und dadurch mehr toxische Metabolite entstehen lassen. Histologisch entsteht eine perizentrale Nekrose. Charakteristisch ist eine Einnahme von > 4 g auf einmal, Transaminasen über 1000 U/l in den ersten 24 Stunden nach Einnahme und relativ geringe Erhöhung des Bilirubins. Die prolongierte Erhöhung der INR ist ein schlechtes prognostisches Zeichen. Als Antidot wird N-Acetylcystein (oral oder intravenös) in hohen Dosen möglichst rasch eingesetzt. Treten Symptome eines Leberversagens auf (insbesondere Enzephalopathie), so sterben ein Drittel der Patienten oder benötigen eine Lebertransplantation. Der Rest erholt sich innerhalb von sieben Tagen vollständig.
Idiosynkratische DILI
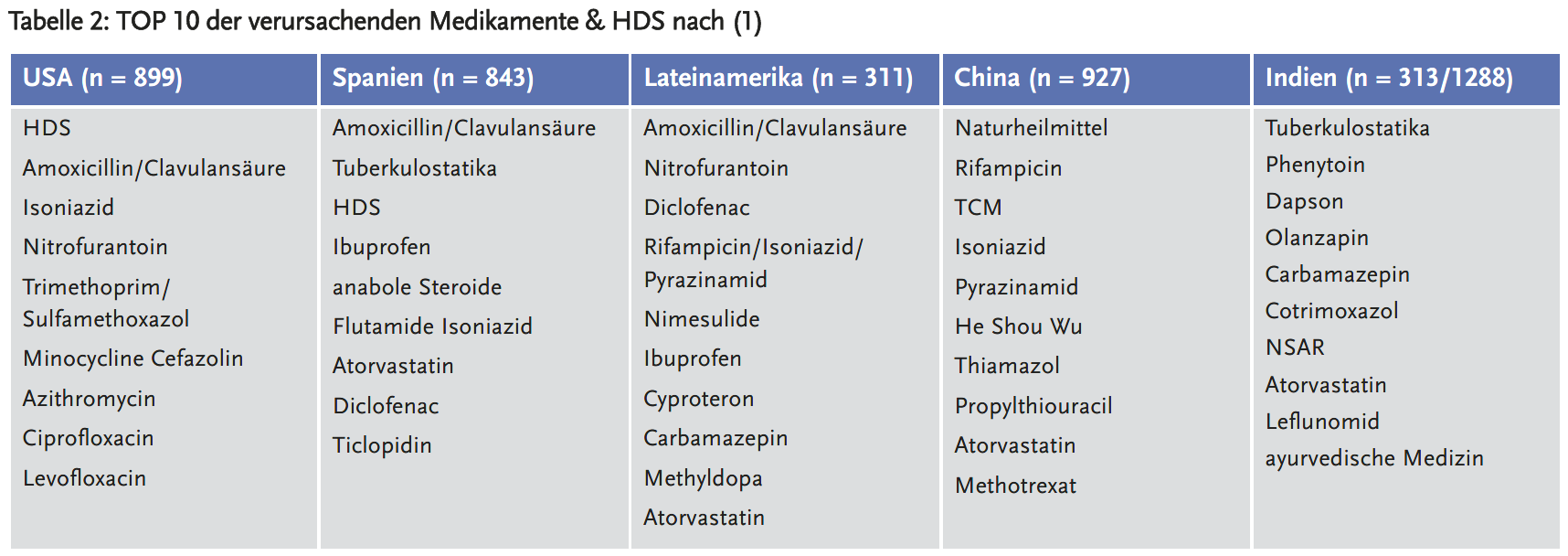
Als Hauptursachen einer idiosynkratischen DILI gelten Antibiotika und auf das ZNS wirkende oder immunmodulatorische Arzneimittel und Zytostatika, obwohl eine Vielzahl von Substanzen infrage kommen. Bemerkenswert sind geographische Unterschiede: In China, Korea und Singapur sind HDS die Hauptursache für idiosynkratische DILI, während diese in Japan, den USA und Spanien nur für eine Minderheit der Fälle die Ursache darstellen. Amoxicillin-Clavulansäure ist die häufigste Einzelsubstanz in westlichen Ländern. In Asien sind die häufigsten Auslöser Tuberkulostatika (Tabelle 2).
Risikofaktoren
Eigenschaften der Substanzen: Die meisten Substanzen, die eine idiosynkratische DILI auslösen, werden in Dosen von mehr als 50–100 mg pro Tag gegeben. Mehr als 80 % aller zur Lebertransplantationen führenden DILI wurden durch Medikamente mit einer Dosierung von mehr als 50 mg/Tag verursacht. Dosiseskalation führt zu einem höheren Risiko, Dosisreduktion oder eine Verlängerung des Dosisintervalls vermindert das Risiko. Lipophilie, extensive Metabolisierung in der Leber, Hemmung von Gallensäuretransportern und die Kombination vieler hepatotoxischer Substanzen erhöhen die Wahrscheinlichkeit für DILI.
Eigenschaften der Patienten: Ältere Patienten haben ein höheres Risiko, nehmen aber in der Regel auch mehr Medikamente ein. Im Alter von über 50 Jahren haben Frauen ein zweifach erhöhtes Risiko, unter 50 Jahren sind Männer genauso häufig betroffen. Cotrimoxazol ist die häufigste Einzelsubstanz bei Patienten afroamerikanischer Herkunft, Amoxicillin/Clavulansäure bei Patienten weißer Hautfarbe. Patienten asiatischer Herkunft haben ein höheres Risiko für Tod durch Leberversagen oder Lebertransplantation.
Komorbiditäten und Umweltfaktoren: Übergewicht erhöht das Risiko einer Fettleberhepatitis durch Tamoxifen. Übergewicht, Diabetes, Alkohol und virale Hepatitis sind assoziiert mit einer progressiven Fibrose durch MTX. Wie vorhandene Lebererkrankungen idiosynkratische Reaktionen beeinflussen können, ist nicht bekannt. Erhöhte Transaminasen vor Beginn einer antituberkulostatischen Therapie stellen ein höheres Risiko als das Alter der Patienten dar.
Genetische Faktoren: Genetische Faktoren, die Enzyme des Medikamentenabbaus beeinflussen, aber auch HLA-Allele werden mit dem Risiko einer idiosynkratischen DILI assoziiert. Die Bestimmung solcher Merkmale ist leider nicht zur Risikoeinschätzung vor der Gabe eines Medikamentes geeignet, da idiosynkratische DILI sehr selten sind. Sie können aber hilfreich werden in der Beurteilung einer Kausalität.
Diagnose
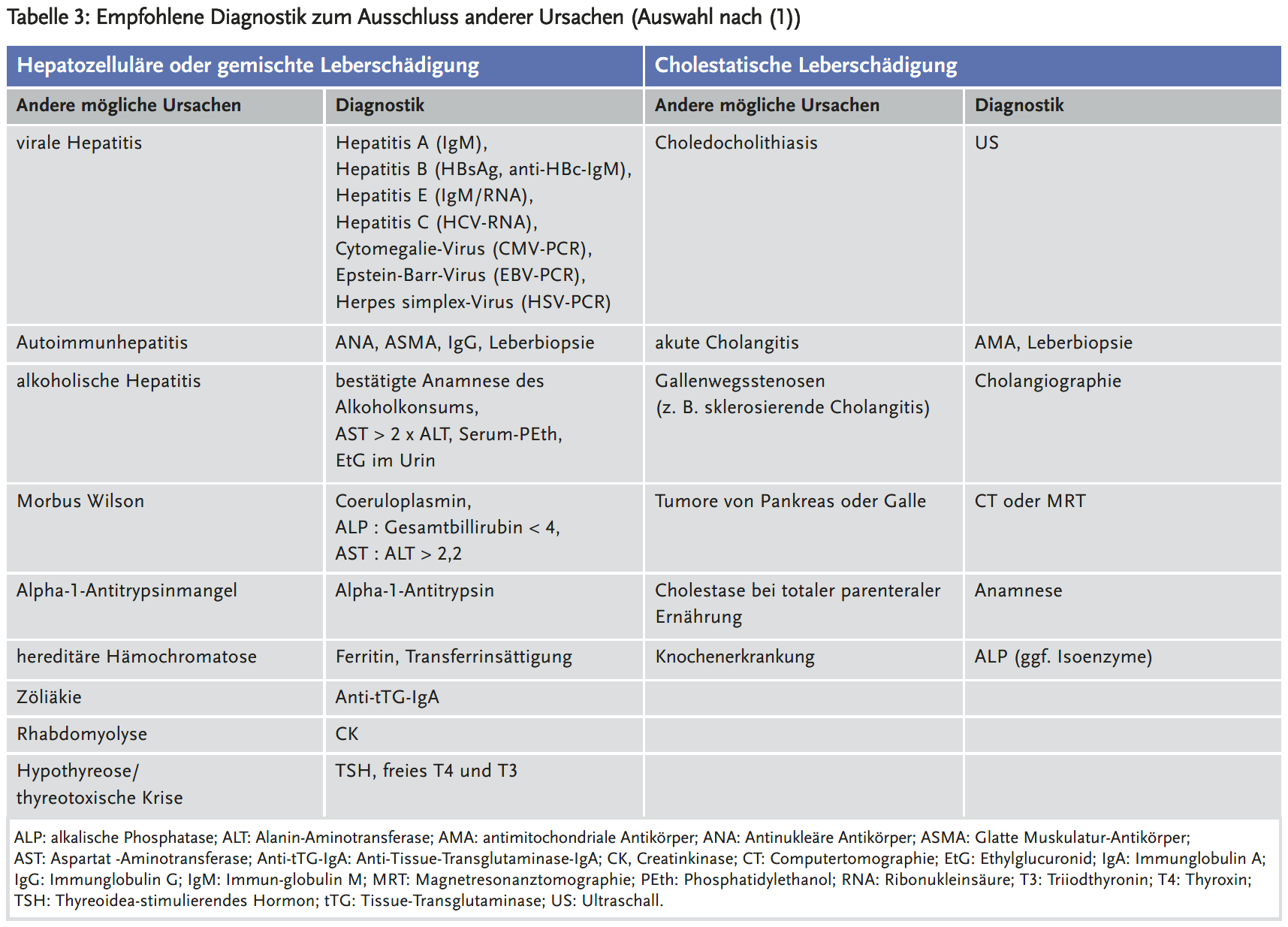
DILI ist eine Ausschlussdiagnose. Die genaue Anamnese der Einnahme von Arzneimitteln, von Nahrungsergänzungsmitteln, aber auch von pflanzlichen Heilmitteln ist unerlässlich. Die Bestimmung von GOT (AST), GPT (ALT) und alkalischer Phosphatase, direktem und gesamten Bilirubin ist indiziert. Serumalbumin und INR sind Marker der Schwere des Leberschadens.
Ein klinisch signifikantes DILI wird folgendermaßen definiert:
1. GOT oder GPT 5 x über Normalbereich oder ALP 2 x über Normalbereich.
oder
2. Serumbilirubin > 2,5 mg/dl zusammen mit Erhöhungen von GOT, GPT oder ALP
oder
3. INR > 1,5 mit Erhöhung von GOT, GPT und ALP.
Arzneimittelanamnese
Die genauen Einnahmezeiträume aller infrage kommenden Substanzen sollten erfragt und mit dem Verlauf der Leberwerte in Beziehung gebracht werden. Dies gilt insbesondere für Absetzversuche und Reexposition. Normalerweise beginnt eine Reaktion innerhalb von sechs Monaten nach Beginn der Medikation, obwohl auch längere Zeiträume möglich sind. Topisch zu applizierende Arzneimittel lösen fast nie ein DILI aus.
Laboruntersuchungen
GOT- und GPT-Erhöhungen sprechen für eine primär hepatozelluläre Schädigung. Eine Erhöhung der ALP für eine cholestatische Form der Schädigung. Gemischte Formen sind auch möglich.
Ausschluss anderer Ursachen
Bei Patienten mit DILI sollte eine akute virale Hepatitis ausgeschlossen werden. Dazu gehören insbesondere Hepatitis A, B, C und E (Tabelle 3). Bei jüngeren Patienten sollte man auch an einen Morbus Wilson denken. Bei Patienten mit Sepsis, Herzinsuffizienz und/oder Schock normalisieren sich die Transaminasen normalerweise rasch nach Besserung des Zustandes ohne große Erhöhungen des Bilirubins. Antimitochondriale Antikörper (AMA, ggf. SP 100-Antikörper) sollten insbesondere bei cholestatischen Verlaufsformen bestimmt werden. Ist die GOT deutlich höher als die GPT, sollte eine alkoholinduzierte Leberschädigung in Betracht gezogen werden. Zumindest sollte ein Ultraschall der Leber durchgeführt werden, bei unklarem Herdbefund eine CT-Untersuchung mit Kontrastmittel, bei führender Cholestase, sofern klinisch eine sklerosierende Cholangitis oder ein Abflusshindernis als Differenzialdiagnose infrage kommt, eine MR-Cholangiografie (Tabelle 3).
Die Besserung der Leberwerte nach Absetzen des vermuteten Agens ist wichtig für die Diagnose eines DILI. Unter LiverTox (siehe Seitenrand) kann recherchiert werden, wie häufig mit der verdächtigten Substanz schon ein DILI gemeldet wurde.
LiverTox ist eine englischsprachige Datenbank des National Institute of Diabetes and Digestive and Kidney Diseases, die aktuelle Informationen über Diagnose, Ursache, Häufigkeit, klinische Symptomatik und Behandlung von Leberschäden bietet, die auf verschreibungspflichtige und nicht verschreibungspflichtige Arzneimittel sowie ausgewählte pflanzliche Mittel und Nahrungsergänzungsmittel zurückzuführen sind. Informationen über ein bestimmtes Arzneimittel oder ein Nahrungsergänzungsmittel finden Sie, indem Sie den Namen des Medikaments oder Nahrungsergänzungsmittels in die Suchmaske eingeben oder indem Sie die alphabetische Liste der Wirkstoffe durchsuchen: https://www.ncbi.nlm.nih.gov/books/NBK547852/.
Ein ausführlicher Algorithmus für die Diagnostik ist hier verfügbar: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9936988/.
Leberbiopsie
Normalerweise wird die Diagnose eines DILI ohne eine Leberbiopsie gestellt. Bei Unsicherheiten kann diese jedoch erforderlich werden. Manche Arzneimittel haben charakteristische histologische Schädigungsmuster, die gut erkennbar sind. Meist sind die Veränderungen jedoch unspezifisch. Bei fehlender Besserung der Leberwerte nach Absetzen kann durch eine Biopsie das Ausmaß der Schädigung histologisch genauer beurteilt und Hinweise auf konkurrierende Ursachen gefunden werden.
30–50 % der DILI zeigen eine akute hepatozelluläre Schädigung mit Zeichen der Entzündung und Nekrosen. Besonders schwierig ist die Unterscheidung einer medikamenteninduzierten autoimmunen Hepatitis von idiopathischer Autoimmunhepatitis. Der Nachweis einer vorbestehenden Fibrose kann die Diagnose einer idiopathischen Autoimmunhepatitis stützen. Zunehmend werden Fälle von DILI durch Checkpoint-Inhibitoren (ICI) gemeldet. 70 % dieser Patienten zeigen eine panlobuläre Hepatitis, 30 % centrilobuläre Koagulationsnekrosen. Ikterus und Leberversagen sind dabei selten.
Cholestatische Verlaufsformen können sich als blande Cholestase, als Cholestase mit lobulärer Entzündung und als chronische Entzündung mit schweren Schäden der Gallengänge bis hin zum Verlust derselben manifestieren.
Schwere der Krankheit und Prognose
Eine Leberbiospie hilft bei der Prognosestellung (z. B. bei hohen Transaminasen oder eingeschränkter Syntheseleistung). Das Ausmaß der Nekrosen und starke duktale Reaktionen sprechen für eine schlechte, der Nachweis von Eosinophilen und Granulomen eher für eine gute Prognose. Ein chronisches DILI wird meistens als Persistenz der Leberschädigung > 6 Monate definiert, kann aber auch durch den histologischen Nachweis einer signifikanten Fibrose oder Zirrhose erkannt werden.
Beurteilung der Kausalität
1. Scoresysteme zur Bewertung der Kausalität
A. Roussel-Uclaf Causality Assessment Method (RUCAM): –9 bis +14 Punkte. Fragen nach Beginn und Beendigung der Medikation, Beginn der Leberschädigung, Unterscheidung hepatozellulärer oder cholestatischer Form, konkurrierender Ursachen der Leberschädigung ausgeschlossen, Reexposition, ob von der Substanz schon Leberschäden bekannt sind, nach weiterer Medikation. Einteilung dann in sicher, wahrscheinlich, möglich, unwahrscheinlich und ausgeschlossen (2).
B. Maria-Victorino Clinical Diagnostic Scale (CDS): Ähnlich wie RUCAM ohne die Berücksichtigung weiterer Medikation, zusätzlich aber Frage nach extrahepatischen Manifestationen, wird in der Praxis selten angewendet, da dem RUCAM unterlegen (3).
C. Digestive Disease Week-Japan 2004 Score (DDW-J) ist eine Modifikation des RUCAM Score in dem zusätzlich ein Lymphozyten-Stimulationstest und eine periphere Eosinophilie bewertet werden. Wird nur in Japan benutzt u.a. da gut reproduzierbare Lymphyozytenstimulationstests nicht weit verbreitet sind (und teuer) (4).
D. RECAM: Mit online Zugang (http://dilirecam.com). Von –6 bis +20 Punkten. Scheint mindestens so gut wie RUCAM zu sein, legt noch mehr Wert auf den Ausschluss konkurrierender Ursachen (5).
2. Strukturierte Expertenmeinung
Semiquantitative Skala, die vom DILI-Netzwerk entwickelt wurde und den Vorteil hat, auch eher atypische Fälle zu erwischen. Dieser Ansatz hat sich als ebenso nützlich erwiesen wie der RUCAM, obwohl Expertenmeinungen in der klinischen Routinepraxis selten verfügbar sind (6).
Grenzen der Kausalitätsbewertung
Folgende Aspekte erschweren in der Praxis die Bewertung der Kausalität bei DILI: Patienten nehmen in der Regel mehrere Arzneimittel gleichzeitig ein bzw. mehrere Arzneimittel werden gleichzeitig begonnen (z. B. Tuberkulostatika). Für HDS sind häufig die Dosis und die genaue Zusammensetzung nicht eindeutig definiert. Eine vorher schon bestehende Lebererkrankung kann den Verlauf beeinflussen.
Als Limitationen des RUCAM-Scores gelten unter anderem, dass er aus einem Set von Reexpositionsfällen entwickelt wurde und daher bestimmte Fragen unterrepräsentiert gewesen sein können. Zudem müssen HCV und HEV nicht ausgeschlossen werden. Für Patienten mit chronischer vorbestehender Lebererkrankung ist der Score nicht konzipiert.
RECAM könnte, da er online durchführbar ist, der neue Standard werden, wurde aber bisher nur in Spanien und den USA getestet. Ebenfalls noch nicht häufig getestet wurde er bei HDS.
Natürlicher Verlauf von idiosynkratischen DILI
Die meisten DILI treten 2–24 Wochen nach Einnahme auf, selten später als sechs Monate. 50 % haben eine hepatozelluläre Schädigung, der Rest verteilt sich auf cholestatische Schäden und Mischformen. Schlechte Prognosefaktoren sind hohes Bilirubin, hohe INR und niedriges Albumin bei Erstvorstellung sowie eine schon vorbekannte Lebererkrankung. Einige Zeichen wie Granulome und Eosinophilie in der Leberbiospie sprechen eher für einen günstigen Verlauf.
Von einem chronischen DILI spricht man, wenn Erhöhungen der Leberwerte, und/oder radiologische oder histologische Zeichen einer Leberschädigung nach 6–12 Monaten noch persistieren.
Therapie des idiosynkratischen DILI (Zusammenfassung)
- Allgemein unterstützende Maßnahmen bei der Therapie des idiosynkratischen DILI sind Antiemetika, Analgetika, antipruriginöse Arzneimittel und parenteraler Flüssigkeitsersatz.
- Die Krankenhausaufnahme ist indiziert bei schwerer Übelkeit und Erbrechen, Gerinnungsstörungen oder Zeichen der Enzephalopathie.
- Eine 3-Tages-Therapie mit N-Acetylcystein (NAC) sollte bei Patienten mit akutem Leberversagen überlegt werden.
- Methylprednisolon mit 1 mg/kg KG wird oft bei Patienten mit Hypersensitivitätsreaktionen eingesetzt, z.B. beim DRESS (Drug reaction with eosinophilia and systemic syndrom) sowie beim Auftreten unter Checkpoint-Inhibitoren oder Tyrosinkinase-Inhibitoren.
- Ursodesoxycholsäure kann gegen den Juckreiz helfen.
- Eine spezifische medikamentöse Therapie ist nur in Sonderfällen indiziert: L-Carnitin bei Valproat-Toxizität bei Kindern, Cholestyramin zur Unterbrechung des enterohepatischen Kreislaufs bei Leflunomid.
Frühe Diagnose des DILI
Patienten, die ein Arzneimittel mit einer moderaten bis hohen Wahrscheinlichkeit einer Leberschädigung einnehmen, sollten unter der laufenden Medikation überwacht werden. Die Empfehlungen der jeweiligen Fachinformation zur Überwachung der verordneten Arzneimittel sollten befolgt werden.
Beispiele zur Überwachung einzelner Medikamente
Isoniazid
Monatliche Tests werden nur für Patienten mit vorbekannter Lebererkrankung, viraler Hepatitis, schwerem Alkoholkonsum, HIV-Infektion, anderen hepatotoxischen Medikamenten und Schwangerschaft angeraten. In der deutschen Fachinformation werden regelmäßige Kontrollen der Leberwerte ohne genaues Zeitintervall empfohlen. Außerdem sollen die Patienten bei Zeichen der Leberschädigung wie Schwächegefühl, Appetitlosigkeit, Übelkeit oder Erbrechen die Einnahme pausieren und sich unverzüglich ärztlich untersuchen lassen (7). Zudem muss bei der Kombinationstherapie der Tuberkulose die additive hepatotoxische Wirkung der eingesetzten Kombinationspartner beachtet werden. Während der Behandlung sollten die Patienten keinen Alkohol zu sich nehmen.
Methotrexat
Risikofaktoren für Langzeitschäden der Leber durch Methotrexat sind Alkohol, vorbestehende Lebererkrankung, Diabetes, Hyperlipidämie und Übergewicht.
Das American College of Rheumatology empfiehlt Laborwerte zu Beginn zu kontrollieren, dann alle 2–4 Wochen in den ersten drei Monaten und alle 8–12 Wochen nach 3–6 Monaten und später vierteljährlich. Zumindest nach Gesamteinnahme von mehr als 3,5–4 g kumulativer Gesamtdosis werden eine Elastographie und/oder eine Leberbiopsie für alle Patienten vorgeschlagen. In der deutschen Fachinformation Methotrexat-haltiger Arzneimittel wird empfohlen, vor Therapiebeginn die Kontrolle durchzuführen von u. a. Leberenzymen, Bilirubin und Serumalbumin sowie die Untersuchung der Hepatitis-Serologie (A, B, C). Während der Therapie (in den ersten beiden Wochen wöchentlich, dann zweiwöchentlich für den nächsten Monat; danach, abhängig von der Leukozytenzahl und der Stabilität des Patienten, ca. monatlich) sollen unter anderem Leberfunktionstests erfolgen und die Behandlung abgebrochen werden, wenn anhaltende oder signifikante Anomalien bei Leberfunktionstests, anderen nichtinvasiven Untersuchungen der Leberfibrose oder Leberbiopsien vorliegen. Bei Dosierungsänderung oder aufgrund erhöhter Wirkstoffspiegel (z. B. durch Dehydratation) gesteigerter Toxizität von Methotrexat kann auch eine häufigere Untersuchung erforderlich sein. Während der Methotrexat-Therapie sollen Patienten keine zusätzlichen hepatotoxischen oder potenziell hepatotoxischen Arzneimittel einnehmen und auf Alkohol verzichten bzw. den Alkoholkonsum deutlich einschränken (8).
Statine
Selbstlimitierende Transaminasenerhöhungen sind häufig, schwere Leberschäden sehr selten. Nur 1,8 % aller DILI über einen Zeitraum von acht Jahren waren auf diese Medikamentengruppe zurückzuführen. Aus diesem Grund wird zwar auch eine Laborkontrolle vor Einsatz der Statine, unter laufender Therapie aber nur bei Symptomen empfohlen. Statine sollten bei bekannter Leberzirrhose wegen des hepatischen Metabolismus nur in Absprache mit einem Hepatologen angewendet werden.
In der deutschen Fachinformation statinhaltiger Arzneimittel werden Leberfunktionstests vor Beginn der Behandlung empfohlen und danach, wenn klinisch angezeigt. Eine zusätzliche Bestimmung sollte vor einer Dosiserhöhung, drei Monate nach Dosiserhöhung und danach regelmäßig (z. B. halbjährlich) im ersten Behandlungsjahr erfolgen. Besondere Aufmerksamkeit sollte denjenigen Patienten gelten, die erhöhte Transaminasen entwickeln; bei diesen Patienten sollten die Bestimmungen umgehend wiederholt und dann häufiger durchgeführt werden. Wenn die Transaminasenerhöhungen weiter fortschreiten, insbesondere wenn sie bis zum Dreifachen der oberen Normgrenze ansteigen und persistieren, sollten Statine abgesetzt werden. Es sollte beachtet werden, dass GPT aus dem Muskelgewebe freigesetzt werden kann. Daher kann ein Anstieg von GPT und Creatinkinase (CK) ein Hinweis auf eine Myopathie sein (9).
DILI bei Immuntherapie
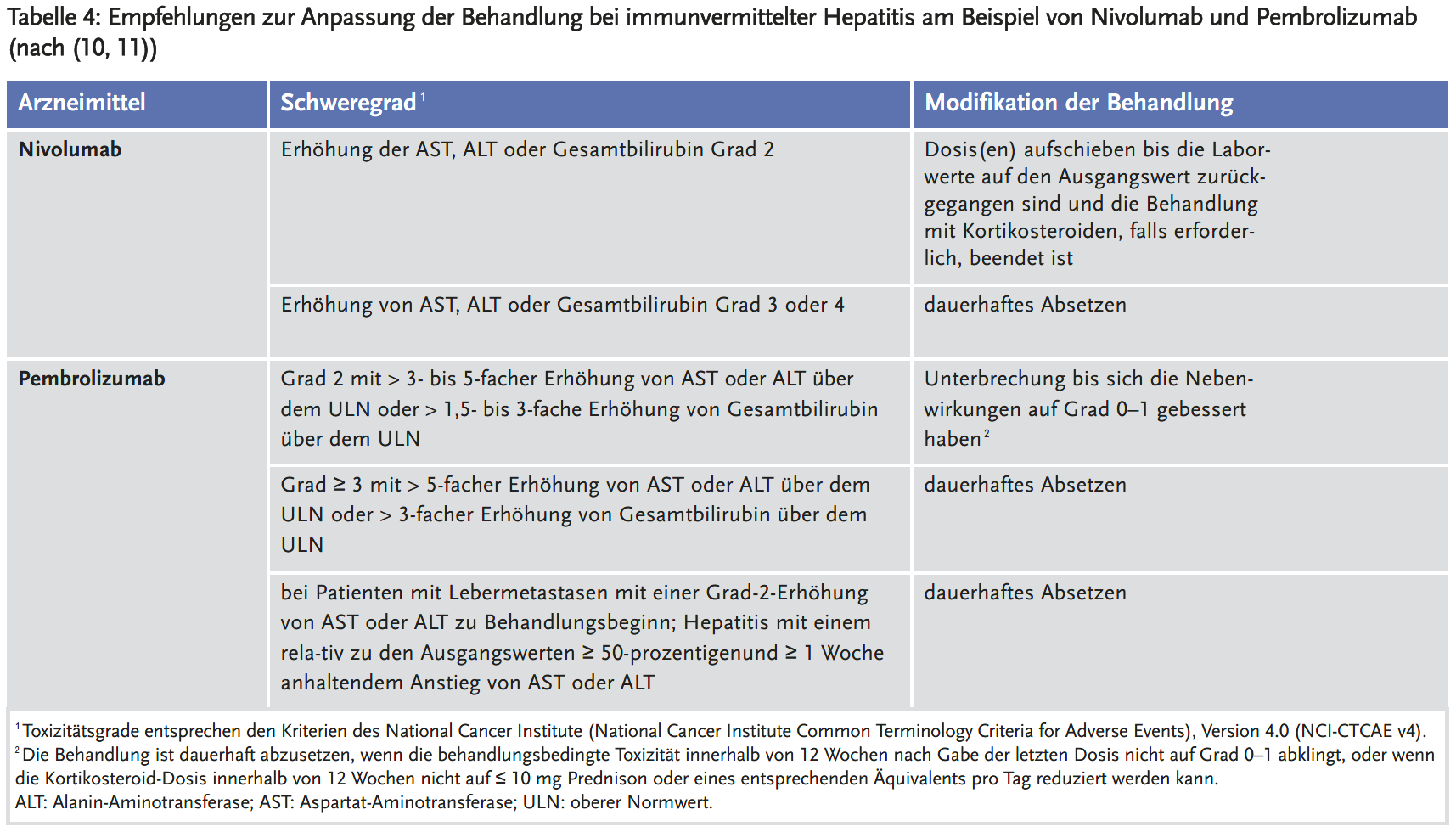
Checkpoint-Inhibitoren (wie z. B. Atezolizumab, Avelumab, Cemiplimab, Durvalumab, Ipilimumab, Nivolumab und Pembrolizumab) werden bei mehr als 50 % aller Patienten mit soliden Organtumoren eingesetzt. Eine immunvermittelte Hepatitis tritt je nach Studie in 1–15 % der Behandlungen auf und ist in den Fachinformationen als häufige Nebenwirkung aufgeführt (10, 11). Die meisten Patienten entwickeln eine asymptomatische Transaminasenerhöhung in den ersten 6–12 Wochen der Therapie. Dabei ist differenzialdiagnostisch öfter eine Metastasierung die Ursache als eine Leberschädigung durch die Arzneimittel. Bei geringen Transaminasenerhöhungen (GPT 1–3 x des Normwertes und oder Bilirubin zwischen 1 und 1,5 des oberen Normwertes) kann die Therapie mit häufigeren Kontrollen fortgesetzt werden. Bei mittelgradigen Erhöhungen (GPT 3–5 x erhöht und/oder Bilirubin 1,5–3 x des unteren Normwertes) muss die Therapie unterbrochen und Kortikosteroide i.v. (1–1,5 mg/kg KG) gegeben werden, in therapierefraktären Fällen sollten auch Azathioprin oder Mycophenolatmofetil eingesetzt werden. Bei höheren Werten sollte der Checkpoint-Inhibitor nicht wieder verordnet werden (Tabelle 4).
Durch HDS verursachte Leberschäden
Nach dem DILIN-Register sind 20 % aller akuten Leberschäden durch Nahrungsergänzungsmittel oder pflanzliche Heilmittel (HDS) verursacht. Nahrungsergänzungsmittel können beabsichtigt oder unbeabsichtigt nicht deklarierte Zusatzstoffe beinhalten. Sowohl pflanzliche Beimischungen als auch Verunreinigungen durch Chemikalien, Schwermetalle oder Pestizide sind möglich. Ein Beispiel ist die Beimischung von Sildenafil bei Potenzmitteln. Bei manchen pflanzlichen Mitteln ist die Zusammensetzung und die Menge der Wirkstoffe nicht gut standardisierbar. Außerdem fällt der erste Verdacht selten auf pflanzliche Heil- oder Nahrungsergänzungsmittel, da sie allgemein als unschädliche Naturprodukte wahrgenommen werden.
Viele Beispiele von Hepatotoxizität der HDS kommen von Zubereitungen mit vielen verschiedenen Inhaltsstoffen. Einigen Substanzen konnten spezielle Schädigungsprofile zugeordnet werden. So haben Polyphenolcatechine aus grünem Tee Fälle von hepatozellulärer Schädigung ausgelöst, die eine starke Assoziation zu HLA-B*35:01 zeigten. Mit demselben HLA ist Hepatotoxizität bei HAN-Chinesen mit Polygonum multiflorum vergesellschaftet, was gerne zur Steigerung der Fruchtbarkeit eingenommen wird.
HDS-Leberschäden verlaufen öfter tödlich oder benötigen eine Transplantation als durch chemische oder biologische Arzneimittel ausgelöste DILI. Dies könnte vielleicht darauf beruhen, dass die Diagnose oft erst verspätet gestellt wird. Werden die HDS bei DILI abgesetzt, erholen sich 80 % der Patienten ohne bleibende Leberschäden. Patienten mit akutem Leberversagen sollten in ein Transplantationszentrum verlegt werden, da die Chance einer Erholung lediglich 25 % beträgt.
Ausblick
Bessere diagnostische und prognostische Biomarker sind wünschenswert ebenso wie verlässliche Kausalitätsbeurteilungen und ein tieferes Verständnis der Pathogenese der Leberschädigungen.
Sensitivere Marker werden zurzeit untersucht (GLDH, mRNA 122, Serumzytokeratin 18 (CK18) und durch Caspase gespaltenes CK18). Lymphozytentests der Patienten mit dem verdächtigten Medikament waren bis jetzt nicht wegweisend, Tests mit zirkulierenden Makrophagen und menschlichen Leberorganoiden sind bisher nicht standardisiert.
Key Points für die Praxis
- Direkte Hepatotoxine wie Paracetamol können bei fast allen exponierten Personen Leberschäden verursachen, sobald eine Schwellendosis oder die Dauer der Anwendung überschritten wird. Schädigungen durch indirekte Hepatotoxine entstehen unabhängig von der verabreichten Dosis und haben eine variable Latenzzeit und Erscheinungsformen.
- Die idiosynkratische DILI ist weitgehend unabhängig von der Dosis und der Dauer der Einnahme und zeichnet sich durch eine geringe Inzidenz (14–19/100.000 Personen pro Jahr) und eine variable Latenzzeit aus. Es wird angenommen, dass sie durch eine aberrante adaptive Immunantwort auf das Arzneimittel und/oder seine Metaboliten entsteht.
- Antibiotika, Arzneimittel mit Wirkung auf das zentrale Nervensystem und entzündungshemmende Arzneimittel verursachen weltweit am häufigsten ein DILI. In einigen asiatischen Ländern sind allerdings HDS häufiger ursächlich, die zunehmend auch in westlichen Ländern eingesetzt werden.
- Die Tagesdosis eines Arzneimittels, seine Lipophilie und das Ausmaß des hepatischen Metabolismus beeinflussen das Risiko für DILI.
- Es liegen nicht genügend Daten vor, um Alter, Geschlecht, Rasse und ethnische Zugehörigkeit als zuverlässige Risikofaktoren für DILI zu bestätigen. Einige Arzneimittel verursachen jedoch eher DILI bei älteren Personen (z. B. Amoxicillin-Clavulansäure, Isoniazid), andere eher bei Kindern (Valproat, Minocyclin).
- Komorbiditäten wie Fettleibigkeit und Diabetes sind mit einer erhöhten Inzidenz und Schwere der DILI assoziiert. Bei Patienten mit vorbestehender Lebererkrankung besteht ein erhöhtes Risiko für DILI durch bestimmte Arzneimittel (z. B. Methotrexat, Tuberkulose-Therapie).
- Eine klinisch signifikante DILI ist in der Regel definiert als eines der folgenden Kriterien: (1) Serum-AST oder -ALT > 5× ULN oder -ALP > 2× ULN (oder Ausgangswert vor der Behandlung, wenn der Ausgangswert abnormal ist) bei zwei verschiedenen Gelegenheiten; (2) Gesamtserumbilirubin > 2,5 mg/dl zusammen mit einem erhöhten AST-, ALT- oder ALP-Wert; oder (3) INR > 1,5 mit erhöhtem AST-, ALT- oder ALP-Wert.
- Eine chronische Leberschädigung, die länger als 6–12 Monate anhält, wird bei 10–20 % der Patienten mit DILI beobachtet und kann häufiger bei cholestatischen DILI auftreten.
- Die meisten hepatotoxischen Arzneimittel führen innerhalb der ersten sechs Monaten zu Leberschäden, gelegentlich gibt es jedoch längere Latenzzeiten oder sie können sogar nach Absetzen auftreten (z. B. Amoxicillin-Clavulansäure). Daher sollte die Untersuchung eines Patienten mit Verdacht auf eine DILI eine detaillierte Anamnese der Medikation (inklusive HDS) innerhalb der letzten 180 Tage vor der Vorstellung umfassen.
- Der Ausschluss alternativer Ursachen für eine Leberschädigung ist in allen DILI-Fällen erforderlich, einschließlich der Untersuchung auf Virushepatitis, metabolische Lebererkrankungen, Autoimmunhepatitis und Erkrankungen der Pankreas und Gallenblase. Eine Leberbiopsie ist nicht erforderlich, um die Diagnose einer idiosynkratischen DILI zu stellen, kann aber bei DILI-Fällen mit schwerem oder langwierigem Verlauf und bei diagnostischer Unsicherheit sinnvoll sein.
- LiverTox gibt einen Überblick über die veröffentlichte Literatur zu Leberschäden durch über 1000 Arzneimittel und mehr als 60 HDS.
Literatur
- Fontana RJ, Liou I, Reuben A, Suzuki A, Fiel MI, Lee W et al. AASLD practice guidance on drug, herbal, and dietary supplement-induced liver injury. Hepatology 2023; 77(3):1036–65. doi: 10.1002/hep.32689.
- Danan G, Teschke R. RUCAM in Drug and Herb Induced Liver Injury: The Update. Int J Mol Sci 2015; 17(1). doi: 10.3390/ijms17010014.
- Lucena MI, Camargo R, Andrade RJ, Perez-Sanchez CJ, La Sanchez De Cuesta F. Comparison of two clinical scales for causality assessment in hepatotoxicity. Hepatology 2001; 33(1):123–30. doi: 10.1053/jhep.2001.20645.
- Hanatani T, Sai K, Tohkin M, Segawa K, Kimura M, Hori K et al. A detection algorithm for drug-induced liver injury in medical information databases using the Japanese diagnostic scale and its comparison with the Council for International Organizations of Medical Sciences/the Roussel Uclaf Causality Assessment Method scale. Pharmacoepidemiol Drug Saf 2014; 23(9):984–8. doi: 10.1002/pds.3603.
- Hayashi PH, Lucena MI, Fontana RJ, Bjornsson ES, Aithal GP, Barnhart H et al. A revised electronic version of RUCAM for the diagnosis of DILI. Hepatology 2022; 76(1):18–31. doi: 10.1002/hep.32327.
- Hayashi PH, Barnhart HX, Fontana RJ, Chalasani N, Davern TJ, Talwalkar JA et al. Reliability of causality assessment for drug, herbal and dietary supplement hepatotoxicity in the Drug-Induced Liver Injury Network (DILIN). Liver Int 2015; 35(5):1623–32. doi: 10.1111/liv.12540.
- Esteve Pharmaceuticals GmbH. Fachinformation "Isozid® 100 mg"; November 2021.
- Hexal AG. Fachinformation "MTX Hexal® Tabletten"; Februar 2023.
- AbZ-Pharma GmbH. Fachinformation "Simvastatin AbZ 80 mg Filmtabletten"; März 2023.
- Merck Sharp & Dohme B. V. Fachinformation "Keytruda® 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung"; Oktober 2023.
- Bristol-Myers Squibb GmbH & Co. KGaA. Fachinformation "Opdivo® 10 mg/ml Konzentrat zur Herstellung einer Infusionslösung"; August 2023.
Interessenkonflikte
Die Autoren geben an, keine Interessenkonflikte zu haben.
