Behandlung der Herzinsuffizienz bei Kindern und Jugendlichen
Therapie aktuell
Weitere Autorin: Dr. P.H. Stanislava Dicheva-Radev, Berlin
Herzinsuffizienz im Kindesalter
Die chronische Herzinsuffizienz ist im Kindesalter deutlich seltener als bei Erwachsenen. Ältere Daten aus bevölkerungsbezogenen Studien in den USA zeigen, dass 4 Kinder unter einem Jahr und 1,3 Kinder im Alter zwischen 1 und 10 Jahren in 1000 Personenjahren eine Herzinsuffizienz erleiden (1). In einer monozentrischen deutschen Untersuchung ergab sich eine Inzidenz der Herzinsuffizienz bei 23 von 1000 Kindern (2), wobei es meist Säuglinge betraf. Neuere Studien schätzen die Inzidenz einer Herzinsuffizienz im Kindesalter mit 0,9–7,4 pro 100.000 Kinder, aber trotz der relativ niedrigen Inzidenz ist die Morbiditäts- und Mortalitätslast hoch und mit einer Sterblichkeitsrate im Krankenhaus von 7–26 % behaftet (3;4).
Die Ursachen der chronischen Herzinsuffizienz sind im Kindesalter vielschichtiger als bei Erwachsenen. Folgende Ursachen kommen infrage: strukturelle Herzerkrankungen mit Volumenbelastung durch Links-Recht-Shunt (z. B. Ventrikelseptumdefekt, offener Ductus arteriosus) oder Klappeninsuffizienzen (z. B. Aorteninsuffizienz) oder mit Druckbelastung durch Linksherzobstruktion (z. B. kritische Aortenstenose) bzw. Rechtsherzobstruktion (z. B. kritische Pulmonalstenose). Neben komplexen angeborenen Herzfehlern (z. B. funktionell univentrikuläres Herz) sind auch Herzerkrankungen wie Kardiomyopathien, Herzmuskelbeteiligung bei angeborenen Störungen der Muskelfunktion und Myokarditis Ursache einer chronischen Herzinsuffizienz im Kindesalter (5;6).
Aufgrund der Heterogenität des klinischen Erscheinungsbildes und der unterschiedlichen Ätiologie ist die Entwicklung therapeutischer Strategien bei Kindern schwieriger als bei Erwachsenen. Es fehlt auch die Evidenz für den Einsatz einzelner Arzneimittel, die bei Erwachsenen zur Therapie der Herzinsuffizienz zugelassen sind. Die Empfehlungen für eine medikamentöse Therapie für pädiatrische Herzinsuffizienz in Artikeln und Leitlinien werden aus Studien an Erwachsenen extrapoliert. Es fehlen valide Daten zur Evidenz und deshalb kam und kommt es nicht zur Zulassung dieser Wirkstoffe für diese Altersgruppe. Trotzdem werden sie bei pädiatrischen Patienten eingesetzt. Leider kommt es trotz aller verfügbaren Behandlungen häufig zu einer Progression und zur Herztransplantation.
Medikamentöse Therapie der chronischen Herzinsuffizienz im Kindesalter
Randomisierte, kontrollierte klinischen Studien zur medikamentösen Therapie der chronischen Herzinsuffizienz bei Kindern mit validen Endpunkten fehlen weitestgehend (5-7). Die deutsche Leitlinie (5) wird aktuell überarbeitet.
Viele Therapieoptionen stammen aus Analogieschlüssen von Studien bei Erwachsenen. So werden im Kindesalter bei chronischer Herzinsuffizienz Medikamente eingesetzt, die den peripheren Widerstand senken, damit das geschwächte Herz eine bessere Auswurfleistung hat. An erster Stelle werden Angiotensin-Converting-Enzym-Inhibitoren (ACE-Inhibitoren) eingesetzt. Obwohl weit verbreitet, ist die Therapie mit ACE-Inhibitoren durch keine randomisierte, kontrollierte Studie validiert, die ein längeres Überleben bei Kindern und Jugendlichen mit symptomatischer Herzinsuffizienz durch die Therapie aufzeigt.
Eine den Leitlinien der Erwachsenenmedizin ähnelnde Reihenfolge der Arzneistoffklassen in der Therapie der chronischen Herzinsuffizienz bei Kindern wäre:
- ACE-Hemmstoffe als First-Line-Therapie: langsame Steigerung bis Zieldosis; bei Nebenwirkungen AT1-Rezeptorantagonisten erwägen;
- Betarezeptorblocker: langsame Auftitrierung;
- Mineralokortikoid-Rezeptor-Antagonisten: bei Persistenz klinischer Symptome und reduzierter linksventrikulärer Ejektionsfraktion (5-7).
Bei Salz- und Wasserretention kommen zudem Diuretika zum Einsatz.
Der ACE-Hemmer Captopril ist zugelassen zur Therapie der arteriellen Hypertonie, der Herzinsuffizienz und zur Behandlung einer diabetischen Nephropathie mit Makroproteinurie bei Typ-I-Diabetikern (8). Die Wirksamkeit und Unbedenklichkeit von Captopril bei Kindern und Jugendlichen sind nicht vollständig ermittelt. Deshalb sollte die Anwendung von Captopril bei Kindern und Jugendlichen unter sorgfältiger medizinischer Überwachung begonnen werden. Die Anfangsdosis von Captopril beträgt ca. 0,3 mg/kg Körpergewicht. Bei Patienten, bei denen besondere Vorsichtsmaßnahmen erforderlich sind, wie Kinder mit Niereninsuffizienz, Frühgeborene, Neugeborene und Säuglinge, die eine geringere Nierenfunktion als ältere Kinder und Erwachsener aufweisen, sollte die Anfangsdosis nur 0,15 mg/kg Körpergewicht betragen. Im Allgemeinen wird Captopril Kindern dreimal täglich verabreicht (8); Dosis und Dosierungsintervall sollten jedoch individuell an das Ansprechen des Patienten angepasst werden.
Enalapril ist zugelassen zur Therapie der arteriellen Hypertonie und der symptomatischen Herzinsuffizienz (9). Bei pädiatrischen Patienten über sechs Jahren mit Hypertonie liegen begrenzte Daten zur Anwendung von Enalapril vor. Die empfohlene Anfangsdosis beträgt 2,5 mg für Patienten mit einem Körpergewicht von 20 bis < 50 kg und 5 mg für Patienten mit einem Körpergewicht ≥ 50 kg. Enalapril wird einmal täglich angewendet. Die Dosierung sollte gemäß den Erfordernissen des Patienten angepasst werden, wobei ein Maximum von 20 mg/Tag für Patienten mit einem Körpergewicht von 20 bis < 50 kg und von 40 mg/Tag für Patienten ≥ 50 kg nicht überschritten werden sollte.
Eine pharmakokinetische Studie mit verschiedenen Dosierungen wurde bei 40 hypertonen Mädchen und Jungen im Alter von zwei Monaten bis zu 16 Jahren durchgeführt, die oral 0,07–0,14 mg/kg Körpergewicht pro Tag erhielten. Insgesamt ergab diese Studie bezüglich der Pharmakokinetik von Enalaprilat (der aktiven Form von Enalapril) keine größeren Unterschiede zwischen Kindern und Erwachsenen (9). Die Beziehung zwischen der aus Erwachsenenstudien extrapolierten Dosis und der Pharmakokinetik wurde kürzlich extensiv untersucht, auch im Rahmen einer geplanten PUMA-Zulassung (10-12). Die Kinder wurden acht Wochen lang mit orodispensiblen Minitabletten gemäß einem altersgerechten Dosierungsschema behandelt. Das primäre Ziel war die Beschreibung der Pharmakokinetik von Enalapril und seinem aktiven Metaboliten Enalaprilat (12). Von 102 Patienten wurden 89 Patienten (n = 26 mit dilatativer Kardiomyopathie; n = 63 mit angeborenem Herzfehler) eingeschlossen und die Kinetik von Enalapril und Enalaprilat beschrieben. Die verwendeten Dosierungsschema schienen gut vertragen zu werden und führten zu keinen signifikanten arzneimittelbedingten schwerwiegenden unerwünschten Ereignissen. Die Autoren schlussfolgerten, dass die Analyse der Pharmakokinetik und das Fehlen schwerwiegender Nebenwirkungen die Anwendung von Enalapril mit der untersuchten Minitablette rechtfertigen. Patientenrelevante Endpunkte wurden leider nicht erhoben.
PUMA (Paediatric use marketing authorisation) – Genehmigung für die pädiatrische Verwendung: PUMA ist eine relativ neue Form der Arzneimittelzulassung. Diese besondere, zusätzliche Genehmigung kann für jedes Arzneimittel erteilt werden, welches bereits für Erwachsene zugelassen ist, und für das eine weitere Zulassung ausschließlich für die Verwendung in der pädiatrischen Bevölkerung beantragt wird. Diese Genehmigung kann für alle pädiatrischen Indikationen in allen oder bestimmten Altersgruppen und für die Entwicklung kindgerechter Darreichungsformen erteilt werden. Als Ausgleich für den Aufwand für eine PUMA gewährt die Zulassungsbehörde einen zehnjährigen Unterlagenschutz (achtjähriger Unterlagenschutz für die an Kindern erhobenen Daten plus zweijährige Marktexklusivität), der die Marktexklusivität des kindgerechten Präparats sichern soll.
Die akuten hämodynamischen Wirkungen von ACE-Hemmern auf Links-Rechts-Shunts wurden in drei Studien mit 8–12 Kindern untersucht (6). Sechs Beobachtungsstudien mit 12–63 Patienten berichten über positive Wirkungen von ACE-Hemmern auf Gewichtszunahme, Atemfrequenz und Überlebensrate nach ein und zwei Jahren, wenn der Wirkstoff zusätzlich zur konventionellen Therapie verabreicht wird (6). In einer großen randomisierten, kontrollierten Studie mit 230 Säuglingen mit Single-Ventrikel besserte die Gabe von Enalapril (Zieldosis 0,4 mg/kg Körpergewicht pro Tag) gegenüber Placebo zwar das somatische Wachstum, aber die Ventrikelfunktion oder der Schweregrad der Herzinsuffizienz änderten sich nicht (13). Die Therapie mit Enalapril war aber recht sicher (14). So unterschied sich die Inzidenz von Hyperkaliämie und Neutropenie nicht zwischen den Gruppen. Eine Nierenfunktionsstörung trat bei 3 % der Enalapril-Gruppe und bei keinem der Placebo-Patienten auf, war aber statistisch nicht signifikant. In beiden Gruppen wurden häufig schwerwiegende unerwünschte Ereignisse berichtet, und es gab keinen Unterschied in der Häufigkeit von Herztransplantationen oder Todesfällen zwischen den Gruppen.
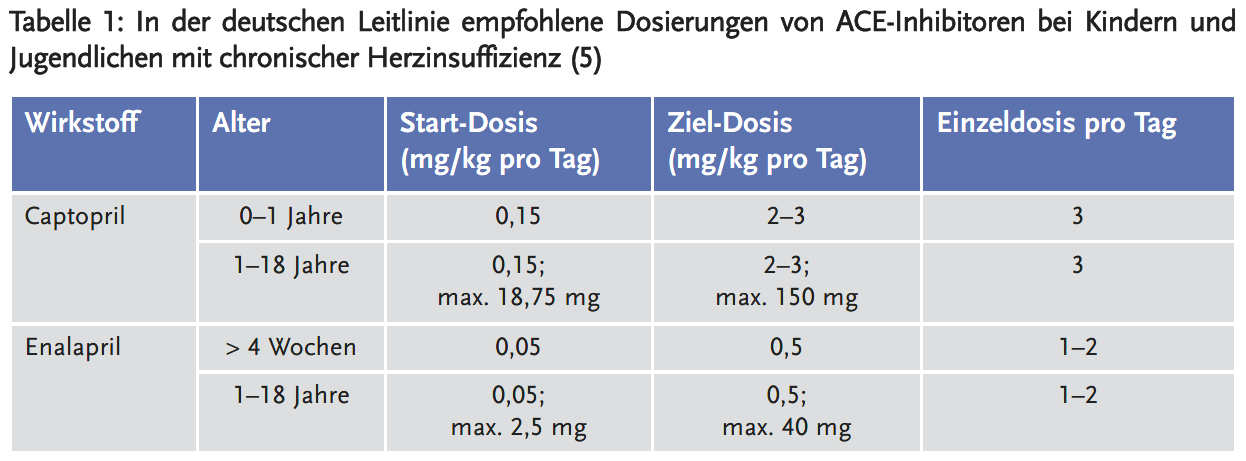
Neben ACE-Inhibitoren (Tabelle 1) werden Betablocker zur Therapie der chronischen Herzinsuffizienz bei Kindern eingesetzt.
Metoprolol ist unter anderem zugelassen bei Erwachsenen zur Behandlung der Hypertonie, der chronisch stabilen koronaren Herzkrankheit und der schnellen Formen der Herzrhythmusstörungen, sowie bei Kindern ab sechs Jahren und Jugendlichen zur Behandlung der Hypertonie (15). Die empfohlene Anfangsdosis bei Kindern ab sechs Jahren beträgt einmal täglich 0,5 mg/kg Körpergewicht.
Bisoprolol ist zugelassen zur Behandlung der essenziellen Hypertonie, der stabilen chronischen Angina pectoris und der stabilen chronischen Herzinsuffizienz mit eingeschränkter systolischer linksventrikulärer Funktion, zusätzlich zu ACE-Hemmern und Diuretika (16). Für Kinder und Jugendliche gibt es wegen fehlender Daten keine Zulassung. Aber es wird in mehreren kinderkardiologischen Zentren in Deutschland als Betablocker der Wahl eingesetzt.
Carvedilol ist zugelassen bei Erwachsenen zur Behandlung der essenziellen Hypertonie, der chronisch stabilen Angina pectoris und als zusätzliche Behandlung bei mittelschwerer bis schwerer stabiler Herzinsuffizienz (17). Bei Kindern und Jugendlichen gibt es laut Fachinformation keine Erfahrungen.
Ein Cochrane-Review aus dem Jahre 2020 bewertete die Wirkung von Betablockern bei Kindern mit chronischer Herzinsuffizienz und kam zu dem Schluss, dass die eingeschlossenen Studien keinen signifikanten Unterschied zwischen der Betablocker- und der Kontrollgruppe bezüglich der Sterblichkeit oder Notwendigkeit einer Herztransplantation zeigten (18). Insgesamt wurden sieben Studien mit 420 Teilnehmern betrachtet, vier davon sehr klein mit jeweils 20 bis 30 Kindern und zwei größere Studien mit jeweils 80 Kindern. Sie zeigten eine Verbesserung der dekompensierten Herzinsuffizienz unter Betablocker-Therapie. Eine größere randomisierte, placebokontrollierte Studie untersuchte einen kombinierten Endpunkt bezüglich der Herzinsuffizienz (19). Bei der Mehrheit der Teilnehmer (59 %) war die der Herzinsuffizienz durch eine dilatative Kardiomyopathie bedingt; bei 27 % handelte es sich um einen angeborenen Herzfehler mit einem systemischen Ventrikel, der kein linker Ventrikel war; und bei 14 % handelte es sich um einen angeborenen Herzfehler mit einem dysfunktionalen systemischen linken Ventrikel. Carvedilol (n = 106; Dosis: 0,2 oder 0,4 mg/kg pro Tag) zeigte versus Placebo (n = 54) keine klinische Verbesserung der Herzinsuffizienzparameter bei den Kindern und Jugendlichen (mittleres Alter: 1,8 bis 3,6 Jahre in den unterschiedlichen Gruppen).
Bei Betablockern wurden keine signifikanten unerwünschten Ereignisse berichtet, abgesehen von einer Episode eines kompletten Herzblocks. Eine Metaanalyse der Daten zur linksventrikulären Ejektionsfraktion und Verkürzungsfraktion zeigte eine sehr geringe Verbesserung mit Betablockern.
Die Charakteristika der Patienten aus vier weiteren prospektiv randomisierten, kontrollierten Studien waren sehr unterschiedlich: Carvedilol bei Kardiomyopathien (n = 40) (20), Carvedilol bei linksventrikulärer Dysfunktion vor Herztransplantation (n = 14) (21), Propranolol bei Säuglingen mit Links-Rechts-Shunt-Defekten (n = 10) (22), Bisoprolol bei Kindern mit operierter Fallot-Tetralogie (n = 13) (23).
Sieben Beobachtungsstudien zeigten ausnahmslos eine Verbesserung der klinischen Scores und Echoparameter (insgesamt 199 Patienten aus sieben Studien mit 6 bis 53 Patienten) (6). Die Studienpopulation war homogener: fünf Studien mit dilatativer Kardiomyopathie und eine mit kardialer Beteiligung bei Duchenne-Muskeldystrophie; eine Studie betraf Patienten mit univentrikulärem Herzen (6).
Somit fehlt für Betablocker – wie auch für ACE-Inhibitoren – die notwendige Evidenz, um Betablocker bei Kindern mit dekompensierter Herzinsuffizienz zu empfehlen oder gar davon abzuraten. Es können auch keine validen Dosisempfehlungen gegeben werden. Die spärlichen verfügbaren Daten deuteten jedoch darauf hin, dass Kinder mit kongestiver Herzinsuffizienz davon profitieren könnten. Während Carvedilol in den USA beliebt ist, wird in Deutschland in den Kinderherzzentren oft Bisoprolol oder Metoprolol verwendet (Tabelle 2).
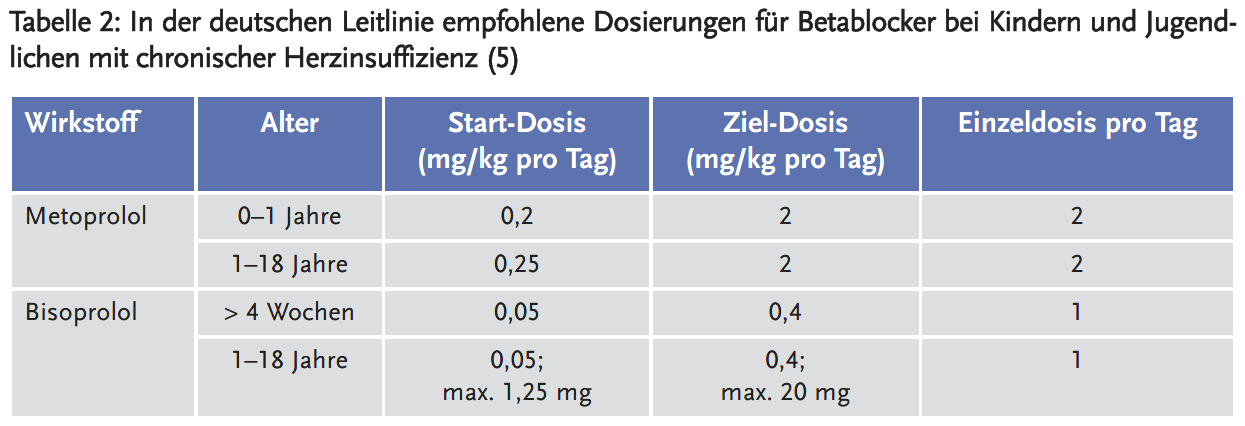
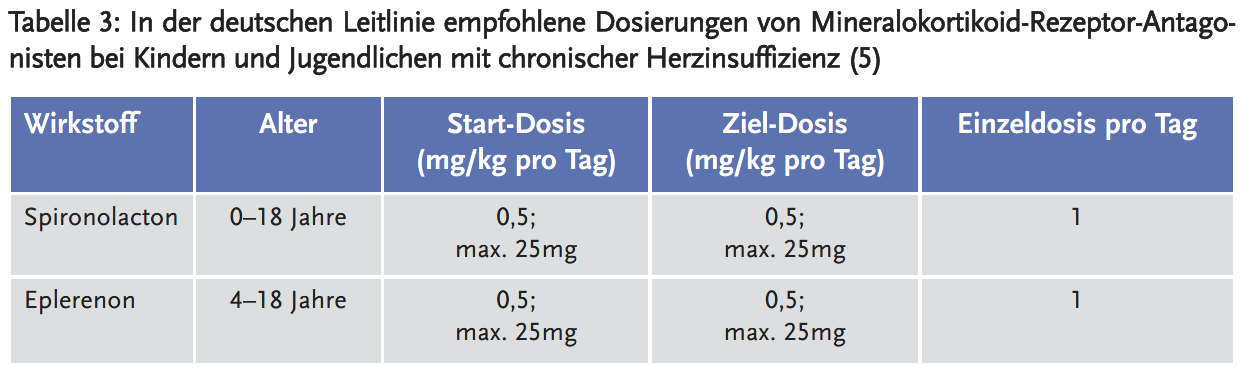
Neben Betablockern und ACE-Inhibitoren werden zur Therapie der chronischen Herzinsuffizienz bei Kindern und Jugendlichen in den Leitlinien auch Mineralokortikoid-Rezeptor-Antagonisten empfohlen (5;6) (Tabelle 3).
Spironolacton ist zugelassen zur Behandlung des primären Hyperaldosteronismus, sofern nicht eine Operation angezeigt ist und zur Behandlung von Ödemen und/oder Aszites bei Erkrankungen, die mit einem sekundären Hyperaldosteronismus einhergehen (24). Es gibt für Kinder und Jugendliche keine klinischen Studiendaten, aber in der Fachinformation werden folgende Dosierungen aus Leitlinien angegeben:
- Neugeborene: 1–2 mg/kg täglich, aufgeteilt in 1–2 Einzeldosen; bis zu 7 mg/kg täglich bei resistentem Aszites;
- Kinder ab 1 Monat bis 12 Jahre: 1–3 mg/kg täglich, aufgeteilt in 1–2 Einzeldosen; bis zu 9 mg/kg täglich bei resistentem Aszites.
- Jugendliche von 12 bis 18 Jahren: 50–100 mg täglich, aufgeteilt in 1–2 Einzeldosen; bis zu 9 mg/kg täglich (maximal 400 mg täglich) bei resistentem Aszites (24).
Für Spironolacton gibt es nur kleine Beobachtungsstudien aus dem letzten Jahrhundert, aber keine prospektive Studie mit klar definierten Endpunkten zur Beurteilung der Wirksamkeit und Sicherheit; damit ist die Datenlage sehr begrenzt (6).
Eplerenon ist zugelassen bei Erwachsenen zur Behandlung der Herzinsuffizienz zusätzlich zur Standardtherapie nach kürzlich aufgetretenem Myokardinfarkt und zusätzlich zu einer optimalen Standardtherapie bei Erwachsenen mit chronischer Herzinsuffizienz zur Verringerung des Risikos der kardiovaskulären Mortalität und Morbidität (25). Für Eplerenon werden in der Fachinformation Daten bei Kindern mit arterieller Hypertonie berichtet (25). In einer zehnwöchigen Studie an 4 bis 16 Jahre alten Kindern und Jugendlichen mit Hypertonie (n = 304) bewirkte Eplerenon in Dosen (25 mg täglich bis 100 mg täglich) entsprechend der Dosierung bei Erwachsenen keine effektive Blutdrucksenkung. In dieser Studie sowie in einer Sicherheitsstudie über ein Jahr wurde bei 149 Kindern und Jugendlichen (Altersbereich: 5 bis 17 Jahre) ein Sicherheitsprofil erhoben, das vergleichbar mit dem von Erwachsenen war (25).
Ein populationspharmakokinetisches Modell für die Eplerenon-Konzentrationen aus zwei Studien an 51 pädiatrischen Probanden mit Hypertonie im Alter von 4 bis 16 Jahren ergab, dass das Körpergewicht einen statistisch signifikanten Einfluss auf das Verteilungsvolumen von Eplerenon hat, nicht jedoch auf dessen Clearance (25).
Behandlungsentscheidungen bei der Behandlung der Herzinsuffizienz bei Kindern und Jugendlichen
Die Behandlung der Herzinsuffizienz bei Kindern und Jugendlichen erfolgt derzeit bei mangelnder Evidenzlage und fehlender Zulassung. Es ist wichtig zu unterscheiden, welche Grundkrankheit die Herzinsuffizienz verursacht hat (angeborene Herzfehler, unzureichender Erfolg einer operativen Korrektur, dilatative oder restriktive Kardiomyopathie, Herzmuskelbeteiligung bei genetischen Muskelerkrankungen und Stoffwechseldefekten, Myokarditis). Leider ist es auch dem Pediatric Heart Network in den USA bisher nicht gelungen, ausreichend große, homogene Patientengruppen in klinische Studien einzubeziehen, die konsistente Schlussfolgerungen zulassen. Deswegen ist die medikamentöse Behandlung als Extrapolation von Ergebnissen der Studien an Erwachsenen bei Kindern und Jugendlichen als Off-label-Anwendung leider als Standard anzusehen.
Literatur
- Rodeheffer RJ, Jacobsen SJ, Gersh BJ et al.: The incidence and prevalence of congestive heart failure in Rochester, Minnesota. Mayo Clin Proc 1993; 68: 1143-1150.
- Sommers C, Nagel BH, Neudorf U, Schmaltz AA: Herzinsuffizienz im Kindesalter. Eine epidemiologische Studie. Herz 2005; 30: 652-662.
- Burstein DS, Shamszad P, Dai D et al.: Significant mortality, morbidity and resource utilization associated with advanced heart failure in congenital heart disease in children and young adults. Am Heart J 2019; 209: 9-19.
- Rossano JW, Kim JJ, Decker JA et al.: Prevalence, morbidity, and mortality of heart failure-related hospitalizations in children in the United States: a population-based study. J Card Fail 2012; 18: 459-470.
- Rickers C, Läer S, Diller GP et al.: S2k-Leitlinie Pädiatrische Kardiologie: Chronische Herzinsuffizienz: www.awmf.org/uploads/tx_szleitlinien/023-006l_S2k_Chronische_Herzinsuffizienz_Kinder_Jugendliche_2015-10-abgelaufen.pdf (letzter Zugriff: 1. September 2022). Leitlinie der Deutschen Gesellschaft für Pädiatrische Kardiologie, AWMF-Register-Nr. 023/006. Stand: Oktober 2015 (nicht mehr gültig; zurzeit in Überarbeitung).
- Schmaltz AA: Chronic congestive heart failure in infancy and childhood: new aspects of diagnosis and treatment. Klin Padiatr 2015; 227: 3-9.
- Kantor PF, Lougheed J, Dancea A et al.: Children's Heart Failure Study Group: Presentation, diagnosis, and medical management of heart failure in children: Canadian Cardiovascular Society guidelines. Can J Cardiol. 2013; 29: 1535-1552.
- AbZ-Pharma GmbH: Fachinformation „Captopril AbZ 12,5 mg Tabletten“. Stand: Juli 2019.
- AbZ-Pharma GmbH: Fachinformation „Enalapril-CT 5 mg/10 mg/20 mg Tabletten“. Stand Juli 2020.
- Smeets NJL, Schreuder MF, Dalinghaus M et al.: Pharmacology of enalapril in children: a review. Drug Discov Today 2020; 15: 1957-1970.
- Faisal M, Cawello W, Laeer S: LENA Consortium: Clinical pharmacokinetics of enalapril and enalaprilat in pediatric patients – a systematic review. Front Pediatr 2021; 9: 611322.
- Laeer S, Cawello W, Burckhardt BB et al.: Enalapril and enalaprilat pharmacokinetics in children with heart failure due to dilated cardiomyopathy and congestive heart failure after administration of an orodispersible enalapril minitablet (LENA-Studies). Pharmaceutics 2022; 14: 1163.
- Hsu DT, Zak V, Mahony L et al.: Enalapril in infants with single ventricle. Results of a multicenter randomized trial. Circulation 2010; 122: 333-340.
- Mathur K, Hsu DT, Lamour JM, Aydin SI. Safety of enalapril in infants: data from the Pediatric Heart Network Infant Single Ventricle Trial. J Pediatr 2020; 227: 218-223.
- AbZ-Pharma GmbH: Fachinformation „Metoprolol AbZ O.K. Retardtabletten“. Stand: Februar 2014.
- AbZ-Pharma GmbH: Fachinformation „Bisoprolol-AbZ 2,5 mg Tabletten“. Stand: Juni 2022.
- Ratiopharm GmbH: Fachinformation „Carvedilol-ratiopharm® 6,25 mg/12,5 mg/25 mg Tabletten“. Stand: Mai 2014.
- Alabed S, Sabouni A, Al Dakhoul S, Bdaiwi Y: Beta-blockers for congestive heart failure in children. Cochrane Database Syst Rev 2020; Issue 7: CD007037.
- Shaddy RE, Boucek MM, Hsu DT et al.: Carvedilol for children and adolescents with heart failure – a random-ized controlled trial. JAMA 2007; 298: 1171-1179.
- Huang M, Zhang X, Chen S et al.: The effect of carvedilol treatment on chronic heart failure in pediatric patients with dilated cardiomyopathy: a prospective, randomized-controlled study. Pediatr Cardiol 2013; 34: 680-685.
- Azeka E, Franchini Ramires JA, Valler C et al.: Delisting of infants and children from heart transplantation waiting list after carvedilol treatment. J Am Coll Cardiol 2002; 40: 2034-2038.
- Buchhorn R, Hulpke-Wette M, Hilgers R et al.: Propranolol treatment of congestive heart failure in infants with congenital heart disease. The CHF-PRO-INFANT Trial. Int J Cardiol 2001; 79: 176-173.
- Norozi K, Bahlmann J, Raab B et al.: A prospective, randomized, double blind, placebo controlled trial of beta-blockade in patients who have undergone surgical correction of tetralogy of Fallot. Cardiol Young 2007; 17: 372-379.
- Ratiopharm GmbH: Fachinformation „Spironolacton-ratiopharm® Tabletten“. Stand: Januar 2022.
- Ratiopharm GmbH: Fachinformation „Eplerenon-ratiopharm® 25 mg, 50 mg Filmtabletten“. Stand: August 2020.
Interessenkonflikte
Der Autor und die Autorin geben an, keine Interessenkonflikte zu haben.
