Zulassungserweiterung für Dupilumab
Therapie aktuell
Dupilumab
Der rekombinante, humane, monoklonale IgG4-Antikörper Dupilumab ist spezifisch gegen die an Typ-I- und -II-Rezeptoren vorkommende Interleukin(IL)-4Rα-Untereinheit auf Immunzellen wie B- oder T-Zellen gerichtet und hemmt so die über Interleukin-4 und Interleukin-13 (IL-4 und IL-13) ausgelösten Reaktionskaskaden. Dupilumab wirkt dadurch bei Erkrankungen, deren Pathophysiologie auf einer überaktiven IL-4- und IL-13-Signalübertragung beruhen, antiphlogistisch und immunsuppressiv (1;2).
Zulassung
Initial wurde Dupilumab 2017 zur Behandlung der mittelschweren bis schweren atopischen Dermatitis (AD) bei Erwachsenen zugelassen (3). Zwischenzeitlich erfolgten mehrere Indikationserweiterungen (Tabelle 1).
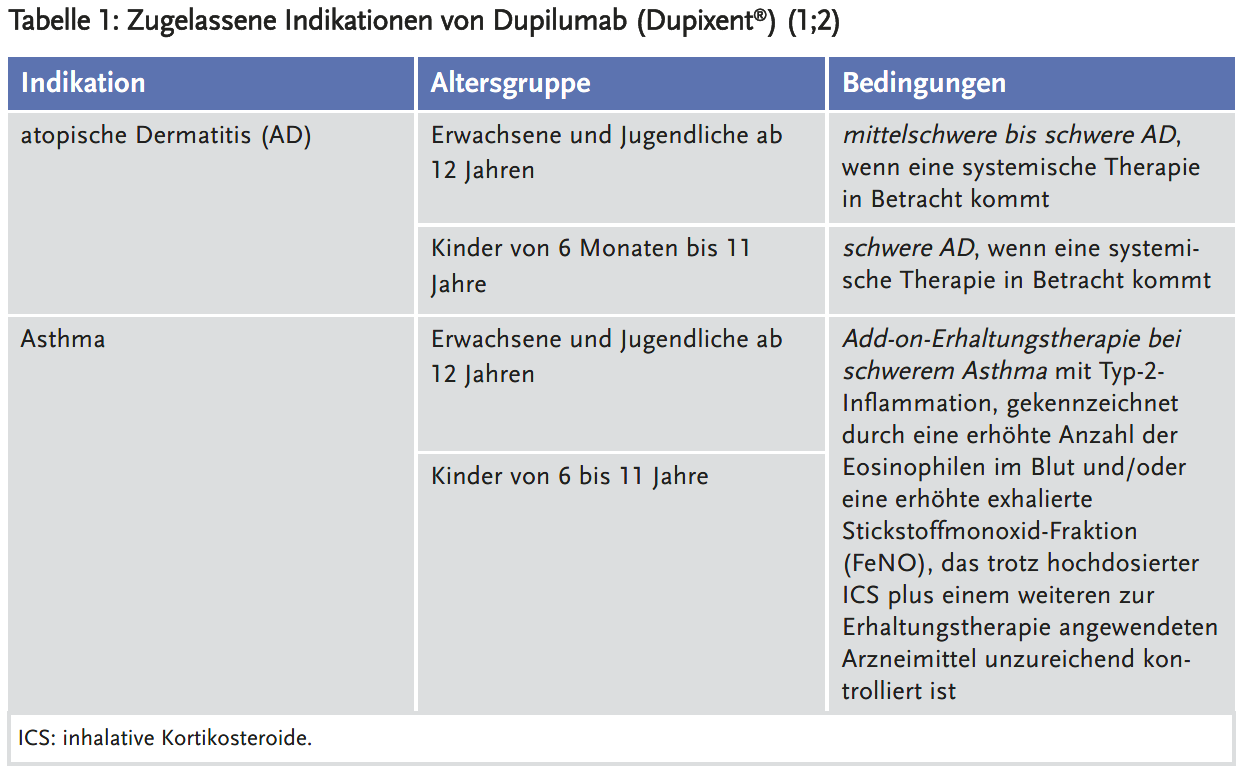
Die letzte Indikationserweiterung erfolgte im März 2023 bei Kindern im Alter von sechs Monaten bis fünf Jahren mit AD (4).
Behandlung der AD bei Kindern im Alter von sechs Monaten bis fünf Jahren
Eine mögliche Zulassungserweiterung von Dupilumab als systematische Therapieoption bei Kindern mit AD von sechs Monaten bis fünf Jahren hatten wir in einem Artikel in AVP (Ausgabe 4/2022 vom Dezember 2022) besprochen. Nachfolgend fassen wir die Evidenz aus den Zulassungsstudien zusammen.
Die Wirksamkeit und Sicherheit von Dupilumab in Kombination mit topischen Kortikostikosteroiden (TCS) wurden in einer pivotalen multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie (AD-1539) mit 162 Patienten im Alter von sechs Monaten bis fünf Jahren mit mittelschwerer bis schwerer AD (125 Patienten hatten eine schwere AD mit IGA = 4 zum Studieneinschluß) evaluiert (4). Die eingeschlossen Patienten hatten zuvor auf eine topische Behandlung nicht ausreichend angesprochen. Patienten mit einem Ausgangsgewicht von ≥ 5 kg bis < 15 kg erhielten eine Anfangsdosis von 200 mg an Tag 1, gefolgt von 200 mg alle vier Wochen von Woche 4 bis Woche 12. Patienten mit einem Ausgangsgewicht von ≥ 15 kg bis < 30 kg erhielten eine Anfangsdosis von 300 mg an Tag 1, gefolgt von 300 mg alle vier Wochen von Woche 4 bis Woche 12. Die Patienten konnten nach Ermessen des Prüfarztes eine Rescue-Therapie erhalten, wurden dann aber als Non-Responder eingestuft. Das mittlere Alter betrug 3,8 Jahre, das mediane Körpergewicht 16,5 kg, 38,9 % der Patienten waren weiblich.
Als ko-primäre Endpunkte wurden erhoben:
- der Anteil der Patienten mit einem Investigator Global Assessment (IGA) Score von 0 oder 1 („erscheinungsfrei“ oder „fast erscheinungsfrei“) in Woche 16;
- der Anteil der Patienten mit einer Eczema Area and Severity Index (EASI)-75-Verbesserung um mindestens 75 %) in Woche 16.
Investigator Global Assessment (IGA) ist ein Instrument (5-Punkte-IGA-Skala) zur Beurteilung des Schweregrads einer atopischen Dermatitis:
0 – nicht betroffen: Keine entzündlichen Anzeichen einer atopischen Dermatitis (kein Erythem, keine Induration/Infiltration, keine Lichenifikation, kein Nässen, keine Verkrustungen). Postinflammatorische Hyperpigmentierung und/oder Hypopigmentierung können vorhanden sein.
1 – Wenig betroffen: Kaum wahrnehmbare Erytheme, kaum wahrnehmbare Induration/Erhabenheit und/oder minimale Lichenifikation. Kein Nässen, keine Krustenbildung.
2 – mild: Leichtes aber deutliches Erythem (rosa), leichte aber deutliche Induration/Erhabenheit und/oder leichte, aber deutliche Lichenifikation. Kein Nässen, keine Krustenbildung.
3 – mäßig: Deutlich wahrnehmbares Erythem (stumpfes Rot), deutlich wahrnehmbare Induration/Erhabenheit und/oder deutlich wahrnehmbare Lichenifikation. Nässen und Krustenbildung können vorhanden sein.
4 – schwer: Ausgeprägtes Erythem (tief oder hellrot), deutliche Induration/Erhabenheit und/oder deutliche Lichenifikation. Die Krankheit ist weit verbreitet. Nässen oder Krustenbildung kann vorhanden sein.
Quelle: Simpson E, Bissonnette R, Eichenfield LF et al.: The Validated Investigator Global Assessment for Atopic Dermatitis (vIGA-AD): The development and reliability testing of a novel clinical outcome measurement instrument for the severity of atopic dermatitis. J Am Acad Dermatol 2020; 83: 839-846.
Eczema Area and Severity Index (EASI): Der EASI-Score dient zur objektiven Erfassung der Schwere und Ausbreitung der AD. EASI beurteilt die Krankheitsaktivität durch Erfassung der Schwere der Erkrankung, der Ausbreitung bzw. der befallenen Fläche. Es können Werte zwischen 0 und 72 errechnet werden. Der Körper wird zur Beurteilung in vier verschiedene Körperabschnitte unterteilt: Kopf, Rumpf, Arme und Beine. Diese werden dann entsprechend ihres prozentualen Anteils an der Gesamtoberfläche unterschiedlich altersadaptiert gewichtet.
Die Ausdehnung des Krankheitsbefalls wird dann für jeden einzelnen Körperabschnitt bestimmt anhand einer numerischen Skala. Für die Beurteilung des Schweregrades werden die Hautläsionen auf einer Skala von 0 bis 3 bewertet: 0 = keine, 1 = gering, 2 = mittel, 3 = stark. Im Einzelnen beurteilt man dabei Erythem, Infiltration, Exkoriation sowie Lichenifizierung.
Quelle: Barbier N, Paul C. Luger T et al.: Validation of the Eczema Area and Severity Index for atopic dermatitis in a cohort of 1550 patients from the Pimecrolimus cream 1% randomized controlled clinical trials programme. Br J Dermatol 2003; 150: 96-102.
Die Ergebnisse zu ausgewählten Endpunkten sind in Tabelle 2 dargestellt.
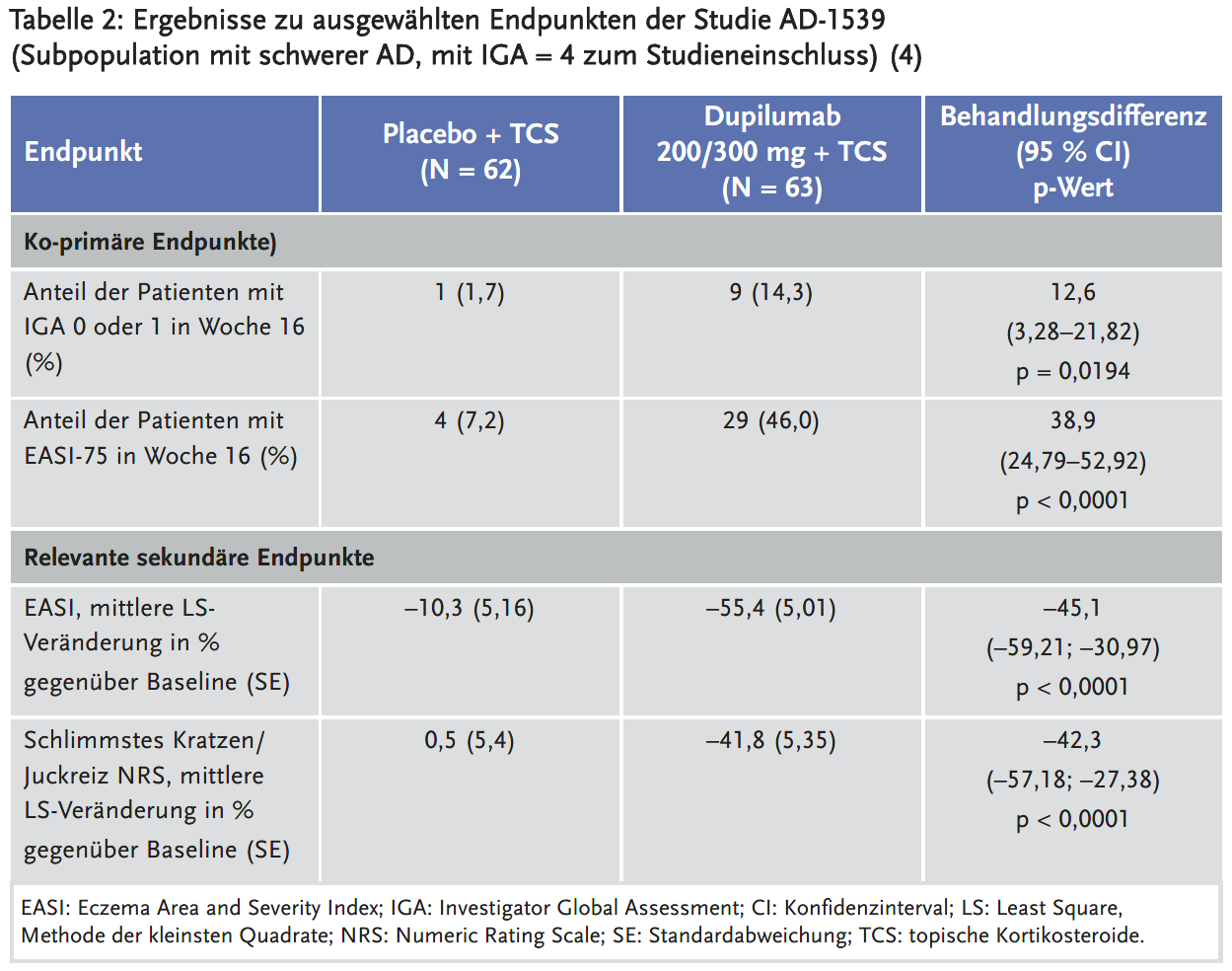
Beim Lesen der Fachinformation zu Dupilumab sollte unbedingt darauf geachtet werden, dass der pharmazeutische Unternehmer in einer Tabelle die Wirksamkeitsergebnisse der Studie AD-1539 erst zum Gesamtanalyse-Datensatz (Patienten mit mittelschwerer und schwerer AD, Full Analysis Set, FAS) angegeben hat und direkt daneben in derselben Tabelle die relevanteren Ergebnisse zur Subpopulation mit schwerer AD (1;2). Die FAS-Ergebnisse sehen – zumindest nummerisch – besser aus, da das Ansprechen höher als in der Subpopulation mit schwerer AD war. Dies ist irreführend, da Dupilumab in dieser Altersgruppe nur bei schwerer AD zugelassen wurde.
Die Sicherheit von Dupilumab war in dieser Studie bis einschließlich Woche 16 mit dem Sicherheitsprofil von Dupilumab in Studien bei Erwachsenen sowie bei Kindern und Jugendlichen im Alter von 6 bis 17 Jahren mit AD vergleichbar. Vorzeitige Therapieabbrüche aufgrund von Nebenwirkungen traten bei je 1,6 % der Patienten mit schwerer AD unter Dupilumab und unter Placebo auf. Ausgewählte Nebenwirkungen, die unter Dupilumab häufiger auftraten als unter Placebo in dieser Subpopulation waren: Nasopharyngitis (9,5 % vs. 3,3 %), Dellwarzen (6,3 % vs. 3,3 %), Konjunktivitis (4,8 % vs. 0 %), virale Gastroenteritis (4,8 % vs. 0 %) und Karies (6,3 % vs. 0 %). Schwerwiegende Nebenwirkungen traten in dieser Subpopulation allerdings nur unter Placebo auf (Überempfindlichkeitsreaktionen und Infektionen) (4).
Dupilumab wird derzeit in der Indikation schwere AD bei Kindern von sechs Monaten bis fünf Jahren bezüglich seines Zusatznutzens von G-BA bewertet (5). Der Beschluss wird für Ende September 2023 erwartet.
Literatur
Sanofi-Aventis Deutschland GmbH: Fachinformation „Dupixent® 200 mg Injektionslösung in einer Fertigspritze, Dupixent® 200 mg Injektionslösung im Fertigpen“. Stand: März 2023.
Sanofi-Aventis Deutschland GmbH: Fachinformation „Dupixent® 300 mg Injektionslösung in einer Fertigspritze, Dupixent® 300 mg Injektionslösung im Fertigpen“. Stand: März 2023.
European Medicines Agency: Assessment Report: Dupixent: https://www.ema.europa.eu/en/documents/assessment-report/dupixent-epar-public-assessment-report_en.pdf. (letzter Zugriff: 1. Juni 2023). London, 20. Juli 2017.
European Medicines Agency: Assessment Report – Variation: Dupixent: https://www.ema.europa.eu/en/documents/variation-report/dupixent-h-c-4390-ii-0060-epar-assessment-report-variation_en.pdf. (letzter Zugriff: 1. Juni 2023). Amsterdam, 26. Januar 2023.
Gemeinsamer Bundesausschuss (G-BA): Nutzenbewertungsverfahren zum Wirkstoff Dupilumab (Neues Anwendungsgebiet: Atopische Dermatitis, 6 Monate bis 5 Jahre): https://www.g-ba.de/bewertungsverfahren/nutzenbewertung/932/. Letzter Zugriff: 1. Juni 2023.
