Leitfaden der AkdÄ: „Medikamentöse Cholesterinsenkung zur Vorbeugung kardiovaskulärer Ereignisse“
Therapie aktuell
Weiterer Autor: Dr. med. Hans Wille, Bremen
Einführung
Die Leitfäden der AkdÄ wollen Ärztinnen und Ärzte dabei unterstützen, gut begründete Behandlungsentscheidungen zu treffen. Aktuell wurde der 5. Leitfaden der AkdÄ veröffentlicht. Unter dem Titel „Medikamentöse Cholesterinsenkung zur Vorbeugung kardiovaskulärer Ereignisse“ diskutiert der Leitfaden Nutzen und Risiken verschiedener Lipidsenker (Abbildung 1). Der Leitfaden konzentriert sich auf typische klinische Entscheidungssituationen, die charakterisiert sind durch 1. häufige Indikationen für eine lipidsenkende Therapie (z. B. KHK) und 2. gängige Vorbehandlungen (z. B. Statine). Nichtmedikamentöse Therapien und andere Indikationen der Lipidsenkung (z. B. Pankreatitis bei Hypertriglyzeridämie) werden nicht thematisiert.

PICO-Fragen: Was ist der beste Lipidsenker für diesen Patienten?
Als Substanzen zur Senkung des Low-density-Lipoprotein-Cholesterin (LDL-C) stehen Statine, Cholesterinresorptionshemmer (Ezetimib), PCSK9-Hemmer (Alirocumab, Evolocumab), ACL-Hemmer (Bempedoinsäure) und Inclisiran zur Verfügung. Anionenaustauscher (Cholestyramin) und Fibrate haben zur Senkung des LDL-C aufgrund ihres Nebenwirkungsprofils keine klinische Relevanz mehr in der Versorgung. Statine werden entsprechend ihrer durchschnittlichen prozentualen LDL-C-Senkung in drei Gruppen eingeteilt:
- prozentuale LDL-C-Senkung < 30 %: niedrige Intensität, z. B. Pravastatin 20 mg
- prozentuale LDL-C-Senkung 30–49 %: moderate Intensität, z. B. Simvastatin 40 mg
- prozentuale LDL-C-Senkung ≥ 50 %: hohe Intensität, z. B. Atorvastatin 40 mg.
Die Auswahl der medikamentösen Therapie wird geleitet durch die Frage: Was ist der beste Lipidsenker für diesen Patienten? Diese klinische Kernfrage lässt sich in vier Teilfragen untergliedern:
- Mit welchen anderen Patienten ist dieser Patient vergleichbar?
- Welches Medikament könnte eine Option sein?
- Welches andere Medikament steht alternativ zur Verfügung bzw. ist der Therapieverzicht auch eine sinnvolle Möglichkeit?
- Was sind die Ziele der Behandlung?
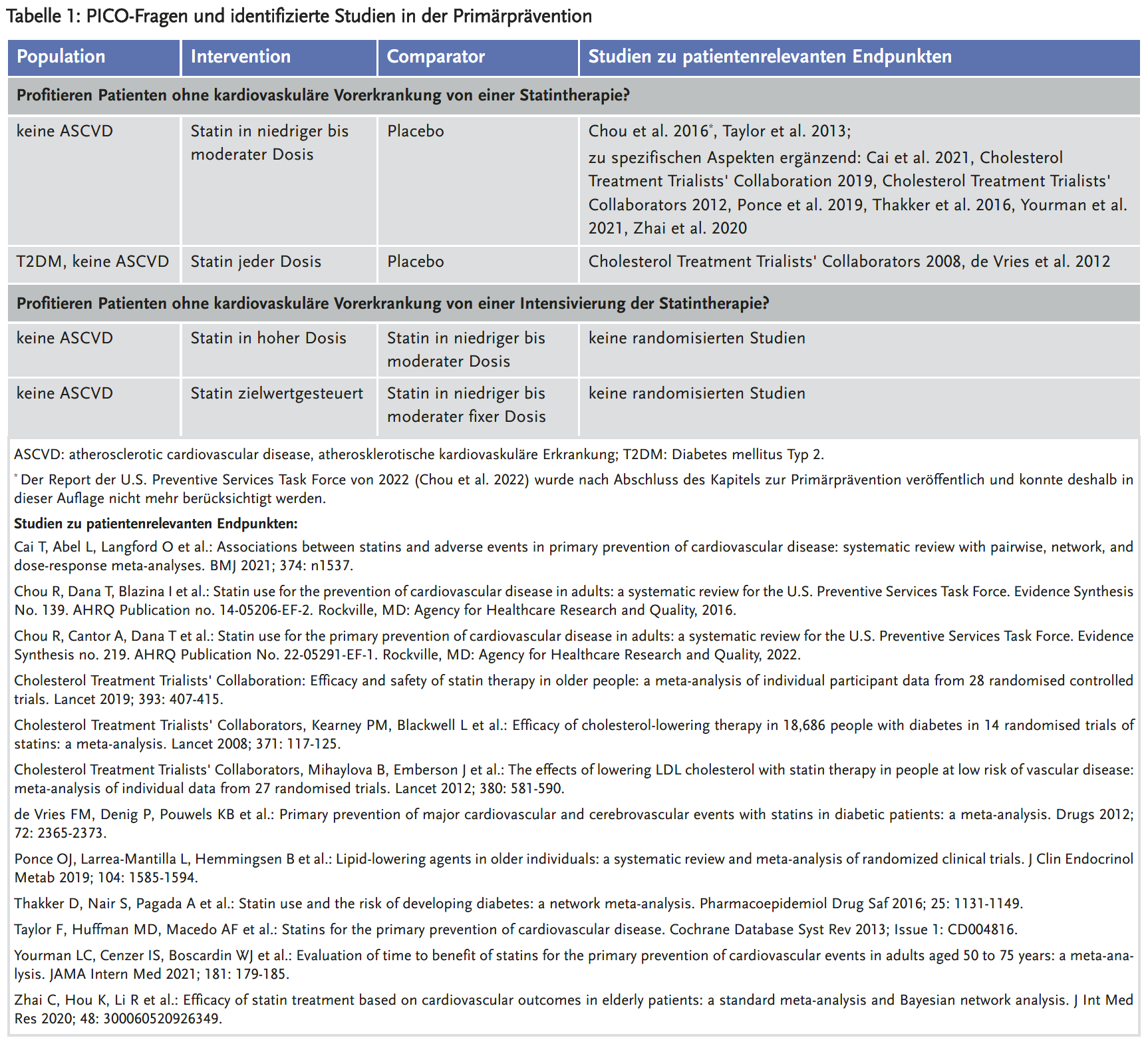
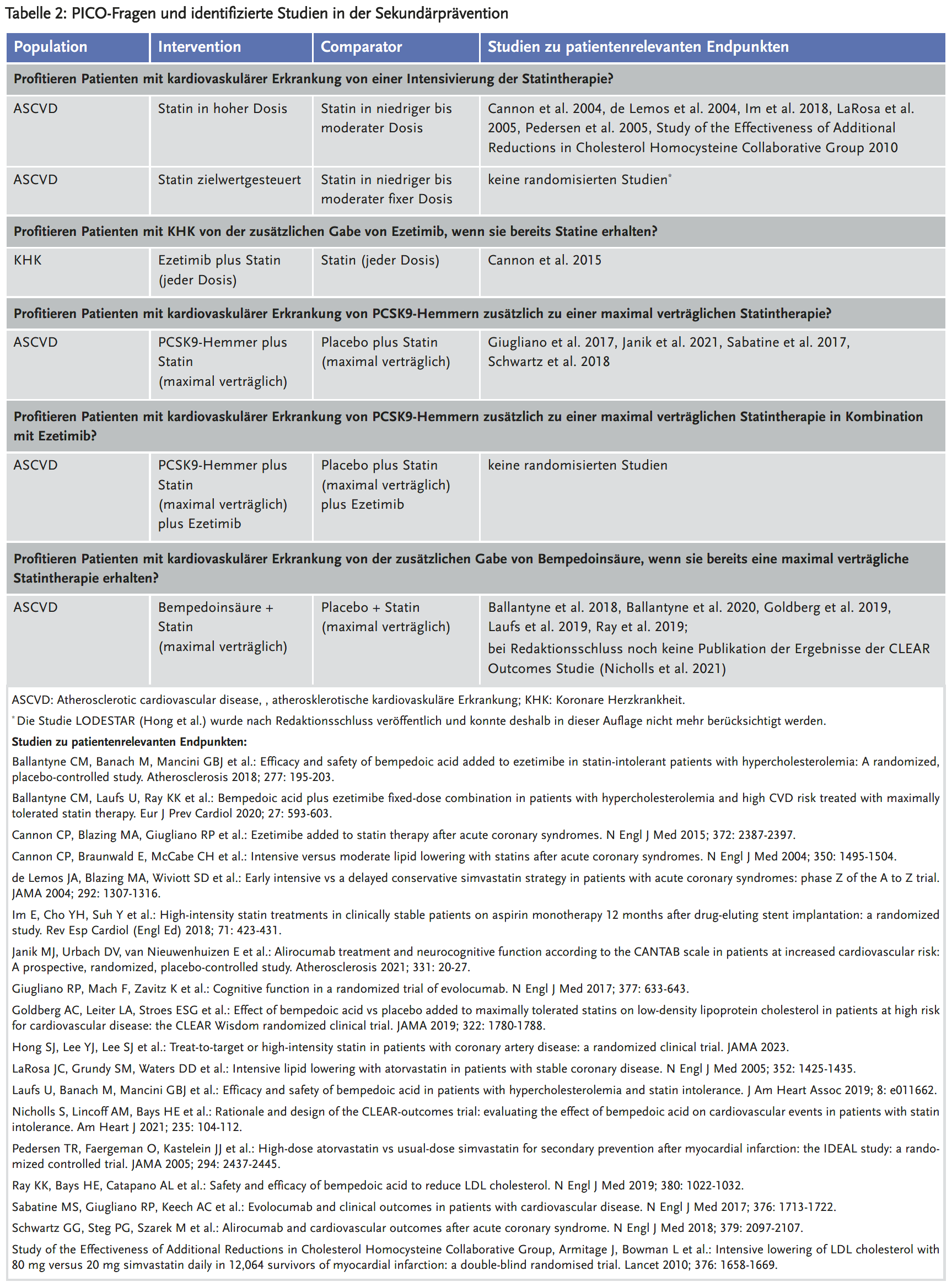
Für eine strukturierte Literaturrecherche nach randomisierten klinischen Studien werden diese vier Aspekte als sogenannte PICO-Frage formuliert: P (Population) – I (Intervention) – C (Comparator) – O (Outcome). Die Autoren des Leitfadens wählten für die erste Auflage zehn PICO-Fragen aus (siehe Tabellen 1 und 2).
Behandlungsziele: Surrogatparameter und patientenrelevante Endpunkte
Die Frage nach den Therapiezielen muss bei der klinischen Behandlungsentscheidung am Anfang stehen und kann nur gemeinsam mit dem Patienten beantwortet werden. Für Frau Müller ist es zunächst unwichtig, ob ihr LDL-C-Wert um 50 % gesenkt wird und auf dem nächsten Laborausdruck unter 70 mg/dl liegt. Für Frau Müller ist die LDL-C-Senkung nur relevant als Mittel zu ihren eigentlichen Zielen: Frau Müller möchte noch möglichst lange selbstständig zu Hause leben und sie will nächstes Jahr wieder im Allgäu mit ihrem Mann wandern gehen. Eine wirksame LDL-C-Senkung ist für Frau Müller deshalb nur dann von Bedeutung, wenn hierdurch ihre Lebenserwartung steigt und ihre körperliche Belastbarkeit und ihr Wohlbefinden erhalten bleiben.
Die gemeinsamen Leitlinien der Europäischen Kardiologischen Gesellschaft (ESC) und der Europäischen Atherosklerose-Gesellschaft (EAS) (1) zur Behandlung von Dyslipidämien gehen davon aus, dass das relative Risiko für kardiovaskuläre Ereignisse umso stärker gesenkt wird, je größer die absolute LDL-C-Senkung ist. Diese These stützt sich u. a. auf eine Analyse der von der pharmazeutischen Industrie initiierten CTT-Collaboration von 2010, die bei der gepoolten Analyse von Statinstudien pro 1 mmol/l LDL-C-Senkung eine relative Risikoreduktion schwerer kardiovaskulärer Ereignisse von 23 % fand (2). Die Leitlinien der ESC/EAS betrachten den LDL-C-Wert als ausreichend validierten Surrogatparameter, d. h. als einen einfach und schnell zu messenden Wert, von dem vorausgesetzt wird, dass eine Assoziation zu patientenrelevanten Endpunkten besteht.
Die Studienergebnisse zu Ezetimib (3) und den PCSK9-Hemmern (4;5) widersprechen jedoch einer Übertragbarkeit der CTT-Ergebnisse auf andere Lipidsenker: Sowohl bei Ezetimib als auch bei den PCSK9-Inhibitoren ist die relative kardiovaskuläre Risikoreduktion pro 1 mmol/l LDL-C-Senkung deutlich geringer als bei Statinen. Zudem sind die Cholesterin-Ester-Transfer-Protein(CETP)-Hemmer (wie z. B. Torcetrapib) ein Beispiel dafür, dass Lipidsenker trotz starker LDL-C-Reduktion keinen – oder sogar einen negativen – Einfluss auf das kardiovaskuläre Risiko haben (6;7). Aus Sicht der AkdÄ ist es deshalb nicht möglich, bei Lipidsenkern vom Ausmaß der LDL-C-Senkung auf den klinischen Nutzen zu schließen. Der Leitfaden der AkdÄ diskutiert nur ausreichend große und aussagekräftige klinische Studien, die patientenrelevante Endpunkte direkt untersuchen. Patientenrelevante Endpunkte sind dabei insbesondere die Sterblichkeit und die Häufigkeit von Myokardinfarkten und Schlaganfällen.
Patientengruppen: Abschätzung des Ausgangsrisikos
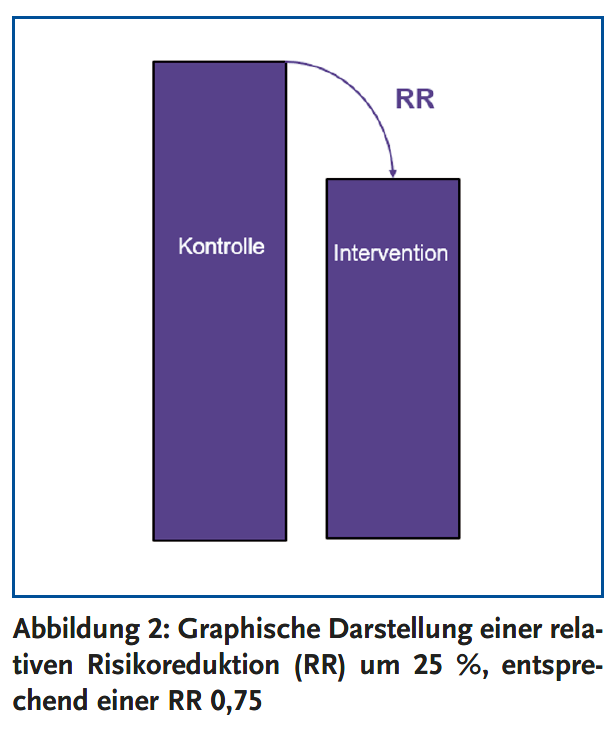
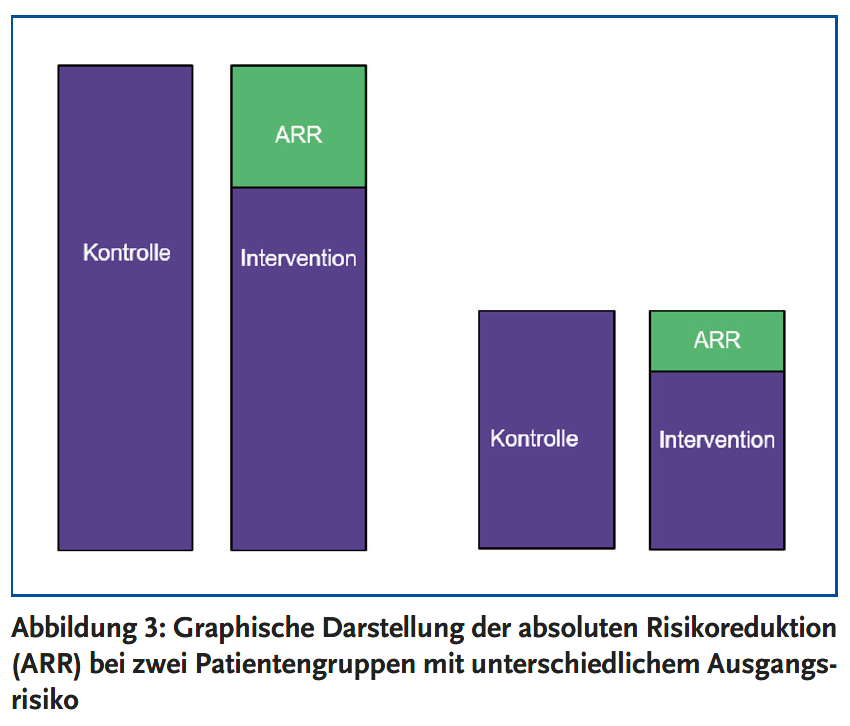
Die relative Risikoreduktion vergleicht das Risiko, im Interventionsarm ein bestimmtes Ereignis zu erleiden, mit dem Risiko, dieses Ereignis im Placeboarm zu erleiden (Abbildung 2). Das Ausmaß der relativen Risikoreduktion ist beispielsweise unter Statinen in verschiedenen Patientengruppen sehr ähnlich. Für den Patienten wichtig ist jedoch die Höhe der absoluten Risikoreduktion: Die absolute Risikoreduktion gibt an, um wieviel Prozent das Risiko für ein bestimmtes Ereignis gesenkt wird, wenn der Patient sich für die Therapie entscheidet. Die absolute Risikoreduktion wird nicht nur von dem Ausmaß der relativen Risikoreduktion beeinflusst, sondern auch von dem kardiovaskulären Ausgangsrisiko (Abbildung 3). Je höher das individuelle Ausgangsrisiko des Patienten ist, desto höher ist die absolute Risikoreduktion, d. h. desto stärker profitiert er von der Lipidsenkung.
Die PICO-Fragen des Leitfadens beziehen sich auf zwei große Patientengruppen: erstens Patienten mit kardiovaskulären Risikofaktoren ohne manifeste atherosklerotische kardiovaskuläre Erkrankung (ASCVD) und zweitens Patienten mit manifester ASCVD. Bei Patienten mit manifester ASCVD bestehen 1. morphologisch oder funktionell nachgewiesene klinisch relevante Stenosen (z. B. mittels Koronarangiographie oder Myokardszintigraphie) 2. chronische oder akut aufgetretene, ischämietypische Symptome (z. B. Schmerz, Funktionseinschränkung) und 3. ein klinisch plausibler Zusammenhang zwischen Stenosierung und Symptomatik. Hierzu gehören Patienten mit koronarer Herzkrankheit (KHK) und peripherer arterieller Verschlusskrankheit (pAVK) sowie Patienten nach ischämischem Schlaganfall oder transitorischer ischämischer Attacke (TIA). Die medikamentöse Cholesterinsenkung soll bei Patienten mit erhöhtem kardiovaskulärem Risiko das erstmalige Auftreten kardiovaskulärer Ereignisse vermeiden (Primärprävention) und bei Patienten mit manifester ASCVD Rezidivereignissen vorbeugen (Sekundärprävention).
Bei manifester ASCVD besteht ein sehr hohes Risiko, einen Myokardinfarkt oder Schlaganfall zu erleiden oder an einem kardiovaskulären Ereignis zu versterben (1;8-11). Die Gruppe der Patienten mit kardiovaskulärem-Risiko ohne vorheriges Ereignis ist heterogen und schließt Patienten mit sehr unterschiedlichem Ausgangsrisiko für kardiovaskuläre Ereignisse ein. In der Primärprävention ist deshalb die Kalkulation des individuellen kardiovaskulären Risikos von großer Bedeutung für die Behandlungsentscheidung.
Literatursuche
Für alle priorisierten PICO-Fragen erfolgte eine strukturierte Literaturrecherche in den Datenbanken Medline und Cochrane. Ergänzend wurden die Literaturverzeichnisse relevanter Leitlinien gesichtet (1;8-12). Randomisierte kontrollierte Studien (RCT) haben im Vergleich zu anderen Studienarten das geringste Risiko für systematische Verzerrungen, d. h. für eine Über- oder Unterschätzung der Wirksamkeit einer Maßnahme. Der Leitfaden der AkdÄ berücksichtigt deshalb in erster Linie RCT, die 1000 oder mehr Patienten untersuchen und eine Laufzeit von mindestens zwölf Monaten aufweisen, sowie publizierte systematische Reviews aus RCT. Eine Ausnahme hiervon stellten lediglich Studien zu Bempedoinsäure dar. Daten zu patientenrelevanten Endpunkten waren für Bempedoinsäure erst ab März 2023 von der Studie CLEAR Outcomes zu erwarten. Im Leitfaden wurden deshalb alle Phase-III-Studien zu Bempedoinsäure unabhängig von ihrer Größe und Dauer berücksichtigt. Tabellen 1 und 2 geben einen Überblick über die identifizierten RCT.
Studiendaten zu klinischen Fragestellungen
Statine in der Primärprävention
Die meisten Patienten können eine relative Risikoreduktion kardiovaskulärer Ereignisse von etwa 30 % durch moderat dosierte Statine erwarten. Bei einem hohen Ausgangsrisiko von 20 % in zehn Jahren entspricht dies einer absoluten Risikoreduktion von 6 % durch eine zehnjährige Statintherapie. Hat der Patient dagegen ein kardiovaskuläres Risiko von lediglich 5 % in zehn Jahren, liegt der erwartbare Nutzen einer zehnjährigen Statintherapie bei einer absoluten Risikoreduktion von 1,5 %. Bei einer Herzinsuffizienz ohne manifeste kardiovaskuläre Erkrankung oder einer terminalen Niereninsuffizienz ist ein Nutzen der Statintherapie nicht belegt. Auch bei älteren Menschen (> 75 Jahren) ohne kardiovaskuläre Vorerkrankung ist unsicher, ob sie von Statinen profitieren. Statine sind überwiegend gut verträglich. Schwerwiegende Risiken (hämorrhagische Schlaganfälle, Diabetes mellitus Typ 2 oder schwere Leberfunktionsstörungen) sind selten.
Es ist nicht belegt, dass Patienten in der Primärprävention von einer Hochdosistherapie oder einer Titration nach bestimmten LDL-C-Zielwerten profitieren.
Statine in der Sekundärprävention
Statine in moderater Dosierung senken bei Patienten mit manifester KHK die Sterblichkeit und reduzieren das Risiko für Myokardinfarkte und Schlaganfälle (10). Es ist nicht belegt, dass eine LDL-C-Zielwert-gesteuerte Statintherapie wirksamer ist als eine feste Statindosis. Die Sterblichkeit unterscheidet sich nicht zwischen einer Hochdosistherapie und einer moderaten Statindosis. Eine Steigerung der Statindosis von einer Standarddosis auf eine Hochdosis senkt geringfügig das Risiko für nichttödliche Myokardinfarkte: Um einen zusätzlichen Myokardinfarkt zu verhindern, müssen 100 Personen über fünf Jahre eine Hochdosistherapie statt einer moderaten Statindosis erhalten.
Diesem Nutzen steht ein erhöhtes Risiko für die Entwicklung eines Diabetes mellitus Typ 2 gegenüber (eine zusätzliche Neudiagnose bei 125 Personen innerhalb von im Mittel fünf Jahren). Zudem treten gehäuft Muskelbeschwerden und Leberfunktionsstörungen auf. Der geringe Nutzen einer Hochdosistherapie mit Statinen ist lediglich bei manifester KHK ohne begleitende Herzinsuffizienz oder fortgeschrittene Nierenfunktionsstörung gesichert. Für Patienten mit anderen kardiovaskulären Erkrankungen – beispielsweise mit pAVK oder nach ischämischem Schlaganfall – liegen keine Daten aus randomisierten Studien zum Nutzen einer Hochdosistherapie im Vergleich zu einer Standarddosis vor.
Ezetimib in der Sekundärprävention
Bei Patienten mit akutem Koronarsyndrom senkt Ezetimib, zusätzlich zu einer Statintherapie in moderater Dosierung gegeben, die Häufigkeit von nichttödlichen Herzinfarkten. Der Effekt ist jedoch gering (absolute Risikoreduktion von 1,6 % über eine Behandlungsdauer von sieben Jahren). Am ehesten und deutlichsten profitieren ältere Menschen (≥ 75 Jahre) und Personen mit Diabetes. Die Sterblichkeit wird nicht beeinflusst. Es liegen keine Daten dazu vor, ob Patienten mit einer Statinhochdosis von einer zusätzlichen Ezetimib-Gabe profitieren. Auch der Nutzen von Ezetimib als Monotherapie, beispielsweise bei Statinunverträglichkeit, lässt sich mangels Daten aus klinischen Studien nicht beurteilen.
PCSK9-Hemmer in der Sekundärprävention
Bei Patienten mit symptomatischen kardiovaskulären Erkrankungen, die Statine in moderater oder hoher Dosis erhalten, senkt die zusätzliche Gabe von PCSK9-Hemmern die Häufigkeit von Myokardinfarkten und ischämischen Schlaganfällen. Der Effekt ist gering (Reduktion von Myokardinfarkten um absolut 1,0–1,2 % und von ischämischen Schlaganfällen um absolut 0,4 % über eine Behandlungsdauer von etwa 2,5 Jahren). Die bisherigen Studien belegen nicht, dass PCSK9-Hemmer die Gesamtsterblichkeit oder die kardiovaskuläre Sterblichkeit verringern. Die meisten Daten liegen für Patienten nach akutem Koronarsyndrom vor. Es bestehen Unsicherheiten, ob Patienten im westeuropäischen Versorgungskontext oder mit bereits niedrigen LDL-C-Ausgangswerten profitieren. Zudem liegen keine ausreichenden Daten vor, um die Wirksamkeit von PCSK9-Hemmern bei Statinintoleranz oder bei einer vorbestehenden Kombinationstherapie aus Ezetimib und Statinen zu beurteilen.
Bempedoinsäure in der Sekundärprävention
Bei Redaktionsschluss war unklar, ob Bempedoinsäure kardiovaskuläre Ereignisse verhindert. Je nach Intensität der begleitenden Statintherapie senkt Bempedoinsäure das LDL-C um etwa 16–23 %. Die bislang vorliegenden Daten zeigen ein signifikant erhöhtes Risiko für Gicht und renale Ereignisse, bei gleichzeitiger Statintherapie auch für muskuläre Beschwerden. Die AkdÄ plant eine zeitnahe Aktualisierung dieses Kapitels unter Einbezug der Studiendaten von CLEAR Outcomes.
Literatur
- Visseren FLJ, Mach F, Smulders YM et al.: 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J 2021; 42: 3227-3337.
- Cholesterol Treatment Trialists' Collaboration, Baigent C, Blackwell L et al.: Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010; 376: 1670-1681.
- Cannon CP, Blazing MA, Giugliano RP et al.: Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015; 372: 2387-2397.
- Sabatine MS, Giugliano RP, Keech AC et al.: Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med 2017; 376: 1713-1722.
- Schwartz GG, Steg PG, Szarek M et al.: Alirocumab and cardiovascular outcomes after acute coronary syndrome. N Engl J Med 2018; 379: 2097-2107.
- Barter PJ, Caulfield M, Eriksson M et al.: Effects of torcetrapib in patients at high risk for coronary events. N Engl J Med 2007; 357: 2109-2122.
- Lincoff AM, Nicholls SJ, Riesmeyer JS et al.: Evacetrapib and cardiovascular outcomes in high-risk vascular disease. N Engl J Med 2017; 376: 1933-1942.
- Ludt S, Angelow A: Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM) (Hrsg.): S3-Leitlinie Hausärztliche Risikoberatung zur kardiovaskulären Prävention: https://register.awmf.org/de/leitlinien/detail/053-024 (letzter Zugriff: 24. Januar 2023). AWMF-Register-Nr. 053-024, DEGAM-Leitlinie Nr. 19, 2017.
- National Institute for Health and Care Excellence (NICE): Lipid modification: cardiovascular risk assessment and the modification of blood lipids for the primary and secondary prevention of cardiovascular disease: https://www.nice.org.uk/guidance/cg181 (letzter Zugriff: 24. Januar 2023). Clinical guideline CG181; NICE 2014.
- Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF): Nationale VersorgungsLeitlinie Chronische KHK: https://www.leitlinien.de/themen/khk (letzter Zugriff: 24. Januar 2023). Version 6.0, AWMF-Register-Nr.: nvl-004, ÄZQ 2022.
- Grundy SM, Stone NJ, Bailey AL et al.: 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol 2019; 73: e285-e350.
- Arnett DK, Blumenthal RS, Albert MA et al.: 2019 ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation 2019; 140: e596-e646.
Interessenkonflikte
Die Autoren geben an, keine Interessenkonflikte zu haben.
