Behandlung der Hyperkaliämie bei Erwachsenen
Therapie aktuell
Hyperkaliämie
Die Hyperkaliämie ist eine potenziell lebensbedrohliche Elektrolytstörung. Etwa 40–50 % der Patienten mit chronischer Nierenerkrankung haben eine Hyperkaliämie gegenüber lediglich 2–3 % der Normalbevölkerung (1). Die Behandlung mit Hemmern des Renin-Angiotensin-Systems, insbesondere in Kombination mit Aldosteronantagonisten und anderen Substanzen, welche die Kaliumausscheidung hemmen, sind zusätzliche prädisponierende Faktoren, wie auch Herzinsuffizienz und Diabetes mellitus (2). Je nach Begleiterkrankungen, Schnelligkeit des Auftretens und Höhe ist das Serumkalium klinisch unterschiedlich relevant. EKG-Veränderungen sind sehr variabel und können auch schon bei relativ niedrigen Kaliumwerten auftreten oder auch bei hohen Spiegeln (2) fehlen.
Es gibt verschiedene Definitionen für eine Hyperkaliämie. Am gebräuchlichsten ist Folgende:
- Kalium 5,0–5,4 mmol/l = milde Hyperkaliämie
- 5,5–5,9 mmol/l = mittelschwere Hyperkaliämie
- 6,0–6,4 mmol/l = schwere Hyperkaliämie
- > 6,5 mmol/l = lebensbedrohliche Hyperkaliämie (2).
Mit einer Inzidenz zwischen 1–10 % ist diese Laborveränderung ein häufiges Problem im ärztlichen Alltag. Die durchschnittliche Mortalität liegt bei 1 in 1000 (3;4). Meist ist eine Hyperkaliämie asymptomatisch. Gelegentlich treten nichtspezifische Symptome wie Übelkeit und Diarrhoe, Muskelschwäche bis hin zur Parese, Parästhesien oder Palpitationen auf.
Kalium-Homöostase
Die Niere spielt eine wesentliche Rolle für die Kaliumausscheidung. Kalium wird frei filtriert. 90–95 % werden im proximalen Tubulus und der Henleschen Schleife rückresorbiert und im distalen Tubulus und den Sammelrohren ausgeschieden. Diese Ausscheidung wird im Wesentlichen von der Höhe des Kaliumspiegels und des Aldosteronspiegels reguliert. Nimmt die Nierenfunktion ab, so kann die Niere die Kaliumsekretion der verbliebenen Nephrone steigern, falls nicht die Sekretion oder Wirkung des Aldosterons beeinträchtigt ist. Die Kaliumelimination im Dickdarm steigt (bis auf das Dreifache), wenn die Kaliumsekretion aus der Niere nachlässt (5). Die Kaliumausscheidung unterliegt einer circadianen Variabilität: mittags wird 1,6-mal mehr Kalium ausgeschieden als nachts (6).
Kardiale Auswirkungen und EKG-Veränderungen
Der Großteil des Kaliums im Körper liegt intrazellulär vor. Im Vergleich zum extrazellulären Bereich liegt ein Verhältnis von ca. 30:1 vor (7). Der relative Anstieg von extrazellulärem Kalium reduziert das Ruhemembranpotenzial, welches insbesondere in Kardiomyozyten zu Hyperexzitabilität über spannungsabhängige Natriumkanäle fuhrt und die Repolarisationsdauer verlängert. Die Folge sind Herzrhythmusstörungen bis hin zu letalen Arrhythmien. Typische EKG-Veränderungen sind eine zeltförmig erhöhte T-Welle (insbesondere in V2-V4 als Ausdruck der verlängerten Repolarisation), eine reduzierte P-Wellen-Höhe, ein verlängertes P-R-Intervall und eine QRS-Verbreiterung. In schwereren Fällen kann ein „Sinusmuster“ auftreten. Eine Hyperkaliämie prädisponiert sowohl durch reduziertes Membranpotenzial zur Hyperexzitation (ventrikuläre Tachykardien bis hin zum Kammerflimmern) als auch zur Kardiodepression durch inaktivierte spannungsabhängige Natriumkanäle bei sehr stark erhöhtem Kalium (Bradykardie, AV-Block bis hin zur Asystolie). Die klinische Risikoeinschätzung sowie die Therapie sollten jedoch nicht nach EKG-Veränderungen gesteuert werden, da die Höhe der Hyperkaliämie schlecht mit EKG-Veränderungen korreliert (2). In einer prospektiven Studie zur Hyperkaliämie zeigten sich nur in 46 % der Hyperkaliämien > 6 mmol/l typische EKG-Veränderungen (8). Das Risiko von potenziell letalen Arrhythmien steigt ab einem Kaliumwert von 6,5 mmol/l stark an. Sie können ohne vorherige EKG-Veränderung auftreten. Des Weiteren können Störfaktoren wie Komedikation, metabolische Azidose oder Störungen des Kalziumhaushalts das EKG beeinflussen. Es ist jedoch zu empfehlen, bei allen Patienten mit einer schweren Hyperkaliämie möglichst schnell ein 12-Kanal-EKG zu schreiben, und danach ein kontinuierliches 3-Kanal-EKG-Monitoring durchzuführen (4). Es zeigt sich eine Exazerbation der Hyperkaliämie und ihrer Folgen bei Hyponatriämie, Hypokalzämie oder Azidose (4). Demnach sollte bei der Diagnosestellung und Therapie auch auf diese Faktoren Rücksicht genommen werden.
Kalium-Messung
Die Messung des Kaliumspiegels ist sehr störanfällig. Es zeigen sich oft falsch-hohe Werte, sodass zunächst eine sofortige Kontrolle mittels arterieller oder venöser Blutgasanalyse (BGA) durchzuführen ist. Eine Pseudohyperkaliämie im Serum entsteht oft durch eine fehlerhafte Blutentnahme, die eine In-vitro-Hämolyse induziert. Die Nutzung von Heparin in Blutentnahmeröhrchen verhindert die Koagulation des Blutes, bei welcher ebenfalls Kalium freigesetzt wird. Weitere häufige Fehlerquellen sind zu lange Stauzeit (insbesondere bei schwierigen Venenverhältnissen) oder Blutentnahme nach Blutdruckmessung, zu starker Zug bei Sarstedt-Röhrchen oder Blutentnahme am selben Arm, an dem kaliumreiche Lösungen infundiert werden. Andere Ursachen umfassen erhöhte Thrombozyten- oder Erythrozytenzahl oder zu lange oder kalte Lagerung. Zur erneuten Laborkontrolle empfiehlt sich die Messung von Elektrolyten in einem Lithium-Heparin-Röhrchen mit kurzer Staudauer aus einer großen Vene mit geringem Zug und sofortiger Laboranalyse (4).
Ursachen
Zu den häufigsten Ursachen einer Hyperkaliämie zählen Nierenversagen (77 %), Arzneimittel (63 %) sowie Hyperglykämie (49 %) (9) (Tabelle 1). Meistens liegt jedoch eine Kombination dieser Faktoren vor. Es wird unterteilt in Verteilungsstörungen (erhöhter Kaliumaustritt aus der Zelle beziehungsweise reduzierter Transport nach intrazellulär), erhöhte Zufuhr oder verminderte Ausscheidung (renal oder über den Darm). Um die Ursache zu erkennen, genügt oft schon eine genaue Anamnese auf das Vorhandensein von Risikofaktoren.
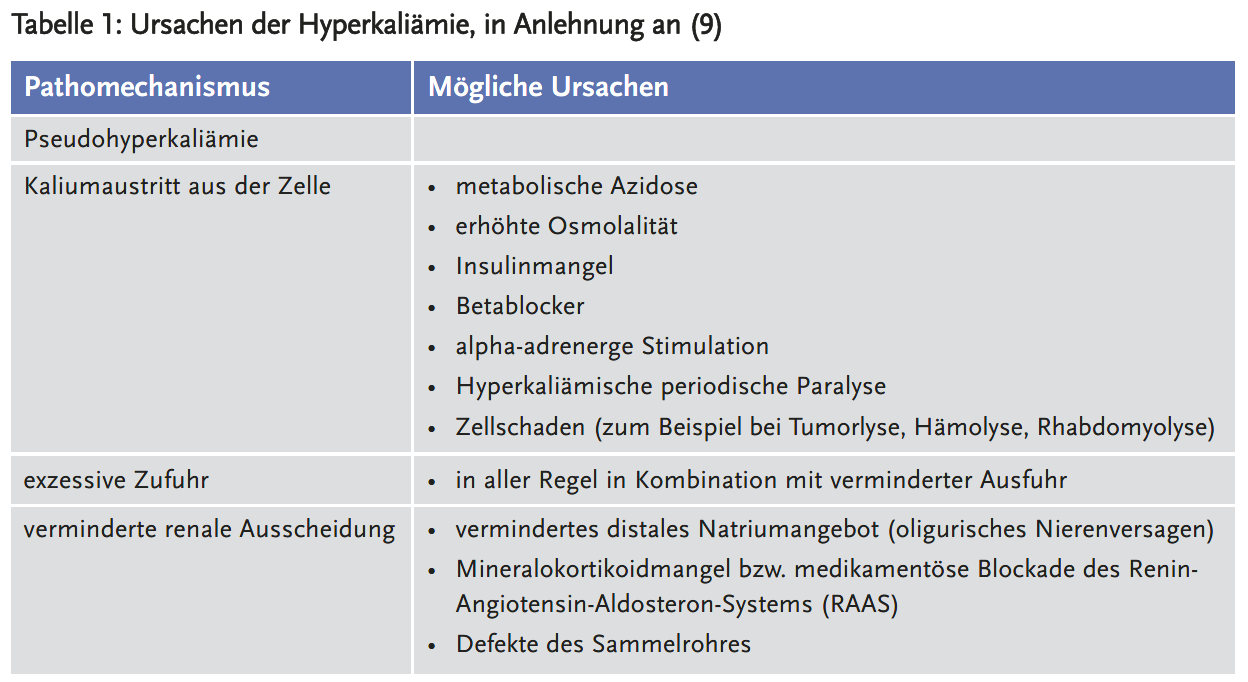
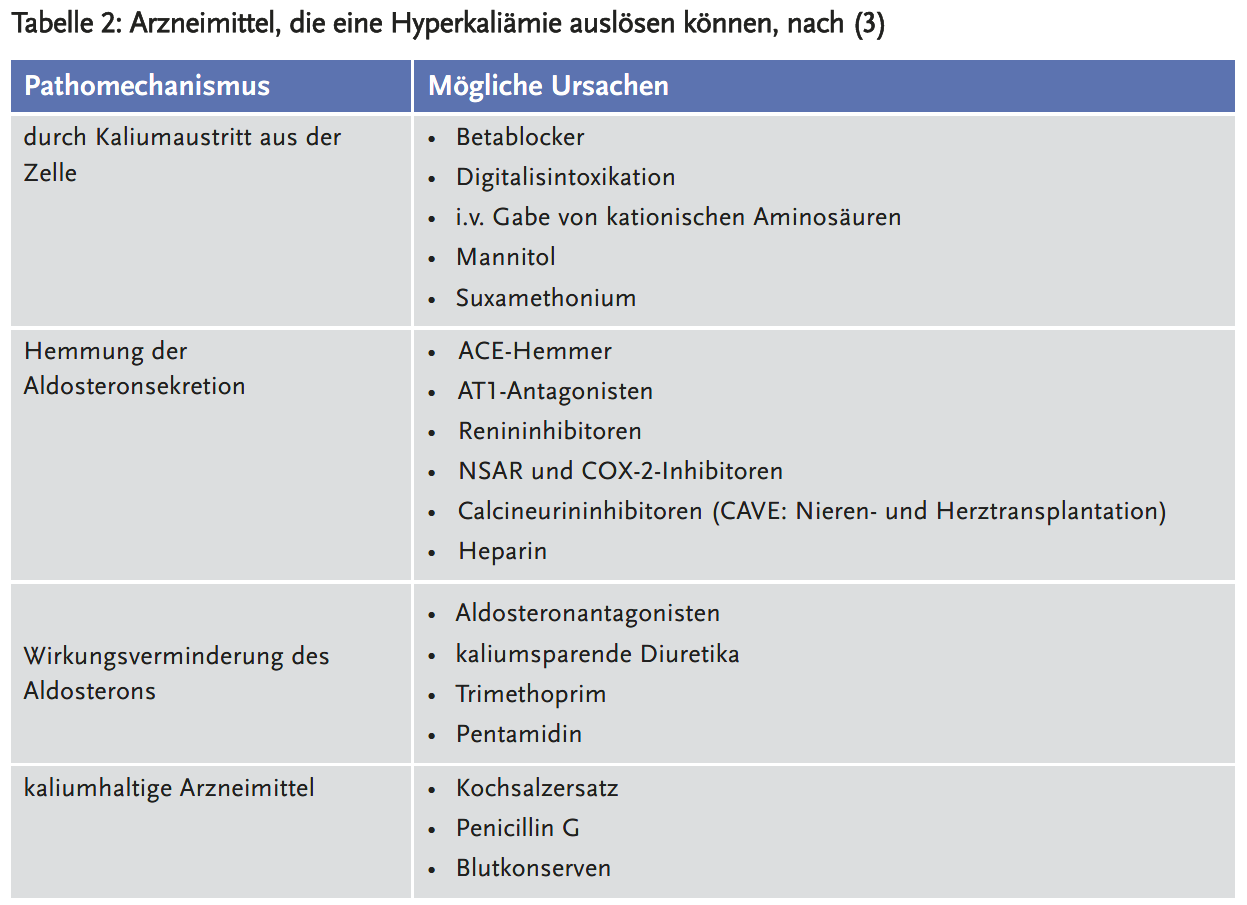
Besonders häufig tritt die Hyperkaliämie auf, wenn ein klinischer Risikofaktor (wie zum Beispiel chronische Niereninsuffizienz) mit einem oder sogar mehreren Arzneimitteln mit kaliumerhöhender Wirkung kombiniert wird (Tabelle 2). Zum Beispiel sind ACE-Hemmer (mit)-verantwortlich für 10–38 % der Hyperkaliämien bei hospitalisierten Patienten. 10 % der Patienten, die ACE-Hemmer verschrieben bekommen, entwickeln innerhalb eines Jahres eine Hyperkaliämie (10).
Akute Hyperkaliämie
Eine akute, isoliert auftretende Hyperkaliämie wird oft verursacht durch massive Freisetzung von Kalium aus dem Intrazellularraum. Dies kann zum Beispiel bei einem schweren Trauma, einer Ischämie, bei Tumorlyse, metabolischer Azidose oder Hämolyse der Fall sein. Einige dieser Ursachen können auch mit einem akuten Nierenversagen einhergehen, was die Situation durch die fehlende Ausscheidung aggraviert. Besonders gefährdet sind diese Patienten, da es oft zu einem schnellen Anstieg der Kaliumkonzentration im Körper kommt und diese mit einer erhöhten Mortalität einhergeht (2).
Chronische Hyperkaliämie
Chronisch erhöhte Kaliumwerte beziehungsweise rezidivierende Hyperkaliämien sind meist Folge einer dauerhaften Beeinträchtigung der Kaliumausscheidung (11). Auf Grund des meist langsamen Anstiegs des Kaliumspiegels ist bei mild bis moderat erhöhten Werten selten eine akute Intervention nötig. Der Fokus sollte auf der Behandlung der zugrundeliegenden Ursache und damit auch auf der Prävention lebensbedrohlicher Kaliumerhöhungen liegen. Hyperkaliämie bei kritisch kranken Patienten zeigt ein erhöhtes Mortalitätsrisiko an. Diese Daten beruhen in der Regel jedoch auf retrospektiven Studien (12;13). Auch nach Myokardinfarkt lassen sich Daten finden, die dies bestätigen (14;15). Sowohl bei Patienten mit hohen Kaliumspiegeln (16;17) in der prädialytischen Phase, aber auch in früheren Stadien einer chronischen Nierenerkrankung (18) können solche Korrelationen zwischen Hyperkaliämie und erhöhter Sterblichkeit gefunden werden. Die reine Assoziation von Kaliumhöhe und Mortalität darf jedoch nicht mit einer Kausalität verwechselt werden.
Paradoxerweise sinkt das Risiko bei Patienten mit hohen Kaliumwerten im CKD-Stadium 5 gegenüber Patienten mit CKD-Stadium 3 und 4 (11;12;14;15). Adaptationsvorgänge (steigende Katecholamine, Aldosteron und Steigerung der gastrointestinalen Ausscheidung) können diese bessere Prognose eventuell erklären. Diese physiologischen Anpassungsvorgänge sollten jedoch eine Hyperkaliämie verhindern. Da diese trotzdem gehäuft in progredienten CKD-Stadien auftreten, ist diese Erklärung nicht ausreichend. Patienten mit der niedrigsten Nierenfunktion haben eigentlich die schlechteste Prognose.
Sollte hier eventuell die Hyperkaliämie sogar protektiv wirksam sein (2)? In der Studie von An et al. (12) konnte eine geringere Hyperkaliämie-assoziierte Mortalität gefunden werden, wenn die Patienten mit RAAS-Inhibitoren und Betablockern behandelt worden sind. Ähnliche Daten wurden für die Aldosteronantagonisten erhoben: Sie behielten ihren Vorteil in Bezug auf die Sterblichkeit der Patienten, obwohl sie vermehrt zu Hyperkaliämien führten (19). Allerdings werden diese möglichen Vorteile der Aldosteronantagonisten trotz erhöhtem Hyperkaliämierisiko durch Daten von Juurlink (20) und Tseng (21) infrage gestellt. Insgesamt sind die Verbindungen zwischen Hyperkaliämie und Mortalität also im Wesentlichen retrospektiv und nicht als Beweis der Kausalität zu werten. Außerdem gibt es fast keine prospektiven Daten, die einen Zusammenhang zwischen Senkung einer Hyperkaliämie und Verbesserung der Mortalität belegen würden. Mac Mahon et al. (13) konnten eine Abschwächung des Risikos bei kritisch Kranken zeigen, wenn man die Hyperkaliämie um mehr als 1 mmol/l verminderte. An et al. (12) stellten dar, dass eine Steigerung der Versuche das Kalium zu senken ebenfalls zu einem verbesserten Überleben führt. Allerdings war der Einfluss anderer Therapien auf diese Verbesserung nicht ganz auszuschließen. Erstaunlicherweise verschwand dieser Überlebensvorteil wieder, wurde die Nierenersatztherapie in die Maßnahmen zur Kaliumsenkung eingeschlossen. Dies zeigt vielleicht, dass doch andere Einflussgrößen (zum Beispiel Schwere der Erkrankung) wichtiger waren. Die Elimination von Kalium durch Dialyse ist eine der wirksamsten Verfahren zur Senkung von Kalium und konnte doch keine Verbesserung der Prognose herbeiführen (12). Es zeigt sich eine U-förmige Kurve, setzt man Kaliumspiegel und Mortalität zueinander in Beziehung (22). Auch eine zu intensive Therapie zur Kaliumsenkung kann also die Sterblichkeit erhöhen. Ähnliche Ergebnisse finden sich bei Nakhoul (18) und Dunn (23).
Akute Hyperkaliämie, schwere Hyperkaliämie
Bei der akut aufgetretenen oder der schweren Hyperkaliämie > 6,5 mmol/l ist eine Monitorüberwachung, eventuell sogar Intensivüberwachung indiziert. Eine schnelle Kaliumsenkung durch Verschiebung von extrazellulärem Kalium nach intrazellulär zum Beispiel durch Insulin oder Beta-2-Sympathomimetika ist die Therapie der Wahl. Dadurch sollen lebensbedrohliche Arrhythmien oder eine Asystolie verhindert werden. Bei Auftreten von EKG-Veränderungen, zum Beispiel im Sinne einer Sinuskurve, ist Kalziumgluconat i.v. zur Stabilisierung des Membranpotenzials indiziert. Diesen Akutmaßnahmen sollten jedoch immer Therapien zur Kaliumelimination aus dem Körper folgen. Bei vital gefährdeten Patienten, insbesondere bei Anurie oder schwerer Niereninsuffizienz, ist die notfallmäßige Hämodialyse Therapie der Wahl. Selbst unter Reanimation ist die Hämodialyse noch möglich.
Chronische Hyperkaliämie
Ziel der Behandlung der chronischen Hyperkaliämie ist die Vermeidung von stationären Aufnahmen und lebensbedrohlichen Komplikationen wie Arrhythmien oder Asystolie. Ein stabiler Zustand mit chronisch erhöhten Kaliumwerten an der oberen Normgrenze verringert den Sicherheitsabstand zu lebensbedrohlich erhöhten Kaliumwerten. Dies zeigt sich zum Beispiel bei einem akut auftretenden chronischen Nierenversagen, welches prärenal oder durch Gabe von nichtsteroidalen Antirheumatika entstehen kann. Durch generelle Maßnahmen wie kaliumarme Diät, nichtkaliumsparende Diuretika und Reduktion beziehungsweise Absetzen Kalium erhöhender Arzneimittel kann die chronische Hyperkaliämie meist gut kontrolliert werden.
Aktuell liegen weder deutsche noch europäische Leitlinien zur Therapie der Hyperkaliämie vor. In den englischen Leitlinien zur Hyperkaliämie wird ein 5-Stufen-Algorithmus zur Therapie vorgeschlagen (4):
1. Stabilisierung des Herzens
2. Kaliumshift in die Zellen
3. Entfernung von überschüssigem Kalium aus dem Körper
4. Monitoring von Kalium und Glukose
5. Prävention von weiteren Hyperkaliämien.
Medikamentöse Behandlung der Hyperkaliämie bei Erwachsenen
Akut-Therapie
Kalziumgluconat
Kalziumgluconat dient der Stabilisierung des kardialen Membranpotenzials. Es wirkt nicht über eine Absenkung des Serumkaliums. Ein schneller Wirkeintritt nach bereits drei Minuten macht es zum idealen Medikament in der vital bedrohlichen Hyperkaliämietherapie mit bereits eingetretenen EKG-Veränderungen. Die Wirkdauer beträgt lediglich 30–60 Minuten, sodass nach Applikation unverzüglich weitere Maßnahmen zur Kaliumsenkung erfolgen müssen. Man gibt 30 ml 10 % Kalziumgluconat i.v. über ca. fünf Minuten. Die Monitorüberwachung ist dabei obligat, da die intravenöse Kalziumgabe selbst proarrhythmogen wirken kann. Dies ist insbesondere bei Digitalis-Therapie relevant; dort sollte die Infusionsdauer leicht verlängert werden. Sollten sich die EKG-Veränderungen nicht normalisieren, ist eine Wiederholung der Applikation nach fünf bis zehn Minuten möglich. Zum aktuellen Zeitpunkt liegen jedoch keine randomisiert kontrollierten Studien zur Therapie mit Kalziumgluconat vor. Genauso wirksam scheint die Gabe von Kalziumchlorid zu sein. Da der Kalziumgehalt im Vergleich zum Kalziumgluconat jedoch dreimal höher ist, ist es deutlich venenreizender und muss langsamer appliziert werden. Bei Paravasaten kann es zu ausgeprägten Gewebsnekrosen kommen. Außerdem darf nicht die gleichzeitige Gabe mit Natriumbicarbonat erfolgen, da es zur Bildung von unlöslichen Kalziumsalzen kommen kann. Mögliche Nebenwirkungen sind Hypotension, Bradykardie, Arrhythmien und Synkopen (4).
Insulin und Glukose
Die intravenöse Insulintherapie in Kombination mit Glukose bewirkt einen Kaliumshift von extra- nach intrazellulär durch Aktivierung der Natrium-Kalium-ATPase. Die Wirkung beginnt nach ca. 15 Minuten und hält zwei bis drei Stunden an. Danach beginnt das Serumkalium wieder sukzessive anzusteigen. Man gibt 10 IE eines schnellwirksamen, löslichen Insulins (Altinsulin) in 25 g Glukose (entspricht 125 ml 20-prozentiger Glukoselösung). Dies führt zu einer Reduktion des Kaliums um bis zu maximal 0,6–1 mmol/l (4;24). Auf die Gabe von Glukose sollte bei Hyperglykämien verzichtet werden, wie zum Beispiel bei Patienten mit diabetischer Ketoazidose. Zur Vermeidung von Hypoglykämien sollten regelmäßige Blutzuckermessungen bis mindestens sechs Stunden nach Insulinapplikation erfolgen. Dies ist insbesondere bei chronischer Niereninsuffizienz wichtig, da dort die Halbwertszeit von Insulin verlängert sein kann (4).
Beta-2-Sympathomimetika
Beta-2-Sympathomimetika führen ebenfalls zu einem Kaliumshift von extra- nach intrazellulär über die Aktivierung der Natrium-Kalium-ATPase. Die Wirkung beginnt nach ca. 30 Minuten und hält im Vergleich zum Insulin mit vier bis sechs Stunden etwas länger an. Über einen Vernebler werden 10–20 mg Salbutamol appliziert. Dies kann zu einer Reduktion des Kaliums um bis zu 0,88 mmol/l führen. Prinzipiell ist auch die intravenöse Gabe möglich und führt zu einer leicht stärkeren Kaliumsenkung von ca. 1 mmol/l, zeigt jedoch mehr Nebenwirkungen. Die Wiederholung ist bei fehlendem beziehungsweise nicht ausreichendem Therapieansprechen nach ein bis zwei Stunden möglich. Das Ansprechen ist jedoch inkonstant, sodass es nicht zur Monotherapie geeignet ist. Zu den möglichen Nebenwirkungen zählen Tachykardie, Tremor, Palpitationen, Angstzustände, Blutdruckanstieg, Migräne und leichter Anstieg des Blutzuckers (24). Bei ischämischer Herzerkrankung sollte lediglich eine reduzierte Dosis von 10 mg verabreicht werden. Ebenfalls ist Vorsicht geboten bei Tachyarrhythmie und Offenwinkelglaukom (4).
Kombinationstherapie
Die Kombinationstherapie von intravenösem Insulin und Glukose-Gabe mit vernebeltem Salbutamol ist effektiver als die Monotherapie und kann den Kaliumspiegel um bis zu 1,21 mmol/l senken. Es wurden jedoch vermehrt Hyperglykämien beobachtet (4;24).
Nichtkaliumsparende Diuretika
Zur Verstärkung der physiologischen renalen Elimination von Kalium können Thiazide und unterhalb einer glomerulären Filtrationsrate (GFR) < 30 ml/min/1,73 m2 Schleifendiuretika verabreicht werden. In Studien zeigte sich eine höhere Effektivität von Thiaziden bezüglich der Kaliumelimination (9). Ab einem CKD-Stadium 4 sind Thiazide jedoch nicht mehr ausreichend wirksam, sodass auf Schleifendiuretika (mit höherer Maximaldosis) zurückgegriffen werden sollte. Außerdem sind sie nur oral verabreichbar. Besteht eine Exsikkose, so sind sie mit einer Volumengabe, vorzugsweise 0,9 % NaCl, zu kombinieren. Die diuretische Therapie bei hypotensiven Patienten, sobald sie im Schockzustand sind, ist nicht erfolgversprechend aufgrund des reduzierten mittleren arteriellen Perfusionsdrucks der Niere und des Katecholaminüberschusses.
Natriumhydrogencarbonat
Die Studienlage zur Wirkung von Bikarbonat zur Therapie der Hyperkaliämie ist schwach (4;24). Ein Einsatz empfiehlt sich jedoch insbesondere, falls eine metabolische Azidose besteht. Es besteht jedoch das Risiko einer Natrium- und Flüssigkeitsüberladung. Die Applikation von 8,4 % Bicarbonat (ca. 50–100 ml) sollte jedoch vorzugsweise zentralvenös erfolgen.
Nierenersatzverfahren
Die Hämodialyse ist, da es sich bei Kalium um ein kleines Molekül handelt, deutlich effektiver als die Hämofiltration. Bei akuter Lebensgefahr ist die Hämodialyse, falls vorhanden, die schnellste und effektivste Möglichkeit Kalium zu senken. Dies empfiehlt sich insbesondere bei anurischen Patienten und bei Zuständen mit hoher Nachproduktion beziehungsweise Freisetzung von Kalium, zum Beispiel bei Gewebsnekrosen oder Tumorlysesyndrom. Obwohl kontrovers diskutiert, ist eine anfangs niedrige Kaliumkonzentration im Dialysat wahrscheinlich sinnvoll und nicht risikoreicher als ein geringerer Kaliumgradient. Ein möglichst hoher Blutfluss ist dabei anzustreben. Es zeigt sich jedoch kein Einfluss von Bicarbonat im Dialysat auf den Kaliumspiegel (4;24).
Chronische Hyperkaliämie
Kaliumarme Diät
Grundsatz der Behandlung beziehungsweise der Prävention von chronischer Hyperkaliämie sollte zunächst die Restriktion des mit der Nahrung aufgenommenen Kaliums sein. Allgemein wird eine kaliumarme Kost mit einer Einfuhr < 40 mmol/Tag empfohlen (2). Patienten mit erhöhtem Risiko für Hyperkaliämie sollte eine Ernährungsschulung zu kaliumreichen Nahrungsmitteln angeboten werden. Alternativ kann den Patienten auch eine Liste kaliumreicher Nahrungsmittel ausgehändigt werden, um diese in Zukunft zu vermeiden. Ebenfalls scheint die Aufklärung über mögliche Gefahren der Hyperkaliämie wichtig, um die Compliance bezüglich der Ernährungsmodifikation zu erhöhen. Mit dieser einfachen, jedoch oft zeitaufwendigen Maßnahme, könnten möglicherweise Folgemedikationen zur Kaliumsenkung und ihre Nebenwirkungen reduziert werden.
Kaliumreiche Lebensmittel: Einige Gemüse- und Obstarten, z. B. Aprikosen, Bananen, Karotten, Kohlrabi, Avocado und Tomaten sind kaliumreich; besonders hoch ist dabei der Kaliumgehalt in konzentrierter Form, z. B. bei Tomatenmark oder Trockenobst. Ebenso Haselnüsse, Cashewkerne, Erdnüsse und Mandeln sowie Bitterschokolade, Kartoffeln, Pommes frites, Kartoffelpüree und einige Mehlsorten (Dinkel-, Roggen-, Buchweizenvollkornmehl) besitzen einen hohen Kaliumgehalt. Weitere Informationen zum Kaliumgehalt von Lebensmittel finden Sie unter: https://www.dge.de/wissenschaft/faqs/kalium/.
Reduktion oder Absetzen von kaliumerhöhender Medikation
Potenziell kaliumerhöhende Arzneimittel (siehe Tabelle 2), sollten bei chronischer Hyperkaliämie zumindest reduziert oder ganz abgesetzt werden. Zur Vorbeugung von Hyperkaliämien empfehlen sich insbesondere bei eingeschränkter Nierenfunktion mit GFR < 30 ml/min/1,73 m2 und Neuansetzen eines ACE-Hemmers, AT1-Antagonisten oder Aldosteronantagonisten häufige Kaliumkontrollen, anfangs wöchentlich. Die Verantwortung dafür sollte beim verordnenden Arzt liegen. Die isolierte Betrachtung eines Krankheitsbildes (zum Beispiel der Herzinsuffizienz) ist damit nicht mehr möglich, da wichtige Komorbiditäten wie die Niereninsuffizienz in der Behandlungsstrategie berücksichtigt werden müssen.
Mineralokortikoide
Die Gabe von 0,1 mg Fludrocortison pro Tag zeigte bei hämodialysepflichtigen Patienten in Studien keinen Effekt (24). Manche Autoren empfehlen jedoch die Dosiserhöhung auf bis zu 1 mg pro Tag (7). Zu den möglichen Nebenwirkungen zählen u. a. Natriumretention, Ödeme und Hypertonus (7;25).
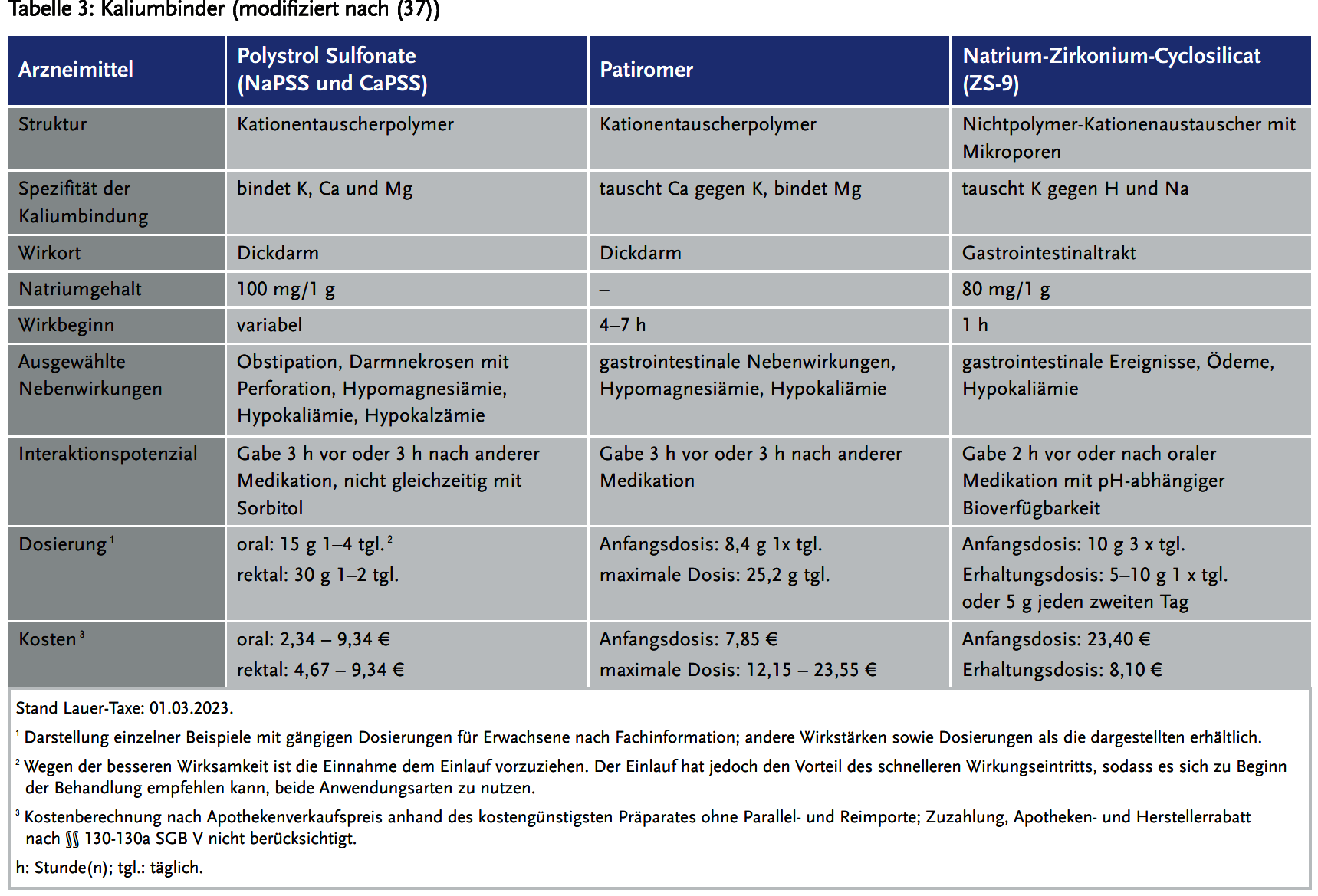
Kaliumbinder
Polystrol Sulfonate (NaPSS und CaPSS)
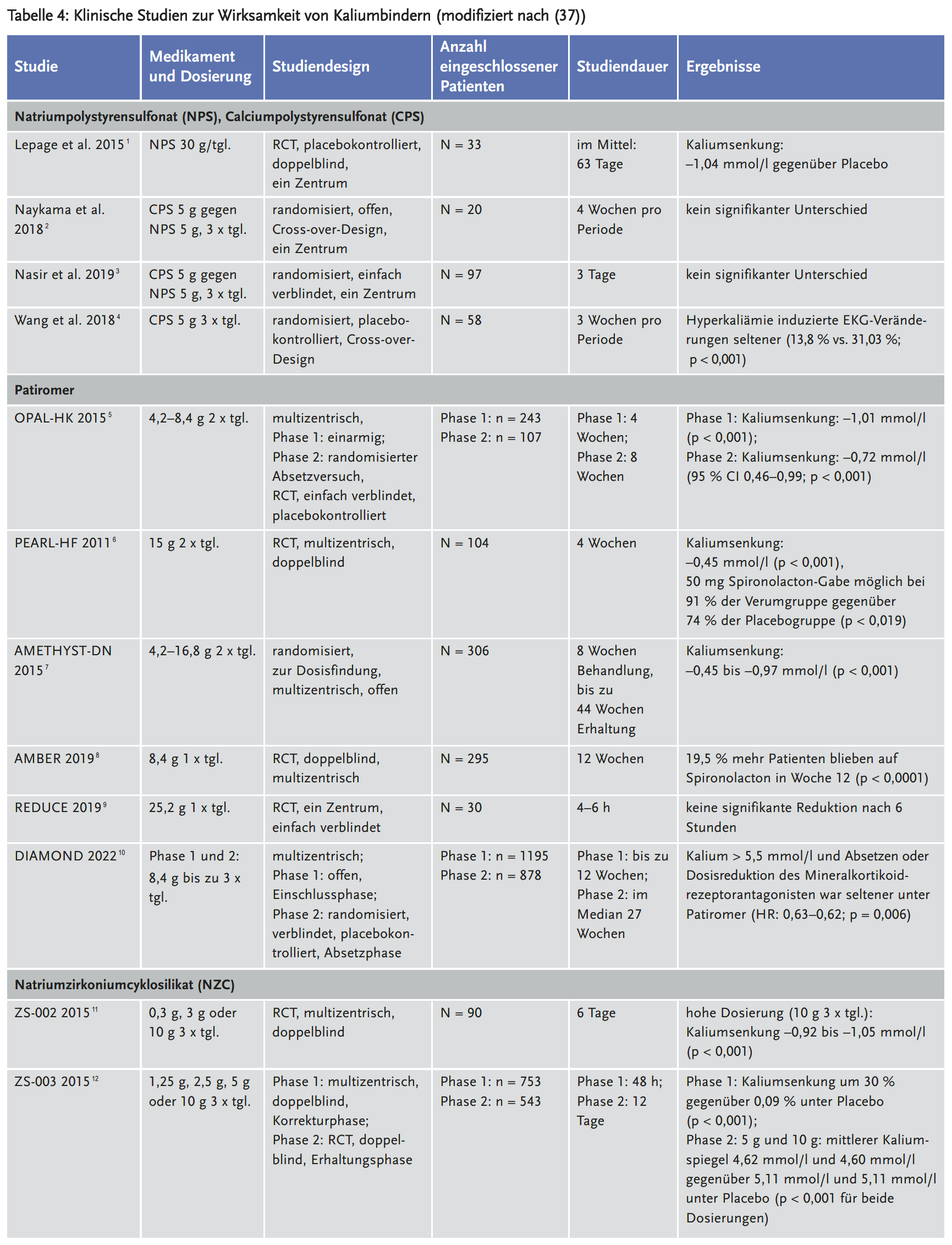
Die Evidenz bezüglich der Wirksamkeit von Sodium Polystyrene Sulfonat (NaPSS; Resonium® A; Anti-Kalium Na) ist mangelhaft. Die Originalstudie zur Wirksamkeit aus dem Jahr 1961 wurde mit nur 32 Patienten durchgeführt (26). Nach heutigen Standards wäre diese geringe Patientenzahl nicht ausreichend, um eine Wirksamkeit zu belegen und die Arzneimittelsicherheit insbesondere bezüglich seltener Nebenwirkungen zu gewährleisten. Unklar war auch, ob die erzielte Kaliumsenkung tatsächlich durch NaPSS oder durch die abführende Komedikation (anfangs meist Sorbitol) zur Vermeidung der Obstipation verursacht wird (27). In einem Cochrane Review zeigte sich keine Kaliumsenkung nach einer Einzeldosis im Vergleich zur Placebogruppe (28). Für eine effektive Senkung ist die wiederholte Einnahme über mindestens ein bis fünf Tage notwendig. Der Wirkeintritt liegt bei über vier Stunden und damit ist das Arzneimittel für die Therapie in der Akutsituation ungeeignet (4). Zu den häufigsten Nebenwirkungen gehören Obstipation, Hypomagnesämie, sowie Hyperkalzämie (4). Eine seltene, jedoch schwerwiegende Nebenwirkung, welche mit einer erheblichen Mortalität verbunden ist, ist die Darmnekrose. Sie tritt ungefähr bei 0,3 % der Patienten auf (26). Die Seltenheit dieser wichtigen Nebenwirkungen beweist, dass gerade die initiale Studie zur Sicherheit des Medikaments mit einer größeren Patientenzahl erfolgen sollte. Da die Häufigkeit der Darmnekrose möglicherweise mit der Kombination mit Sorbitol als Laxans steigt, sind andere Komedikationen zum Beispiel mit Lactulose zu favorisieren (29). Deswegen ist NaPSS kontraindiziert bei Patienten mit obstruktiver Darmerkrankung. Die Applikation ist entweder oral oder rektal möglich. Per os ist je nach Kaliumspiegel eine Gabe von 15 g drei- bis viermal pro Tag gelöst in Wasser möglich. Auf Grund der obstipierenden Wirkung empfiehlt sich jedoch die Kombination mit einem Laxans, um die Darmpassage zu erhöhen. Die rektale Applikation von NaPSS ist zum Beispiel für Patienten mit Erbrechen oder Erkrankungen des oberen Gastrointestinaltrakts geeignet. Es werden 30 g in 150 ml Wasser gelöst und rektal appliziert (4). Auch die Kombination von oraler und rektaler Therapie ist möglich.
Patiromer
Patiromer (Veltassa®) ist ein nicht absorbierbares Polymer, welches Kalium im Austausch gegen Kalzium im Darm bindet. Die orale Einnahme erfolgt als Suspension mit ausreichend Wasser. Der Wirkbeginn liegt bei ca. sieben Stunden und erreicht ein Maximum nach 48 Stunden (30). In der OPAL-HK-Studie (Study Evaluating the Efficacy and Safety of Patiromer for the Treatment of Hyperkalemia) mit 237 Patienten mit CKD-Stadium III und IV, RAASi-Therapie und Hyperkaliämie zwischen 5,1–6,5 mmol/l wurde Patiromer in zwei Phasen untersucht. In Phase 1 erfolgte eine vierwöchige initiale Behandlung mit entweder 4,2 g oder 8,4 g zweimal pro Tag. In der achtwöchigen Phase 2 wurde bei Patienten mit einem Kaliumspiegel zwischen 3,8–5,1 mmol/l Patiromer vs. Placebo untersucht. Endpunkt war in beiden Phasen die Veränderung des mittleren Kaliums nach Woche 4. In Phase 1 konnte ein Unterschied der Kaliumspiegel im Vergleich zum Baselinewert von –1,01 (95 % Konfidenzintervall [CI] 1,07 bis –0,95; p < 0,001) beobachtet werden. Der Effekt von Patiromer war bei höheren Kaliumausgangswerten stärker (–1,23; 95 % CI –1,31 bis –1,16). In Phase 2 konnten wieder bei 60 % der Placebogruppe eine Hyperkaliämie von > 5,5 mmol/l gegen 15 % in der Behandlungsgruppe beobachtet werden (p < 0,001) (31).
In der AMETHYST-DN-Studie (Patiromer in the Treatment of Hyperkalemia in Patients With Hypertension and Diabetic Nephropathy) wurden 306 Diabetiker mit Kalium > 5,0 mmol/l, GFR zwischen 15–60 ml/min/1,73 m2 und einer RAASi-Therapie untersucht (32). Es erfolgte eine Dosistitration in zwei Gruppen mit milder (5–5,4 mmol/l) beziehungsweise moderater (5,5–6 mmol/l) Hyperkaliämie. Die Startdosen lagen bei 4,2 g, 8,4 g oder 12,6 g bzw. 16,8 g, 25,2 g oder 33,6 g pro Tag und wurden je nach Kaliumspiegel im Verlauf angepasst um Werte < 5 mmol/l zu erreichen. Primärer Endpunkt war die mittlere Kaliumveränderung nach vier Wochen oder vor Dosistitration. In der ersten Gruppe mit milder Hyperkaliämie zeigte sich eine signifikante (p < 0,001) Reduktion des Kaliums um –0,47 mmol/l. In Gruppe 2 um –0,92 mmol/l. Des Weiteren wurden die Sicherheitsendpunkte über 52 Wochen beobachtet. Bei 8,6 % zeigte sich eine Hypomagnesiämie, bei 5,6 % eine Hypokaliämie < 3,5 mmol/l und bei 7–11 % Obstipation oder Diarrhoe (31;32). Außerdem sind Interaktionen mit Ciprofloxacin, Levothyroxin, Metformin und Chinidin gesichert, sodass diese mindestens drei Stunden vor oder nach Patiromer appliziert werden sollten. Gleiches gilt für Substanzen mit enger therapeutischer Breite. Der Nachteil der Studien ist die kleine Patientenzahl sowie die fehlenden klinischen Langzeiterfahrungen. Außerdem liegen bisher keine Studien bezüglich klinischer Endpunkte wie Arrhythmien, kardiovaskulärer Mortalität oder Hospitalisation vor. Bisher konnte also nur bewiesen werden, dass Patiromer den Laborwert „Serumkalium“ erniedrigen kann. Ob dies mit einem klinischen Nutzen verbunden ist, ist noch nicht bewiesen. Ein Zusatznutzen zur gegenwärtigen Standardtherapie wird vom G-BA als nicht belegt gesehen (Beschluss vom 20. September 2018 (33)). In der Dauertherapie tritt das Medikament bisher kaum in Erscheinung schon wegen der vielen möglichen Interaktionen.
Natrium-Zirkonium-Cyclosilicat (ZS-9, SZC)
Natrium-Zirkonium-Cyclosilicat (ZS-9; Lokelma®) ist ein nicht absorbierbares Polymer, welches Kalium im Darm bindet. Es imitiert physiologische Kaliumkanäle, sodass es selektiv für dieses Ion ist. Andere positiv geladene Ionen, zum Beispiel Natrium oder Magnesium, passen weniger gut in die Pore und befinden sich damit in einem energetisch ungünstigen Zustand (10). Zu den Vorteilen gehören ein schneller Wirkeintritt sowie ein gutes Sicherheitsprofil (die Inzidenz von Nebenwirkungen ist vergleichbar mit Placebo). In einer internationalen doppelblinden placebokontrollierten Studie mit 753 Patienten fand sich eine signifikante dosisabhängige Kaliumreduktion um durchschnittlich –0,73 mmol/l bei einer Höchstdosis von 10 g (34). In der Dossierbewertung des IQWIQ werden die einzelnen zur Verfügung stehenden Studien kritisch bewertet (35) und es findet sich eine ausführliche Bewertung der aktuellen Studien zu Natrium-Zirkonium-Cyclosilicat. Ein Zusatznutzen wurde vom GBA nach den vorgelegten Studien nicht gesehen (Beschluss vom 16. September 2021 (36)). Gegenwärtig wird das Arzneimittel von vielen Notfallambulanzen zur Notfallbehandlung verwendet. In der kontinuierlichen Therapie ist es noch nicht häufig zu finden. Eine sehr gute Zusammenfassung über den aktuellen Studienstand findet sich bei Larivee (37).
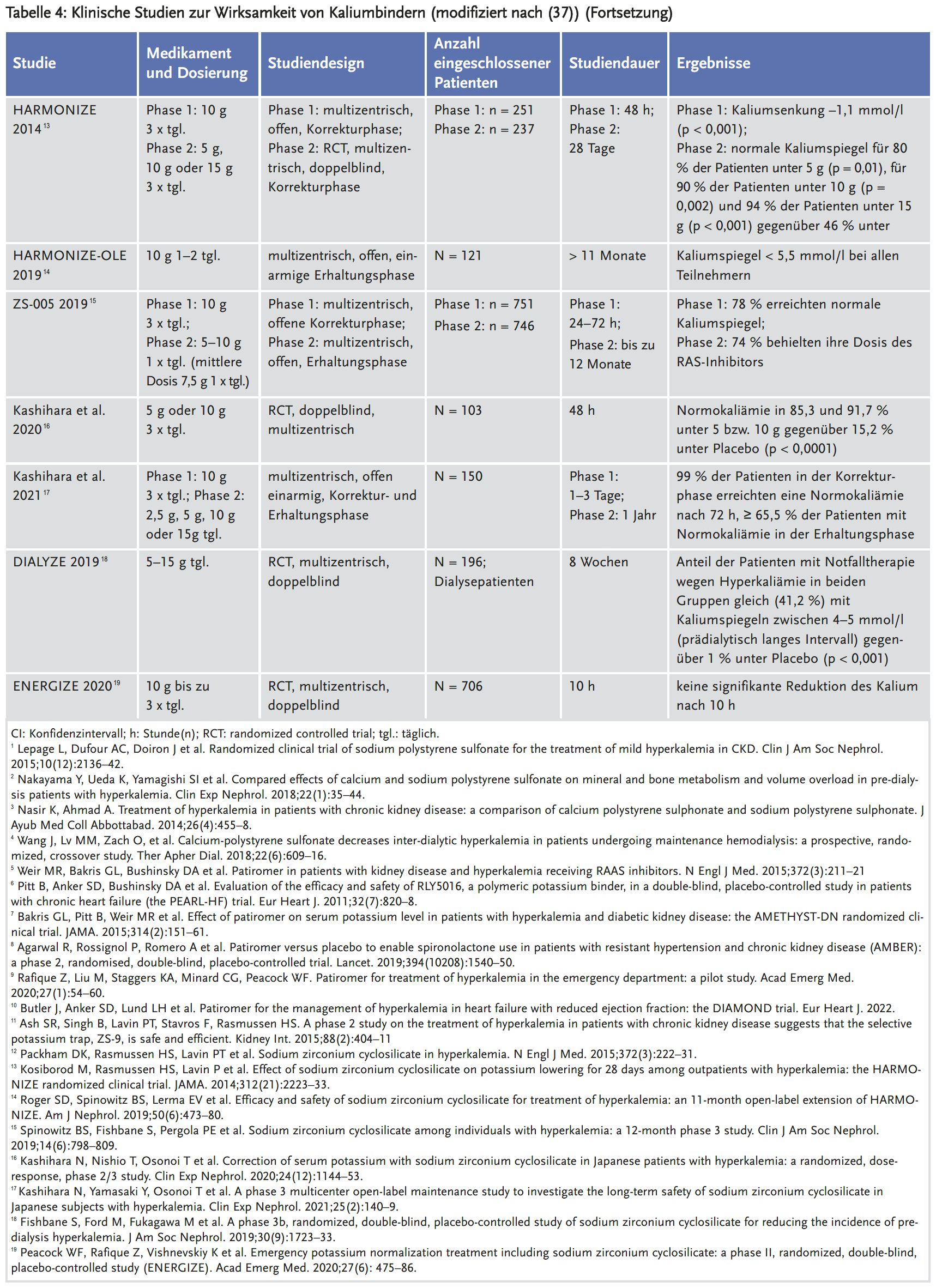
- In Tabelle 3 sind die Eigenschaften der drei Kaliumbinder dargestellt. Die Ergebnisse der relevanten klinischen Studien zur Wirksamkeit dieser Arzneimittel sind in Tabelle 4 zusammengefasst.
Kriterien für unterschiedliche Behandlungsentscheidungen bei Hyperkaliämie
Chronische Nierenerkrankung und Hämodialyse
Die Niere ist eines der wichtigsten Organe für die Kalium-Homöostase. Nimmt ihre Funktion ab, so ist die Ausscheidung von Kalium eingeschränkt. Demnach sind Patienten mit chronischer Nierenerkrankung (CKD) eine der wichtigsten Untergruppen bezüglich der Hyperkaliämie. Obwohl die Kaliumelimination über den Dickdarm kompensatorisch bis auf das Dreifache gesteigert werden kann (5), ist ein erhöhter Kaliumspiegel eine der häufigsten Komplikationen der chronischen Nierenerkrankung. Etwa zwei Millionen Patienten im Erwachsenenalter leiden in Deutschland unter einer eingeschränkten Nierenfunktion (eGFR < 60 ml/min) (38). Jedoch nimmt die Nierenfunktion mit dem Alter stetig ab und insbesondere in der Gruppe > 80 Jahre ist die höchste Prävalenz zu erwarten. Auf Grund des hohen Anteils an der Bevölkerung ist diese Patientengruppe hochrelevant. Die Prävalenz von Hämodialyse beziehungsweise Peritonealdialyse liegt mit ungefähr 80.000 bei ca. 0,1 % der deutschen Bevölkerung (39). Doch nicht nur die eingeschränkte Nierenfunktion allein ist verantwortlich für die erhöhte Gefahr einer Hyperkaliämie. Insbesondere die in dieser Subgruppe häufigen Medikamente wie ACE-Hemmer, AT1-Antagonisten und Aldosteronantagonisten erhöhen in Kombination mit eingeschränkter Nierenfunktion die Wahrscheinlichkeit eines erhöhten Kaliumspiegels (11). Sie müssen oft dosisreduziert werden. Aldosteronantagonisten sind sogar nur bis zu einer GFR von 30 ml/min/1,73 m2 zugelassen.
Doch inwiefern ist der erhöhte Kaliumspiegel für dieses Patientenkollektiv klinisch relevant? Eine amerikanische Studie von Nakhoul et al. mit 36.359 Patienten mit einer GFR < 60ml/min/1,73 m2 zeigte eine erhöhte Mortalität bei Patienten mit einem Kaliumspiegel > 5,5 mmol/l (18). Für Hämodialysepatienten ist schon in mehreren Studien bewiesen, dass Hyperkaliämie (> 5,6, > 5,7 und > 6,0 mmol/l) ein Mortalitätsfaktor ist (40;41;16). In einer größeren Studie mit 245.808 Patienten von Einhorn et al. wurde die 1-Tages-Mortalität bei Hyperkaliämie sowohl bei Patienten mit normaler Nierenfunktion als auch mit Niereninsuffizienz untersucht (11). Es zeigte sich, dass Patienten mit einer normalen Nierenfunktion die stärkste Assoziation von Hyperkaliämie und Mortalität hatten (Odds Ratio [OR] 10,32 für Kalium 5,5–5,9 mmol/l und OR 31,64 für > 6,0 mmol/l). Die Odds Ratio sank mit steigendem CKD-Stadium. Im Stadium 5 lag die Odds Ratio nur noch bei 2,31 für einen Kaliumbereich von 5,5–5,9 mmol/l und 8,02 für > 6,0 mmol/l. Ähnliche Ergebnisse zeigten sich bei An et al. (12) für Patienten mit schwerer Hyperkaliämie > 6,5 mmol/l. Die Odds Ratios zeigten sich wie folgt: CKD-Stadium 2: OR 0,52; CKD-Stadium 3: OR 0,31; CKD-Stadium 4: OR 0,13 und CKD-Stadium 5: OR 0,17. Patienten mit chronischer Niereninsuffizienz scheinen in diesem Zusammenhang also weniger vulnerabel als das nierengesunde Patientenkollektiv zu sein. Eigentlich müssten Patienten mit CKD jedoch besonders vulnerabel für die toxischen (insbesondere proarrhythmogenen) Effekte der Hyperkaliämie sein, da sie vermehrt an Herzinsuffizienz, Hypokalzämie, Linksherzhypertrophie und metabolischer Azidose leiden. Bisher sind uns keine Studien bekannt, welche die protektiven Effekte der chronischen Nierenerkrankung für die Folgen der Hyperkaliämie erklären.
Herzinsuffizienz
Patienten mit Herzinsuffizienz zeigen generell ein erhöhtes Risiko für Arrhythmien, welches diese Gruppe besonders vulnerabel gegenüber Elektrolytstörungen, insbesondere Hyperkaliämie macht (42). Gleichzeitig findet sich eine hohe Koinzidenz von Herzinsuffizienz und chronischer Nierenerkrankung. In beiden Patientengruppen werden standardmäßig ACE-Hemmer, AT1-Antagonisten und Aldosteronantagonisten eingesetzt. Zusammen potenzieren diese das Risiko einer Hyperkaliämie. Bei Patienten mit reduzierter Ejektionsfraktion konnte ein besseres Outcome mit höheren Dosen dieser Medikamente beobachtet werden (42). Insgesamt überwiegt bisher jedoch das Risiko der Hyperkaliämie in diesem vulnerablen Kollektiv, sodass bisher oft die Dosis reduziert werden muss. Pathophysiologisch liegt bei der Herzinsuffizienz oft ein Hyperaldosteronismus vor. Der Perfusionsdruck der Niere fällt und es kommt zur reflektorischen Sekretion von Renin in den juxtaglomerulären Zellen. Angiotensinogen wird über eine Zwischenstufe mit Hilfe vom Angiotensin Converting Enzyme (ACE) zum Angiotensin II gespalten. Es folgt eine Stimulation der Aldosteronsekretion, Vasokonstriktion, Salz- und Wasser-Retention, sowie eine gesteigerte Kaliumsekretion im Sammelrohr (10). Wird dieser Prozess unterbrochen, zum Beispiel von ACE-Hemmern, AT1-Antagonisten und Aldosteronantagonisten, steigt die Gefahr von Hyperkaliämien. Insbesondere ist dies der Fall, wenn ACE-Hemmer oder AT1-Antagonisten mit Aldosteronantagonisten kombiniert werden. Die Kombination von ACE-Hemmern und AT1-Antagonisten ist aus diesem Grunde kontraindiziert.
In der RALES-Studie (Randomized Aldactone Evaluation Study) konnte ein Überlebensvorteil von herzinsuffizienten Patienten unter Therapie mit Spironolacton gezeigt werden (p < 0,0001). Dieser war unabhängig vom Kaliumspiegel (43). Die Mortalität der Patienten in der Spironolacton-Gruppe war jedoch erhöht, wenn das Serumkalium > 5,5 mmol/l war. Auch hier zeigte sich die weiter oben beschriebene U-Kurve im Vergleich von Kaliumhöhe und Mortalität. Nach Veröffentlichung dieser Studie wurde mehr Spironolacton in der Herzinsuffizienztherapie eingesetzt. Gleichzeitig wurden jedoch mehr Hyperkaliämie-assoziierte Hospitalisationen und Tode bei Herzinsuffizienzpatienten verzeichnet (20). Dies zeigt, dass trotz möglichem Überlebensvorteil in der Behandlung der Grunderkrankung nicht uneingeschränkt RAASi eingesetzt werden dürfen. Bei Verordnung dieser Medikamente ist also die engmaschige Kaliumkontrolle durch den verordnenden Arzt wichtig. Insbesondere auf Grund der hohen Koinzidenz mit der CKD, welche in der ADHERE-Studie (Acute Decompensated Heart Failure National Registry) bei mehr als 60 % lag (44).
Patiromer und Herzinsuffizienz
In der Subgruppenanalyse der OPAL-HK-Studie von 102 (42 %) herzinsuffizienten Patienten zeigten sich in Phase 1 fast identische Ergebnisse zum Gesamtkollektiv (Kaliumreduktion um –1,06). In Phase 2 zeigte sich eine Wiederkehr der Hyperkaliämie bei 52 % der Placebogruppe und 8 % der Behandlungsgruppe (45).
In der PEARL-HF-Studie (Evaluation of Patiromer in Heart Failure Patients) wurden 105 Patienten mit Herzinsuffizienz und neuer Spironolacton-Therapie über vier Wochen untersucht. Es wurde randomisiert zwischen Therapie mit 30 g Patiromer pro Tag und Placebo. Der primäre Endpunkt war wieder die mittlere Veränderung des Kaliumspiegels nach vier Wochen. In der Behandlungsgruppe normalisierte sich das Kalium bei 24 % vs. 7 % in der Placebogruppe (p = 0,015). Mehr Patienten in der Behandlungsgruppe erreichten die Maximaldosis von 50 mg Spironolacton pro Tag als in der Placebogruppe (91 % vs. 74 %; p = 0,019). 6 % der Behandlungsgruppe hatten eine Hypokaliämie < 3,5 mmol/l vs. 0 % in der Placebogruppe (46).
Diabetes mellitus
Die Prävalenz von Diabetes mellitus Typ 1 und 2 lag 2010 bei ca. 9,9 % (47). Der Anteil von Diabetikern mit fallender GFR ist steigend (10). Diabetes und CKD stehen, zum Beispiel im Krankheitsbild der diabetischen Nephropathie, in Wechselwirkung. Es stellt sich also die Frage, ob Diabetiker auch eine besondere Patientengruppe bezüglich Hyperkaliämien darstellen. In einer Studie mit 245.808 Patienten von Einhorn et al. war die Odds Ratio für eine Hyperkaliämie (> 5,5 mmol/l) bei Diabetikern bei 1,51 (95 % CI 1,47–155) (11). Eine kleinere Studie aus Griechenland ordnete 180 niereninsuffizienten (Stadium 2–4) Patienten mit Typ-2-Diabetes 180 äquivalente Nicht-Diabetiker zu. Insgesamt zeigte sich eine 25 % höhere Inzidenz von Hyperkaliämien bei Diabetikern (27,2 % vs. 20 %), welche jedoch nicht statistisch signifikant war. Lediglich im CKD-Stadium 3 zeigten sich signifikante Unterschiede: 28,6 % Hyperkaliämien bei Diabetikern und 17,5 % bei Nicht-Diabetikern (p = 0,036) (48). Die Einnahme von ACE-Hemmern, AT1-Antagonisten, Aldosteronantagonisten und Schleifendiuretika war in beiden Gruppen gleich. Lediglich Betablocker wurden mehr bei Diabetikern und Thiazide signifikant weniger bei Nicht-Diabetikern verschrieben. Signifikante Faktoren für die Entwicklung einer Hyperkaliämie waren das steigende CKD-Stadium, die Einnahme von ACE-Hemmern (OR 2,228; 95 % CI 1,254–3,958) und das Rauchen (OR 2,254; 95 % CI 1,218–4,171)), nicht jedoch die Einnahme von AT1-Antagonisten. Pathophysiologisch liegt ein Insulinmangel beziehungsweise eine periphere Insulinresistenz vor. Da Insulin den Kaliumspiegel durch Verschiebung nach intrazellulär senkt, ist in diesem Fall mehr extrazelluläres Kalium vorhanden. Des Weiteren liegt oft ein hyporeninämischer Hypoaldosteronismus vor, bedingt durch Natrium- und Flüssigkeitsretention, welche zu verringerter Aldosteronwirkung im distalen Nephron und damit reduzierter Kaliumexkretion führt (49).
Kritisch kranke Patienten
In einer koreanischen retrospektiven Analyse von An et al. von 923 hospitalisierten Patienten mit Hyperkaliämie > 6,5 mmol/l zeigte sich eine Rate von 13,7 % Arrhythmien und 20,3 % Herzstillständen (Diagnose der Hyperkaliämie beim Herzstillstand) (12). Die Verstorbenen hatten erhöhte Komorbiditäten: Multiorganversagen (OR 7,64; 95 % CI 4–14,57), Aufenthalt auf der Intensivstation (OR 3,62; 95 % CI 1,79–7,32), Malignität (OR 2,88; 95 % CI 1,68–4,96), akutes Nierenversagen (OR 2,17; 95 % CI 1,27–3,71) und einen erhöhten Kaliumanstieg im Vergleich zu den Überlebenden. In einer retrospektiven amerikanischen Studie von McMahon et al. mit 39.705 Patienten zeigte sich Hyperkaliämie ebenfalls als ein unabhängiger Mortalitätsfaktor für Patienten auf Intensivstation (13). Kritisch kranke Patienten scheinen besonders vulnerabel für die Auswirkungen einer Hyperkaliämie zu sein und sollten als Subgruppe besonders streng behandelt werden, um die Mortalität zu senken.
Afroamerikanische Patienten
In einer amerikanischen Studie mit 1227 Patienten mit chronischer Nierenerkrankung Stadium 1–4 (86 % im Stadium 3–4) wurden prädialytische Mortalität sowie eGFR in Korrelation mit dem Kaliumspiegel analysiert (22). 933 Patienten waren kaukasisch und 294 afroamerikanischer Herkunft. Patienten mit höherem Baselinekalium hatten eine höhere Wahrscheinlichkeit kaukasischer Herkunft und Diabetiker (p < 0,01) zu sein. Ein erniedrigtes Serumkalium war signifikant (p < 0,05) mit afroamerikanischer Herkunft assoziiert.
Im afroamerikanischen Kollektiv war die Hypokaliämie jedoch ein stärkerer Mortalitätsfaktor als bei den kaukasischen Patienten. Im Gegenzug wurde Hyperkaliämie besser vertragen, sodass keine signifikante Assoziation zwischen hohem Kalium und Mortalität gefunden werden konnte (selbst im direkten Vergleich mit einem äquivalenten kaukasischen Kollektiv). Physiologisch zeigen afroamerikanische Patienten eine geringere Kaliumausscheidung im Urin. Eine Studie führte dies auf eine reduzierte Kaliummenge in der Diät zurück (50). In einer anderen Studie, in der die Patienten identische Nahrungsmittel zu sich nahmen, konnte dies als Erklärung jedoch widerlegt werden (51). Eventuell haben Patienten afroamerikanischer Herkunft bisher nicht bekannte geeignetere Mechanismen, um mit Hyperkaliämien umzugehen. In diesem Patientenkollektiv ist also ein liberalerer Umgang mit kaliumerhöhenden Medikamenten möglich. Im Gegenzug ist jedoch bei kaliumsenkenden Maßnahmen besondere Vorsicht geboten, um die erhöhte Mortalität in der Hypokaliämie zu vermeiden.
Hypokaliämie (1 mmol/l unterhalb der Norm) steigert minimal die CKD-Progression (–0.13 ml/min/1.73 m2/Jahr (95 % CI –0.20 bis –0.07), p < 0.001. Die Hyperkaliämie hatte keinen Einfluss auf die Nierenfunktionsverschlechterung. Auch wenn der Einfluss auf den Progress gering ist, sollte bei der Therapie der Hyperkaliämie Vorsicht geboten sein, um keine iatrogenen Hypokaliämien zu erzeugen (22).
Fazit für die Praxis
Hyperkaliämie ist eine potenziell lebensbedrohliche Elektrolytstörung, von der insbesondere Patienten mit chronischer Nierenerkrankung betroffen sind. Die Behandlung mit ACE-Hemmern oder AT1-Antagonisten, insbesondere in Kombination mit Aldosteronantagonisten und anderen Arzneimitteln, welche die Kaliumausscheidung hemmen, sind zusätzliche prädisponierende Faktoren, wie auch Herzinsuffizienz und Diabetes mellitus. Je nach Begleiterkrankungen, Schnelligkeit des Auftretens und Höhe ist das Serumkalium klinisch unterschiedlich relevant. EKG-Veränderungen sind sehr variabel und können auch schon bei relativ niedrigen Kaliumwerten auftreten oder auch bei hohen Spiegeln fehlen. In den englischen Leitlinien zur Hyperkaliämie wird ein 5-Stufen-Algorithmus zur Therapie vorgeschlagen, der aus Stabilisierung des Herzens, Kaliumshift in die Zellen, Entfernung von überschüssigem Kalium aus dem Körper, Monitoring von Kalium und Glukose und Prävention von weiteren Hyperkaliämien besteht.
Literatur
- Kovesdy CP: Management of hyperkalaemia in chronic kidney disease. Nat Rev Nephrol 2014; 10: 653-662.
- Montford JR, Linas S: How dangerous is hyperkalemia? J Am Soc Nephrol 2017; 28: 3155-3165.
- Ben Salem C, Badreddine A, Fathallah N et al.: Drug-induced hyperkalemia. Drug Saf 2014; 37:677-692.
- Alfonzo A, Harrison A, Baines R et al.: Clinical Practice Guidelines: treatment of acute hyperkalemia in adults: ukkidney.org/sites/renal.org/files/RENAL%20ASSOCIATION%20HYPERKALAEMIA%20GUIDELINE%20-%20JULY%202022%20V2_0.pdf (letzter Zugriff: 13. Januar 2023). UK Renal Association; Juni 2020.
- Mathialahan T, Maclennan KA, Sandle LN et al.: Enhanced large intestinal potassium permeability in end-stage renal disease. J Pathol 2005; 206: 46-51.
- Gumz ML, Rabinowitz L, Wingo CS: An integrated view of potassium homeostasis. N Engl J Med 2015; 373: 60-72.
- Kovesdy CP: Management of hyperkalaemia: an update for the internist. Am J Med 2015; 128: 1281-1287.
- Acker CG, Johnson JP, Palevsky PM, Greenberg A: Hyperkalemia in hospitalized patients: Causes, adequacy of treatment, and results of an attempt to improve physician compliance with published therapy guidelines. Arch Intern Med 1998; 158: 917-924.
- Palmer BF, Clegg DJ: Diagnosis and treatment of hyperkalemia. Cleve Clin J Med 2017; 84: 934-942.
- Sarwar CMS, Papadimitriou L, Pitt B et al.: Hyperkalemia in heart failure. J Am Coll Cardiol 2016; 68: 1575-1589.
- Einhorn LM, Zhan M, Hsu VD et al.: The frequency of hyperkalemia and its significance in chronic kidney disease. Arch Intern Med 2009; 169: 1156-1162.
- An JN, Lee JP, Jeon HJ et. al: Severe hyperkalemia requiring hospitalization: Predictors of mortality. Crit Care 2012; 16: R225.
- McMahon GM, Mendu ML, Gibbons FK, Christopher KB: Association between hyperkalemia at critical care initiation and mortality. Intensive Care Med 2012; 38: 1834-1842.
- Goyal A, Spertus JA, Gosch K et al.: Serum potassium levels and mortality in acute myocardial infarction. JAMA 2012; 307: 157-164.
- Grodzinsky A, Goyal A, Gosch K et al.: Prevalence and prognosis of hyperkalemia in patients with acute myocardial infarction. Am J Med 2016; 129: 858-865.
- Genovesi S, Valsecchi MG, Rossi E et al.: Sudden death and associated factors in a historical cohort of chronic haemodialysis patients. Nephrol Dial Transplant 2009; 24: 2529-2536.
- Brunelli SM, Du Mond C, Oestreicher N et al.: Serum potassium and short-term clinical outcomes among hemodialysis patients: impact of the long interdialytic interval. Am J Kidney Dis 2017; 70: 21-29.
- Nakhoul GN, Huang H, Arrigain S et al.: Serum potassium, end-stage renal disease and mortality in chronic kidney disease. Am J Nephrol 2015, 41: 456-463.
- Pitt B, Bakris G, Ruilope LM et al.: Serum potassium and clinical outcomes in the Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study (EPHESUS). Circulation 2008; 118: 1643-1650.
- Juurlink DN, Mamdani MM, Lee DS et al.: Rates of hyperkalemia after publication of the Randomized Aldactone Evaluation Study. N Engl J Med 2004; 351: 543-551.
- Tseng WC, Liu JS, Hung SC et al.: Effect of spironolactone on the risks of mortality and hospitalization for heart failure in pre-dialysis advanced chronic kidney disease: A nationwide population-based study. Int J Cardiol 2017; 238: 72-78.
- Hayes J, Kalantar-Zadeh K, Lu JU et al.: Association of hypo- and hyperkalemia with disease progression and mortality in males with chronic kidney disease: the role of race. Nephron Clin Pract 2012; 120, c8-c16.
- Dunn JD, Benton WW, Orozco-Torrentera E, Adamson R: the burden of hyperkalemia in patients with cardiovascular and renal disease. Am J Manag Care 2015; 21: 307-315.
- Elliott MJ, Ronksley PE, Clase CM et al.: Management of patients with acute hyperkalemia. CMAJ 2010; 182: 1631-1635.
- DeFronzo RA: Hyperkalemia and hyporeninemic hypoaldosteronism. Kidney Int 1980; 17: 118-134.
- Flinn RB, Merrill JP, Welzant WA: Treatment of the oliguric patient with a new sodium-exchange resin and sorbitol; a preliminary report. N Engl J Med 1961; 264: 111-115.
- Sterns RH, Rojas M, Bernstein P, Chennupati S: Ion-exchange resins for the treatment of hyperkalemia: are they safe and effective? J Am Soc Nephrol 2010; 21: 733-735.
- Mahoney BA, Smith WAD, Lo D et al.: Emergency interventions for hyperkalaemia. Cochrane Database Syst Rev 2005; Issue2: CD003235.
- Gerstman BB, Kirkman R, Platt R: Intestinal necrosis associated with postoperative orally administered sodium polystyrene sulfonate in sorbitol. Am J Kidney Dis 1992; 20: 159-161.
- Europäische Arzneimittel-Agentur (EMA), Committee for Medicinal Products for Human Use (CHMP): European Public Assessment Report (Assessment Report): Veltassa, Common name: patirome: www.ema.europa.eu/en/documents/assessment-report/veltassa-epar-public-assessment-report_en.pdf (letzter Zugriff: 13. Januar 2023). London, 18. Mai 2017.
- Weir MR, Bakris GL, Bushinsky DA et al.: OPAL-HK Investigators. Patiromer in patients with kidney disease and hyperkalemia receiving RAAS inhibitors. N Engl J Med 2015; 372: 211-221.
- Bakris GL, Pitt B, Weir MR et al.: AMETHYST-DN Investigators. Effect of patiromer on serum potassium level in patients with hyperkalemia and diabetic kidney disease: the AMETHYST-DN randomized clinical trial. JAMA 2015; 314: 151-161.
- Gemeinsamer Bundesausschuss (G-BA): Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII – Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V – Patiromer: www.g-ba.de/downloads/39-261-3480/2018-09-20_AM-RL-XII_Patiromer_D-351_BAnz.pdf (letzter Zugriff: 13. Januar 2023). Berlin, 20. September 2018.
- Packham DK, Rasmussen HS, Lavin PT et al.: Sodium zirconium cyclosilicate in hyperkalemia. N Engl J Med 2015; 372: 222-231.
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG): IQWiG-Berichte – Nr. 1149: Natriumzirkoniumcyclosilicat (Hyperkaliämie) – Nutzenbewertung gemäß § 35a SGB V: www.g-ba.de/downloads/92-975-4598/2021-04-01_Nutzenbewertung-IQWiG_Natriumzirkoniumcyclosilicat_D-664.pdf (letzter Zugriff: 13. Januar 2023). Köln, 29. Juni 2021.
- Gemeinsamer Bundesausschuss (G-BA): Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie: Anlage XII – Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V Natrium-Zirconium-Cyclosilicat (Hyperkaliämie): www.g-ba.de/downloads/39-261-5022/2021-09-16_AM-RL-XII_Natrium-Zirconium-Cyclosilicat_D-664_BAnz.pdf (letzter Zugriff: 13. Januar 2023). Berlin, 16. September 2021.
- Larivee NL, Michaud JB, More KM et al.: Hyperkalemia: prevalence, predictors and emerging treatments. Cardiol Ther 2023; 12: 35-63.
- Girndt M, Trocchi P, Scheidt-Nave C et al.: The prevalence of renal failure – results from the German Health Interview and Examination Survey for Adults, 2008–2011 (DEGS1). Dtsch Arztebl Int 2016; 113: 85-91.
- Medical Netcare GmbH: Jahresbericht Datenanalyse Dialyse für den Gemeinsamen Bundesausschuss, Berichtsjahr 2013: www.g-ba.de/downloads/17-98-3758/2014-07-17_QSD-RL_Jahresbericht_2013_Bericht.pdf (letzter Zugriff: 13. Januar 2023). Münster, 28. März 2014.
- Kovesdy CP, Regidor DL, Methrotra R et al.: Serum and dialysate potassium concentrations and survival in hemodialysis patients. Clin J Am Soc Nephrol 2007; 2: 999-1007.
- Yusuf AA, Hu Y, Singh B et al.: Serum potassium levels and mortality in hemodialysis patients: A Retrospective Cohort study. Am J Nephrol 2016; 44: 179-186.
- Konstam MA, Neaton JD, Dickstein K et al.: HEAAL Investigators. Effects of high-dose versus low-dose losartan on clinical outcomes in patients with heart failure (HEAAL study): a randomised, double-blind trial. Lancet 2009; 374: 1840-1848.
- Pitt B, Zannad F, Remme WJ et al.: Randomized Aldactone Evaluation Study Investigators. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med 1999; 341: 709-717.
- Adams KF, Fonarow GC, Emerman CL et al.: ADHERE Scientific Advisory Committee and Investigators. Characteristics and outcomes of patients hospitalized for heart failure in the United States: rationale, design, and preliminary observations from the first 100,000 cases in the Acute Decompensated Heart Failure National Registry (ADHERE). Am Heart J 2005; 149: 209-216.
- Pitt B, Bakris GL, Bushinsky DA et al.: Effect of patiromer on reducing serum potassium and preventing recurrent hyperkalaemia in patients with heart failure and chronic kidney disease on RAAS inhibitors. Eur J Heart Fail 2015; 17: 1057-1065.
- Pitt B, Anker SD, Bushinsky DA et al.: Evaluation of the efficacy and safety of RLY5016, a polymeric potassium binder, in a double-blind, placebo-controlled study in patients with chronic heart failure (the PEARL-HF) trial. Eur Heart J 2011; 32: 820-888.
- Tamayo T, Brinks R, Hoyer A et al.: The prevalence and incidence of diabetes in Germany - an analysis of statutory health insurance data on 65 million individuals from the years 2009 and 2010. Dtsch Arztebl Int 2016; 113: 177-182.
- Loutradis C, Tolika P, Skodra A et al.: Prevalence of hyperkalemia in diabetic and non-diabetic patients with chronic kidney disease: a nested case – control study. Am J Nephrol 2015; 42: 351-360.
- Liamis G, Liberopoulos E, Barkas F, Elisaf M: Diabetes mellitus and electrolyte disorders. World J Clin Cases 2014; 2: 488-496.
- Langford HG, Cushman WC, Nsu H: Chronic effect of KCl on black-white differences in plasma renin activity, aldosterone, and urinary electrolytes. Am J Hypertens 1991; 4: 399-403.
- Luft FC, Rankin LI, Bloch R et al: Cardiovascular and humoral responses to extremes of sodium intake in normal black and white men. Circulation 1979; 60: 697-706.
Interessenkonflikte
Der Autor gibt an, keine Interessenkonflikte zu haben.
