Die Problematik der Off-Label-Anwendung bei Kindern am Beispiel von Fentanyl
Arzneimittel – kritisch betrachtet
Weitere Autorin: Dr. P.H. Stanislava Dicheva-Radev, Berlin
Fentanyl im Kindesalter
Kinder und Jugendliche erhalten oft Arzneimittel, die nicht für sie zugelassenen sind (Off-Label-Use; Off-Label-Anwendung). Dies stellt nicht nur ein Risiko für die Sicherheit der Arzneimitteltherapie dar, sondern hat auch haftungsrechtliche Konsequenzen. Aber ohne Off-Label-Anwendung würden Kinder und Jugendliche nicht dem Stand der Wissenschaft entsprechend mit Medikamenten behandelt. Oft, aber nicht immer (1), gibt es für die Off-Label-Anwendung hinreichende Evidenz für den Einsatz in bestimmten Indikationen, Altersgruppen oder Dosisempfehlungen aufgrund pharmakokinetischer Studien und validen Daten zur Wirksamkeit und Sicherheit. Ein Beispiel für eine gute Evidenzlage ist das Opioid Fentanyl. Fentanyl-haltige Arzneimittel sind in Deutschland für Kinder erst ab zwei Jahren zugelassen (2). Dieses Opioid wird aber seit Jahrzehnten bei Früh- und Neugeborenen sowie bei Säuglingen national wie international am häufigsten zur Analgosedierung verwendet (3). Für Früh- und Neugeborene liegen aussagekräftige pharmakokinetische Daten und valide Dosierungsvorschläge vor (4;5), die aber nicht für eine Zulassung verwendet wurden. Fentanyl ist daher ein gutes Beispiel dafür, dass die pharmazeutische Industrie trotz guter Datenlage für eine Zulassung für Säuglingen und Kleinkinder anscheinend keinen Vorteil sieht und keine Bemühungen unternimmt, eine Zulassung zu erwirken. Die Kinder unter zwei Jahren werden aber trotz fehlender Zulassung in großem Stil mit diesem Wirkstoff behandelt.
Evidenz für Fentanyl-Anwendung im Kindesalter
In der außerklinischen Notfallmedizin wird Fentanyl bei schweren akuten Schmerzen gerne über einen nasalen Applikationsweg (transmukosale Anwendung) mit einem für diese spezielle Therapie nicht zugelassenem Applikator (Mucosal Atomization Device – MAD® MAD Nasal™; Fa. Teleflex, USA) verabreicht (6). Damit spart man sich die oft mühsame intravenöse Anlage einer Infusionsnadel. Aus Beobachtungsstudien mit mehreren tausend Kindern gibt es für die intranasale Anwendung von Fentanyl im Notfall umfangreiche Daten zur Wirksamkeit und Sicherheit bei Kindern (7;8). Auch gibt es gute Übersichtsarbeiten, die diese Notfalltherapie untersucht haben (9-11).
In einer retrospektive Krankenaktenanalyse über sieben Jahre in einer Notfallambulanz in den USA wurde intranasales Fentanyl in der Indikation akute Schmerzen untersucht (7). Insgesamt wurden 3205 Patienten mit einem mittleren Alter von 13,7 + 2,65 Jahre (Spannbreite 5 bis 18 Jahre) in dieser Studie eingeschlossen. Die intranasal applizierte Dosis von Fentanyl betrug 2–5 µg/kg (max. 200 µg; mit Fentanyl-Lösung 50 µg/ml). Die Anfangsdosis betrug 2,62 + 0,5 μg/kg. Absolut wurden 162 + 30 μg (Spannbreite 102 bis 265 μg) verabreicht und nur zwei Patienten erhielten mehr als 200 μg Fentanyl. In dieser retrospektiven Kohorte traten nur 13 unerwünschte Ereignisse auf, nur drei bei Dosen über 100 μg. Kein Patient benötigte Naloxon als Antidot oder eine invasive Atemunterstützung.
In einer weiteren Beobachtungsstudie aus einer pädiatrischen Notaufnahme wurden Kleinkinder, die mit intranasalem Fentanyl, auch in Kombination mit Midazolam, behandelt worden waren, retrospektiv untersucht (8). Insgesamt erhielten 6198 Kinder im Altersmedian 2,2 Jahre (1,5–3 Jahre; Quartile) Fentanyl, Midazolam oder eine Kombination beider Medikamente intranasal appliziert. Davon wurde bei 1762 Kleinkindern nur Fentanyl, bei 1115 nur Midazolam verabreicht, und 3321 Kleinkinder erhielten eine Kombination beider Wirkstoffe. Häufige Indikationen waren Wundversorgung (33,8 %), Inzision und die Anlage einer Drainage (22,2 %). Die Startdosis (Median, Quartile) von Fentanyl betrug 2,7 (2–3) µg/kg und 13,3 % erhielten eine zweite Dosis. Die Startdosis vom Midazolam betrug 0,3 (0,2–0,3) mg/kg und nur bei 3,3 % wurde eine zweite Dosis gegeben. Die Dosierung bei Kindern mit Kombinationstherapie betrug für Fentanyl 2,8 (2,1–3) µg/kg und für Midazolam 0,3 (0,2–0,3) mg/kg. Nur 3,2 % der Kleinkinder benötigten wiederholte Dosen beider Medikamente. Nur 2,9 % (n = 178) erhielten zusätzliche Opioide. Es wurden keine schwerwiegenden unerwünschten Arzneimittelwirkungen beobachtet und es war keine Gabe eines Antidots oder eine Atemunterstützung notwendig.
Zusammenfasend lässt sich feststellen, dass intravenöses Fentanyl nahezu auf jeder neonatologischen und pädiatrischen Intensivstation, bei vielen Narkosen von Früh- und Neugeborenen und Säuglingen täglich off-label in Deutschland eingesetzt wird. Aber auch intranasales Fentanyl wird bei Kindernotfällen häufig als wirksames Schmerzmittel bei Kindern off-label eingesetzt, vornehmlich beim außerklinischen Einsatz durch die Erstversorger. Dazu gibt es diverse Empfehlungen der pädiatrischen Notärzte (6;12;13). Hier wird insbesondere die intranasale Gabe propagiert, für die eine gute Wirksamkeit und Sicherheit belegt ist (7-9;14-16).
Aber nicht nur der Applikationsweg über die Nase, auch der verwendete Nasenapplikator (MAD Nasal™) wird als Medizinprodukt außerhalb der Zulassung verwendet (12;13), da er nur für die Anwendung mit dafür laut Fachinformation indizierten Arzneimitteln zugelassen ist. Zu erwähnen ist, dass die Sektion Pädiatrische Intensiv- und Notfallmedizin der Deutschen Interdisziplinären Vereinigung für Intensiv- und Notfallmedizin (DIVI e.V.) die intranasale Gabe von Fentanyl wie auch von Esketamin und Midazolam als Standard in der Analgesie von Säuglingen und Kleinkindern in der außerklinischen Notfallversorgung propagiert (12). Dabei weist sie daraufhin, dass Kinder bei Verletzungen deutlich weniger Analgetika erhalten als vergleichbar verletzte Erwachsene.
Fentanyl ist auch ein wichtiger Wirkstoff in der palliativen Versorgung, bei Kindern, Jugendlichen und Erwachsenen. Dafür sind diverse Darreichungsformen verfügbar z. B. intravenös, intraoral, transdermal (17;18). In der Darreichungsform Nasenspray gibt es auch Berichte über die Anwendung bei Atemnot in der palliativen Behandlung (19); zugelassen sind die Fentanyl-haltigen Nasensprays allerdings zur Behandlung von Durchbruchschmerzen bei Erwachsenen, die bereits eine Opioid-Basistherapie gegen ihre chronischen Tumorschmerzen erhalten.
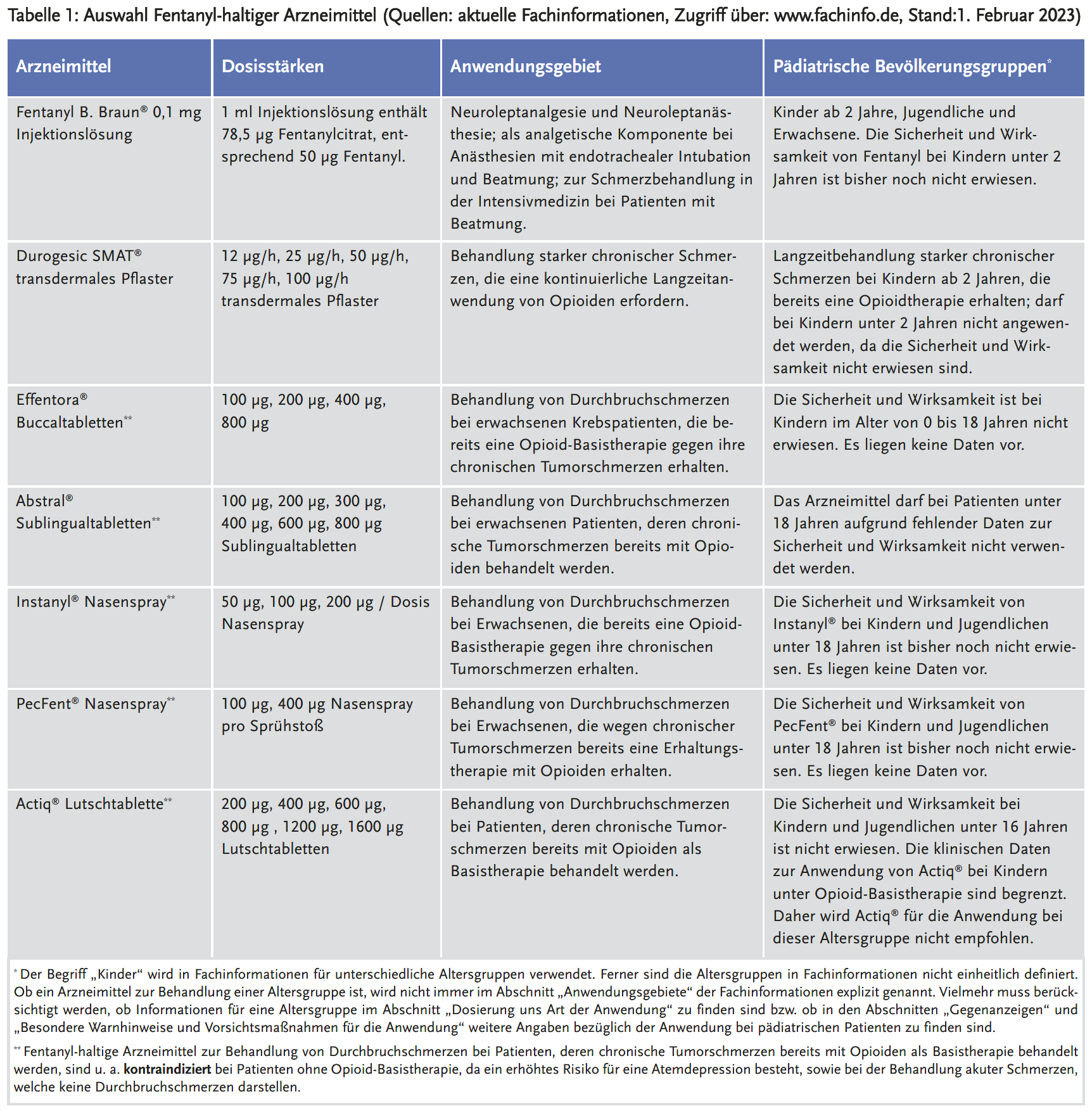
Einen Überblick über die Zulassung ausgewählter Fentanyl-haltiger Arzneimittel gibt Tabelle 1 (2;20-25).
Rechtliche Situation der Off-Label-Anwendung
Die intranasale Applikation von Fentanyl bei pädiatrischen Patienten ist derzeit immer eine Off-Label-Anwendung. Auch die Verwendung des Nasenzerstäubers MAD® zur Applikation Fentanyl-haltiger Arzneimittel ist als zulassungsüberschreitend anzusehen. Diese doppelte Anwendung außerhalb der Zulassung erfordert eine besondere Begründung und eine höhere Plicht des Arztes zur Aufklärung. Die rechtlichen Rahmenbedingungen zur Off-Label-Anwendung wurden in diversen Urteilen deutscher Gerichte festgelegt (26), aber diese sind nicht einfach auf Kinder übertragbar.
Bei den vor deutschen Gerichten verhandelten Streitigkeiten über die Off-Label-Anwendung ging es meistens um Fragen der Refinanzierung der Arzneimittel durch die gesetzliche Krankenversicherung (26). Das Bundessozialgericht entschied letztlich, dass bei einer Off-Label-Verschreibung eine schwerwiegende (lebensbedrohliche oder die Lebensqualität auf Dauer nachhaltig beeinträchtigende) Erkrankung behandelt werden muss und für den Patienten keine andere Therapie verfügbar ist und aufgrund der Datenlage die begründete Aussicht besteht, dass mit dem betreffenden Präparat ein Behandlungserfolg (kurativ oder palliativ) erzielt werden kann (26;27). Dabei erfordert die begründete Aussicht Erkenntnisse in der Qualität einer kontrollierten klinischen Prüfung der Phase III (gegenüber Standard oder Placebo) mit belegtem, klinisch relevantem Nutzen bei vertretbaren Risiken und Erkenntnisse, die erwarten lassen, dass das betroffene Arzneimittel für die relevante Indikation zugelassen werden kann. Zudem reichen ausschließlich Fallberichte, Fallserien, kleinere epidemiologische Untersuchungen und Übersichtsarbeiten nicht aus (26).
Diese Voraussetzungen können bei der Off-Label-Anwendung bei Kindern und Jugendlichen in der Regel nicht erfüllt werden. Eine Refinanzierung preiswerter Generika ist in der Kinder- und Jugendmedizin kein relevantes Problem. Kinder bestimmter Altersklassen erhalten meist Dosierungen und Darreichungsformen preiswerter Generika. Deswegen gilt für Kinder und Jugendliche als wichtigste Voraussetzung bei der Off-Label-Anwendung vor allem die bestmögliche Evidenz, wenn keine zugelassenen Arzneimittel für bestimmte Altersgruppen bzw. kindergerechte Darreichungsformen zur Verfügung stehen.
Für die Off-Label-Anwendung sind die Zulassungen von Fentanyl zu beachten (Tabelle 1). Während Fentanyl in der Darreichungsform Injektionslösung (Indikation: Neuroleptanalgesie und Neuroleptanästhesie, analgetische Komponente bei Anästhesien mit endotrachealer Intubation und Beatmung und zur Schmerzbehandlung in der Intensivmedizin bei Patienten mit Beatmung) und als transdermales Pflaster (Indikation: Behandlung starker chronischer Schmerzen, die eine kontinuierliche Langzeitanwendung von Opioiden erfordern) für Kinder ab zwei Jahren zugelassen ist, gibt es für Kinder und Jugendliche für die Darreichungsformen Buccaltablette, Nasenspray, Sublingualtablette und Lutschtablette keine Zulassung in der Indikation Durchbruchsschmerzen bei Tumortherapie, die schon eine Erhaltungstherapie mit Opioiden erhalten. Bei diesen Präparaten besteht zudem eine Kontraindikation für die Behandlung akuter Schmerzen, welche keine Durchbruchsschmerzen darstellen (Tabelle 1).
Die rechtliche Basis einer Off-Label-Anwendung und damit die Notwendigkeit und das Ausmaß der Aufklärung der Sorgeberechtigten hängt damit nicht nur vom Wirkstoff, sondern auch von der Darreichungsform ab, weil für jedes Fertigarzneimittel eine individuelle Zulassung und eine entsprechende Fachinformation bestehen.
Eine Off-Label-Anwendung ist in der Regel als Heilversuch legitimiert und erfordert hohe Anforderungen an Aufklärung der Sorgeberechtigten mit Darstellung des Nutzen-Risiko-Verhältnisses. Für den Notfall zur Behandlung akuter Schmerzen, der eine besondere Ausnahmebedingung darstellt, ist der Einsatz von Fentanyl, appliziert per Nasenspray als individuelle Therapieentscheidung in der Nothilfe sicherlich gerechtfertigt, muss aber den Sorgeberechtigten erklärt werden, damit sie verstehen, dass diese therapeutische Maßnahme ihrem Kind die akuten Schmerzen lindert und die in der Notfallsituation schwierige Anlage einer intravenösen Injektionsnadel erspart. Der Einsatz von Darreichungsformen für Erwachsenen mit Durchbruchsschmerzen bei Tumortherapie wie Buccaltabletten, Lutschatabletten und Sublingualtabletten sind in der Notfallsituation für Kinder keine Alternative. Die transnasal applizierbaren Darreichungsformen wie Instanyl® Nasenspray oder PecFent® Nasenspray sind sehr teuer und finden vermutlich deswegen bei Kindernotfällen keine Anwendung. Aufgrund der Angaben in der Fachinformation (Anwendungsgebiete, Gegenanzeigen) erscheint eine rechtliche Legitimation dieser für die Durchbruchsschmerzen bei Tumortherapie Erwachsener zugelassenen Präparaten zur Behandlung akuter Schmerzen sehr zweifelhaft und für Kinder fast ausgeschlossen.
Kinderformularium.DE
Eine Off-Label-Anwendung ist sehr vielschichtig (hinsichtlich Indikation des Wirkstoffes, der Dosierung, Behandlungsdauer, Patientengruppe, des Alters des Patienten, und der vorgeschriebenen Vor- oder Begleittherapie) und bei Kindern und Jugendlichen oft anders gelagert als bei Erwachsenen. Deswegen wurde u. a. ein spezielles Arzneimitteinformationssystem für Kinder und Jugendliche entwickelt (www.kinderformularium.de), in dem neben den für Kinder zugelassenen Dosierungen der Wirkstoffe auch evidenzbasierte Dosisangaben für eine sinnvolle Off-Label-Anwendung bei Kindern zu finden sind. Die Evidenz ist hinterlegt, damit pädiatrische Patienten dem Stand der Wissenschaft entsprechend sicher und wirksam behandelt werden können.
Zulassung von Arzneimitteln für Kinder
Vor der Zulassung eines Humanarzneimittels muss dessen Sicherheit und Qualität durch umfassende Studien nachgewiesen werden. Derartige Studien wurden früher für das Kindesalter nicht oder nur für wenige Arzneimittel durchgeführt. Das Europäische Parlament und der Rat der Europäischen Union haben daher im Jahr 2006 die Verordnung 1901/2006 über Kinderarzneimittel beschlossen und damit begründet, dass bei Kindern inadäquate Dosierungsempfehlungen das Risiko von Nebenwirkungen, einschließlich solcher mit tödlichem Ausgang, erhöhen oder die Behandlung wegen zu niedriger Dosierung unwirksam sei (28). Seit Juli 2008 muss in der EU für jedes neu zuzulassende Arzneimittel mit dem Zulassungsantrag ein pädiatrisches Prüfkonzept (Paediatric Investigation Plan, PIP) vorgelegt werden, in dem das geplante Entwicklungsprogramm für eine Anwendung an Kindern bzw. Jugendlichen beschrieben wird. Von dieser Verpflichtung gibt es nur wenige Ausnahmen, wie Generika, Biosimilars, Arzneimittel mit mindestens zehnjähriger allgemeiner medizinischer Verwendung in der EU sowie Homöopathika und traditionelle pflanzliche Arzneimittel. Das vom Antragsteller eingereichte Prüfkonzept wird von einem bei der europäischen Arzneimittelagentur eigens eingerichteten wissenschaftlichen Ausschuss, dem Pädiatrieausschuss (Paediatric Committee, PDCO) beurteilt. In bestimmten Fällen kann allerdings eine Zurückstellung oder eine Freistellung von der Pflicht zur Vorlage eines PIP erwirkt werden, z. B. wenn die Erkrankung bei Kindern nicht vorkommt. Für zugelassene, aber noch patentgeschützte Stoffe sind die Kinderdaten nötig, wenn eine Zulassungsänderung beantragt wird. Eine jeweils sechsmonatige Verlängerung des Patentschutzes soll die Forschungsanstrengungen belohnen.
Komplizierter ist es bei nicht mehr patentgeschützten, „alten“ Arzneistoffen. Entwickelt ein pharmazeutischer Unternehmer damit ein spezielles Kinderarzneimittel und beantragt eine Genehmigung für die pädiatrische Verwendung (Paediatric use marketing authorisation (PUMA)), gewährt die Zulassungsbehörde einen zehnjährigen Unterlagenschutz (achtjähriger Unterlagenschutz für die an Kindern erhobenen Daten plus zweijährige Marktexklusivität), der die Marktexklusivität des kindgerechten Präparats sichern soll. Diese Genehmigung kann für alle pädiatrischen Indikationen in allen oder bestimmten Altersgruppen und für die Entwicklung kindgerechter Darreichungsformen erteilt werden. Die Entwicklung für die Anwendung bei Kindern muss dem durch den PDCO gebilligten PIP folgen. Die Entscheidungen der EMA bezüglich des PIP werden transparent auf der EMA-Homepage dargestellt.
Seit 2008 wurden in der EU allerdings gerade mal sechs Arzneimittel mit PUMA zugelassen: Buccolam® (Midazolam), Hemangiol® (Propranololhydrochlorid), Sialanar® (Glycopyrroniumbromid), Alkindi® (Hydrocortison), Slenyto® (Melatonin) und Kigabeq® (Vigabatrin).
Erklärung einiger Begriffe
Off-label-Gebrauch von Arzneimitteln
Unter Off-Label-Use wird der zulassungsüberschreitende Einsatz eines Arzneimittels außerhalb der von den nationalen oder europäischen Zulassungsbehörden genehmigten Anwendungsgebiete (Indikationen, Patientengruppen, Applikationsweg, Darreichungsformen, Behandlungsdauer und der vorgeschriebenen Vor- oder Begleittherapie) verstanden. Grundsätzlich ist Ärzten eine zulassungsüberschreitende Anwendung von Arzneimitteln erlaubt. Eine Leistung der gesetzlichen Krankenversicherung (GKV) ist ein Off-Label-Use jedoch nur in Ausnahmefällen. Denn grundsätzlich kann ein Arzneimittel in Deutschland nur dann zulasten der GKV verordnet werden, wenn es zur Behandlung von Erkrankungen eingesetzt wird, für die ein pharmazeutischer Unternehmer die arzneimittelrechtliche Zulassung bei der zuständigen Behörde erwirkt hat. Weitere Informationen: https://www.g-ba.de/themen/arzneimittel/arzneimittel-richtlinie-anlagen/Off-Label-use/.
Wenn unter bestimmungsgemäßem Gebrauch eines Arzneimittels tödliche oder gesundheitlich erhebliche Schäden entstanden sind, haftet hierfür nach § 84 Abs. 1 Arzneimittelgesetz (AMG) der pharmazeutische Unternehmer. Dies gilt insbesondere auch für bis dato nicht bekannte unerwünschte Ereignisse. Diese Herstellerhaftung entfällt bei Off-Label-Einsatz, sodass der verordnende Arzt in vollem Umfang für eventuelle Schäden haftet. Die ohnehin bestehende Aufklärungspflicht des Arztes über mögliche Nebenwirkungen und Risiken ist somit erweitert.
Unlicensed use von Arzneimitteln
Die Anwendung eines zulassungspflichtigen, jedoch nicht zugelassenen Arzneimittels.
Fachinformation
Zusammenfassung der im Rahmen der Zulassung genehmigten Merkmale eines Arzneimittels (AMG § 11a).
Gebrauchsinformation (Packungsbeilage)
Allgemein verständliche Zusammenfassung der Angaben der Fachinformation für den Patienten (AMG §11).
Fazit für die Praxis
Für Kinder und Jugendliche benötigte Arzneimittel sind nur teilweise für diese Altersgruppen zugelassen. Somit gibt es für diese Patientengruppe noch immer zu wenige Arzneimittel, deren Sicherheit und Wirksamkeit in klinischen Studien evaluiert wurden. Die europäische Kinderarzneimittelverordnung zeigt zwar bei neu entwickelten Arzneimitteln erste Fortschritte, doch bei der Nachzulassung bekannter Wirkstoffe muss die Maßnahme derzeit als gescheitert eingestuft werden. Um pädiatrische Patienten entsprechend dem aktuellen Stand der medizinischen Wissenschaft zu behandeln, werden weiterhin Arzneimittel im Rahmen eines Off-Label-Use eingesetzt werden müssen. Für Fentanyl zeigt sich dabei eine belastbare Evidenzbasis, die die Sicherheit bestätigt. Da Fentanyl-haltige Arzneimittel für bestimmte Altersgruppen bzw. Indikationen keine Zulassung besitzen, sind gegebenenfalls spezielle Aufklärungs- und Dokumentationspflichten zu beachten.
Literatur
- Arzneimittelkommission der deutschen Ärzteschaft: „Aus der UAW-Datenbank“: Intraossäre Gabe von Lidocain zur Schmerztherapie bei pädiatrischen Patienten – eine nicht sachgerechte, potenziell gefährliche Off-Label-Empfehlung. Dtsch Arztebl 2022; 119: A 2157-2158.
- Aktuelle Fachinformationen Fentanyl-haltiger Fertigarzneimittel. Zugriff über: www.fachinfo.de, mit DocCheck-Kennung. Letzter Zugriff: 1. Februar 2023.
- Hünseler C, Roth B: Analgosedierung in der pädiatrischen Intensivmedizin. Intensiv up2date 2009; 5: 229-247.
- Koehntop DE, Rodman JH, Brundage DM et al.: Pharmacokinetics of fentanyl in neonates. Anesth Analg. 1986; 65: 227-232.
- Santeiro ML, Christie J, Stromquist C et al.: Pharmacokinetics of continuous infusion fentanyl in newborns. J Perinatol 1997; 17: 135-139.
- Deutsche Gesellschaft für Kinder- und Jugendmedizin e. V.: Medikamentensicherheit bei Kindernotfällen: https://www.awmf.org/uploads/tx_szleitlinien/027-071l_S2k_Medikamentensicherheit-bei.Kindernotfällen_2021-03.pdf (letzter Zugriff: 1. Februar 2023). AWMF-Register-Nr.: 027-071; Stand: März 2021.
- Anderson T, Harrell C, Snider M, Kink R: The safety of high-dose intranasal fentanyl in the pediatric emergency department. Pediatr Emerg Care 2022; 38: e447-e450.
- Chang JG, Regen RB, Peravali R et al.: intranasal fentanyl and midazolam use in children 3 years of age and younger in the emergency department. J Emerg Med 2021; 61: 731-739.
- Mudd S: Intranasal fentanyl for pain management in children: a systematic review of the literature. J Pediatr Health Care 2011; 25: 316-322.
- Herd D, Borland M: Intranasal fentanyl paediatric clinical practice guidelines. Emerg Med Australas 2009; 21: 335.
- Hansen MS, Dahl JB: Limited evidence for intranasal fentanyl in the emergency department and the prehospital setting – a systematic review. Dan Med J 2013; 60: A4563.
- Gliwitzky B, Olivieri M, Bathe J et al.: Intranasale Analgesie bei Säuglingen und Kleinkindern. Notfall Rettungsmed 2022; 25, 53-57.
- Hofman F, Heinzel O, ÄLRD Bayern: Pädiatrische Notfallkarte: https://www.aelrd-bayern.de/images/stories/pdf/rda/6.2_Empfehlung_Pädiatrische_Dosierungshilfe.pdf (letzter Zugriff: 1. Februar 2023). Version 07, 2017.
- Williams JM, Schuman S, Regen R et al.: Intranasal fentanyl and midazolam for procedural analgesia and anxiolysis in pediatric urgent care centers. Pediatric Pediatr Emerg Care 2020; 36: e494-e499.
- Hansen MS, Mathiesen O, Trautner S, Dahl JB: Intranasal fentanyl in the treatment of acute pain-a systematic review. Acta Anaesthesiol Scand 2012; 56: 407-419.
- Reynolds SL, Bryant KK, Studnek JR et al.: Randomized controlled feasibility trial of intranasal ketamine compared to intranasal fentanyl for analgesia in children with suspected extremity fractures. Acad Emerg Med 2017; 24: 1430-1440.
- Wiffen PJ, Cooper TE, Anderson AK et al.: Opioids for cancer-related pain in children and adolescents. Cochrane Database Syst Rev. 2017; 7: CD012564.
- Harlos MS, Stenekes S, Lambert D et al.: Intranasal fentanyl in the palliative care of newborns and infants. Journal of pain and symptom management 2013; 46: 265-274.
- Pieper L, Wager J, Zernikow B: Intranasal fentanyl for respiratory distress in children and adolescents with life-limiting conditions. BMC Palliat Care 2018; 17: 106.
- Janssen-Cilag GmbH: Fachinformation Durogesic SMAT® 12 μg/h, 25 μg/h, 50 μg/h, 75 μg/h, 100 μg/h, transdermales Pflaster. Stand: März 2022.
- Teva B.V.: Fachinformation Effentora® Buccaltabletten. Stand: September 2022.
- Kyowa Kirin Holdings B.V.: Fachinformation Abstral® 100 μg/200 μg/300 μg/400 μg/600 μg/800 μg Sublingualtabletten. Stand: September 2022.
- Takeda Pharma A/S: Fachinformation Instanyl® 50, 100, 200 Mikrogramm/Dosis. Stand: Mai 2021.
- Kyowa Kirin Holdings B.V.: Fachinformation PecFent® 100 / 400 Mikrogramm/Sprühstoß Nasenspray, Lösung. Stand: April 2022.
- Teva GmbH: Fachinformation Actiq® 200/400/600/800/1200/1600 Mikrogramm Lutschtablette. Stand: März 2022.
- Rascher W, Wimmer S, Neubert A, Kommission für Arzneimittelsicherheit im Kindesalter (KASK): „Off-Label-“-Anwendung in der Klinik – Welche Folgen hat ein Urteil des Bundessozialgerichts für die Pädiatrie? Monatsschr Kinderheilkd 2020; 168:628-633.
- Neelmeier EM: Vorsicht beim Off-Label-Use. Dtsch Arztebl 2018; 115 (43): [2].
- Verordnung (EG) Nr. 1901/2006 des Europäischen Parlaments und des Rates vom 12. Dezember 2006 über Kinderarzneimittel: https://eur-lex.europa.eu/legal-content/DE/TXT/PDF/?uri=CELEX:32006R1901&from=DE. Letzter Zugriff: 1. Februar 2023.
Interessenkonflikte
Die Autoren geben an, keine Interessenkonflikte zu haben.
