Standardzulassungen von ASS: Risiko für Fehldosierungen
Das aktuelle Thema
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) bittet aktuell darum, dass Arzneimittel mit 100 mg Acetylsalicylsäure (ASS), die sich auf Basis einer Standardzulassung im Verkehr befinden, nicht für die Thromboseprophylaxe verordnet werden – und auch nicht durch Apotheken abgegeben werden (1).
Standardzulassungen
Bestimmte Fertigarzneimittel können, sofern keine Gefährdung von Mensch und Tier zu befürchten ist, auf Grund von Standardzulassungen von der Zulassungspflicht freigestellt werden (§ 36 AMG). Standardzulassungen basieren auf Monografien, die das Bundesministerium für Gesundheit in Kraft setzt.
Vereinfacht bedeutet dies, dass diese Fertigarzneimittel nach einer allgemein gültigen Herstellungsanweisung produziert werden, die in der Monografie festgelegt wurde, und deswegen eine reguläre Zulassung nach AMG nicht erforderlich ist. In der Monografie sind zudem die genauen Wortlaute der Fach- und Gebrauchsinformation enthalten.
Die Nutzung einer Standardzulassung ist beim BfArM gemäß § 67 Abs. 5 AMG anzuzeigen, genauso wie Änderungen oder der Verzicht auf die Nutzung einer Standardzulassung. Standardzulassungen können von pharmazeutischen Unternehmern aber auch von öffentlichen und Krankenhausapotheken genutzt werden, um Arzneimittel herzustellen und in den Verkehr zu bringen.
Das Spektrum der aktuell gültigen Standardzulassungen ist sehr heterogen. Dazu gehören diverse Arzneiformen wie Salben, Lösungen und Tabletten aber auch pflanzliche Arzneitees. Beispiele dafür sind unter anderem Paracetamol-Zäpfchen und Tabletten, Zinksalbe, Ringerlösung, Codein-Tabletten, Ambroxol-Lösung und Atropin-Augentropfen (2).
Eine aktuelle Liste der gültigen Monografien für Standardzulassungen ist bei BfArM verfügbar (2).
Acetylsalicylsäure
Acetylsalicylsäure (ASS) zählt zu den nichtsteroidalen Analgetika/Antiphlogistika. ASS hemmt die Cyclooxygenasen und damit die Synthese von Prostaglandinen, Thromboxan A2 und Prostacyclin. Dadurch wirkt sie analgetisch, antipyretisch, antiphlogistisch und thrombozytenaggregationshemmemd.
ASS ist zugelassen zur Behandlung von Schmerzen und Fieber in folgender Dosierung:
- Erwachsene: 500–1000 mg ASS als Einzeldosis; 1500–3000 mg ASS als Tagesgesamtdosis.
- Kinder 6 bis 14 Jahre: 250–500 mg ASS als Einzeldosis; 750–1500 mg ASS als Tagesgesamtdosis.
- Jugendliche: 500–1000 mg ASS als Einzeldosis; 1500–3000 mg ASS als Tagesgesamtdosis.
In einer Dosierung von 100 mg pro Tag ist ASS zugelassen:
- zur Sekundärprävention von Myokardinfarkt;
- zur Vorbeugung kardiovaskulärer Morbidität bei Patienten mit stabiler Angina pectoris;
- zur Vorbeugung einer Transplantatokklusion nach Koronararterien-Bypass-Chirurgie;
- bei instabiler Angina pectoris in der Anamnese, ausgenommen während der Akutphase;
- nach Koronarangioplastie, ausgenommen während der Akutphase;
- zur Sekundärprävention transitorischer ischämischer Attacken (TIA) und ischämischer zerebrovaskulärer Insulte (CVA).
Die Standardzulassungen mit ASS in der Stärke 100 mg weisen allerdings als alleinige Indikation „Schmerzen und Fieber“ auf, im Gegensatz zu den regulär zugelassenen ASS-Präparaten in dieser Stärke, die ausschließlich zur Thromboseprophylaxe eingesetzt werden.
Werden entsprechende ASS-Standardzulassungen zur Thromboseprophylaxe eingesetzt, stehen den betroffenen Patienten jedoch keine adäquaten, d. h. auf die Thromboseprophylaxe bezogenen Dosierungshinweise in der Gebrauchsinformation zur Verfügung. Das birgt neben der möglichen Irritation der Anwendenden die Gefahr der potenziellen Fehldosierung (Überdosierung) durch die Patienten, da der Text der Gebrauchsinformationen nur die übliche Dosierung als Analgetikum für Kinder ausweist (ab 50 mg bis 600 mg täglich).
Das BfArM bittet daher darum, dass bei der ärztlichen Verordnung keine Arzneimittel, die sich auf der Grundlage einer Standardzulassung in Verkehr befinden, für die Thromboseprophylaxe verordnet und/oder durch Apotheken abgegeben werden.
Standardzulassung erkennen
Die Standardzulassungen für ASS verfügen alle über die gemeinsame Zulassungsnummer 1899.98.99. Diese Information findet man in der Fachinformation unter Punkt 8 Zulassungsnummer. Zudem ist unter Punkt 9 Datum der Erteilung der Zulassung/Verlängerung der Zulassung die Angabe: Standardzulassung. Die Gebrauchsinformation beinhaltet leider keine Information, die das Arzneimittel als Standardzulassung kennzeichnet.
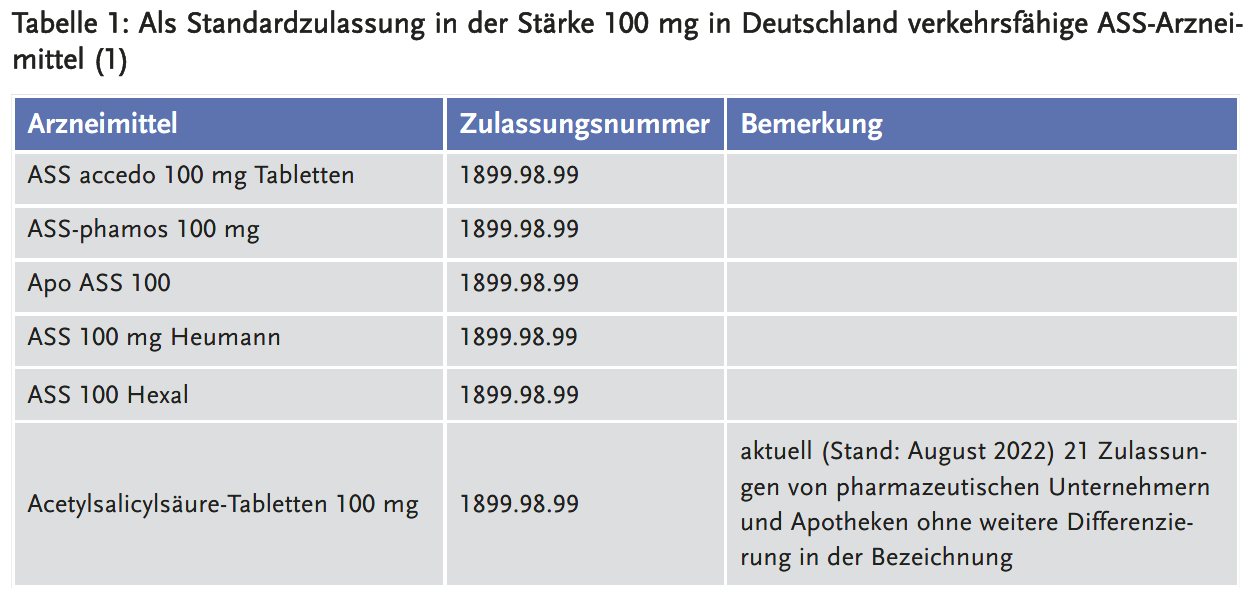
Zudem hat das BfArM eine aktuelle Liste der ASS-Arzneimittel veröffentlicht, die als Standardzulassung in der Stärke 100 mg in Deutschland verkehrsfähig sind (Tabelle 1) (1).
Verordnung von ASS
ASS-Tabletten (bis 300 mg/Dosiseinheit) als Thrombozytenaggregationshemmer sind für Erwachsene gemäß Arzneimittel-Richtlinie bei koronarer Herzkrankheit (gesichert durch Symptomatik und ergänzende nicht-invasive oder invasive Diagnostik) und in der Nachsorge von Herzinfarkt und Schlaganfall sowie nach arteriellen Eingriffen zu Lasten der gesetzlichen Krankenversicherung verordnungsfähig (3). Sie können daher regulär auf Muster 16 verordnet werden. Dabei sollte sichergestellt werden, dass keine Standardzulassungen zur Thromboseprophylaxe verordnet werden.
Literatur
- Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM): ASS 100 mg Standardzulassungen: Risiko für Fehldosierungen: https://www.bfarm.de/SharedDocs/Risikoinformationen/Pharmakovigilanz/DE/RI/2022/RI-acetylsalicylsaeure.html (letzter Zugriff: 14. Dezember 2022). Stand 4. Oktober 2022.
- Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM): Liste der aktuell gültigen Monografien für Standardzulassungen – Humanarzneimittel: https://www.bfarm.de/SharedDocs/Downloads/DE/Arzneimittel/Zulassung/ZulRelThemen/stdZul_und_Reg/aktuell_gueltige_liste_standardzulassungen_stand_030220 (letzter Zugriff: 14. Dezember 2022). Stand 3. Februar 2020.
- Gemeinsamer Bundesausschuss (G-BA): Arzneimittel-Richtlinie, Anlage I zum Abschnitt F Gesetzliche Verordnungsausschlüsse in Arzneimittelversorgung und zugelassene Ausnahmen: Zugelassene Ausnahmen zum gesetzlichen Verordnungsausschluss nach § 34 Abs. 1 Satz 2 SGB V (OTC-Übersicht). Verfügbar unter: https://www.g-ba.de/downloads/83-691-725/AM-RL-I-OTC-2022-05-04.pdf (letzter Zugriff: 14. Dezember 2022). 4. Mai 2022.
Interessenkonflikte
Die Autorin gibt an, keine Interessenkonflikte zu haben.
