Frühe Nutzenbewertung von Arzneimitteln: Beteiligung der AkdÄ
Hintergrund
Mit dem Gesetz zur Neuordnung des Arzneimittelmarktes (AMNOG) nach § 35a SGB V erhielt der Gemeinsame Bundesausschuss (G-BA) den Auftrag, den Zusatznutzen von Arzneimitteln mit neuen Wirkstoffen im Vergleich zum Therapiestandard zu bewerten. Diese sogenannte „frühe“ Nutzenbewertung verpflichtet den pharmazeutischen Unternehmer (pU) seit dem 1. Januar 2011, unmittelbar nach Markteintritt eines erstattungsfähigen Arzneimittels mit neuem Wirkstoff den Zusatznutzen gegenüber einer zweckmäßigen Vergleichstherapie nachzuweisen (1). Dies gilt auch für neu zugelassene Anwendungsgebiete dieser Arzneimittel.
Bevor der G-BA einen Beschluss fasst, auf dessen Grundlage die Preisverhandlungen zwischen pU und dem Spitzenverband Bund der Krankenkassen (GKV-SV) stattfinden, wird ein Stellungnahmeverfahren (schriftlich und mündlich) durchgeführt. Damit wird der Preis neu zugelassener, patentgeschützter Arzneimittel nur noch im ersten Jahr vom pU frei festgesetzt. Danach gilt ein zwischen pU und GKV-SV vereinbarter Erstattungsbetrag, der sich nach dem Ausmaß des Zusatznutzens des neuen Arzneimittels richtet. Ziel des Gesetzes ist eine zweckmäßige, qualitativ hochwertige und wirtschaftliche Arzneimittelversorgung in Deutschland sicherzustellen.
Über den Ablauf des Verfahrens der frühen Nutzenbewertung wurde in AVP 1/2016 berichtet: https://www.akdae.de/Arzneimitteltherapie/AVP/Artikel/201601/043h/. Die unterschiedlichen Kategorien bezüglich des Ausmaßes des Zusatznutzens eines Arzneimittels nach Nutzenbewertungsverordnung sind in Tabelle 1 dargestellt.

Stellungnahmen der AkdÄ
Die AkdÄ wurde als Sachverständige der medizinischen Wissenschaft und Praxis vom G-BA als stellungnahmeberechtigte Organisation bestimmt (§ 92 Abs. 3a SGB V). Die AkdÄ-Stellungnahmen zu Verfahren der frühen Nutzenbewertung werden auf der Homepage der AkdÄ veröffentlicht (https://www.akdae.de/Stellungnahmen/AMNOG/") und am Tag der mündlichen Anhörung beim G-BA über den AkdÄ-Newsletter „AkdÄ News“ an die Abonnenten versendet. Zu ausgewählten versorgungsrelevanten Wirkstoffen findet sich nach Beschlussfassung durch den G-BA eine Zusammenfassung in AVP in der Rubrik „Update - Neue Arzneimittel“: https://www.akdae.de/Arzneimitteltherapie/NA/.
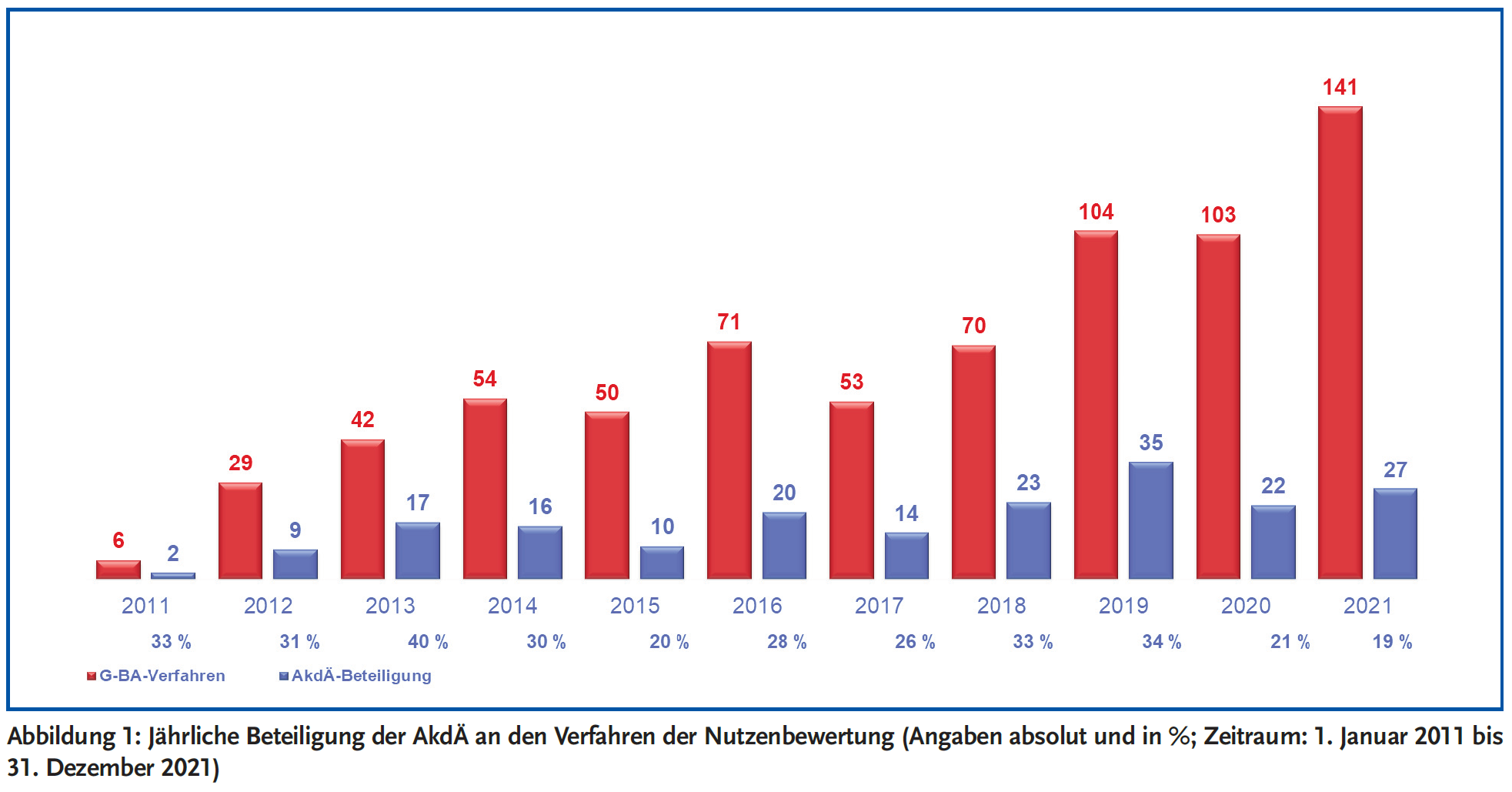
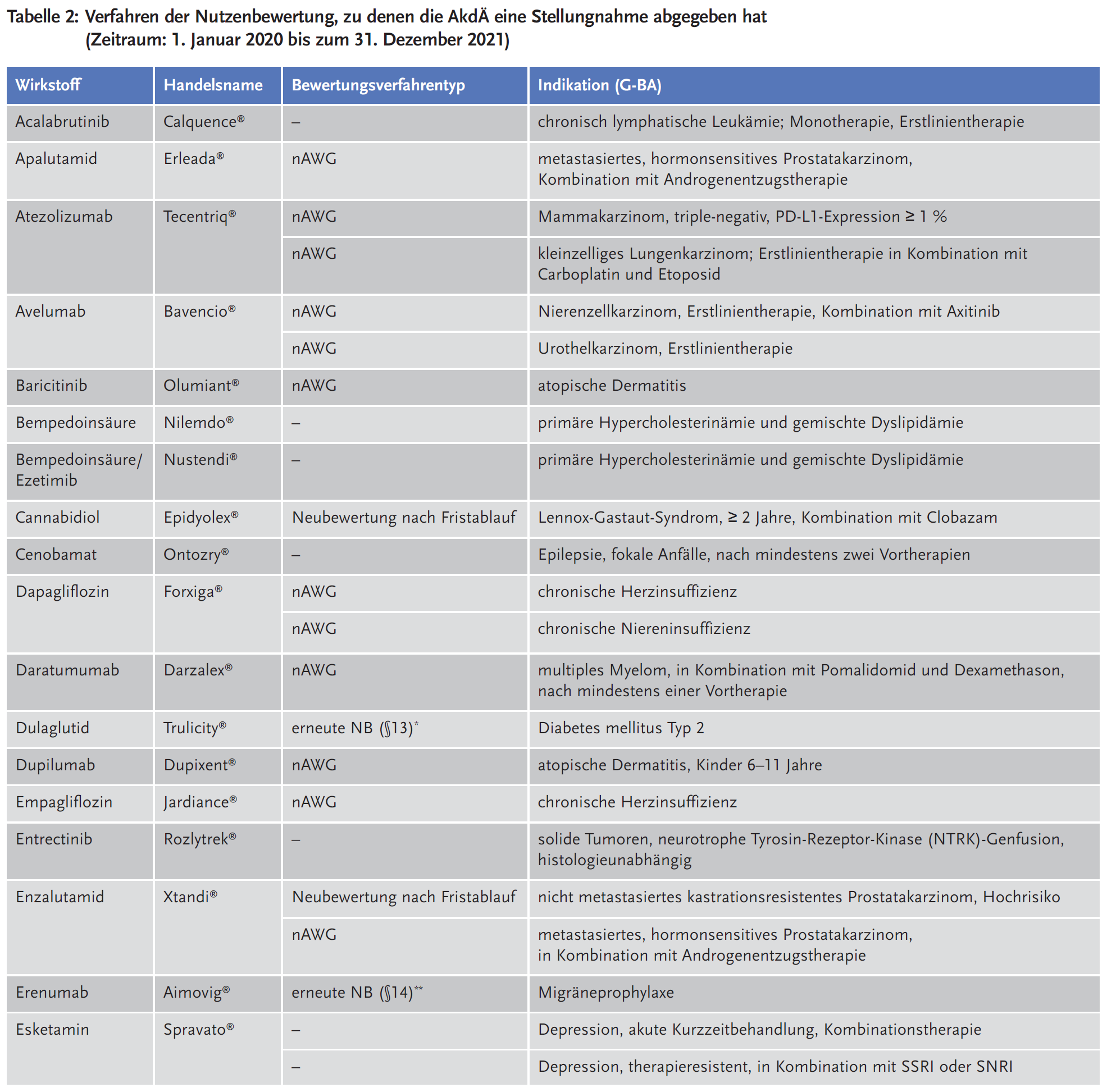
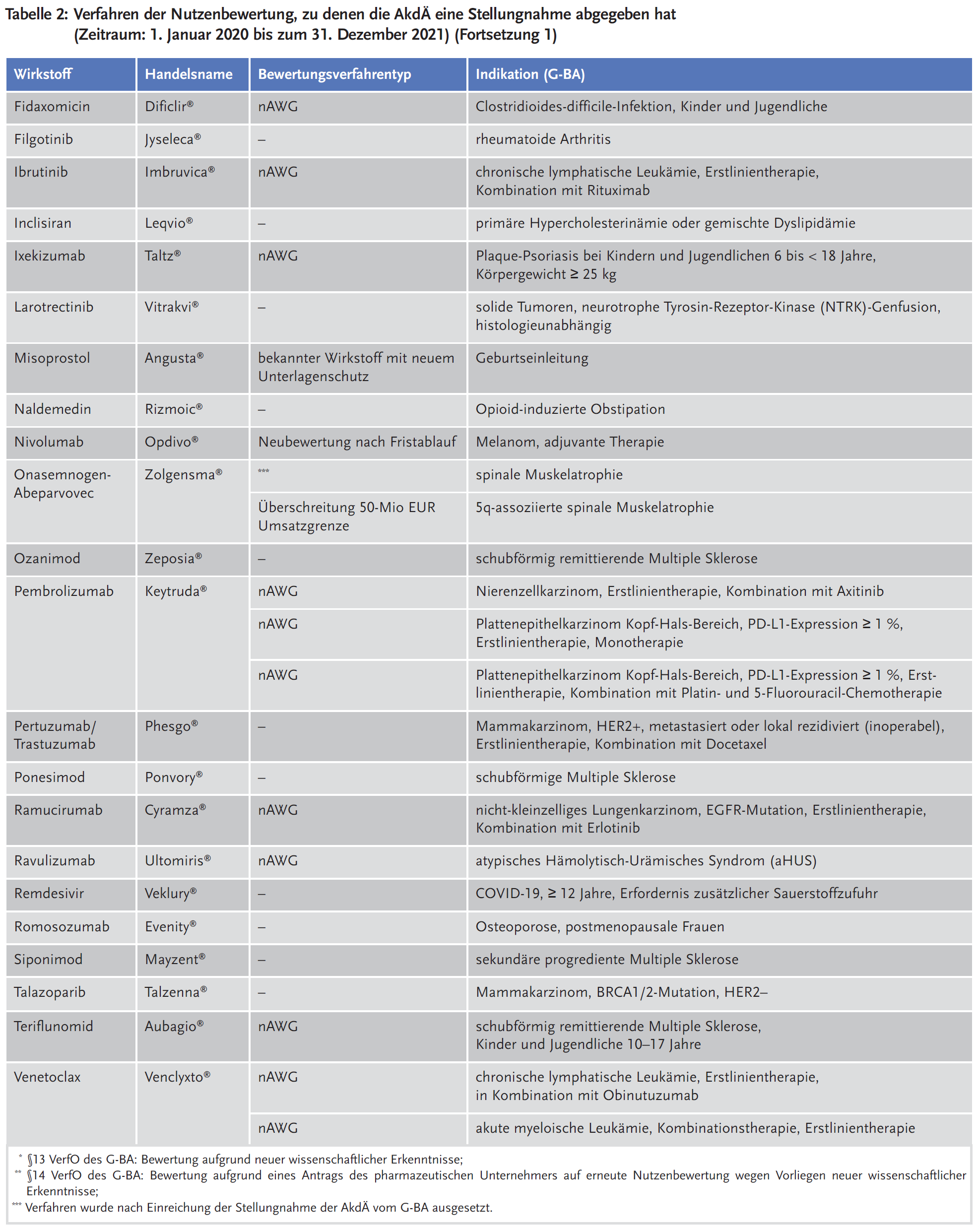
Die AkdÄ hat sich im Zeitraum vom 1. Januar 2011 bis zum 31. Dezember 2021* an insgesamt 195 Verfahren beteiligt. In Tabelle 2 ist die Beteiligung der AkdÄ in den Jahren 2020 und 2021 dargestellt. Weitere Informationen zur Beteiligung im Zeitraum 2011–2019 sind verfügbar unter: https://www.akdae.de/Arzneimitteltherapie/AVP/Artikel/2020-3-4/171.pdf.
2021 hat die AkdÄ 27 Stellungnahmen eingereicht, 2020 waren es 22 Stellungnahmen. Legt man die Gesamtzahl der Verfahren beim G-BA von 723 zugrunde, liegt die durchschnittliche jährliche Beteiligung der AkdÄ bisher bei 27 % (siehe Abbildung 1).
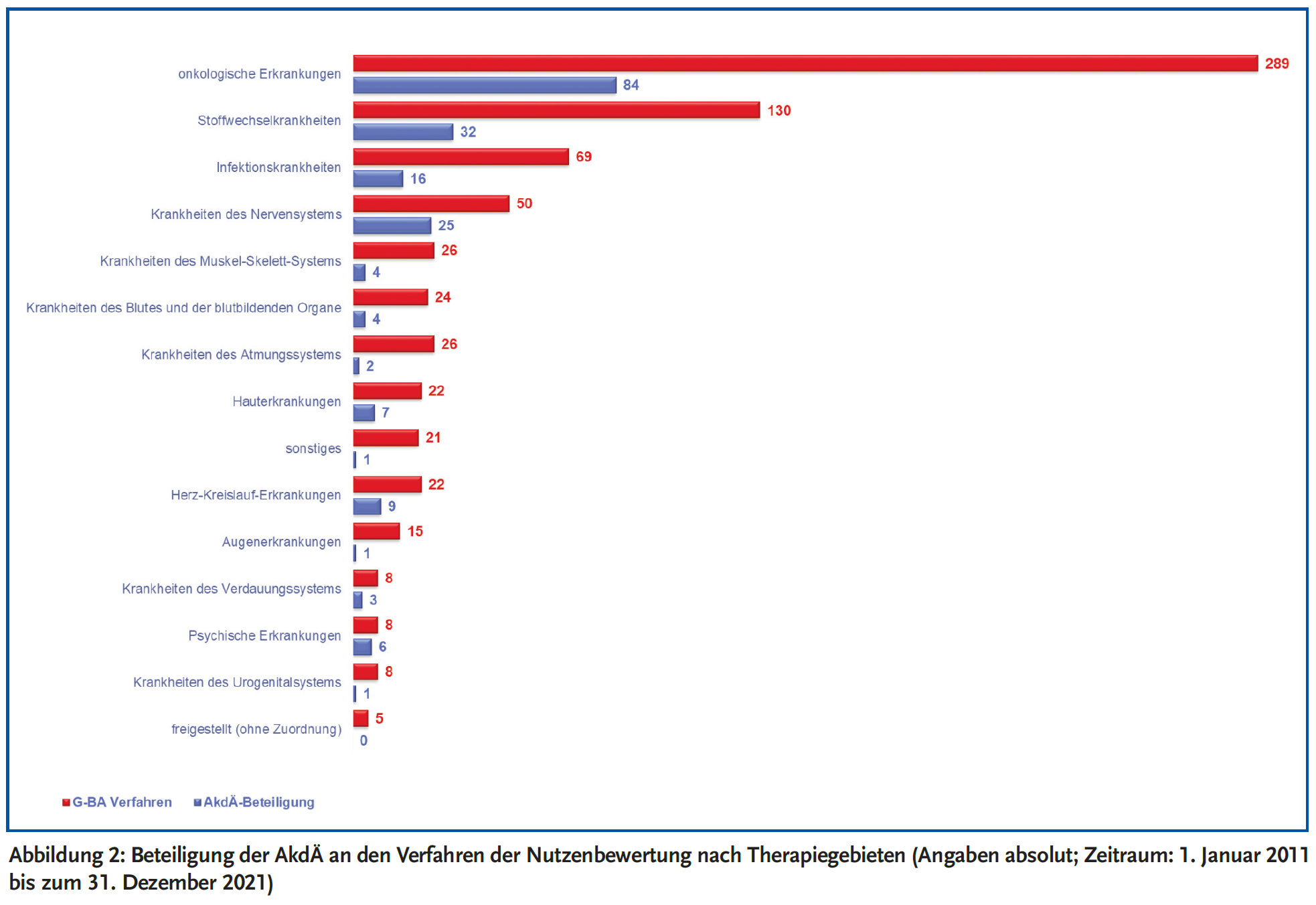
Bei Betrachtung der Arzneimittel mit neuen Wirkstoffen, zu denen der G-BA ein Stellungnahmeverfahren bis dato eröffnet hat, steht das Therapiegebiet der onkologischen Erkrankungen mit 40 % an erster Stelle. Die Beteiligungsraten der AkdÄ an den Stellungnahmeverfahren nach Therapiegebieten sind in Abbildung 2 dargestellt.
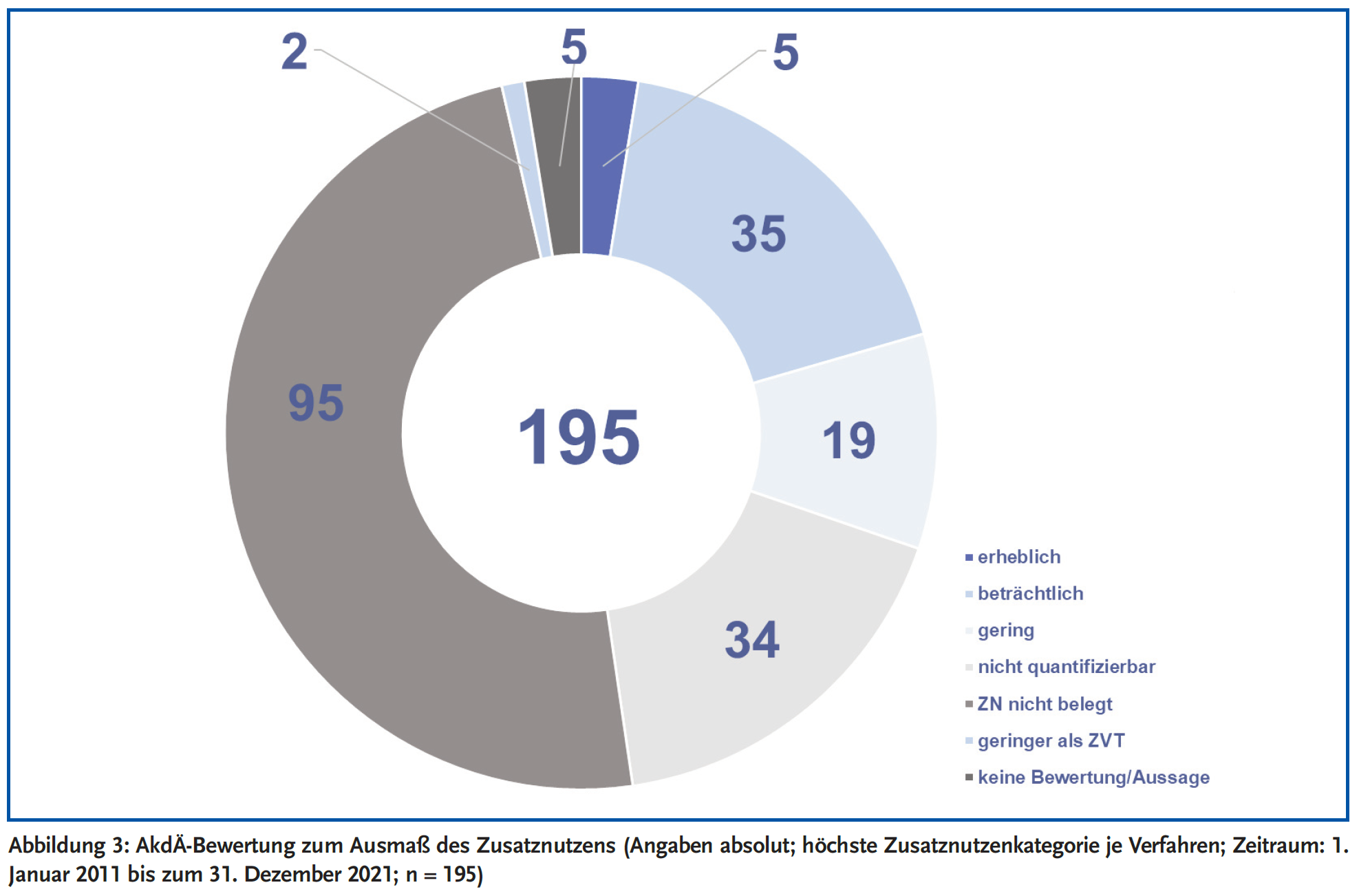
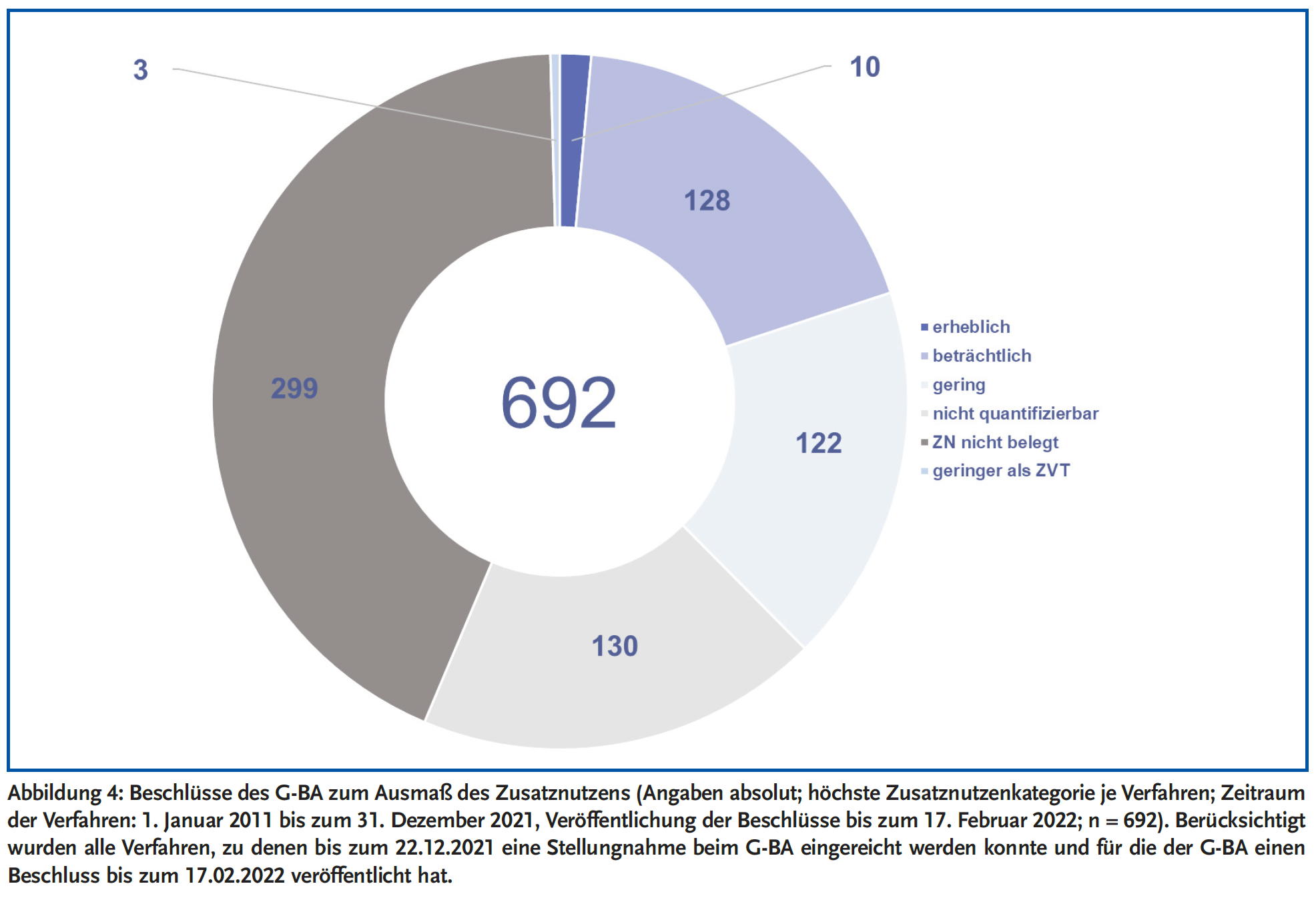
Empfehlungen der AkdÄ für die Bewertung des Zusatznutzens sind Bestandteil der AkdÄ-Stellungnahmeverfahren und werden in einem Fazit festgehalten. Dabei resümierte die AkdÄ bei 49 % der 195 eingereichten Stellungnahmen den Zusatznutzen als nicht belegt (siehe Abbildung 3), wohingegen der G-BA diese Kategorie bei 43 % der 692 gefassten Entscheidungen beschloss (siehe Abbildung 4). In ihrem Fazit hat die AkdÄ bei 17 % ihrer Stellungnahmen einen nicht quantifizierbaren Zusatznutzen empfohlen, der G-BA beschloss bei 19 % der Verfahren einen nicht quantifizierbaren Zusatznutzen (siehe Abbildungen 3 und 4).
Das Verfahren der frühen Nutzenbewertung hat in den 11 Jahren seit seiner Einführung eine deutlich bessere Transparenz hinsichtlich der Ergebnisse von klinischen Studien implementiert, auf deren Basis neue Arzneimittel zugelassen wurden, und damit einen enormen Informationsgewinn bedingt, von dem alle im deutschen solidarisch finanzierten Gesundheitswesen profitieren: Patienten, Ärzte, Krankenversicherung (2).
Seit dem 1. Oktober 2020 erhalten Vertragsärzte einen Hinweis in ihrer Verordnungssoftware, wenn für ein Arzneimittel ein Beschluss zur frühen Nutzenbewertung vorliegt. Unter anderem sind dabei Angaben über das Anwendungsgebiet, Aussagesicherheit und Ausmaß des Zusatznutzens und Ergebnisse der klinisch relevanten Endpunkte (Mortalität, Morbidität, Lebensqualität und unerwünschte Ereignisse) verfügbar. Ein Hyperlink ermöglicht den direkten Zugriff auf den Beschluss auf der Internetseite des G-BA. Zudem sind Recherchen möglich, für welche Arzneimittel ein Beschluss zur frühen Nutzenbewertung vorliegt (3).
Beratungen zur zweckmäßigen Vergleichstherapie
Mit dem Gesetz für mehr Sicherheit in der Arzneimittelversorgung (GSAV) wurde u. a. eine Beratung der pU durch den G-BA zur Planung klinischer Prüfungen vor Beginn von Zulassungsstudien der Phase III eingeführt. Diese erfolgt unter Beteiligung des Bundesinstituts für Arzneimittel und Medizinprodukte oder des Paul-Ehrlich-Instituts. Zu Fragen der Vergleichstherapie sollen unter Beachtung der Betriebs- und Geschäftsgeheimnisse des pU die wissenschaftlich-medizinischen Fachgesellschaften und die Arzneimittelkommission der deutschen Ärzteschaft schriftlich beteiligt werden (4).
Die AkdÄ wird daher seit 2020 vom G-BA zu Fragen der Vergleichstherapie befragt. Dabei geht es um den medizinischen Stand der jeweiligen Behandlung in einer entsprechenden Indikation bzw. um den Versorgungsstandard oder bestimmte Subpopulationen, die in der Versorgung berücksichtigt werden müssen.
Fußnote
*Der zeitliche Rahmen eines Verfahrens der Nutzenbewertung von Arzneimitteln gemäß § 35a SGB V wurde gesetzlich auf sechs Monate pro Arzneimittel festgesetzt. Die Beteiligung der AkdÄ beginnt mit der Veröffentlichung der Bewertung und der Einleitung des schriftlichen Stellungnahmeverfahren und dauert drei Wochen, nach denen eine Stellungnahme eingereicht wird. In den darauffolgenden neun Wochen findet die mündliche Anhörung beim G-BA, an der die AkdÄ teilnimmt, statt und es erfolgt die Gesamtabwägung auf Grundlage der Dossierbewertung und der Stellungnahmen beim G-BA. Erst danach wird ein Beschluss des G-BA veröffentlicht. Zwischenzeitlich sind aber mehrere weitere Verfahren angelaufen, immer zum 1. und 15. eines Monats. In diesem Beitrag sind alle Verfahren berücksichtigt worden, für die die AkdÄ bis zum 22.12.2021 eine Stellungnahme eingereicht hat und zu denen der G-BA bis zum 17.02.2022 einen Beschluss veröffentlicht hat.
Literatur
- Verordnung über die Nutzenbewertung von Arzneimitteln nach § 35a Absatz 1 SGB V für Erstattungsvereinbarungen nach § 130b SGB V: www.gesetze-im-internet.de/am-nutzenv/. Letzter Zugriff: 12. Mai 2022.
- Zieschang M, Rosien U: Arzneimittelinnovationen: Nutzen, Schaden, Profit – Bericht über die Jubiläumsveranstaltung aus Anlass des 50. Jahrgangs DER ARZNEIMITTELBRIEF. Arzneiverordnung in der Praxis (AVP) 2017; 44: 45-49.
- www.kbv.de/html/praxisinformationen.php. Letzter Zugriff: 12. Mai 2022.
- Gesetz für mehr Sicherheit in der Arzneimittelversorgung vom 9. August 2019: www.bgbl.de/xaver/bgbl/start.xav (letzter Zugriff: 12. Mai 2022). Bundesgesetzblatt 2019; Teil I Nr. 30: 1202-1220.
