Dapagliflozin (Forxiga®) (Niereninsuffizienz) (frühe Nutzenbewertung)
In Kürze
- Dapagliflozin ist seit 2021 auch zugelassen zur Behandlung der chronischen Niereninsuffizienz (CKD) bei erwachsenen Patienten.
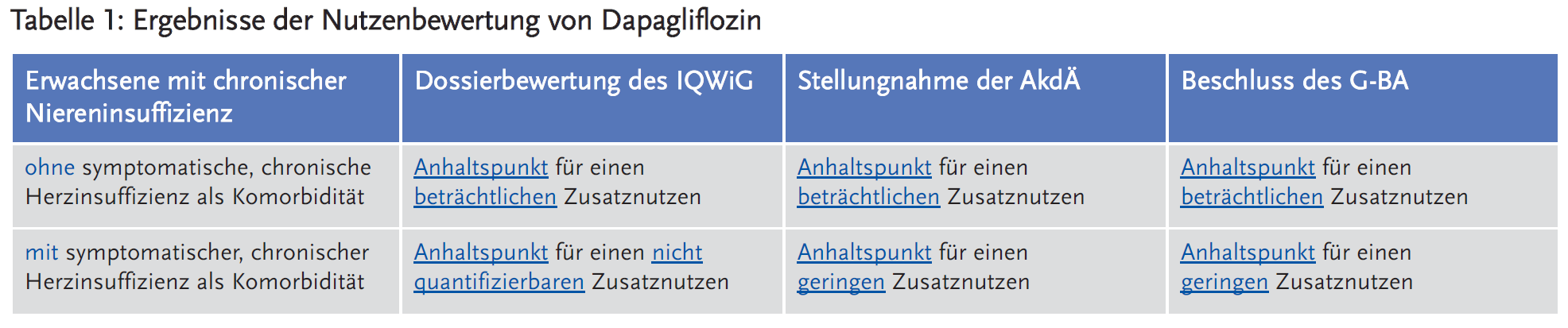
- IQWiG und AkdÄ sehen einen Anhaltspunkt für einen beträchtlichen Zusatznutzen von Dapagliflozin bei Erwachsenen mit CKD ohne symptomatische chronische Herzinsuffizienz. Der G-BA folgte dieser Einschätzung und beschloss einen Anhaltspunkt für einen beträchtlichen Zusatznutzen.
- Bei Erwachsenen mit CKD und symptomatischer, chronischer Herzinsuffizienz als Komorbidität besteht nach Einschätzung des IQWiG ein Anhaltspunkt für einen nicht quantifizierbaren Zusatznutzen, während die AkdÄ nur einen geringen Zusatznutzen sieht. Der G-BA beschloss der AkdÄ folgend einen Anhaltspunkt für einen geringen Zusatznutzen.
Dapaliflozin ist ein Inhibitor des renalen Natrium(Sodium)-Glukose-Cotransporters-2 (SGLT-2). Bei Hyperglykämie bewirkt Dapagliflozin eine verstärkte renale Glukose-Ausscheidung und damit eine insulinunabhängige Blutzuckersenkung. Der Wirkmechanismus bei CKD ist noch nicht vollständig geklärt. Diskutiert werden die Reduktion des intraglomerulären Drucks, eine verbesserte Sauerstoffversorgung der Tubuluszellen sowie antifibrotische Effekte.
Der Gemeinsame Bundesausschuss (G-BA) legte die folgende Fragestellung fest und definierte dazu die zweckmäßige Vergleichstherapie (ZVT):

Vorgelegte Evidenz
Der pharmazeutische Hersteller (pU) zieht für die Nutzenbewertung insbesondere die Zulassungsstudie DAPA-CKD heran. Zudem legt er eine Metaanalyse auf Basis individueller Patientendaten vor, welche die Studie DAPA-CKD sowie Teilpopulationen der Studien DAPA-HF und DECLARE-TIMI 58 einschließt. Die Studien DAPA-HF (1) (n = 4744) und DECLARE-TIMI 58 (2) (n = 17160) sind placebokontrollierte, doppelblinde, randomisierte Studien zu Dapagliflozin in der Indikation Herzinsuffizienz (DAPA-HF) bzw. Diabetes mellitus Typ 2 (DECLARE-TIMI 58) mit einer medianen Behandlungsdauer von 18 Monaten (DAPA-HF) bzw. 4,2 Jahren (DECLARE-TIMI 58). In die Studie DECLARE-TIMI 58 wurden überwiegend Patienten mit einer normalen oder leicht erniedrigten eGFR (geschätzte glomeruläre Filtrationsrate) eingeschlossen. Die Zuordnung zur CKD-Teilpopulation erfolgte deshalb in erster Linie über das Kriterium „UACR“ (Urin-Albumin-Kreatinin-Quotient): Bei 80 % der Patienten der CKD-Teilpopulation von DECLARE-TIMI 58 liegt eine Albuminurie (median 77 mg/g) ohne relevant erniedrigte eGFR vor. In der Studie DAPA-HF wurde der UACR nicht bestimmt, deshalb erfolgte die Zuordnung zur CKD-Teilpopulation allein über die verminderte eGFR. Die so identifizierten CKD-Teilpopulationen machen 41 % (DAPA-HF) bzw. 34 % (DECLARE-TIMI 58) der jeweiligen Gesamtpopulation aus.
Die für die Nutzenbewertung zentrale Studie DAPA-CKD (3) schloss 4304 Patienten mit CKD ein, die neben einer reduzierten eGFR (25–75 ml/min/1,73 m²) auch eine Albuminurie (UACR 200–5000 mg/g) aufwiesen. Etwa zwei Drittel der Patienten hatten einen Diabetes mellitus Typ 2 und knapp 40 % eine manifeste kardiovaskuläre Erkrankung. Die Patienten wurden im Verhältnis 1:1 zur einmal täglichen Gabe von Dapagliflozin 10 mg oder Placebo randomisiert. Alle Patienten erhielten ACE(Angiotensin-Converting-Enzym)-Hemmer oder ARB (Angiotensinrezeptorblocker) in maximal tolerierter Dosis. Zusätzlich sah das Studienprotokoll in beiden Studienarmen eine individuell optimierte Standardtherapie der Nierenerkrankung und Komorbiditäten vor. Laut Protokoll (4) war eine Beendigung der Studie nach 681 Ereignissen des primären Endpunktes geplant. Auf Anraten des DMC (Data Monitoring Committee) wurde die Studie jedoch nach einem regulären Review vorzeitig nach 509 Ereignissen beendet. Die mediane Behandlungsdauer lag bei 27 Monaten.
Dapagliflozin führte in dieser Studie zu einer signifikanten Reduktion der Gesamtmortalität (4,7 % vs. 6,8 %; Hazard Ratio [HR] 0,69 (95 % Konfidenzintervall [CI] 0,53–0,89)), des Neuauftretens von ESRD („end-stage renal disease“, Niereninsuffizienz im Endstadium, 5,1 % vs. 7,5 %; HR 0,64 (95 % CI 0,51–0,82)) und der Hospitalisierungen aufgrund von Herzinsuffizienz (1,7 % vs. 3,3 %; HR 0,51 (95 % CI 0,34–0,76)). Subgruppenanalysen zeigten keine signifikante Beeinflussung dieser Endpunkte durch das Alter, das Vorliegen eines Typ-2-Diabetes bei Studienbeginn, die eGFR, den UACR oder den systolischen Blutdruck. Nichtschwerwiegende unerwünschte Ereignisse (UE) wurden nur dann erhoben, wenn sie zum Therapieabbruch führten oder zu einer vom pU prädefinierten Auswahl gehörten. Zu den „UE von speziellem Interesse“ (UESI) gehörten Symptome eines Volumenmangels. Diese traten unter Dapagliflozin signifikant gehäuft auf (5,6 % vs. 3,9 %). Genitalinfektionen wurden im Studienprotokoll nicht als UESI eingestuft und deshalb nicht vollständig erhoben, obgleich sie in der Praxis häufig zum Behandlungsabbruch bei SGLT-2-Inhibitoren führen.
In der CKD-Teilpopulation der Studie DAPA-HF zeigte sich unter Dapagliflozin lediglich für den Endpunkt „Hospitalisierung aufgrund von Herzinsuffizienz“ ein statistisch signifikanter Effekt. Dies erscheint klinisch von moderater Relevanz (absolute Risikoreduktion (ARR) 5,1 % über eine Behandlungsdauer von 18 Monaten). Die Gesamtmortalität wurde numerisch positiv beeinflusst (HR 0,85), der kombinierte Endpunkt ESRD jedoch numerisch negativ (HR 1,64).
Dossierbewertung des IQWiG
Das IQWiG (5) zieht die Studie DECLARE-TIMI 58 nicht zur Nutzenbewertung heran, da in der Kontrollgruppe die Gabe von SGLT-2-Inhibitoren per Studienprotokoll ausgeschlossen war und nur sehr wenige Patienten Glukagon-like-Peptid(GLP)-1-Analoga erhielten (< 5 %). Zwar gibt es auch in den Studien DAPA-CKD und DAPA-HF einen relevanten Anteil kardiovaskulär vorerkrankter Patienten mit Diabetes mellitus Typ 2, aus Sicht des IQWiG wurde hier die Vergleichstherapie jedoch ausreichend umgesetzt, da keine Evidenz für den Nutzen von SGLT-2-Inhibitoren bei der Behandlung von Patienten mit Diabetes mellitus Typ 2 und einer eGFR < 60 ml/min/1,73 m² vorliege.
In den Studien DAPA-CKD und DAPA-HF fehlen Angaben zur Anpassung der Begleittherapie im Studienverlauf. Laut IQWiG bestehen Zweifel an einer ausreichend optimierten Therapie der Herzinsuffizienz, da nur ein geringer Anteil der Patienten Sacubitril/Valsartan erhielt. Zudem können die Nebenwirkungen nicht vollständig beurteilt werden: Es erfolgte keine systematische Erfassung nicht schwerwiegender UEs und in die Gesamtraten schwerwiegender UEs flossen in großem Umfang erkrankungsbezogene Ereignisse ein.
Die Unsicherheiten bezüglich der Umsetzung der Herzinsuffizienztherapie betreffen in erster Linie die Studie DAPA-HF. Außerdem liegen nur für die Studienpopulation aus DAPA-CKD Angaben zur Albuminurie vor. Das IQWiG analysiert deshalb den Zusatznutzen separat für Patienten mit und ohne komorbide Herzinsuffizienz. Danach können die Effekte von Dapagliflozin bei Patienten mit Herzinsuffizienz nicht quantifiziert werden. Bei Patienten ohne Herzinsuffizienz wird ein Anhaltspunkt für beträchtlichen Zusatznutzen gesehen.
Stellungnahme der AkdÄ
Die AkdÄ (6) stimmt mit dem IQWiG überein, die Studien DAPA-CKD und DAPA-HF für die Nutzenbewertung heranzuziehen und eine separate Analyse für Patienten mit und ohne symptomatische, chronische Herzinsuffizienz als Komorbidität vorzunehmen. Die Argumentation des IQWiG zum Ausschluss der Studie DECLARE-TIMI 58 ist aus Sicht der AkdÄ nicht schlüssig, da weder die aktuelle Fachinformation (7) noch die NVL Typ-2-Diabetes (8) die Anwendung von SGLT-2-Inhibitoren auf Patienten mit einer eGFR > 60 ml/min/1,73 m² einschränken. Es ist deshalb anzunehmen, dass durch den sehr geringen Einsatz von GLP-1-Analoga in allen drei Studien (DAPA-CKD, DAPA-HF und DECLARE-TIMI 58) eine leitlinienkonforme Diabetestherapie in der Kontrollgruppe seltener erfolgte als in der Interventionsgruppe. Entscheidend für den Ausschluss der Studie DECLARE-TIMI 58 ist aus Sicht der AkdÄ die fehlende Repräsentativität der Studienpopulation. Da nur 20 % der durch den pU definierten CKD-Teilpopulation einen eGFR Ausgangswert < 60 ml/min/1,73 m² aufweist, erscheint eine Übertragbarkeit der Studienergebnisse auf die Zielpopulation nicht gegeben.
Aus Sicht der AkdÄ erfolgte in den Studien DAPA-CKD und DAPA-HF eine ausreichende Therapie mit ACE-Hemmern bzw. ARB (Anteil der Patienten 97 % bzw. 93 %). Indirekte Hinweise auf die Güte der weiteren Begleittherapie finden sich lediglich für die Studie DAPA-CKD hinsichtlich der HbA1c-Werte und der Blutdruckwerte. Insgesamt scheint der HbA1c-Wert im Zielkorridor gemäß NVL Typ-2-Diabetes (8) zu liegen, auch wenn keine Aussage dazu möglich ist, inwieweit individuelle Zielwerte erreicht wurden. Der systolische Blutdruck lag bei Studienbeginn in beiden Gruppen durchschnittlich bei 137 mmHg und damit – zumindest in Hinblick auf die aktuelle KDIGO-Leitlinie (9) – nicht im Zielbereich für Patienten mit CKD. Im weiteren Studienverlauf ist der systolische Blutdruck unter Placebo konstant 3–4 mmHg höher als unter Dapagliflozin. Von einer klinisch relevanten Beeinflussung renaler und kardiovaskulärer Endpunkte durch die unterschiedliche Blutdruckeinstellung muss ausgegangen werden.
Abweichend von der IQWiG-Einschätzung ist aus Sicht der AkdÄ entscheidend, inwieweit die Basistherapie der Herzinsuffizienz in der Studie DAPA-HF umgesetzt wurde. Nahezu alle Patienten erhielten eine Kombinationstherapie aus ACE-Hemmern/ARB, Betablockern und Diuretika, 70 % außerdem einen MRA (Mineralokortikoidrezeptor-Antagonisten). Bei einer insgesamt adäquat umgesetzten Basistherapie der Herzinsuffizienz besteht aus Sicht der AkdÄ ein Anhaltspunkt für einen geringen Zusatznutzen für Dapagliflozin bei Patienten mit CKD und komorbider Herzinsuffizienz. Bei Patienten ohne komorbide Herzinsuffizienz sieht die AkdÄ wie das IQWiG einen Anhaltspunkt für einen beträchtlichen Zusatznutzen.
Beschluss des G-BA
Nach Einschätzung des G-BA (10) unterscheiden sich die Patienten der Studie DAPA-CKD in mehreren relevanten Punkten von der CKD-Teilpopulation der Studie DAPA-HF, insbesondere hinsichtlich ihrer Basisrisiken und ihrer Krankheitslast. Der G-BA betrachtet die beiden Patientenpopulationen daher separat.
Bei Patienten mit komorbider Herzinsuffizienz reduzierte Dapagliflozin weder die Gesamtmortalität noch die renale Morbidität, signifikant jedoch die Hospitalisierungen. Der G-BA sieht bei diesen Patienten deshalb einen geringen Zusatznutzen. Dagegen stuft der G-BA das Ausmaß des Zusatznutzens von Dapagliflozin bei Patienten mit Niereninsuffizienz ohne Herzinsuffizienz als beträchtlich ein, da Dapagliflozin signifikant die Gesamtmortalität, die renale Morbidität, die Gesamthospitalisierungen und die Häufigkeit schwerwiegender UE beeinflusste.
Aus Sicht des G-BA schränken fehlende Informationen zu Therapieoptimierungen die Aussagekraft beider Studien ein. Weitere Einschränkungen ergeben sich durch das Fehlen einer systematischen UE-Erhebung und den Ausschluss von Patienten mit einer Albuminurie mit UACR < 200 mg/g (DAPA-CKD) bzw. fehlenden Angaben zum UACR (DAPA-HF). Aufgrund dieser Unsicherheiten sieht der G-BA nur einen Anhaltspunkt für einen Zusatznutzen (Tabelle 1).
Literatur
- McMurray JJV, Solomon SD, Inzucchi SE et al.: Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med 2019; 381: 1995-2008.
- Wiviott SD, Raz I, Bonaca MP et al.: Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2019; 380: 347-357.
- Heerspink HJL, Stefansson BV, Correa-Rotter R et al.: Dapagliflozin in patients with chronic kidney disease. N Engl J Med 2020; 383: 1436-1446.
- Heerspink HJL, Stefansson BV, Chertow GM et al.: Rationale and protocol of the Dapagliflozin And Prevention of Adverse outcomes in Chronic Kidney Disease (DAPA-CKD) randomized controlled trial. Nephrol Dial Transplant 2020; 35: 274-282.
- IQWiG Dossierbewertung: https://www.g-ba.de/downloads/92-975-5040/2021-09-01_Nutzenbewertung-IQWiG_Dapagliflozin-713.pdf.
- Stellungnahme der AkdÄ: https://www.akdae.de/fileadmin/user_upload/akdae/Stellungnahmen/AMNOG/A-Z/Dapagliflozin/Dapagliflozin-IE2.pdf
- AstraZeneca GmbH: Fachinformation "Forxiga® 10 mg Filmtabletten". Stand: August 2021.
- Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. (AWMF): Nationale Versorgungsleitlinie: Typ-2-Diabetes – Teilpublikation der Langfassung: www.leitlinien.de/themen/diabetes/pdf/diabetes-2aufl-vers1.pdf (letzter Zugriff: 14. März 2022). AWMF-Reg-Nr.: nvl-001. 2. Auflage, Version 1: ÄZQ 2021.
- Tomson CRV, Cheung AK, Mann JFE et al.: Management of blood pressure in patients with chronic kidney disease not receiving dialysis: synopsis of the 2021 KDIGO clinical practice guideline. Ann Intern Med 2021; 174: 1270-1281.
- G-BA Tragende Gründe: www.g-ba.de/downloads/40-268-8265/2022-02-17_AM-RL-XII_Dapagliflozin_D-713_TrG.pdf.
„Neue Arzneimittel“ ist eine Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu neu zugelassenen Arzneimitteln oder zu neu zugelassenen Indikationen. Ziel ist es, den Ärzten zeitnah Informationen zu diesen Arzneimitteln zur Verfügung zu stellen, zunächst bei Markteinführung sowie nach der frühen Nutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA) (§ 35a Absatz 1 SGB V). „Neue Arzneimittel“ bei Markteinführung enthält Informationen basierend auf dem Europäischen Öffentlichen Bewertungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) sowie weiteren bei Markteinführung vorliegenden Daten aus klinischen Studien. Nach Abschluss der frühen Nutzenbewertung wird der Zusatznutzen des neuen Arzneimittels und seine therapeutische Bedeutung auf der Basis der Dossierbewertung des IQWiG, der Stellungnahme der AkdÄ und des Beschlusses des G-BA im Rahmen der frühen Nutzenbewertung dargestellt („Update – Neue Arzneimittel“).
vorab online
Dieser Artikel wurde am 18. März 2022 vorab online veröffentlicht.
