Abrocitinib (Cibinqo®) ▼ – Analogpräparat
Zugelassene Indikation und Wirkmechanismus
Abrocitinib ist nach Baricitinib und Upadacitinib ein weiterer oraler Januskinase(JAK)-Inhibitor, der zur Behandlung der mittelschweren bis schweren atopischen Dermatitis (AD) bei Erwachsenen zugelassen wurde. Er hemmt selektiv die Januskinase 1 (JAK1). Es wird angenommen, dass die Hemmung von JAK1 mehrere an der Pathophysiologie der AD beteiligte Zytokine (IL-4, IL-13, IL-22, IL-31) moduliert und darauf die antientzündlichen und antipruriginösen Eigenschaften von Abrocitinib beruhen.
Markteinführung
Abrocitinib wurde am 15.01.2022 in den deutschen Markt eingeführt.
Bewertung
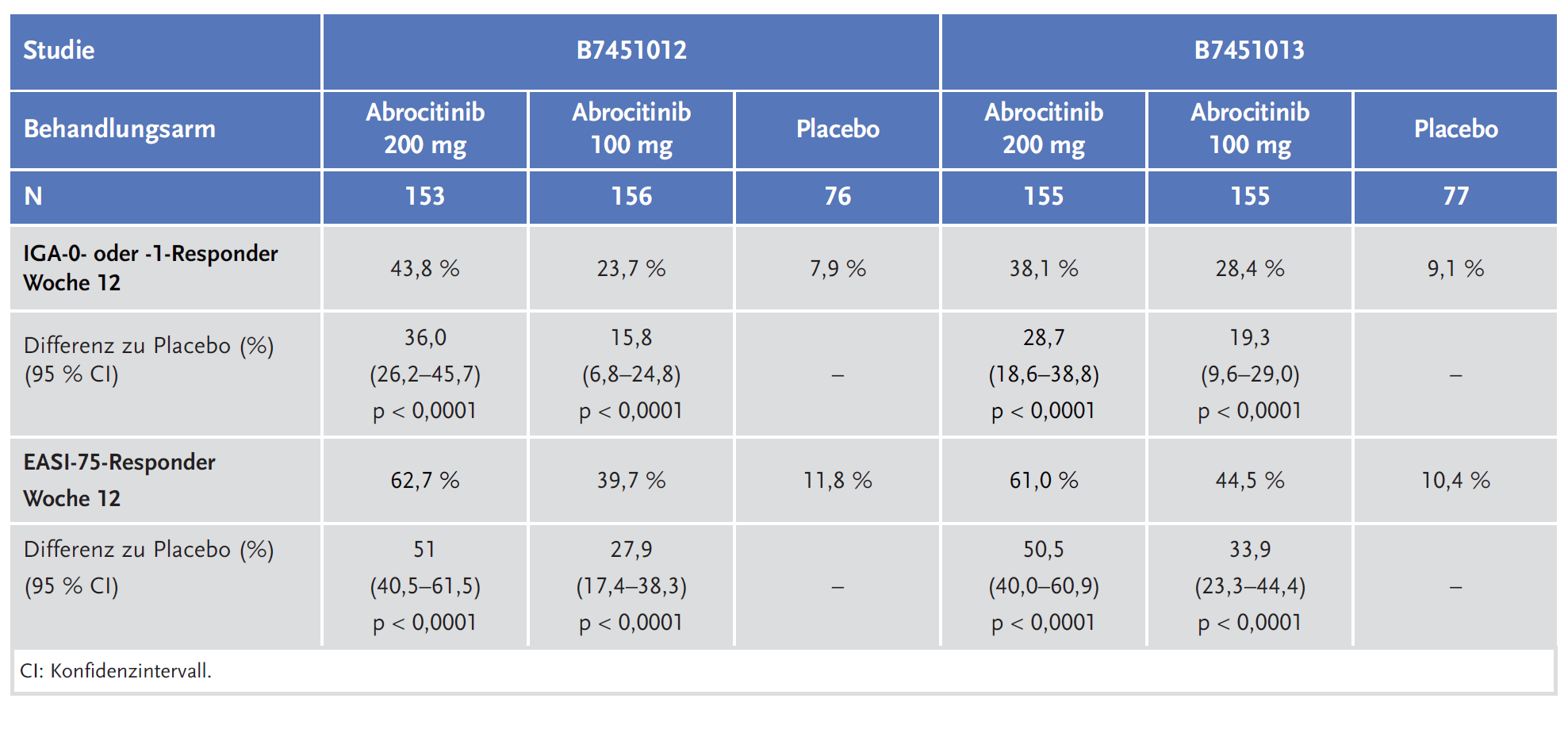
Abrocitinib zeigte in den Zulassungsstudien (B7451012,-13 und -29) für die koprimären Endpunkte IGA* 0 oder 1 und EASI 75 jeweils nach Woche 12 einen statistisch signifikanten Vorteil im Vergleich zu Placebo in der Behandlung von mittelschwerer bis schwerer AD bei erwachsenen Patientinnen und Patienten, die für eine systemische Therapie infrage kommen.
Relevante Nebenwirkungen waren Übelkeit, Kopfschmerzen, Erbrechen, Akne, Herpes simplex und Herpes zoster, Anstieg der Kreatinphosphokinase im Blut, Abfall von Lymphozyten und Blutplättchen sowie schwere Infektionen und venöse Thromboembolien. Kontraindikationen sind aktive, schwerwiegende systemische Infektionen einschließlich Tuberkulose, schwere Leberfunktionsstörungen sowie Schwangerschaft und Stillzeit.
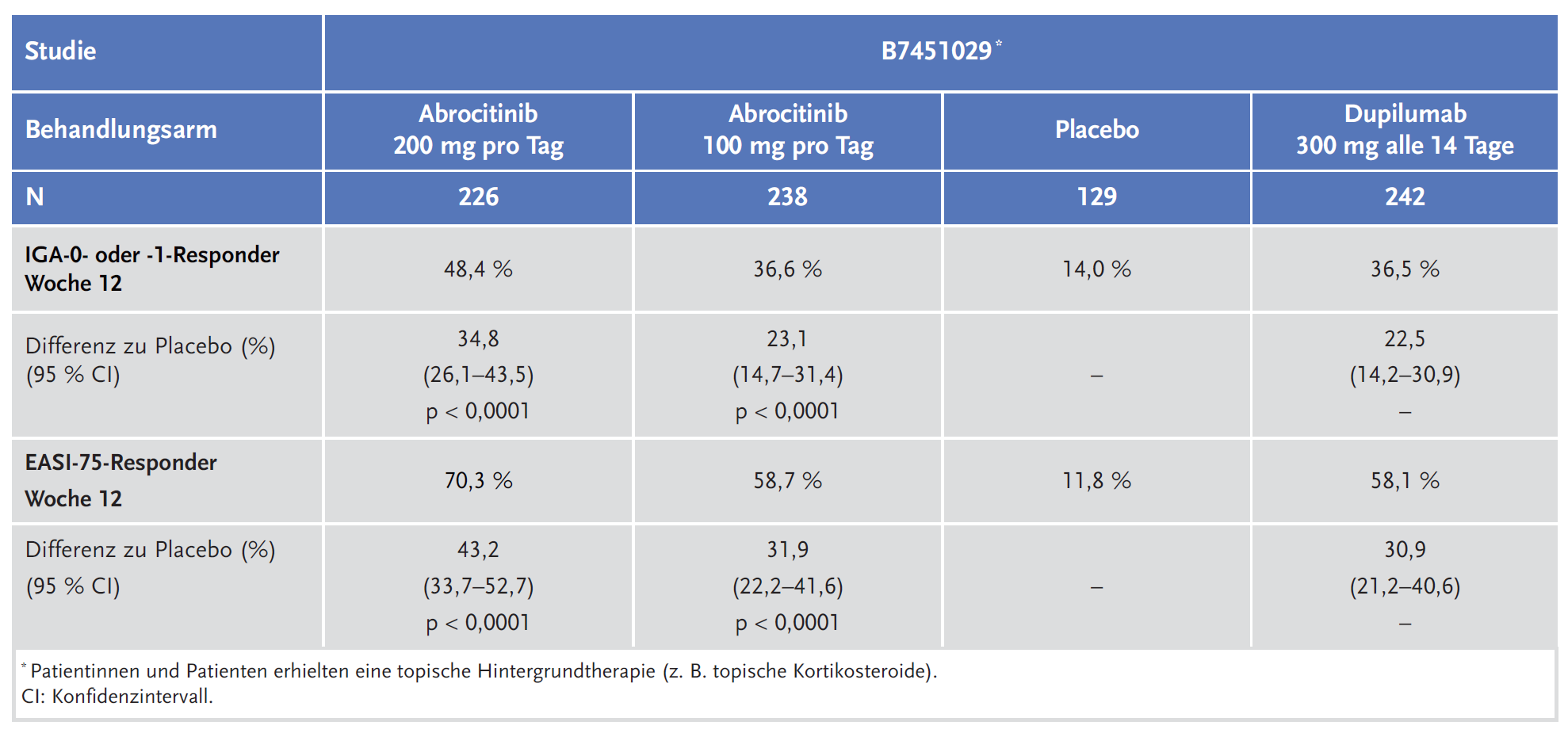
Die Wirksamkeit und Sicherheit von Abrocitinib kann gegenüber den JAK-Inhibitoren Baricitinib und Upadacitinib derzeit ebenso wenig wie gegenüber anderen systemischen Therapien (systemische Kortikosteroide, Azathioprin, Ciclosporin, Methotrexat, Mycophenolatmofetil) beurteilt werden. Direkte Vergleiche fehlen. In der Studie B7451029 wurden Abrocitinib und der monoklonale IgG4-Antikörper Dupilumab jeweils gegenüber Placebo verglichen. Der Vergleich weist auf eine bessere Wirksamkeit von Abrocitinib gegenüber Dupilumab hin.
Anhand der vorliegenden Daten für Abrocitinib sehen wir keine sicheren Vorteile gegenüber den anderen systemischen Therapien der AD einschließlich der bereits in den Markt eingeführten JAK-Inhibitoren Baricitinib und Upadacitinib. Wir raten deshalb zu einer zurückhaltenden Verordnung.
Da in präklinischen Studien nachteilige Effekte auf die Knochenentwicklung festgestellt wurden und die Relevanz dieser Befunde für Heranwachsende unklar ist, wurde das Anwendungsgebiet von Abrocitinib bis zum Vorliegen weiterer Sicherheitsdaten auf Erwachsene ab 18 Jahren beschränkt.
Wirksamkeit in den Zulassungsstudien
Die Zulassung von Abrocitinib basiert auf den Ergebnissen von drei randomisierten, placebokontrollierten klinischen Studien der Phase III mit 1618 Patientinnen und Patienten (B7451012,-13 und -29).
Schulungsmaterial
Abrocitinib darf nur unter Verwendung von Schulungsmaterialien in den Verkehr gebracht werden. Das behördlich beauflagte und genehmigte Material dient dazu, die Wissensvermittlung zu optimieren und Hilfe bei der sicheren Anwendung des Arzneimittels zu geben. Es ist verfügbar auf der Website des BfArM.

Weiterführende Informationen
Das IQWiG wurde am 15.01.2022 mit der Bewertung des Zusatznutzens beauftragt, über den der G-BA entscheiden wird. Sollte sich die AkdÄ mit einer Stellungnahme äußern, wird diese auf der AkdÄ-Website veröffentlicht.
Quelle
Europäischer Öffentlicher Beurteilungsbericht (EPAR) Cibinqo®, erschienen am 17. Dezember 2021. Die vorliegende Information erhebt keinen Anspruch auf Vollständigkeit. Für die Richtigkeit der angegebenen Dosierungen kann keine Gewähr übernommen werden.
Fußnote
*IGA: Investigator's Global Assessment; EASI: Eczema Area and Severity Index.
Hinweise
Arzneimittel, die mit einem schwarzen Dreieck (▼) gekennzeichnet sind, unterliegen einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.
„Neue Arzneimittel“ ist eine Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu neu zugelassenen Arzneimitteln oder zu neu zugelassenen Indikationen. Ziel ist es, den Ärzten zeitnah Informationen zu diesen Arzneimitteln zur Verfügung zu stellen, zunächst bei Markteinführung sowie nach der frühen Nutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA) (§ 35a Absatz 1 SGB V). „Neue Arzneimittel“ bei Markteinführung enthält Informationen basierend auf dem Europäischen Öffentlichen Bewertungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) sowie weiteren bei Markteinführung vorliegenden Daten aus klinischen Studien. Nach Abschluss der frühen Nutzenbewertung wird der Zusatznutzen des neuen Arzneimittels und seine therapeutische Bedeutung auf der Basis der Dossierbewertung des IQWiG, der Stellungnahme der AkdÄ und des Beschlusses des G-BA im Rahmen der frühen Nutzenbewertung dargestellt („Update – Neue Arzneimittel“).
vorab online
Dieser Artikel wurde am 25. März 2022 vorab online veröffentlicht.
