Bimekizumab (Bimzelx®) ▼
Zugelassene Indikation
Bimzelx® (Bimekizumab) ist zugelassen zur Behandlung erwachsener Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis, die für eine systemische Therapie infrage kommen.
Markteinführung
Bimzelx® (Bimekizumab) ist seit 15.09.2021 in dieser Indikation auf dem deutschen Markt verfügbar.
Bewertung
Bimzelx® (Bimekizumab inhibiert zusätzlich zum Interleukin IL-17A selektiv auch IL-17F. Das Arzneimittel hat in den drei Zulassungsstudien eine gute Wirksamkeit gezeigt und zeigte nach 16 Wochen Therapie bessere Ergebnisse als der IL-12/IL-23-Antagonist Ustekinumab bzw. der TNF-α-Inhibitor Adalimumab bezüglich der koprimären Endpunkte (Psoriasis Area and Severity Index (PASI) 90 Response (Patienten mit 90-prozentiger Reduktion des PASI-Scores im Vergleich zu Baseline) bei Woche 16 und Investigator´s Global Assessment (IGA) 0/1 Response (Patienten mit IGA: 0 = erscheinungsfreie Haut, 1 = leichte Hautsymptome) bei Woche 16). Für eine Einordnung bezüglich des Zusatznutzens von Bimekizumab in der Therapie der Plaque-Psoriasis bleibt die frühe Nutzenbewertung abzuwarten – unter Einschluss späterer Beobachtungen zur Sicherheit.
Wirksamkeit in den Zulassungsstudien
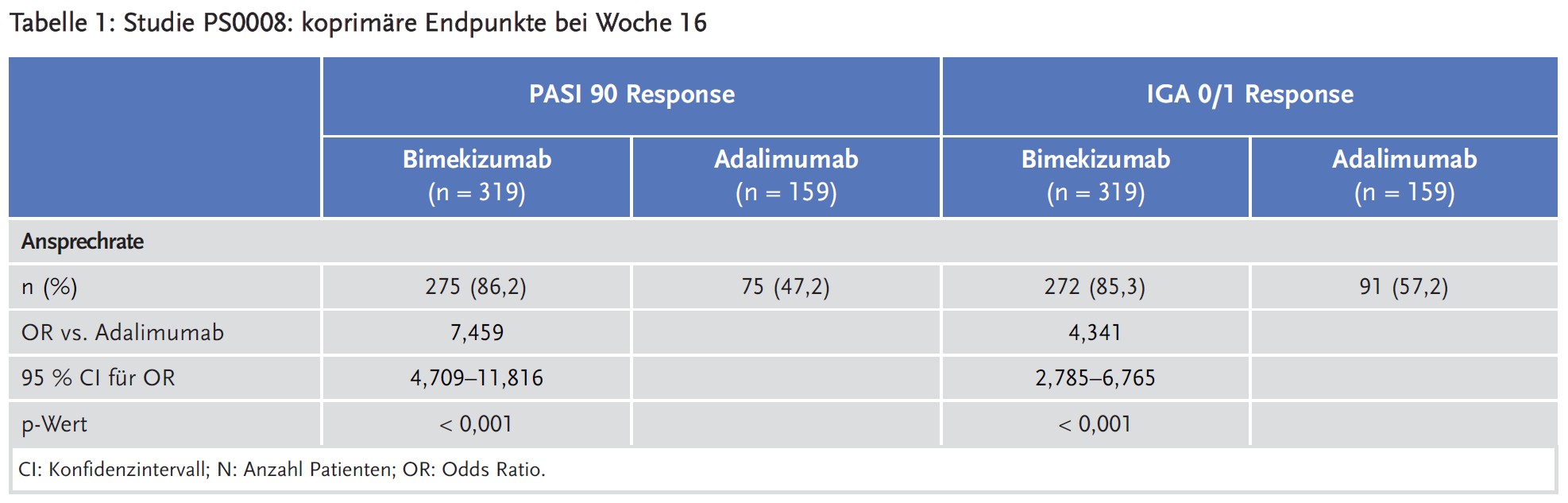
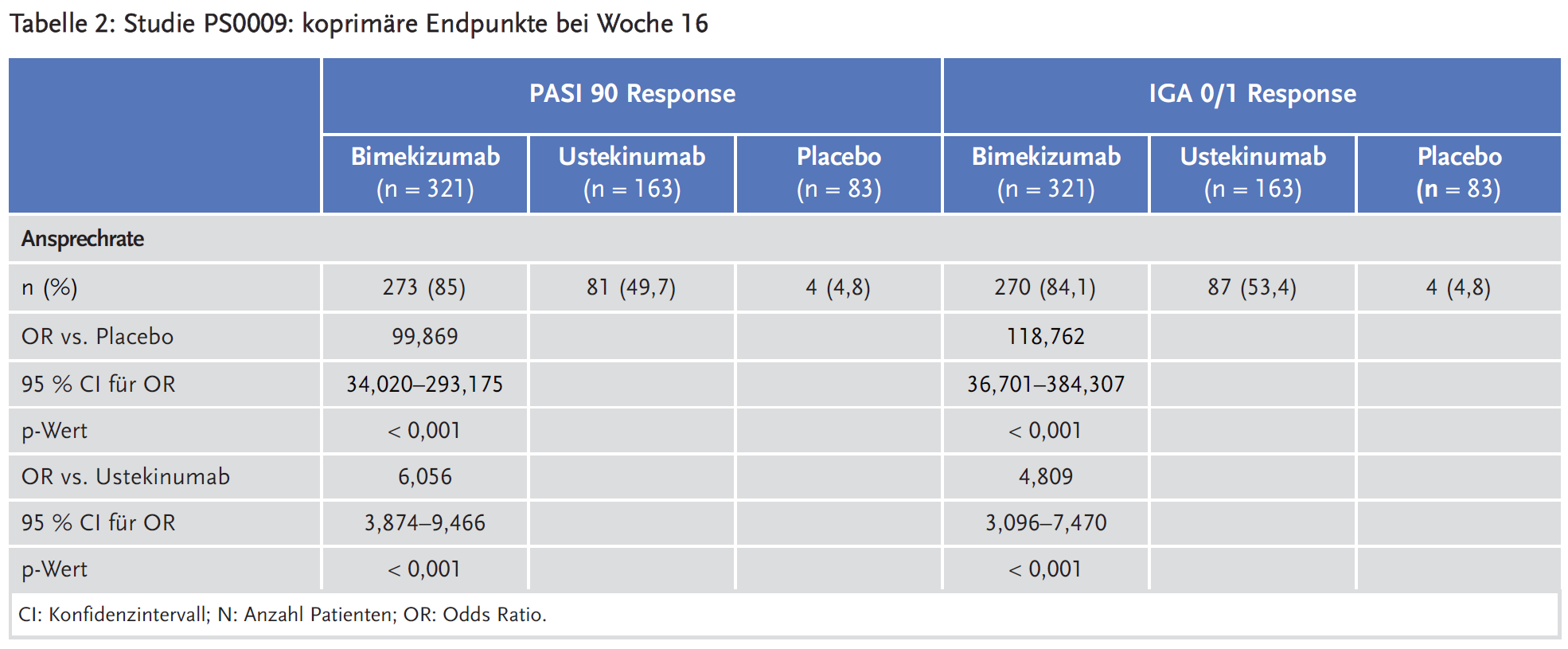
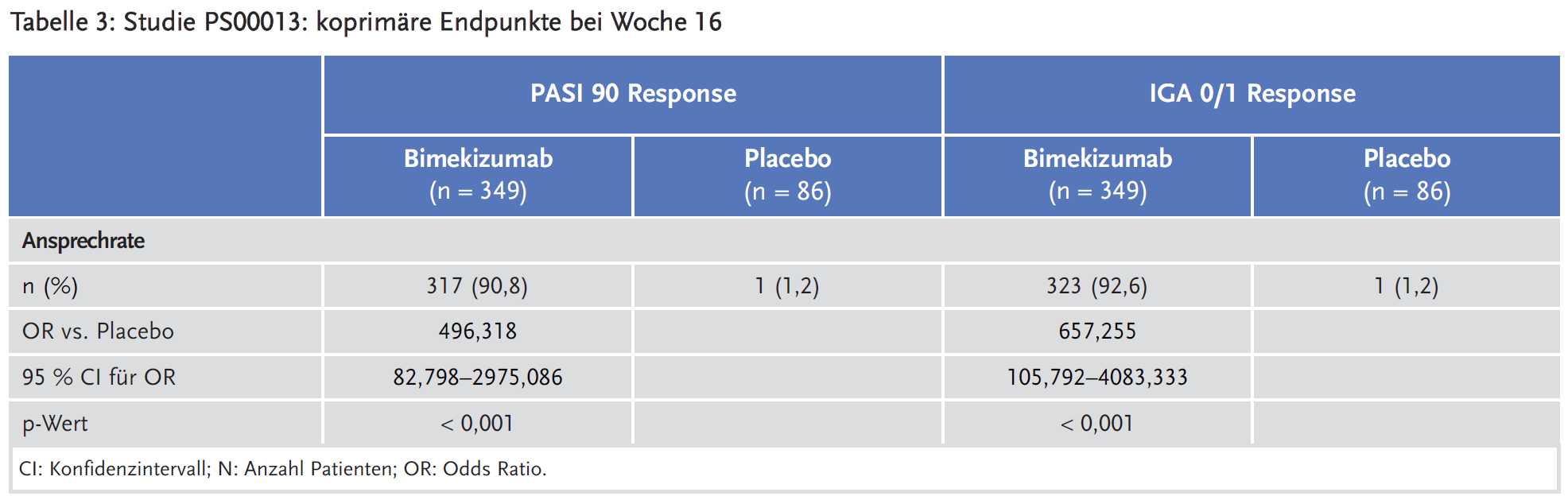
Drei multizentrische, multinationale, randomisierte, doppelblinde, kontrollierte Studien der Phase III sind als zentrale Studien anzusehen: Studie PS0008 („BE SURE“) (1), Studie PS0009 („BE VIVID“) (2) und Studie PS00013 („BE READY“) (3).
Die Studien waren ähnlich aufgebaut und hatten ähnliche Einschlusskriterien. Es wurden erwachsene Patientinnen und Patienten mit chronischer Plaque-Psoriasis, bestehend seit mindestens sechs Monaten, PASI ≥ 12, ≥ 10 % Körperoberfläche (KOF) von Psoriasis betroffen und IGA-Score ≥ 3 auf einer 5-Punkte-Skala eingeschlossen.
In Studie PS0008 wurden insgesamt 478 Patienten 1:1:1 auf drei Therapiearme randomisiert: Arm 1: Bimekizumab 320 mg alle 4 Wochen (Q4W) für 56 Wochen, Arm 2: Bimekizumab 320 mg Q4W für 16 Wochen, gefolgt von einer Erhaltungsphase von 40 Wochen mit Bimekizumab 320 mg alle 8 Wochen (Q8W), Arm 3: Adalimumab für 24 Wochen, gefolgt von Bimekizumab 320 mg Q4W.
In Studie PS0009 wurden insgesamt 567 Patienten 1:4:2 auf drei Therapiearme randomisiert: Arm 1 Placebo für 16 Wochen, gefolgt von Bimekizumab 320 mg Q4W für 32 Wochen, Arm 2: Bimekizumab 320 mg Q4W für 52 Wochen, Arm 3: Ustekinumab für 52 Wochen.
In Studie PS00013 wurden insgesamt 435 Patienten 4:1 randomisiert, zunächst auf einen Bimekizumab-Arm 320 mg Q4W und einen Placebo-Arm. Der Bimekizumab-Arm wurde nach 16 Wochen weiter in drei Unterarme 1:1:1 randomisiert: Arm 1: Bimekizumab 320 Q4W, Arm 2: Bimekizumab 320 mg Q8W und Arm 3: Placebo Q4W. Patienten, die bei Woche 20 einen Rückfall hatten wurden in einem offenen „Escape“-Arm mit Bimekizumab 320 mg Q4W weiterbehandelt.
Die koprimären Endpunkte für alle Studien waren PASI 90 Response (Patienten mit 90 %-iger Reduktion des PASI-Scores im Vergleich zu Baseline) bei Woche 16 und IGA 0/1 Response (Patienten mit IGA: 0 = erscheinungsfreie Haut, 1 = leichte Hautsymptome) bei Woche 16. Da die koprimären Endpunkte bei Woche 16 bereits erhoben wurden, wurden die Bimekizumab-haltigen Arme in den Analysen subsummiert.
In diesen Studien zeigte Bimekizumab eine gute Wirksamkeit und für die koprimären Endpunkte statistisch signifikant bessere Ergebnisse als Ustekinumab und Adalimumab. Auch in allen präspezifizierten sekundären Endpunkten der drei Studien war Bimekizumab statistisch signifikant überlegen. Der Zusatznutzen von Bimekizumab in der Therapie der Plaque-Psoriasis wird noch in der frühen Nutzenbewertung festgestellt werden müssen.
Ausgewählte Nebenwirkungen
Unter anderem folgende Nebenwirkungen traten gelegentlich oder häufiger auf: Infektionen (Infektionen der oberen Atemwege, orale/oropharyngeale Candidose, Tinea-Infektionen, Infektionen des Ohrs, Herpes-simplex-Infektionen, Gastroenteritis, Follikulitis), entzündliche Darmerkrankung, Kopfschmerzen, Dermatitis, Ekzem, Akne, Fatigue-Syndrom, Reaktionen an der Injektionsstelle, Neutropenie, Mukositis, Konjunktivitis.
Nebenwirkungen im Vergleich zu Adalimumab und Ustekinumab
Eine Candidose trat bei Bimekizumab deutlich häufiger als bei Adalimumab und Ustekinumab auf (10,7 % vs. 0 % bzw. 9 % vs. 0 %) (1;2). Eine Diarrhoe (nicht weiter spezifiziert) wurde bei Bimekizumab häufiger beobachtet als bei Adalimumab (1).
Ausgewählte Warnhinweise/Kontraindikationen/Interaktionen
- Lebendimpfstoffe dürfen nicht gleichzeitig mit Bimekizumab verabreicht werden.
- Vor Beginn der Behandlung mit Bimekizumab sind die Patienten auf eine Tuberkulose(TB)-Infektion zu untersuchen. Bimekizumab darf nicht bei Patienten mit aktiver TB angewendet werden. Patienten, die Bimekizumab erhalten, müssen auf Anzeichen und Symptome einer aktiven TB überwacht werden.
- Bimekizumab wird bei Patienten mit entzündlicher Darmerkrankung nicht empfohlen.

Weiterführende Informationen
Das IQWiG wurde am 15.09.2021 mit der Bewertung des Zusatznutzens beauftragt, über den der G-BA entscheiden wird. Sollte sich die AkdÄ mit einer Stellungnahme äußern, wird diese auf der AkdÄ-Website veröffentlicht.
Quelle
Europäischer Öffentlicher Beurteilungsbericht (EPAR) Bimzelx®, erschienen am 24. August 2021. Die vorliegende Information erhebt keinen Anspruch auf Vollständigkeit. Für die Richtigkeit der angegebenen Dosierungen kann keine Gewähr übernommen werden.
Literatur
- Warren RB, Blauvelt A, Bagel J et al.: Bimekizumab versus adalimumab in plaque psoriasis. N Engl J Med 2021; 385: 130-141.
- Reich K, Papp KA, Blauvelt A et al.: Bimekizumab versus ustekinumab for the treatment of moderate to severe plaque psoriasis (BE VIVID): efficacy and safety from a 52-week, multicentre, double-blind, active comparator and placebo controlled phase 3 trial. Lancet 2021; 397: 487-498.
- Gordon KB, Foley P, Krueger JG et al.: Bimekizumab efficacy and safety in moderate to severe plaque psoriasis (BE READY): a multicentre, double-blind, placebo-controlled, randomised withdrawal phase 3 trial. Lancet 2021; 397: 475-486.
Hinweise
Arzneimittel, die mit einem schwarzen Dreieck (▼) gekennzeichnet sind, unterliegen einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.
„Neue Arzneimittel“ ist eine Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu neu zugelassenen Arzneimitteln oder zu neu zugelassenen Indikationen. Ziel ist es, den Ärzten zeitnah Informationen zu diesen Arzneimitteln zur Verfügung zu stellen, zunächst bei Markteinführung sowie nach der frühen Nutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA) (§ 35a Absatz 1 SGB V). „Neue Arzneimittel“ bei Markteinführung enthält Informationen basierend auf dem Europäischen Öffentlichen Bewertungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) sowie weiteren bei Markteinführung vorliegenden Daten aus klinischen Studien. Nach Abschluss der frühen Nutzenbewertung wird der Zusatznutzen des neuen Arzneimittels und seine therapeutische Bedeutung auf der Basis der Dossierbewertung des IQWiG, der Stellungnahme der AkdÄ und des Beschlusses des G-BA im Rahmen der frühen Nutzenbewertung dargestellt („Update – Neue Arzneimittel“).
vorab online
Dieser Artikel wurde am 14. Dezember 2021 vorab online veröffentlicht.
