Icosapent-Ethyl (Vazkepa®) ▼
Zugelassene Indikation und Wirkmechanismus
Vazkepa® (Icosapent-Ethyl) ist zugelassen zur Reduzierung des Risikos für kardiovaskuläre Ereignisse bei mit Statinen behandelten erwachsenen Patienten mit hohem kardiovaskularem Risiko und erhöhten Triglyceridwerten (≥ 150 mg/dl [≥ 1,7 mmol/l]) sowie:
- nachgewiesener kardiovaskulärer Erkrankung oder
- Diabetes und mindestens einem weiteren kardiovaskularen Risikofaktor.
Icosapent-Ethyl ist ein stabiler Ethylester der Omega-3-Fettsäure Eicosapentaensäure (EPA). Fettreicher Kaltwasserfisch aus dem Meer ist die wichtigste natürliche Nahrungsquelle für EPA. Im Vergleich zu bislang zugelassenen Präparaten mit Omega-3-Fettsäuren enthält Vazkepa® keine native EPA, sondern eine chemisch modifizierte Variante in höherer Dosierung und ohne Anteile von Docosahexaensäure (DHA). Die Wirkmechanismen von EPA bzw. Icosapent-Ethyl sind nicht vollständig bekannt. Neben einer Reduktion triglyceridreicher Lipoproteine werden entzündungshemmende und antioxidative Effekte, eine Verbesserung der endothelialen Funktion sowie eine Hemmung der Thrombozytenaggregation diskutiert.
Markteinführung
Vazkepa® (Icosapent-Ethyl) ist seit 01.09.2021 in der oben genannten Indikation auf dem deutschen Markt verfügbar.
Bewertung
Die Zulassungsstudie REDUCE-IT untersuchte Icosapent-Ethyl bei Patienten mit kardiovaskulären Vorerkrankungen oder hohem kardiovaskulärem Risiko, die unter einer Behandlung mit Statinen niedrige LDL-C-Werte (40–100 mg/dl), jedoch moderat erhöhte Triglyceridwerte (durchschnittlich 217 mg/dl) aufwiesen. Unter Icosapent-Ethyl wurde der kombinierte Endpunkt aus kardiovaskulären Todesfällen sowie nichttödlichen Myokardinfarkten und Schlaganfällen im Vergleich zu Mineralöl (Placebo) signifikant reduziert (Number needed to treat (NNT): 28). Die Gesamtmortalität wurde nicht signifikant beeinflusst. Unter Icosapent-Ethyl waren Blutungen (Number needed to harm (NNH): 50) und Vorhofflimmern (NNH: 77) signifikant gehäuft.
Die Relevanz negativer Auswirkungen der Placebokontrolle mit Mineralöl auf kardiovaskuläre Ereignisse ist unklar. Unter der Gabe von Mineralöl stiegen der LCL-C-Wert, das Apolipoprotein B und das C-reaktive Protein (CRP) an. Eine mögliche Ursache dafür könnte die schlechtere Resorption von Statinen unter Mineralöl sein. Zudem erhöhte sich im Studienverlauf der systolische Blutdruck in der Placebogruppe leicht. Weitere negative Effekte von Mineralöl, beispielsweise auf den Elektrolythaushalt und die Blutbildung, sind nicht auszuschließen.
Alle bisherigen Studien zu Omega-3-Fettsäuren zeigten mit Ausnahme einer methodisch fragwürdigen Studie keine Reduktion kardiovaskulärer Ereignisse, sodass noch 2019 die europäische Arzneimittel-Agentur (EMA) von Omega-3-Fettsäuren in der Sekundärprävention dezidiert abriet. REDUCE-IT unterscheidet sich sowohl im Prüfpräparat (Ethylester hochdosierter EPA) als auch im Komparator (Mineralöl) von den bisherigen Studien. Die in REDUCE-IT beobachteten Effekte können somit einerseits durch die höhere Dosis und die chemisch stabilere Form von EPA, andererseits auch durch die ungünstigen Effekte von Mineralöl in der Kontrollgruppe erklärt werden.
Aus Sicht der AkdÄ kann auf Basis der vorliegenden Daten der Stellenwert von Icosapent-Ethyl in der kardiovaskulären Prävention nicht beurteilt werden. Auch wenn es unwahrscheinlich ist, dass der kardiovaskuläre Risikounterschied gänzlich auf negativen Effekten des Mineralöls beruht, bleiben unter Berücksichtigung der bisherigen Studien zu Omega-3-Fettsäuren viele Unklarheiten. Daher ist nach Einschätzung der AkdÄ eine Bestätigung von REDUCE-IT zu fordern. Eine generelle Empfehlung für die Therapie mit Icosapent-Ethyl kann aktuell nicht ausgesprochen werden.
Wirksamkeit in den Zulassungsstudien
Die doppelblinde, randomisierte Studie REDUCE-IT (1) untersuchte Icosapent-Ethyl bei Patienten (n = 8179) mit erhöhten Triglyceridwerten und manifester kardiovaskulärer Erkrankung oder hohem kardiovaskulärem Risiko, zusätzlich zu einer Therapie mit Statinen. Die Patienten wurden 1:1 randomisiert zu Icosapent-Ethyl (zweimal täglich 2 mg) oder Mineralöl als Placebo. Die Studiendauer lag ereignisgesteuert bei median 4,9 Jahren.
Bei der Mehrzahl (71 %) der Patienten bestand eine manifeste kardiovaskuläre Erkrankung (KHK, pAVK, zerebrovaskuläre Erkrankungen); bei 29 % der Patienten war ein Diabetes mellitus bekannt sowie mindestens ein weiterer kardiovaskulärer Risikofaktor (z. B. Nikotinabusus, Hypertonus, GFR < 60 ml/min). Die Studienteilnehmer waren überwiegend (71 %) männlich mit einem Durchschnittsalter von 64 Jahren. Die bestehende Statintherapie war zumeist (93 %) moderat bis hoch dosiert. Eine zusätzliche Ezetimib-Behandlung erfolgte selten (6 % der Patienten). Die Triglyceridwerte mussten laut initialem Studienprotokoll bei mindestens 135 mg/dl liegen; diese Grenze wurde nach zwei Jahren Studiendauer angehoben auf 200 mg/dl. Durchschnittlich lag der LDL-C Wert bei Studienbeginn bei 74 mg/dl, der Triglyceridwert bei 217 mg/dl.
Primärer Endpunkt der Studie war ein kombinierter Endpunkt aus kardiovaskulärem Tod, nichttödlichem Myokardinfarkt, nichttödlichem Schlaganfall, koronarer Revaskularisation oder Hospitalisierung aufgrund instabiler Angina pectoris. Der sekundäre kombinierte Endpunkt umfasste nur die drei härteren Endpunkte kardiovaskulärer Tod, nichttödlicher Myokardinfarkt und nichttödlicher Schlaganfall. Unter Icosapent-Ethyl traten beide kombinierte Endpunkte signifikant seltener auf als unter Placebo, mit einer NNT von 21 (primärer Endpunkt) bzw. 28 (sekundärer Endpunkt). Die Effekte bei Patienten über 65 Jahren waren signifikant geringer als bei jüngeren Patienten (primärer Endpunkt: Hazard Ratio [HR] 0,87 vs. 0,65; Interaktionstest p = 0,004). Werden die Einzelkomponenten als unabhängige Endpunkte analysiert, zeigt sich jeweils eine signifikante Risikoreduktion unter Icosapent-Ethyl. Die Gesamtmortalität wurde durch Icosapent-Ethyl nicht signifikant beeinflusst (siehe Tabelle 1).
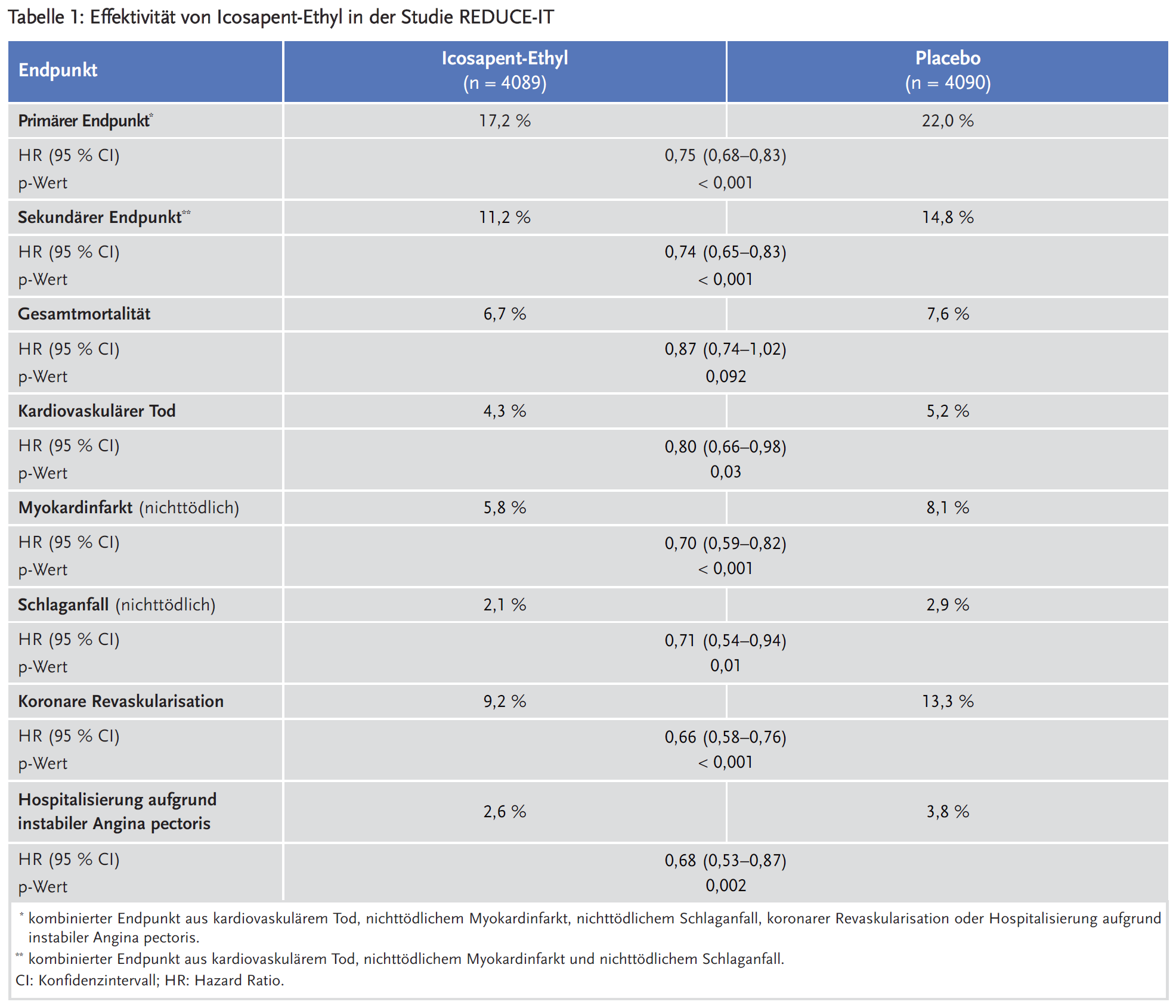
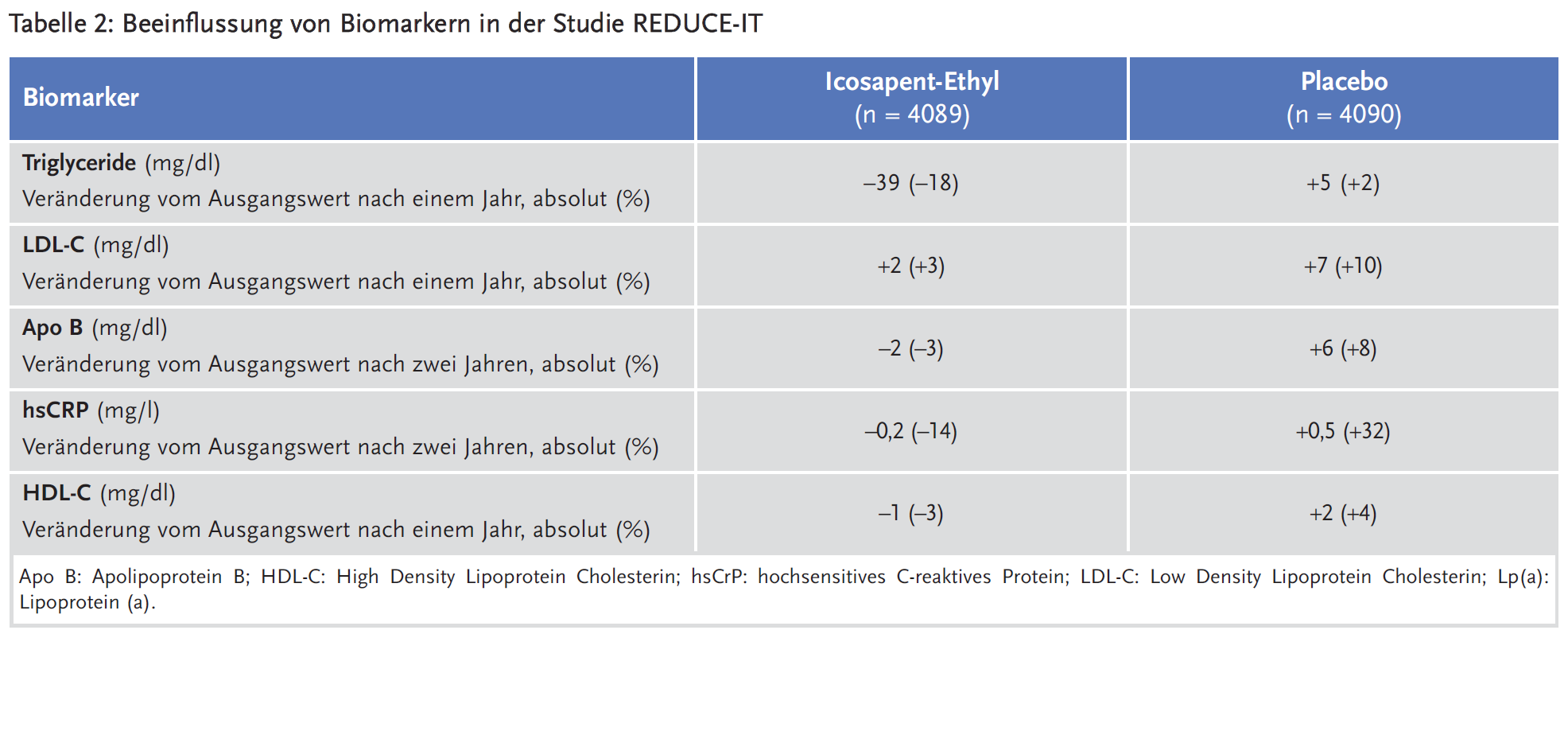
Unter Icosapent-Ethyl nahmen die Triglyceridwerte im ersten Studienjahr um durchschnittlich 18 % bzw. 39 mg/dl ab, während die übrigen Lipide weitgehend konstant blieben. In der Placebogruppe zeigte sich dagegen ein numerischer Anstieg des LDL-C und des Apolipoproteins B. Die Behandlungsgruppen unterschieden sich im Studienverlauf auch hinsichtlich des CRP (siehe Tabelle 2). Es ist anzunehmen, dass diese Biomarker durch das als Placebo gegebene Mineralöl mitbeeinflusst wurden: Mineralöl kann die Resorption von Statinen verschlechtern und somit ihre Wirkung reduzieren.
In einem Worst-Case-Szenario geht die EMA davon aus, dass Mineralöl zu einer Erhöhung kardiovaskulärer Ereignisse in der Placebogruppe um 10 % geführt haben könnte, sodass die relative Risikoreduktion von Icosapent-Ethyl bezüglich des primären Endpunktes nur noch bei 15 % (statt 25 %) läge. Da ein Worst-Case-Szenario nicht den natürlichen Krankheitsverlauf sowie potenziell positive Effekte von Mineralöl (beispielsweise eine Erhöhung des HDL-C) berücksichtigt, schätzt die EMA die Erhöhung kardiovaskulärer Ereignisse durch Mineralöl auf lediglich 0,3–3 %. Die der Modellierung zugrundeliegenden epidemiologischen Studien werden durch die EMA nicht angegeben.
Aus Sicht der AkdÄ ist eine genaue Bezifferung der negativen Effekte von Mineralöl auf Grundlage der derzeit verfügbaren Daten nicht möglich. So ist unklar, inwiefern sich die beobachteten moderaten Einzeleffekte (z. B. Anstieg des hsCrP/LDL-C/Blutdrucks) gegenseitig verstärken. Solange die Wirkungen von Mineralöl nicht vollständig aufgeklärt sind, können zudem weitere negative Effekte nicht ausgeschlossen werden. Durch die EMA unberücksichtigt blieb beispielsweise die numerische Häufung von Hyperglykämien, Elektrolytstörungen (Hyperkaliämie, Hypomagnesiämie) und Anämien (siehe unten) im Kontroll-Arm.
Die meisten Studien zeigen keine kardiovaskuläre Risikoreduktion durch Omega-3-Fettsäuren. Eine Ausnahme stellt lediglich die JELIS-Studie (2) dar, eine randomisierte, kontrollierte, aber offen durchgeführte Studie (n = 18.645). Unter EPA 1800 mg/Tag wurde der weitgefasste kombinierte Endpunkt kardiovaskulärer Ereignisse signifikant reduziert. Dieser Effekt beruhte in erster Linie auf einer reduzierten Häufigkeit instabiler Angina pectoris und koronarer Revaskularisationen. Diese Endpunkte sind bei einem offenen Design einem hohen Verzerrungsrisiko ausgesetzt. Da die Gesamtmortalität numerisch unter EPA sogar erhöht war, belegt diese Studie aus Sicht der EMA keine Risikoreduktion durch Omega-3-Fettsäuren. Im Dezember 2018 hat die EMA deshalb allen zum damaligen Zeitpunkt verfügbaren Omega-3-Fettsäure-Präparaten die Kennzeichnung aberkannt, in der Sekundärprävention nach Myokardinfarkt wirksam zu sein (3).
Auch die 2020 publizierte Studie STRENGTH (4) (n = 13.078) belegte nicht die kardiovaskuläre Effektivität von Omega-3-Fettsäuren. Die Studie wurde nach einer medianen Beobachtungsdauer von 42 Monaten aufgrund einer Interimsanalyse abgebrochen, weil ein Nachweis der Wirksamkeit unwahrscheinlich schien: Bei einem ähnlichen Patientenkollektiv wie in REDUCE-IT wurde der primäre kombinierte Endpunkt (kardiovaskulärer Tod, nichttödlicher Myokardinfarkt, nichttödlicher Schlaganfall, koronare Revaskularisation, instabile Angina pectoris) im Interventionsarm von 12,0 % der Patienten und im Kontrollarm von 12,2 % der Patienten erreicht. In beiden Studien, REDUCE-IT und STRENGTH, wurden hohe Dosierungen von Omega-3-Fettsäuren (4 g) eingesetzt. Im Unterschied zu der Studie REDUCE-IT untersuchte die Studie STRENGTH allerdings eine EPA-Carboxy-Derivat/DHA-Mischung, unter welcher der EPA-Spiegel im Blut geringer anstieg als unter der ausschließlichen EPA-Gabe der Studie REDUCE-IT (270 % vs. 400 %). Außerdem setzte die Studie STRENGTH als Placebo Maiskeimöl ein, unter welchem – anders als unter Mineralöl – keine Laborwertveränderungen (Anstieg des hsCrP/Apolipoprotein B/LDL-C) der Kontrollgruppe auffielen (5).
Zusammenfassend ist die Studie REDUCE-IT nicht mit den übrigen Studien zu Omega-3-Fettsäuren vergleichbar, die niedrigere Dosen von nativen EPA/DHA-Präparaten untersuchten und kein Mineralöl als Placebo einsetzten. Die gleiche Problematik betrifft die Interpretation der deutlich kleineren Studie EVAPORATE (6) (n = 80), welche den Einfluss von Isocapent-Ethyl auf die koronare Plaque-Morphologie untersuchte und ebenfalls Mineralöl als Kontrolle nutzte. Primärer Endpunkt war die per Mehrschicht-CT-Angiographie gemessene Volumenveränderung sogenannter „low attenuation plaques“. Nach 18 Monaten war das Plaque-Volumen unter Icosapent-Ethyl im Vergleich zum Ausgangswert um 17 % gesunken, während es in der Placebogruppe um 109 % zugenommen hatte (p = 0,006). Neben der fraglichen klinischen Relevanz dieses Endpunktes bleibt auch hier unklar, in welchem Maß die gezeigten Effekte auf die Intervention zurückzuführen sind und welchen Anteil das Mineralöl als Komparator hat.
Ausgewählte Nebenwirkungen
Unter Icosapent-Ethyl trat eine zusätzliche Blutung bei einem von 50 Patienten auf (11,8 % vs. 9,9 %; p = 0,0055). Schwerwiegende Blutungen waren numerisch gehäuft (2,7 % vs. 2,1 %; p = 0,0605) und betrafen zumeist den Gastrointestinaltrakt. Zerebrale Blutungen waren in beiden Armen selten. Inkonsistent zu den gehäuften Blutungsereignissen stieg der durchschnittliche Hämoglobingehalt unter Icosapent-Ethyl leicht an (Baseline: 14,2 g/l; nach vier Jahren: 14,8 g/l), während er in der Placebogruppe unter Mineralöl absank (Baseline: 13,9 g/l; nach vier Jahren: 11,2 g/l). Da die Erythrozytenzahl in beiden Gruppen unverändert blieb, stieg somit der MCH (mittlerer Hämoglobingehalt der Erythrozyten) unter Icosapent-Ethyl und sank unter Placebo. Es ist unklar, ob diese Blutbildveränderungen durch eine veränderte Resorption von Vitaminen und Spurenelement unter Icosapent-Ethyl und/oder Mineralöl (beispielsweise Vitamin B12 und Eisen) bedingt sind.
Bei signifikant mehr Patienten im Interventionsarm traten Vorhofflimmern und -flattern auf (5,8 % vs. 4,5 %; p = 0,008; NNH 77). Auch stationäre Behandlungen aufgrund von Vorhofflimmern und -flattern waren unter Icosapent-Ethyl signifikant gehäuft (3,1 % vs. 2,1 %; p = 0,004). Diese Beobachtung stimmt mit einer aktuellen Metaanalyse überein, die unter Einschluss von sieben Studien (n = 81.210) ein signifikant erhöhtes Risiko für Vorhofflimmern unter Omega-3-Fettsäuren fand (HR 1,25; 95 % Konfidenzintervall 1,07–1,46; p = 0,013). Dabei waren höhere Dosierungen von Omega-3-Fettsäuren (> 1 g/d) mit einer stärkeren Risikoerhöhung assoziiert als niedrigere Dosen (HR 1,49 vs. 1,12; p für Interaktion < 0,001) (7). Ursächlich für das vermehrte Auftreten von Vorhofflimmern und -flattern könnte die Beeinflussung verschiedener kardialer Ionenkanäle durch Icosapent-Ethyl sein; es ist jedoch unklar, ob die zirkulierenden EPA-Konzentrationen für eine relevante Hemmung der Ionenkanäle ausreichen, da EPA in hohem Maße an Plasmaproteine gebunden ist.
Ausgewählte Warnhinweise/Kontraindikationen/Interaktionen
- Allergische Reaktionen waren unter Icosapent-Ethyl numerisch häufiger als unter Placebo (2,4 % vs. 1,7 %). Patienten mit bekannten Allergien gegen Fisch und/oder Schalentiere waren von der Studienteilnahme ausgeschlossen. Bei Patienten mit Überempfindlichkeit gegen Fisch und/oder Schalentiere sollte die Indikation von Icosapent-Ethyl besonders sorgfältig geprüft werden und eine entsprechende Aufklärung des Patienten erfolgen.
- Das Risiko für Vorhofflimmern oder -flattern ist unter Icosapent-Ethyl insbesondere für Patienten erhöht, bei denen bereits in der Vorgeschichte Episoden von Vorhofflimmern oder -flattern auftraten. Die Patienten sollten hinsichtlich klinischer Anzeichen für Vorhofflimmern oder -flattern überprüft werden (z. B. Palpitationen, Schwindelgefühl, unregelmäßiger Puls) und bei klinischem Verdacht ein EKG (Elektrokardiogramm) erhalten.
- Eine begleitende Therapie mit Antikoagulanzien oder Thrombozytenaggregationshemmern erhöht zusätzlich das Blutungsrisiko unter Icosapent-Ethyl. Bei diesen Patienten wird eine besonders sorgfältige Nutzen-Risiko-Abwägung von Icosapent-Ethyl empfohlen.
- Unter Icosapent-Ethyl traten numerisch mehr Transaminasen-Erhöhungen auf als unter Placebo (35 % vs. 31 % innerhalb von vier Jahren). Bei etwa 6 % der Patienten bestanden zu Studienbeginn anamnestisch oder laborchemisch Hinweise auf eine Lebererkrankung. Die Häufigkeit von unerwünschten Ereignissen (UE) unterschied sich bei diesen Patienten nicht von der übrigen Studienpopulation. Daten zur Schwere der Lebererkrankung bei den eingeschlossenen Patienten liegen nicht vor. Bei Patienten mit Leberfunktionsstörungen wird unter Icosapent-Ethyl eine regelmäßige Verlaufskontrolle der Transaminasen empfohlen.

Weiterführende Informationen
Nach der frühen Nutzenbewertung durch das IQWiG entscheidet der G-BA über den Zusatznutzen. Sollte sich die AkdÄ mit einer Stellungnahme äußern, wird diese auf der AkdÄ-Website veröffentlicht.
Quelle
Europäischer Öffentlicher Beurteilungsbericht (EPAR) Vazkepa®, erschienen am 14. April 2021. Die vorliegende Information erhebt keinen Anspruch auf Vollständigkeit. Für die Richtigkeit der angegebenen Dosierungen kann keine Gewähr übernommen werden.
Literatur
- Bhatt DL, Steg PG, Miller M et al.: Cardiovascular risk reduction with icosapent ethyl for hypertriglyceridemia. N Engl J Med 2019; 380: 11-22.
- Yokoyama M, Origasa H, Matsuzaki M et al.: Effects of eicosapentaenoic acid on major coronary events in hypercholesterolaemic patients (JELIS): a randomised open-label, blinded endpoint analysis. Lancet 2007; 369: 1090-1098.
- European Medicines Agency (EMA): Omega-3 acid ethyl esters – containing medicinal products for oral use in secondary prevention after myocardial infarction (Assessment report following the re-examination procedure): www.ema.europa.eu/en/documents/referral/omega-3-acid-ethyl-esters-assessment-report-following-re-examination-procedure_en.pdf (letzter Zugriff: 25. Oktober 2021). Amsterdam, 28. März 2019.
- Nicholls SJ, Lincoff AM, Garcia M et al.: Effect of high-dose omega-3 fatty acids vs corn oil on major adverse cardiovascular events in patients at high cardiovascular risk: the STRENGTH randomized clinical trial. JAMA 2020; 324: 2268-2280.
- Sharma G, Martin SS, Blumenthal RS: Effects of omega-3 fatty acids on major adverse cardiovascular events: what matters most: the drug, the dose, or the placebo? JAMA 2020; 324: 2262-2264.
- Budoff MJ, Bhatt DL, Kinninger A et al.: Effect of icosapent ethyl on progression of coronary atherosclerosis in patients with elevated triglycerides on statin therapy: final results of the EVAPORATE trial. Eur Heart J 2020; 41: 3925-3932.
- Gencer B, Djousse L, Al-Ramady OT et al.: Effect of long-term marine omega-3 fatty acids supplementation on the risk of atrial fibrillation in randomized controlled trials of cardiovascular outcomes: a systematic review and meta-analysis. Circulation 2021: Epub ahead of print.
Hinweise
Arzneimittel, die mit einem schwarzen Dreieck (▼) gekennzeichnet sind, unterliegen einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.
„Neue Arzneimittel“ ist eine Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu neu zugelassenen Arzneimitteln oder zu neu zugelassenen Indikationen. Ziel ist es, den Ärzten zeitnah Informationen zu diesen Arzneimitteln zur Verfügung zu stellen, zunächst bei Markteinführung sowie nach der frühen Nutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA) (§ 35a Absatz 1 SGB V). „Neue Arzneimittel“ bei Markteinführung enthält Informationen basierend auf dem Europäischen Öffentlichen Bewertungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) sowie weiteren bei Markteinführung vorliegenden Daten aus klinischen Studien. Nach Abschluss der frühen Nutzenbewertung wird der Zusatznutzen des neuen Arzneimittels und seine therapeutische Bedeutung auf der Basis der Dossierbewertung des IQWiG, der Stellungnahme der AkdÄ und des Beschlusses des G-BA im Rahmen der frühen Nutzenbewertung dargestellt („Update – Neue Arzneimittel“).
vorab online
Dieser Artikel wurde am 16. November 2021 vorab online veröffentlicht.
