Bei Risiken und Nebenwirkungen…
Ein Patient berichtet über depressive Symptome, wenige Wochen nach Beginn der Einnahme eines CSE-Hemmers. Wenige Tage nach Gabe eines neu zugelassenen Antikörpers gegen COVID kommt es zu einem akuten Nierenversagen.
Was tun Sie also in den beiden beschriebenen Fällen, wenn ein Patient über Nebenwirkungen eines Medikaments klagt oder Sie bei einem neu aufgenommenen Patienten eine Nebenwirkung eines Medikamentes als Grund für das akute Nierenversagen vermuten?
Völlig klar! Sie melden diese unerwünschte Arzneimittelwirkung (UAW) der AkdÄ (https://www.akdae.de/Arzneimittelsicherheit/UAW-Meldung/). Entweder direkt online am PC oder auch über ein ausdruckbares PDF-Formular per Fax oder per Post. Das Ausfüllen braucht nur wenige Minuten. Damit sind Sie nicht nur ihren Verpflichtungen nach der Berufsordnung für Ärzte (§ 6 (Muster-)Berufsordnung) nachgekommen1.
Viel wichtiger: Sie helfen mit Ihrer Meldung, das Wissen um unerwünschte Arzneimittelwirkungen zu mehren, unbekannte und seltene Nebenwirkungen2 zu identifizieren, die Sicherheit eines Arzneimittels zu evaluieren in besonderen Populationen wie Kindern, Schwangeren oder Älteren, die nicht in Studien eingeschlossen werden (können), sowie die Sicherheit in der Langzeitanwendung von Arzneimitteln zu gewährleisten.
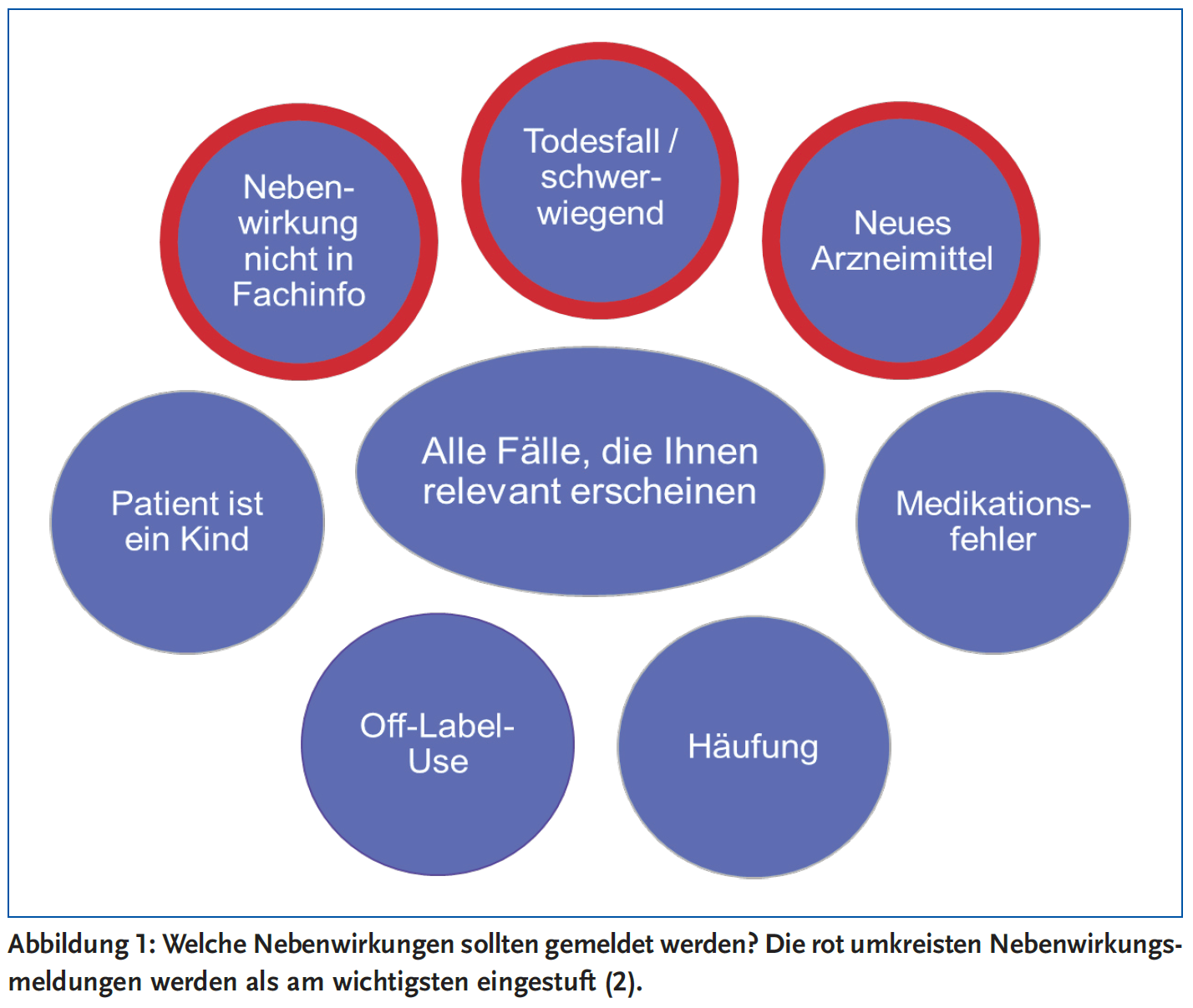
Prinzipiell sollten Sie alle aufgetretenen Nebenwirkungen melden, die Ihnen relevant erscheinen (Abbildung 1). Wichtig sind auf jeden Fall solche Nebenwirkungen, die bisher noch nicht bekannt und auch nicht in der Produktinformation aufgeführt sind. Besonderes Augenmerk sollten Sie daher auf Medikamente richten, die mit einem schwarzen Dreieck gekennzeichnet sind3. Diese stehen unter besonderer Überwachung, entweder weil das Medikament neu zugelassen ist oder Daten zur Langzeitanwendung noch nicht ausreichend bekannt sind. Insbesondere in den ersten fünf Jahren nach Zulassung eines Arzneimittels sollte auf seltene oder sehr seltene (< 0,1 %) Nebenwirkungen geachtet werden, da diese in den Zulassungsstudien wegen der begrenzten Teilnehmerzahl gar nicht erfasst werden können. Dabei spielt es zunächst erst einmal grundsätzlich keine Rolle, ob Sie persönlich glauben, dass das Arzneimittel die Nebenwirkung verursacht hat.
Bei der AkdÄ werden die Meldungen von Nebenwirkungen gesammelt und gesichtet. Danach werden sie nach internationalem Standard kodiert und anonymisiert an die zuständigen Bundesoberbehörden (Bundesinstitut für Arzneimittel und Medizinprodukte bzw. Paul-Ehrlich-Institut) sowie an die Europäische Datenbank (4) weitergeleitet. Erfolgt nur eine einzige Meldung zu einem Arzneimittel, gibt es konkurrierende Ursachen, oder kann kein plausibler Mechanismus der Entstehung gefunden werden, wird die Meldung lediglich anonymisiert weitergeleitet. Wenn aber mehrere Ärzte eine bisher unbekannte Nebenwirkung melden, vielleicht auch noch konkurrierende Ursachen wenig wahrscheinlich und sogar noch ein plausibler Mechanismus möglich scheint, wird die Sache weiterverfolgt und z. B. zur Begutachtung Fachmitgliedern der AkdÄ vorgelegt und in Ausschüssen mit den Bundesoberbehörden diskutiert. Daraus entstehen Publikationen zur Information der Ärzteschaft oder in einigen Fällen lösen Ihre Meldungen Risikobewertungsverfahren aus, die dazu beitragen, die Nebenwirkung in die Fachinformation aufzunehmen. Aktuelles über neue Risikoinformationen zu Arzneimitteln (z. B. Risikobekanntgaben, Rote-Hand-Briefe, neu in die Fachinformation aufgenommene Nebenwirkungen) können Sie z. B. über den Newsletter der AkdÄ „Drug Safety Mail“ (https://www.akdae.de/Arzneimittelsicherheit/DSM/) erhalten4.
Auch hier in AVP finden Sie Berichte über Nebenwirkungen von Arzneimitteln. Damit möchten wir einerseits auf bekannte, aber häufig übersehene Nebenwirkungen aufmerksam machen oder über neue, unbekannte Nebenwirkungen informieren und zudem Sie dazu sensibilisieren und motivieren, Nebenwirkungen zu melden. Wir sind uns aber durchaus auch der Beschränkungen eines solchen Spontanerfassungssystems bewusst: Häufigkeiten von Nebenwirkungen können damit nicht abgeschätzt werden. Dazu bedarf es gesonderter Studien, die aufgelegt werden, wenn die Risikosignale stark genug sind.
Die Meldung von Nebenwirkungen ist nicht nur eine ärztliche Pflicht nach der Berufsordnung, sondern trägt wesentlich zum Erkenntnisgewinn über neue Arzneimittel bei und hilft bei der Risiko-Nutzen-Abschätzung der neuen aber auch einiger älterer Arzneimittel. Sie selbst erhalten in jedem Fall zu der gemeldeten UAW eine Rückmeldung der AkdÄ mit einem Auszug aus unserer Datenbank mit Fallmeldungen. Jede Meldung ist ein Gewinn für uns alle. Daher melden Sie bitte!
Interessenkonflikte
Der Autor erklärt, keine Interessenkonflikte zu haben.
Fußnoten
1 (Muster-)Berufsordnung für die in Deutschland tätigen Ärztinnen und Ärzte (Stand 2021): § 6 Mitteilung von unerwünschten Arzneimittelwirkungen: Ärztinnen und Ärzte sind verpflichtet, die ihnen aus ihrer ärztlichen Behandlungstätigkeit bekanntwerdenden unerwünschten Wirkungen von Arzneimitteln der Arzneimittelkommission der deutschen Ärzteschaft und bei Medizinprodukten auftretende Vorkommnisse der zuständigen Behörde mitzuteilen (1).
2 Nebenwirkungen (häufig auch unerwünschte Arzneimittelwirkungen (UAW) genannt) sind alle schädlichen und unbeabsichtigten Reaktionen auf ein Arzneimittel. Dabei ist es zunächst unerheblich, ob das Medikament bestimmungsgemäß eingenommen wurde oder eine Überdosierung ein Fehlgebrauch oder gar ein Missbrauch der Substanz eine Rolle gespielt hat (2).
3 ▼ Arzneimittel, die unter zusätzlicher Überwachung stehen, werden seit 2013 in allen EU-Mitgliedstaaten mit einem schwarzen Dreieck gekennzeichnet. Dies ist in der Regel dann der Fall, wenn zu ihnen weniger Informationen als zu anderen Arzneimitteln zur Verfügung stehen, weil sie neu auf dem Markt sind oder nur unzureichende Daten zur Langzeitanwendung vorliegen. Das auf der Spitze stehende schwarze Dreieck ist sowohl in der Gebrauchsinformation (Packungsbeilage) als auch in der Fachinformation, abgedruckt. Es ist aber nicht auf der äußeren Umhüllung oder dem Arzneimittel-Etikett abgebildet (3).
4 Welche Nebenwirkungen sollten Ärzte melden und warum? Antworten auf diese Frage und weitere Informationen zum Melden von Nebenwirkungen finden Sie in kompakter Form im Leitfaden der AkdÄ „Nebenwirkungen melden“: https://www.akdae.de/Arzneimitteltherapie/LF/UAW/.
Literatur
- https://www.bundesaerztekammer.de/recht/berufsrecht/muster-berufsordnung-aerzte/muster-berufsordnung/
- https://www.akdae.de/Arzneimitteltherapie/LF/PDF/Nebenwirkungen_melden.pdf
- https://www.bfarm.de/DE/Arzneimittel/Pharmakovigilanz/Risikoinformationen/Schwarzes-Dreieck/_node.html
- https://www.adrreports.eu/de/eudravigilance.html
