Inclisiran (Leqvio®) ▼
Zugelassene Indikation und Wirkmechanismus
Leqvio® (Inclisiran) ist seit dem 09.12.2020 zugelassen bei Erwachsenen mit primärer Hypercholesterinämie (heterozygot familiär und nicht familiär) oder gemischter Dyslipidämie bei Statinintoleranz oder unzureichender LDL-C (Low Density Lipoprotein Cholesterin) Senkung unter der maximal tolerierten Statindosis. Begleitend soll eine diätetische Therapie erfolgen. Eine Kombination mit anderen lipidsenkenden Therapien ist möglich, bei Statinintoleranz oder Kontraindikationen gegen Statine auch eine Monotherapie.
Inclisiran ist ein über RNA (Ribonukleinsäure)-Interferenz wirksamer Cholesterinsenker, der subkutan injiziert wird. Bei der RNA-Interferenz führen kurze RNA-Stücke, sogenannte small interfering RNA (siRNA), zur Spaltung komplementärer mRNA (messenger RNA). Zielstruktur von Inclisiran ist die mRNA für PCSK9 (Proprotein Convertase Subtilisin / Kexin type 9) in Hepatozyten. Inclisiran hemmt die Translation von mRNA in PCSK9 und hierdurch den PCSK9-vermittelten Abbau hepatischer LDL-C-Rezeptoren. Konsekutiv wird vermehrt LDL-C in die Leber aufgenommen und der LCL-C-Spiegel im Plasma sinkt. Die selektive Aufnahme von Inclisiran in Hepatozyten wird durch Konjugation der siRNA mit N-Acetylgalactosamin erhöht.
Markteinführung
Leqvio® (Inclisiran) ist seit Februar 2021 auf dem deutschen Markt verfügbar.
Bewertung
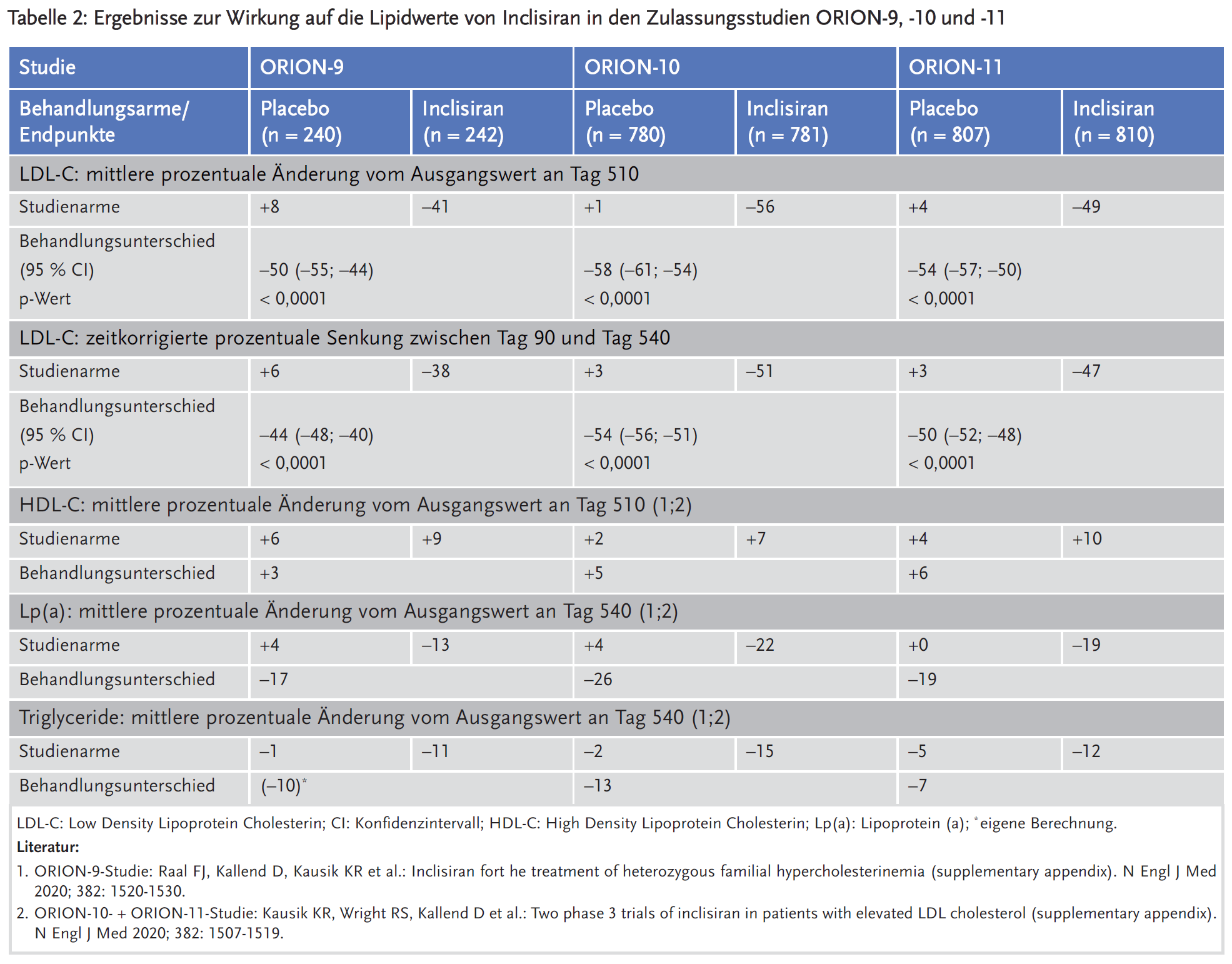
Leqvio® (Inclisiran) senkte in den Zulassungsstudien im Vergleich zu Placebo den LDL-C Wert um gut 50 %. Auch andere Lipide wie Lipoprotein (a), Triglyceride und HDL-C wurden beeinflusst. In die Zulassungsstudien waren überwiegend Patienten mit atherosklerotischer kardiovaskulärer Erkrankung (ACSVD) oder heterozygoter familiärer Hypercholesterinämie (HeFH) eingeschlossen, deren LDL-C-Zielwerte unter einer maximal verträglichen Statintherapie nicht erreicht wurden.
Als unerwünschte Wirkung traten unter Inclisiran häufig lokale Reaktionen an der Injektionsstelle auf (8,2 % unter Inclisiran vs. 1,8 % unter Placebo); sie waren jedoch selbstlimitierend und führten sehr selten zum Abbruch der Behandlung. Geringfügige Erhöhungen der Transaminasen (≤ 3 x ULN) wurden unter Inclisiran häufiger als unter Placebo beobachtet.
Inclisiran wird als einzelne subkutane Injektion zu Behandlungsbeginn, dann nach drei Monaten und anschließend alle sechs Monate verabreicht. Nach aktuellem Kenntnisstand sind keine Dosisanpassungen bei Niereninsuffizienz erforderlich. Klinisch relevante Wechselwirkungen zwischen Inclisiran und anderen Arzneimitteln sind nicht zu erwarten.
Bisher wurden keine patientenrelevanten Endpunkte wie kardiovaskuläre Morbidität oder Mortalität hinreichend untersucht. Eine explorative Analyse schwerer kardiovaskulärer Ereignisse zeigte in den Zulassungsstudien keinen Unterschied in diesen Endpunkten zwischen den Studienarmen. Studienergebnisse zu kardiovaskulären Endpunkten werden erst ab 2024 erwartet. Eine Einordnung von Inclisiran in die derzeit verfügbaren Optionen einer lipidsenkenden Therapie zur Verringerung des kardiovaskulären Risikos ist somit nicht möglich.
Wirksamkeit in den Zulassungsstudien
Sicherheit und Wirksamkeit (lediglich bezüglich der LDL-C-Senkung) wurden in drei multizentrischen, doppelblinden, randomisierten, placebokontrollierten Studien geprüft. Die Studiendauer betrug jeweils 18 Monate, insgesamt nahmen 3660 Patienten teil. Die Studie ORION-9 untersuchte Inclisiran bei Patienten mit heterozygoter familiärer Hypercholesterinämie (HeFH). Die Studien ORION-10 und ORION-11 schlossen Patienten mit atherosklerotischer kardiovaskulärer Vorerkrankung (ACVDS) und LDL-C Werten ≥ 70 mg/dl ein, die Studie ORION-11 zusätzlich auch Patienten mit hohem kardiovaskulärem Risiko und LDL-C Werten ≥ 100 mg/dl (überwiegend Patienten mit Diabetes mellitus Typ 2). Die Patienten erhielten subkutane Injektionen von 284 mg Inclisiran oder Placebo an Tag 1, Tag 90, Tag 270 und Tag 450. Zusätzlich erfolgte eine begleitende lipidsenkende Therapie mit der maximal tolerierten Statindosis, bei ca. 90 % der Patienten mit einem Statin in moderater oder hoher Dosis. Die Gabe weiterer Lipidsenker wie Ezetimib war möglich, nicht jedoch die von monoklonalen PCSK9-Antikörpern (z. B. Evolocumab). Die lipidsenkende Begleittherapie war bez. der Statine ausgeglichen, bei den weiteren Lipidsenkern zeigten sich große Unterschied zwischen den Studien (Tabelle 1).

Primäre Endpunkte der Zulassungsstudien waren die prozentuale Veränderung von LDL-C vom Ausgangswert zu Tag 510 und die zeitkorrigierte prozentuale LDL-C-Senkung zwischen Tag 90 und Tag 540. Diese zeigt die durchschnittliche LDL-C Senkung zwischen den Medikamentengaben.
In der gepoolten Analyse der Zulassungsstudien führte Inclisiran zu einer LDL-C-Senkung von 55 % an Tag 510 bzw. zeitkorrigiert zu einer LDL-C-Senkung von 50 %. Bei niedrigen LDL-C Ausgangswerten war die LDL-C-Senkung signifikant stärker ausgeprägt als bei höheren Ausgangswerten. Außerdem wurden weitere Lipidvariablen wie Lipoprotein (a) und Triglyceride gesenkt. HDL-C stieg unter Inclisiran leicht an.
Eine explorative Analyse der kardiovaskulären Ereignisse zeigte keine Unterschiede zwischen Inclisiran und Placebo. Schwere kardiovaskuläre Ereignisse (kombinierter Endpunkt aus kardiovaskulärem Tod, erfolgreicher kardiovaskulärer Wiederbelebung, nicht-tödlichem Myokardinfarkt und ischämischem oder hämorrhagischem Apoplex) traten bei 7,1 % (131/1833) der Patienten unter Inclisiran und bei 9,4 % (172/1822) der Patienten unter Placebo auf. Der Unterschied war jedoch statistisch nicht signifikant.
Ausgewählte Nebenwirkungen
In der gepoolten Analyse der beschriebenen Studien traten unerwünschte Effekte an der Injektionsstelle unter Inclisiran mit 8,2 % viermal häufiger auf als unter Placebo (1,8 %). Sie waren jedoch leicht bis mäßig ausgeprägt und klangen ohne Folgeschäden ab. 0,2 % der Patienten im Inclisiran-Arm brachen aufgrund der lokalen Reaktionen die Behandlung ab. Erhöhungen der Transaminasen bis zum Dreifachen der oberen Normgrenze wurden unter Inclisiran häufiger (ALT/AST: 19,7 %/17,2 %) als unter Placebo beobachtet (ALT/AST: 13,6 %/11,1 %). Diese hepatischen Effekte waren asymptomatisch.
Die Daten zu den Effekten von Inclisiran auf den Glukosestoffwechsel sind widersprüchlich. Unter Inclisiran waren ein Anstieg des HbA1c (Inclisiran 0,5 % vs. Placebo 0,2 %) und von Hyperglykämien (Inclisiran 1,4 % vs. Placebo 0,8 %) häufiger als unter Placebo, ein neu aufgetretener Diabetes mellitus Typ 2 wurde jedoch unter Inclisiran (0,8 %) seltener festgestellt als unter Placebo (1,2 %).
Ausgewählte Warnhinweise/Kontraindikationen/Interaktionen
- Inclisiran ist zur subkutanen Injektion in der Bauchregion bestimmt; alternative Injektionsstellen sind Oberarm oder Oberschenkel. Die Injektionen sollten nicht in Bereichen mit aktiver Hauterkrankung oder Hautschäden erfolgen.
- Inclisiran ist kein Inhibitor oder Induktor von Cytochrom-P450-Isoenzymen oder bekannten Wirkstofftransportern. Daher werden keine klinisch relevanten pharmakokinetischen Wechsel-wirkungen mit anderen Arzneimitteln erwartet. Mit der Einschränkung begrenzt verfügbarer Daten werden auch keine relevanten Wechselwirkungen mit Statinen erwartet.
- Es liegen nur begrenzte Erfahrungen mit Inclisiran bei Patienten mit schwerer Nierenfunktionsstörung (GFR < 30 ml/min) vor. Eine pharmakokinetische Analyse zeigte bei Patienten mit Nierenfunktionsstörungen eine kurzfristig erhöhte Plasmaexposition von Inclisiran, jedoch eine vergleichbare LDL-C-Senkung wie bei Patienten mit normaler Nierenfunktion. Nach aktuellem Kenntnisstand ist bei Patienten mit Nierenfunktionsstörung keine Dosisanpassung erforderlich.
- In den vorliegenden Untersuchungen wurde die Pharmakodynamik von Inclisiran nicht durch das Patientenalter beeinflusst. Bei älteren Patienten ist deshalb keine Dosisanpassung erforderlich.
- Bei Patienten mit geringer bis mäßiger (Child-Pugh-Klasse A und B) Leberfunktionsstörung ist keine Dosisanpassung notwendig. Für Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Klasse C) liegen keine Daten vor.

Weiterführende Informationen
Das IQWiG wurde am 01.02.2021 mit der Bewertung des Zusatznutzens beauftragt, über den der G-BA entscheiden wird. Sollte sich die AkdÄ mit einer Stellungnahme äußern, wird diese auf der AkdÄ-Website veröffentlicht.
Quelle
Europäischer Öffentlicher Beurteilungsbericht (EPAR) Leqvio®, erschienen am 6. Januar 2021. Die vorliegende Information erhebt keinen Anspruch auf Vollständigkeit. Für die Richtigkeit der angegebenen Dosierungen kann keine Gewähr übernommen werden.
Hinweise
Arzneimittel, die mit einem schwarzen Dreieck (▼) gekennzeichnet sind, unterliegen einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.
„Neue Arzneimittel“ ist eine Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu neu zugelassenen Arzneimitteln oder zu neu zugelassenen Indikationen. Ziel ist es, den Ärzten zeitnah Informationen zu diesen Arzneimitteln zur Verfügung zu stellen, zunächst bei Markteinführung sowie nach der frühen Nutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA) (§ 35a Absatz 1 SGB V). „Neue Arzneimittel“ bei Markteinführung enthält Informationen basierend auf dem Europäischen Öffentlichen Bewertungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) sowie weiteren bei Markteinführung vorliegenden Daten aus klinischen Studien. Nach Abschluss der frühen Nutzenbewertung wird der Zusatznutzen des neuen Arzneimittels und seine therapeutische Bedeutung auf der Basis der Dossierbewertung des IQWiG, der Stellungnahme der AkdÄ und des Beschlusses des G-BA im Rahmen der frühen Nutzenbewertung dargestellt („Update – Neue Arzneimittel“).
