Omalizumab (Xolair®)
Neue Indikation: chronische Rhinosinusitis mit Nasenpolypen
Zugelassene Indikation und Wirkmechanismus
Omalizumab (Xolair®) ist seit 2005 zur Behandlung von allergischem, IgE-vermittelten Asthma sowie seit 2013 als Zusatztherapie für die Behandlung der chronischen spontanen Urtikaria bei Erwachsenen und Jugendlichen (ab 12 Jahren) mit unzureichendem Ansprechen auf eine Behandlung mit H1-Antihistaminika zugelassen. Im August 2020 wurde Omalizumab auch zugelassen zusätzlich zu intranasalen Kortikosteroiden (INCS) bei erwachsenen Patienten mit chronischer Rhinosinusitis mit Nasenpolypen (CRSwNP), bei denen durch eine Therapie mit INCS keine ausreichende Krankheitskontrolle erzielt wird.
Omalizumab ist ein humanisierter monoklonaler Antikörper, der durch rekombinante DNA-Technologie aus chinesischen Hamsterovarzellen (CHO) hergestellt wird. Omalizumab blockiert selektiv humanes Immunglobulin (Ig) E und verhindert damit dessen Bindung an den IgE-Rezeptor auf Basophilen und Mastzellen. Zudem reduziert Omalizumab Aktivität und Anzahl der IgE-Rezeptoren auf der Oberfläche der Basophilen, sodass weniger freies IgE gebunden werden kann. Dadurch wird die Freisetzung von Entzündungsmediatoren wie Histamin und Leukotrienen aus den Mastzellen und die IgE-vermittelte Entzündung gehemmt.
Markteinführung
Xolair® (Omalizumab) ist seit November 2005 auf dem deutschen Markt verfügbar.
Bewertung
Unter Omalizumab (Xolair®) als Add-on-Behandlung zu intranasalen Kortikosteroiden (INCS) zeigten sich in den Zulassungsstudien bei erwachsenen Patienten mit chronischer Rhinosinusitis mit Nasenpolypen (CRSwNP) und keiner ausreichenden Krankheitskontrolle durch INCS statistisch signifikante Effekte im Vergleich zu Placebo bezüglich der Nasenpolypen (Nasenpolypenscore) und der nasalen Kongestion nach 24 Wochen. Auch in den sekundären Endpunkten – Veränderungen der Lebensqualität und Symptomatik (TNSS, SNOT-22 und UPSIT) – waren die Vorteile für Omalizumab statistisch signifikant. Der Anteil der Patienten, die eine Notfallbehandlung mit systemischen Kortikosteroiden für ≥ 3 Tage bzw. nasaler Polypektomie benötigten, war in der gepoolten Analyse unter Omalizumab numerisch aber nicht statistisch signifikant niedriger als unter Placebo: 2,3 % vs. 6,2 %; OR 0,38 (95 % CI 0,10–1,49); p = 0,1639.
Das Sicherheitsprofil von Omalizumab bei CRSwNP entsprach in den Zulassungsstudien dem in früheren Studien bei mittelschwerem bis schwerem allergischen Asthma und chronischer idiopathischer Urtikaria. Omalizumab erscheint mit häufigen Nebenwirkungen wie Kopfschmerzen, Reaktionen an der Injektionsstelle, Schmerzen im Oberbauch und Arthralgie vorteilhafter im Vergleich zu systemischer Kortikosteroid-Therapie.
Ob Omalizumab einen Vorteil gegenüber anderen Therapiealternativen wie z. B. Dupilumab bietet, das als Add-on-Therapie zu INCS zur Behandlung von Erwachsenen mit schwerer CRSwNP zugelassen ist, die mit systemischen Kortikoiden und/oder chirurgischem Eingriff nicht ausreichend kontrolliert werden kann, ist derzeit unklar.
Omalizumab kann daher bei Patienten mit CRSwNP, die auf eine lokale Therapie mit INCS nicht mit einer Besserung der subjektiven Beschwerden (insbesondere behinderte Nasenatmung, aber beispielsweise auch Riechminderung) reagieren, eingesetzt werden. Ebenso können Patienten nach einer operativen Therapie der erkrankten Nasenhaupt- und -nebenhöhlen bei zuvor auf konservative Behandlung (Kochsalzspülungen, INCS) nicht gebesserter Symptomatik, insbesondere Erkrankte mit einem rezidivierenden Krankheitsverlauf und entsprechender klinischer Symptomatik, damit behandelt werden. Omalizumab sollte aber nur Anwendung finden, wenn eine lokale Therapie mit INCS erfolglos (in Bezug auf nasale Symptomatik und Verhalten der Nasenpolypen) geblieben ist. Das Versagen einer intensiven Primärtherapie, der Zustand nach mindestens einer erfolglosen Nasennebenhöhlen‐Operation, der Riechverlust, der Verlust an Lebensqualität und gegebenenfalls auch der erfolglose Versuch einer intensivierten Therapie (Kombination von oralen und topischen Steroiden sowie oralen Antibiotika über vier Wochen) sollte entsprechend in den Behandlungsunterlagen dokumentiert werden.
Wirksamkeit in den Zulassungsstudien
Die Sicherheit und Wirksamkeit von Xolair® wurden in zwei multizentrischen, doppelblinden, randomisierten, placebokontrollierten Studien an Patienten mit CRSwNP und unzureichendem Ansprechen auf INCS untersucht (POLYP 1 und POLYP 2). Die Patienten mussten seit mindestens vier Wochen vor Screening eine intranasale Behandlung mit Mometason (200 µg 1–2 x täglich) erhalten haben, die sie während der gesamten Studie fortführten. Ein vorheriger chirurgischer Eingriff an der Nasenhöhle oder den Nasennebenhöhlen oder die vorherige Behandlung mit systemischen Kortikosteroiden war kein Einschlusskriterium. Beide Studien bestanden aus einer fünfwöchigen Screening/Run-in-Phase, 24-wöchiger Behandlungsphase und vierwöchiger Nachbeobachtung. Die Patienten erhielten Omalizumab oder Placebo subkutan alle zwei oder vier Wochen, Dosierung und Häufigkeit der Gabe richteten nach dem IgE-Basiswert und dem Körpergewicht des Patienten. 87 % der Patienten in den Placebo-Armen und 90 % der Patienten in den Omalizumab-Armen bekamen ihre Injektion alle vier Wochen.
Die co-primären Endpunkte der Studien waren der bilaterale Nasenpolypenscore (NPS) und der durchschnittliche tägliche Score für nasale Kongestion (NCS) in Woche 24. Als sekundäre Endpunkte wurden unter anderem erhoben die patientenberichteten Scores TNSS, SNOT-22 und UPSIT sowie die Notwendigkeit einer Notfallbehandlung mit systemischen Kortikosteroiden für ≥ 3 Tage bzw. nasaler Polypektomie. Die Ergebnisse sind in Tabelle 1 zusammengefasst.
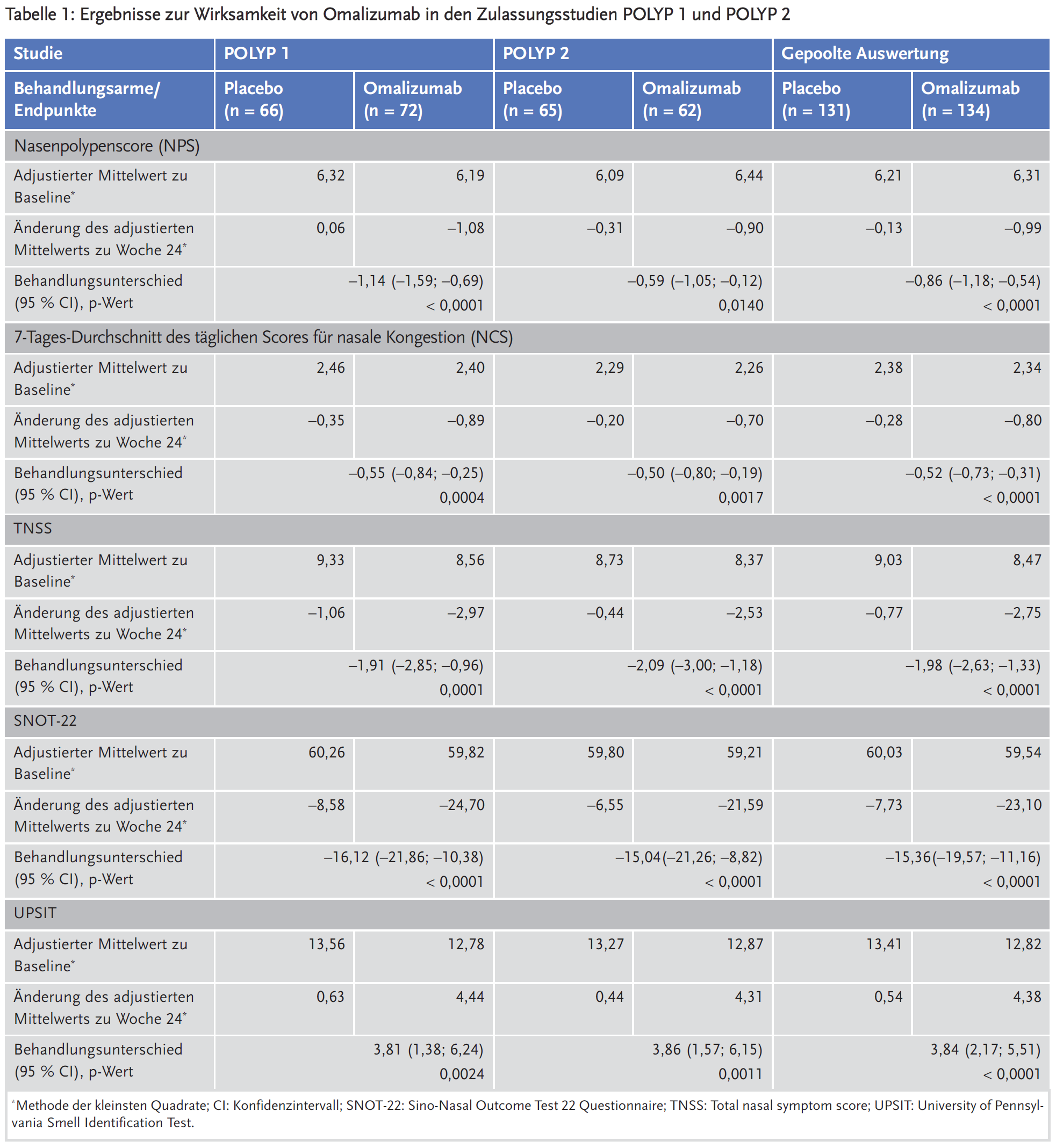
In beiden Zulassungsstudien zeigten sich statistisch signifikante Effekte zugunsten von Omalizumab im Vergleich zu Placebo bezüglich des Nasenpolypenscores (NPS) und des Scores für nasale Kongestion (NCS). Auch in den sekundären Endpunkten – Veränderungen bei TNSS, SNOT-22 und UPSIT in Woche 24 – waren die Vorteile für Omalizumab statistisch signifikant. SNOT-22 ist ein lebensqualitätsbezogener Score, für den ein minimaler klinisch relevanter Unterschied (MCID) von 8,9 Punkten validiert wurde. Für die anderen Scores, einschließlich NPS und NCS, gibt es derzeit keine etablierten MCID. Der Anteil der Patienten, die eine Notfallbehandlung benötigten, war in der gepoolten Analyse unter Omalizumab numerisch niedriger als unter Placebo, erreichte aber keine statistische Signifikanz: 2,3 % vs. 6,2 %; OR 0,38 (95 % CI 0,10–1,49); p = 0,1639.
Ausgewählte Nebenwirkungen
Häufige Nebenwirkungen unter Omalizumab sind Kopfschmerzen, Reaktionen an der Injektionsstelle wie Schwellung, Erythem, Schmerzen, Pruritus, Schmerzen im Oberbauch und Arthralgie. Gelegentlich treten auf Pharyngitis, Schläfrigkeit, Schwindel, Parästhesie, Orthostasesyndrom, allergischer Bronchospasmus, Husten, Diarrhoe, Übelkeit, Ausschlag und Juckreiz.
Ausgewählte Warnhinweise/Kontraindikationen/Interaktionen
- In der Fachinformation von Xolair® sind die Umrechnung der Dosierung auf die Anzahl der Durchstechflaschen, die Anzahl der Injektionen und die Gesamtinjektionsmenge pro Verabreichung sowie die Dosisbestimmung tabellarisch dargestellt.
- Die Notwendigkeit einer fortlaufenden Therapie sollte regelmäßig basierend auf dem Schweregrad der Erkrankung und dem Grad der Symptomkontrolle neu bewertet werden.
- Die Dosisfestsetzung nach Unterbrechungen der Behandlung um weniger als ein Jahr muss anhand der Serum-IgE-Spiegel erfolgen, die bei der ursprünglichen Dosisfestsetzung ermittelt wurden. Die Gesamt-Serum-IgE-Spiegel sollten für die Dosisfestsetzung erneut bestimmt werden, wenn die Behandlung für ein Jahr oder länger unterbrochen wurde.
- Bei erheblichen Veränderungen des Körpergewichts sollte die Dosis angepasst werden.
- Es liegen begrenzte Daten zur Anwendung von Xolair bei Patienten über 65 Jahren vor; es wird angenommen, dass eine Dosisanpassung nicht erforderlich ist.
- Der Einfluss einer eingeschränkten Nieren- oder Leberfunktion auf die Pharmakokinetik von Omalizumab wurde nicht untersucht. Da bei klinischen Dosen die Clearance durch das retikuloendotheliale System überwiegt, ist eine Beeinflussung durch eine eingeschränkte Nieren- oder Leberfunktion unwahrscheinlich. Die Anwendung muss hierbei mit Vorsicht erfolgen.
- Omalizumab darf nicht intravenös oder intramuskulär angewendet werden. Dosen von mehr als 150 mg sollten auf zwei oder mehr Injektionsstellen verteilt werden.
- Es gibt nur begrenzt Erfahrungen mit der Selbstverabreichung Omalizumab. Daher ist die Verabreichung nur durch medizinisches Fachpersonal vorgesehen. Patienten ohne bekannte Anaphylaxie in der Anamnese können sich Omalizumab ab der vierten Anwendung selbst applizieren oder von einer Betreuungsperson injizieren lassen, wenn der Arzt dies für angemessen hält. Der Patient oder die Betreuungsperson müssen in der Applikation und den möglichen frühen Anzeichen von Nebenwirkungen und allergischen Reaktionen geschult sein.
- Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung des Arzneimittels und die Chargenbezeichnung von Omalizumab eindeutig dokumentiert werden und im Fall von Nebenwirkungen angegeben werden.
- Xolair® muss im Kühlschrank bei 2–8°C aufbewahrt werden.
- Nach der Rekonstitution sollte die Lösung schnellst möglich verbraucht werden, wobei das Arzneimittel 15–20 Minuten benötigen kann, um sich komplett aufzulösen. Falls es nicht unmittelbar verbraucht wird, liegen die Aufbewahrungsdauer und -bedingungen in der Verantwortung des Anwenders und sollten normalerweise nicht länger als 8 Stunden bei 2–8°C oder 2 Stunden bei 25°C betragen.

Weiterführende Informationen
Das IQWiG wurde noch nicht mit der Bewertung des Zusatznutzens beauftragt, über den der G-BA entscheiden wird. Sollte sich die AkdÄ mit einer Stellungnahme äußern, wird diese auf der AkdÄ-Website veröffentlicht.
Quelle
Europäischer Öffentlicher Beurteilungsbericht (EPAR) Xolair®, erschienen am 24. August 2020. Die vorliegende Information erhebt keinen Anspruch auf Vollständigkeit. Für die Richtigkeit der angegebenen Dosierungen kann keine Gewähr übernommen werden.
„Neue Arzneimittel“ ist eine Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu neu zugelassenen Arzneimitteln oder zu neu zugelassenen Indikationen. Ziel ist es, den Ärzten zeitnah Informationen zu diesen Arzneimitteln zur Verfügung zu stellen, zunächst bei Markteinführung sowie nach der frühen Nutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA) (§ 35a Absatz 1 SGB V). „Neue Arzneimittel“ bei Markteinführung enthält Informationen basierend auf dem Europäischen Öffentlichen Bewertungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) sowie weiteren bei Markteinführung vorliegenden Daten aus klinischen Studien. Nach Abschluss der frühen Nutzenbewertung wird der Zusatznutzen des neuen Arzneimittels und seine therapeutische Bedeutung auf der Basis der Dossierbewertung des IQWiG, der Stellungnahme der AkdÄ und des Beschlusses des G-BA im Rahmen der frühen Nutzenbewertung dargestellt („Update – Neue Arzneimittel“).
vorab online
Dieser Artikel wurde am 9. Oktober 2020 vorab online veröffentlicht.
