Niederländische Empfehlungen zur sicheren Anwendung von Arzneimitteln bei Leberzirrhose
Das Vorliegen einer Leberzirrhose bei einem Patienten kann den Stoffwechsel und die Dosis-Wirkungsbeziehung von verabreichten Arzneimitteln verändern und das Risiko von Nebenwirkungen erhöhen. Eine niederländische Arbeitsgruppe hat evidenzbasierte Empfehlungen für den Einsatz und die Dosierung zahlreicher praxisrelevanter Arzneimittel bei Leberzirrhose erarbeitet, die im folgenden Beitrag zusammengefasst dargestellt werden.
Ursachen und Häufigkeit der Leberzirrhose
In den westlichen Industrienationen sind die häufigsten Ursachen für eine Leberzirrhose Alkoholabusus, chronische Virushepatitiden B und C sowie nichtalkoholische Fettlebererkrankungen (NAFLD). Seltenere Ursachen sind u. a. Autoimmunhepatitiden, primäre biliäre Cholangitis (PBC), primär sklerosierende Cholangitis (PSC), medikamentös-toxische Lebererkrankungen (z. B. Amiodaron, Methotrexat), Stoffwechselkrankheiten (Hämochromatose, M. Wilson, Alpha1-Antitrypsinmangel), chronische Stauungsleber und Budd-Chiari-Syndrom. Für Deutschland wird die Prävalenz der Leberzirrhose altersstandardisiert auf etwa 900/100.000 geschätzt (1).
Leberzirrhose:
Veränderte Pharmakodynamik und -kinetik bestimmter Arzneimittel
In Abhängigkeit von der verbliebenen Leberfunktion kann bei einer Leberzirrhose der Stoffwechsel einiger Arzneimittel verändert sein. Daher muss gegebenenfalls die Dosis angepasst werden oder bestimmte Arzneimittel sollten ganz vermieden werden. Ursächlich für die Veränderungen der Pharmakodynamik und -kinetik ist vor allem ein verminderter hepatischer First-Pass-Effekt durch den veränderten Blutfluss durch die Leber sowie eine verminderte Aktivität von Arzneimittel metabolisierenden Enzymen, z. B. durch deren quantitative Abnahme (2). Weitere Faktoren für einen veränderten Arzneistoffwechsel sind z. B. eine Hypalbuminämie, die zu einer geringeren Proteinbindung und höheren Serumspiegeln von Arzneimitteln führen kann oder das Vorliegen von Aszites, das zu einem höheren Verteilungsvolumen führt. Die Aufnahme von Arzneimitteln kann durch eine portale Hypertension verändert sein. Darüber hinaus kann eine gestörte biliäre als auch renale Ausscheidung von Arzneimitteln bzw. deren Metaboliten zu erhöhten Serumspiegeln von Arzneimitteln führen. Medikamente mit einer extrarenalen Dosisfraktion (Q0-Wert) > 0,5 werden hauptsächlich über die Leber ausgeschieden. Patienten mit einer Leberzirrhose können eine eingeschränkte hepatische Elimination dieser Medikamente haben, die von der Schwere der Leberzirrhose abhängig ist.
Für Patienten mit Leberzirrhose geht die Verordnung bestimmter Arzneimittel mit besonderen Risiken einher, vor allem wenn spezifische Dosisempfehlungen nicht beachtet werden (3): Die Nierenfunktion kann sich verschlechtern, es können gastrointestinale Blutungen auftreten oder eine hepatische Enzephalopathie kann induziert oder verschlechtert werden. Demgegenüber ist das Risiko für eine arzneimittelbedingte idiosynkratische Hepatotoxizität bei einem Patienten mit Leberzirrhose nicht höher als bei einem Patienten mit gesunder Leber. Jedoch können die Folgen einer solchen zusätzlichen Leberschädigung für einen Patienten mit Leberzirrhose schwerwiegender sein.
Niederländische Empfehlungen
Eine niederländische Arbeitsgruppe hat über 200 Arzneimittel hinsichtlich einer sicheren Anwendung bei Leberzirrhose evaluiert (4). Ausgewählt wurden Arzneimittel, die häufig zur Behandlung von Komplikationen bei Leberzirrhose eingesetzt oder generell breit angewendet werden. Anhand einer umfassenden Literaturrecherche wurden die Arzneimittel durch ein Expertengremium verschiedenen Sicherheitskategorien zugeordnet (siehe Tabelle 1) und gegebenenfalls Dosierungsempfehlungen in Abhängigkeit von dem Grad der Leberfunktionseinschränkung erarbeitet (5). Diese Empfehlungen wurden in den Niederlanden in die dort relevanten Verordnungssoftware-Systeme (Clinical decision support systems) integriert. Außerdem werden die Empfehlungen online zur Verfügung gestellt, allerdings nur in niederländischer Sprache: https://www.geneesmiddelenbijlevercirrose.nl. Empfehlungen für einige kürzlich bewertete Arzneimittel (wie z. B. Benzodiazepine, SSRI oder typische Antipsychotika) lassen sich auch in englischer Sprache abrufen: https://www.drugsinlivercirrhosis.org/healthcare-professionals/.
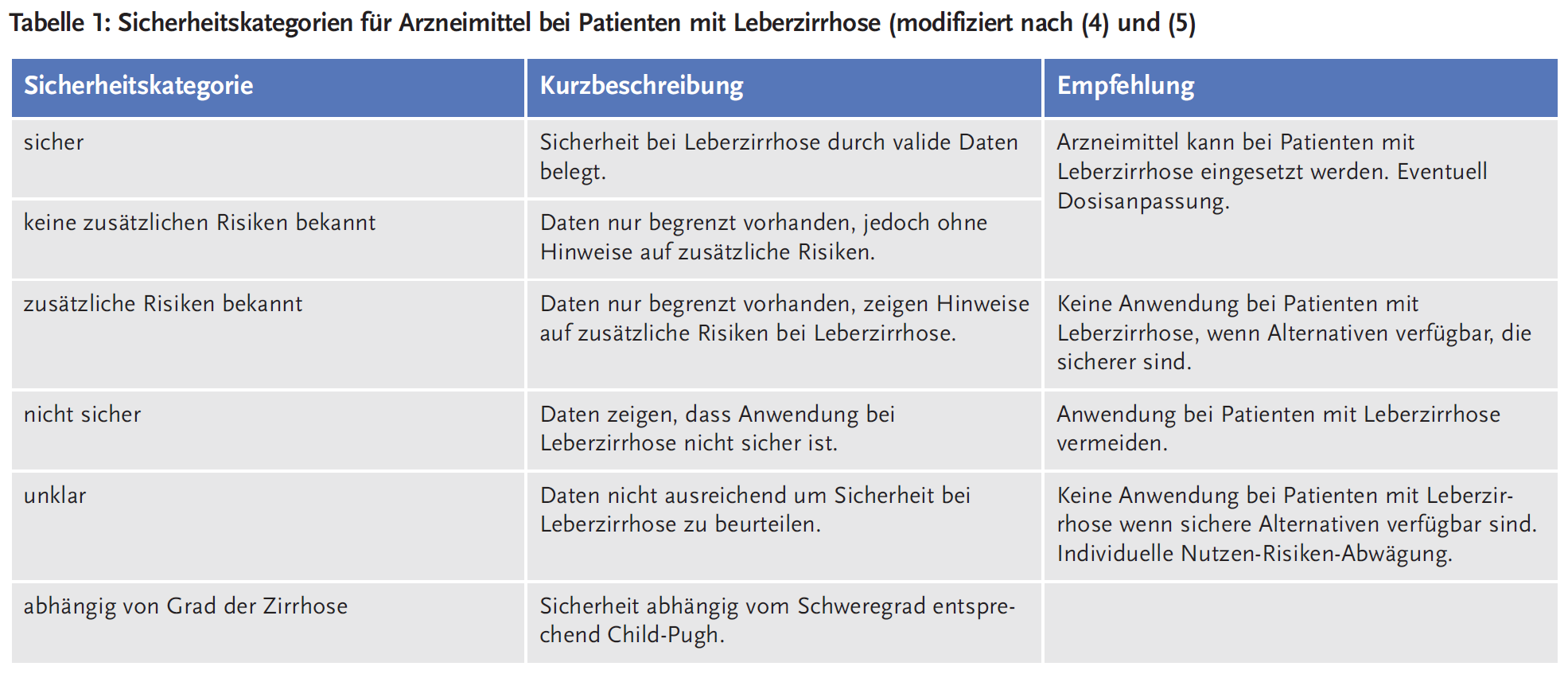
Für 209 Arzneimittel wurden 218 Empfehlungen formuliert (bei 9 Arzneimitteln wurden jeweils 2 Empfehlungen für verschiedene Applikationswege oder Indikationen erarbeitet). In 29 von 218 Empfehlungen (13 %) wurden die Arzneimittel als „sicher“ für die Anwendung bei Leberzirrhose eingestuft und 60 (28 %) wurden der Kategorie „keine zusätzlichen Risiken bekannt“ zugeordnet. Arzneimittel in diesen beiden Kategorien können bei Leberzirrhose eingesetzt werden, es können jedoch Dosisanpassungen notwendig sein und auf Nebenwirkungen sollte geachtet werden. Für drei Arzneimittel (Methadon, Heparin und Azathioprin) wurden zusätzliche Risiken bei Leberzirrhose festgestellt, wie ein hepatopulmonales Syndrom oder eine Verlängerung der QT-Zeit (Methadon), ein höheres Risiko für hämatologische Nebenwirkungen (Azathioprin) oder ein höheres Blutungsrisiko (Heparin). 30 Arzneimittel (14 %) wurden generell als „unsicher“ für Patienten mit Leberzirrhose eingestuft. Hauptgrund für die Einstufung als „unsicher“ waren erhebliche Veränderungen bei der Pharmakodynamik. Ein Beispiel hierfür sind NSAR, die bei Patienten mit Leberzirrhose mit einem höheren Risiko für Nierenschäden einhergehen als bei gesunden Patienten. Bei 57 Arzneimitteln (26 %) war die Sicherheit abhängig vom Grad der Leberzirrhose. Für 39 Arzneimittel (18 %) wurde die Datenlage als unzureichend eingestuft. Bei 67 Arzneimitteln (31 %) ist eine Anpassung der Dosierung erforderlich.
Tabelle 2 gibt eine Übersicht, in welche Kategorien einzelne Arzneimittel für verschiedene Indikationsgebiete eingeordnet wurden und bei welchen dieser Arzneimittel besondere Empfehlungen gelten hinsichtlich Schweregrad der Leberzirrhose und Dosisanpassung. Aus Platzgründen konnten in dieser Tabelle nur ausgewählte Substanzen aufgenommen werden, für eine Gesamtübersicht aller evaluierten Arzneimittel siehe (4). Tabelle 3 enthält Kommentare der Autoren dieses Artikels zu einzelnen Wirkstoffen bzw. Wirkstoffgruppen.
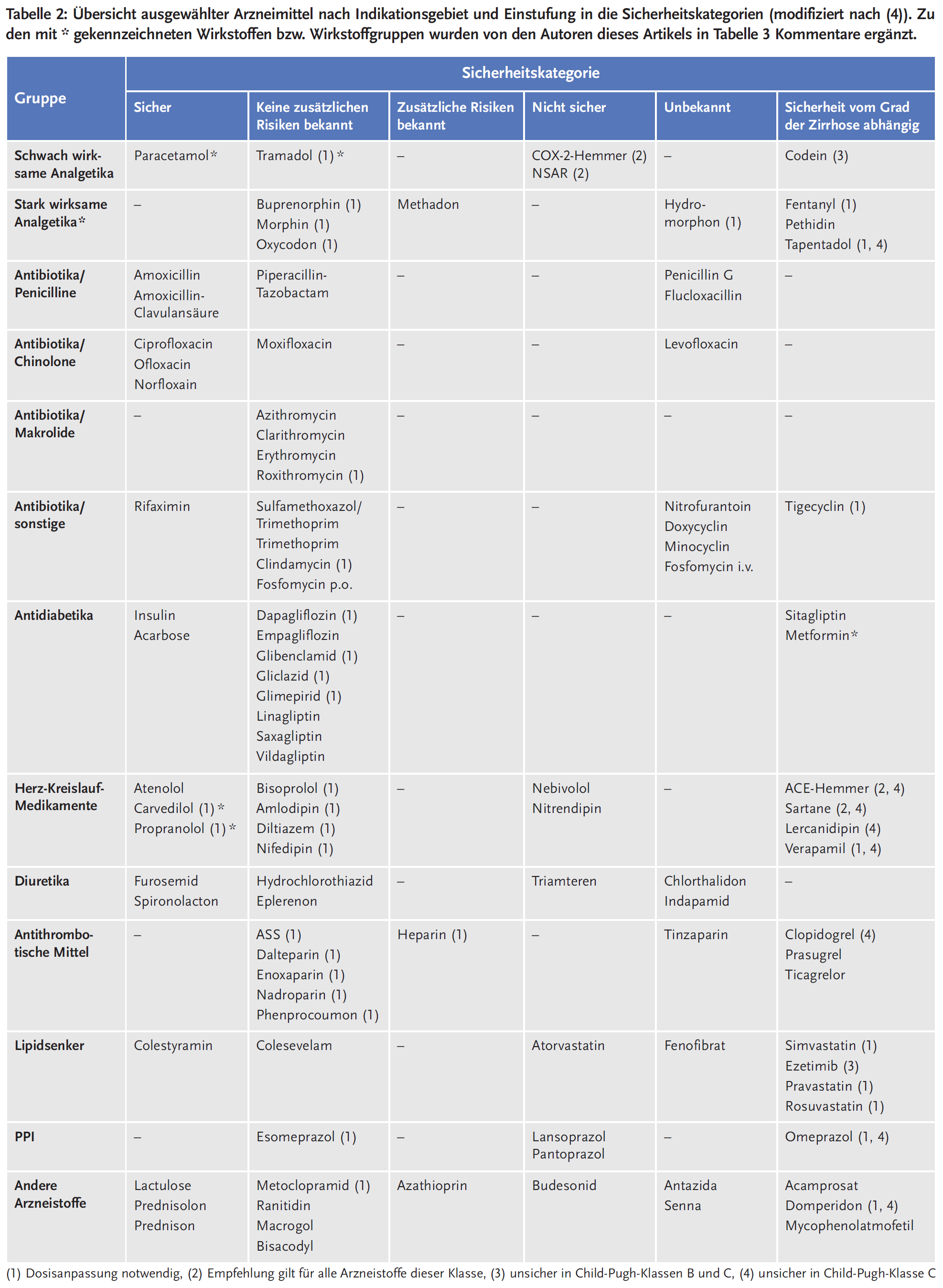

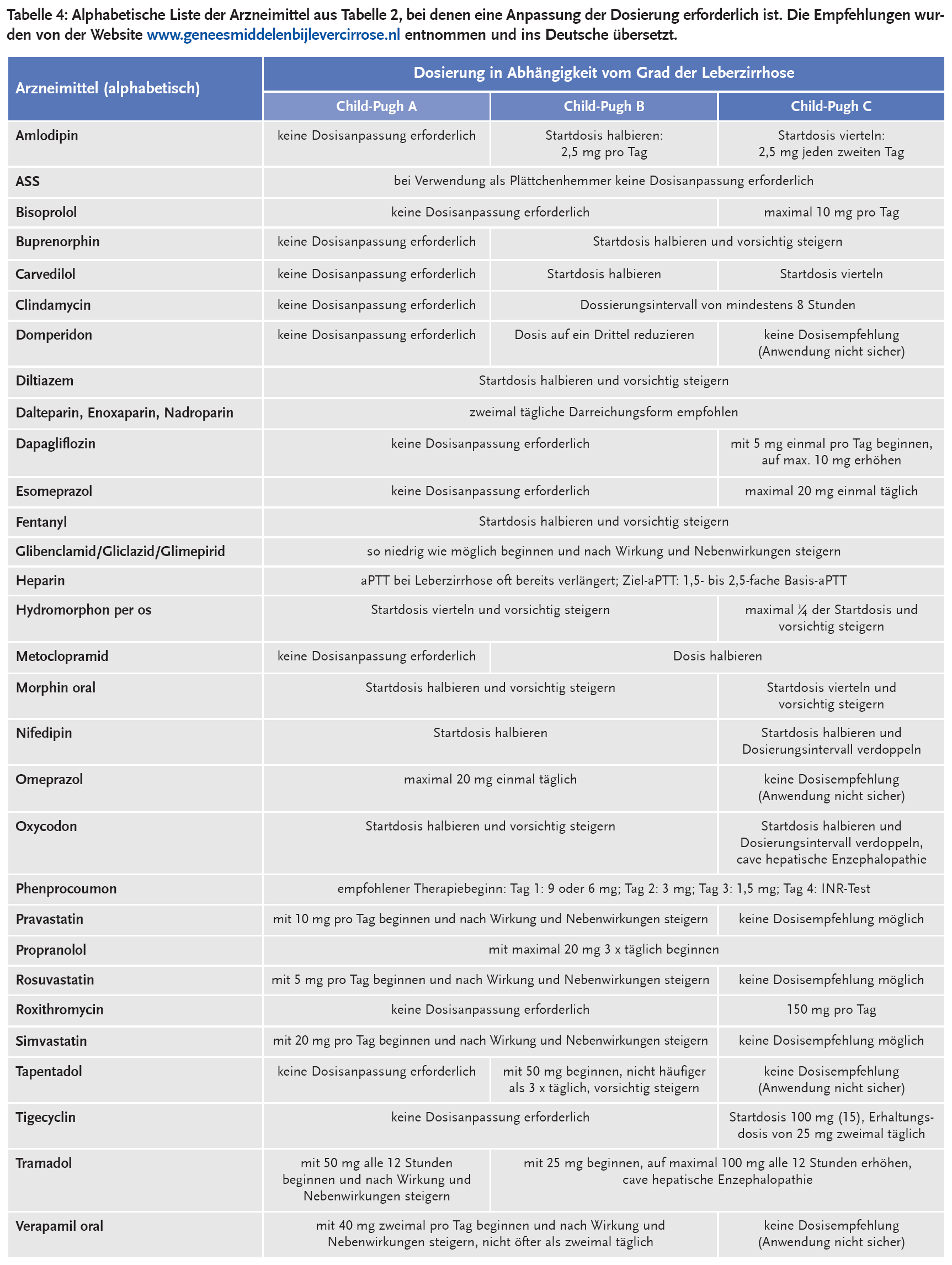
In Tabelle 4 sind die Dosisanpassungen für die entsprechenden Arzneimittel (alphabetisch geordnet) im Einzelnen beschrieben. Die Angaben in dieser Tabelle wurden von der o. g. Website entnommen und ins Deutsche übersetzt.
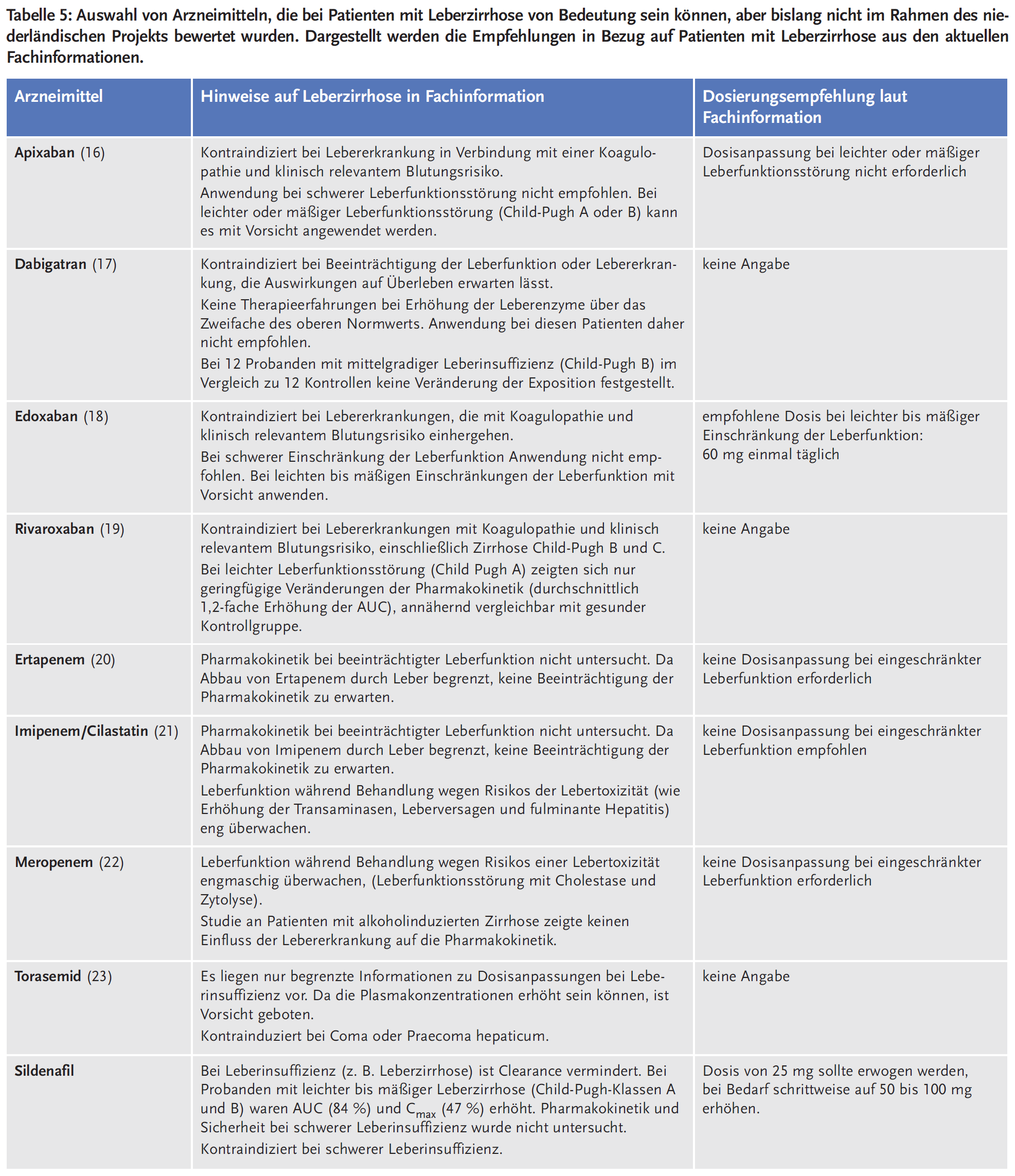
In Tabelle 5 sind einige Arzneimittel aufgeführt, die nach unserer Erfahrung bei Patienten mit Leberzirrhose in Deutschland von Bedeutung sein können, aber bislang nicht im Rahmen des niederländischen Projekts bewertet wurden. Dargestellt werden hier die Empfehlungen aus den aktuellen Fachinformationen in Bezug auf Patienten mit Leberzirrhose.
Hinsichtlich des für die Klassifizierung der Leberfunktion verwendeten Child-Pugh-Scores ist anzumerken, dass die Bestimmung der vielfältigen Leberfunktionen – anders als bei den Nieren – schwierig ist. In den Child-Pugh-Score gehen neben Laborwerten (Albumin, Bilirubin, INR) mit der Aszitesmenge und dem Enzephalopathie-Grad zwei Parameter ein, die subjektiv unterschiedlich bewertet werden können. Für die Evaluation zur Transplantation wird daher der objektivere MELD- bzw. MELD-Natrium-Score verwendet (Model of End Stage Liver Disease: Kreatinin, Bilirubin, INR und Natrium).
Fazit für die Praxis
Die Empfehlungen der niederländischen Arbeitsgruppe geben wertvolle und praxisrelevante Hinweise für die sichere Anwendung von häufig eingesetzten Arzneimitteln bei Patienten mit Leberzirrhose. Bei einem relativ großen Anteil der evaluierten Arzneimittel besteht Handlungsbedarf für den verordnenden Arzt im Sinne einer Dosisanpassung in Abhängigkeit vom Grad der Zirrhose oder der Vermeidung eines bestimmten Wirkstoffs und Auswahl einer sicheren Alternative. In den Niederlanden wurden die Empfehlungen in Verordnungssoftwaresysteme in Apotheken und Allgemeinarztpraxen integriert. Der vorliegende Beitrag gibt einen Überblick über die wichtigsten Empfehlungen. Es wäre darüber hinaus zu begrüßen, wenn die Empfehlungen, die derzeit größtenteils in Niederländisch und zu einem kleinen Teil in Englisch online verfügbar sind, vollumfänglich auch in Deutsch im Netz zur Verfügung stehen würden.
Interessenkonflikte
Ein Interessenkonflikt wird von den Autoren verneint.
Literatur
- Pimpin L, Cortez-Pinto H, Negro F et al.: Burden of liver disease in Europe: Epidemiology and analysis of risk factors to identify prevention policies. J Hepatol 2018; 69: 718-735.
- Lewis JH, Stine JG: Review article: prescribing medications in patients with cirrhosis - a practical guide. Aliment Pharmacol Ther 2013; 37: 1132-1156.
- Franz CC, Hildbrand C, Born C et al.: Dose adjustment in patients with liver cirrhosis: impact on adverse drug reactions and hospitalizations. Eur J Clin Pharmacol 2013; 69: 1565-1573.
- Weersink RA, Bouma M, Burger DM et al.: Evidence-Based Recommendations to Improve the Safe Use of Drugs in Patients with Liver Cirrhosis. Drug Saf 2018; 41: 603-613.
- Weersink RA, Bouma M, Burger DM et al.: Evaluating the safety and dosing of drugs in patients with liver cirrhosis by literature review and expert opinion. BMJ Open 2016; 6: e012991.
- American Association for the Study of Liver D, European Association for the Study of the L: Hepatic encephalopathy in chronic liver disease: 2014 practice guideline by the European Association for the Study of the Liver and the American Association for the Study of Liver Diseases. J Hepatol 2014; 61: 642-659.
- Soleimanpour H, Safari S, Shahsavari Nia K et al.: Opioid Drugs in Patients With Liver Disease: A Systematic Review. Hepat Mon 2016; 16: e32636.
- Tovoli F, De Lorenzo S, Samolsky Dekel BG et al.: Oral oxycodone/naloxone for pain control in cirrhosis: Observational study in patients with symptomatic metastatic hepatocellular carcinoma. Liver Int 2018; 38: 278-284.
- Zhang X, Harmsen WS, Mettler TA et al.: Continuation of metformin use after a diagnosis of cirrhosis significantly improves survival of patients with diabetes. Hepatology 2014; 60: 2008-2016.
- Loomba R: Rationale for conducting a randomized trial to examine the efficacy of metformin in improving survival in cirrhosis: pleiotropic effects hypothesis. Hepatology 2014; 60: 1818-1822.
- Gotz M, Anders M, Biecker E et al.: [S2k Guideline Gastrointestinal Bleeding - Guideline of the German Society of Gastroenterology DGVS]. Z Gastroenterol 2017; 55: 883-936.
- Sauerbruch T, Mengel M, Dollinger M et al.: Prevention of Rebleeding From Esophageal Varices in Patients With Cirrhosis Receiving Small-Diameter Stents Versus Hemodynamically Controlled Medical Therapy. Gastroenterology 2015; 149: 660-668 e661.
- Garcia-Tsao G, Abraldes JG, Berzigotti A, Bosch J: Portal hypertensive bleeding in cirrhosis: Risk stratification, diagnosis, and management: 2016 practice guidance by the American Association for the study of liver diseases. Hepatology 2017; 65: 310-335.
- Bosch J, Sauerbruch T: Esophageal varices: Stage-dependent treatment algorithm. J Hepatol 2016; 64: 746-748.
- Ratiopharm GmbH: Tigecyclin-ratiopharm® 50 mg Pulver zur Herstellung einer Infusionslösung. Stand: Dezember 2017.
- Bristol-Myers Squibb, Pfizer EEIG: Fachinformation "Eliquis® 2,5 mg Filmtabletten". Stand: Juli 2019.
- Boehringer Ingelheim International GmbH: Fachinformation "Pradaxa® 150 mg Hartkapseln". Stand: Mai 2019.
- Daiichi Sankyo Europe GmbH: Fachinformation "Lixiana® Filmtabletten". Stand: Mai 2019.
- Bayer AG: Fachinformation "Xarelto® 20 mg Filmtabletten". Stand: Oktober 2019.
- Merck Sharp & Dohme B.V.: Fachinformation "Invanz®". Stand: Mai 2018.
- Rotexmedica GmbH Arzneimittelwerk: Fachinformation "Imipenem/Cilastatin Rotexmedica 500 mg/500 mg Pulver zur Herstellung einer Infusionslösung". Stand: Juni 2015.
- Fresenius Kabi Deutschland GmbH: Fachinformation "Meropenem Kabi 500 mg Pulver zur Herstellung einer Injektions- bzw. Infusionslösung, Meropenem Kabi 1 g Pulver zur Herstellung einer Injektions- bzw. Infusionslösung". Stand: Dezember 2017.
- Ratiopharm GmbH: Fachinformation "Torasemid-ratiopharm® 5 mg / 10 mg Tabletten". Stand: Dezember 2015.
vorab online
Dieser Artikel wurde am 27. Januar 2020 vorab online veröffentlicht.
