Zweckmäßige Diagnostik und medikamentöse Therapie der Osteoporose
Zusammenfassung
In diesem Artikel werden sinnvolle Prävention, Diagnostik und Therapie der Osteoporose besprochen.
Diagnostik
Die Einleitung einer zweckmäßigen Osteoporosediagnostik erfolgt je nach Risikokonstellation (1). Gravierende Indikatoren für das Vorliegen oder für die Entstehung einer osteoporotischen Knochenstoffwechselstörung und eines konsekutiv erhöhten Frakturrisikos ergeben sich aus Anamnese, der Klinik und durch technische Hinweise (siehe Tabelle 1).

Eine zweckmäßige Osteoporosediagnostik stützt sich daher auf die oben genannten Informationen sowie Röntgenuntersuchungen und das Labor mit folgendem diagnostischen Vorgehen:
- Individual- und Familienanamnese
- klinische Beschwerden und Befund
- bei akuten oder chronischen Rückenschmerzen mit klinisch-anamnestischem Osteoporose-Verdacht einmaliges Röntgen der BWS/LWS in zwei Ebenen
- Knochendichtemessung (Osteodensitometrie) mit einem DXA-Gerät
- Labor zur Differenzialdiagnostik beinhaltet in der Regel: Kalzium, Phosphat, Kreatinin, Harnstoff, gesamt-alkalische Phosphatase, y-GT, Transaminasen, Elektrophorese, CRP, TSH, Blutbild. Die Zweckmäßigkeit einer Bestimmung von Knochenstoffwechselmarkern ist unklar. Ein Vitamin-D-Screening ist nicht zweckmäßig, da die vorliegenden Messverfahren in jedem Labor unzuverlässig sind.
Die Beurteilung eines möglicherweise physiologisch relevanten Kalzium- und/oder Vitamin-D-Defizits ist zuverlässiger möglich durch eine einmalige Intakt-Parathormon-Bestimmung im Serum. - Liegen anamnestische oder klinische Hinweise auf Malassimilationssyndrome, Stoffwechsel (z. B. Sarkoidose, Hypophosphatasie, Hämochromatose) oder endokrine Erkrankungen vor, ist gegebenenfalls die Bestimmung weiterer Laborparameter sinnvoll.
Zweckmäßige pharmakologische Differenzialtherapie
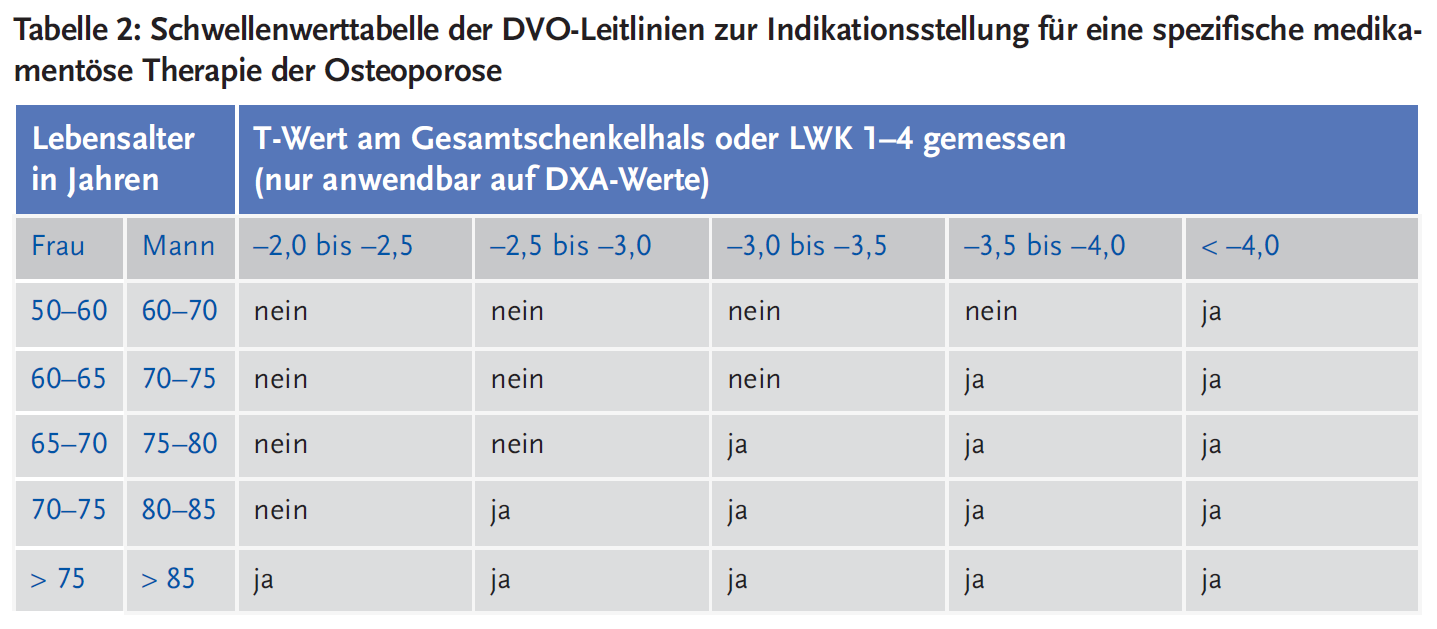
Die Indikation zur pharmakologischen Behandlung einer primären Osteoporose (= Basistherapie plus spezifisches Antiosteoporotikum) ergibt sich aus dem Risikoprofil. Ein 10-Jahres-Wirbelkörperfrakturrisiko ≥ 30 % stellt entsprechend der Konvention in der Leitlinie des Dachverbands Osteologie (DVO) eine zweckmäßige Indikation zur Einleitung einer pharmakologischen Osteoporosetherapie dar (siehe Tabelle 2) (2). Weitere Indikationen sind T-Werte ≤ –2,0 Standardabweichungen und osteoporotische Knochenbrüche sowie die Einnahme von Aromatasehemmern oder Antiandrogenen. Bei Vorliegen gravierender Risikofaktoren (z. B. Immobilität, Organtransplantation, Kurzdarmsyndrom) ohne osteoporotische Brüche ist eine Kalzium-Vitamin-D-Basistherapie und eine jährliche Knochendichte-Verlaufsmessung zweckmäßig. Gezielte osteotrope Medikation zusätzlich zur Basistherapie ist bei einer (nicht nur inhalativen) Glukokortikoid-Dauerbehandlung für voraussichtlich mehr als drei Monate (und T-Wert ≤ –1,5 Standardabweichungen) zweckmäßig.
Nicht jeder Patient und jede klinische Situation wird von der vom DVO vorgeschlagenen Behandlungsindikationstabelle (oder anderen europäischen Leitlinien oder anderen Osteoporose Score Systemen) erfasst. In diesen Fällen ist ein ärztlich begründetes, risikoadaptiertes Vorgehen zweckmäßig und mit dem Leistungsträger abzustimmen.
Basistherapie
Eine Basistherapie mit Vitamin D plus Kalzium ist die Grundlage jeder der im Folgenden erwähnten spezifischen Osteoporosetherapien, da es nur für die gemeinsame Gabe einen Wirksamkeitsnachweis gibt. Eine primärprophylaktische Basistherapie kann – auch wenn keine Leistungspflicht der GKV dafür besteht – medizinisch sinnvoll sein.
Ernährungsmedizinisch wird eine tägliche Kalziumaufnahme im Erwachsenenalter von 800 bis 1500 mg Kalzium empfohlen. Eine alleinige medikamentöse Kalziumsupplementierung ohne eine gleichzeitige Vitamin-D-Therapie ist nicht sinnvoll. Die übliche Kalzium- und Vitamin-D-Supplementation als Osteoporose-Basistherapie ist nicht mit einem erhöhten kardiovaskulären oder Mortalitätsrisiko assoziiert (3-5).
Unverzichtbar ist in der Regel eine Vitamin-D-Supplementation mit einem genuinen Vitamin-D-Präparat, aber nicht mit einem aktiven Vitamin-D-Metaboliten. Im Rahmen der Osteoporose-Kalzium-Vitamin-D-Basistherapie wird eine tägliche Aufnahme von 800 bis 2000 Einheiten Vitamin D pro Tag empfohlen (1; 6-8). Die Messung von 25-OH-Vitamin-D-Spiegeln als Massenuntersuchung ist nicht zweckmäßig (9). Sie kann aber in Ausnahmefällen bei schwerwiegendem klinischem Verdacht auf eine Vitamin-D-Stoffwechselstörung sinnvoll sein. Ob ein täglich einzunehmendes Vitamin-D-Präparat mit 1000 IE oder ein Vitamin-D-Depotpräparat favorisiert wird, erscheint unkritisch, zumal dazu keine konkurrierenden Interventionsstudien zum Endpunkt Frakturen vorliegen. Nach den bisher vorliegenden Studien werden nur Dosierungen von 1000 IE bis maximal 3000 IE genuinem Vitamin D pro Tag empfohlen (10;11).
Spezifische Antiosteoporotika
Da es keine direkten Vergleichsstudien mit patientenrelevanten Endpunkten wie Frakturen gibt, sind Empfehlungen zur Differenzialtherapie evidenzbasiert nicht möglich.
Für die Behandlung der postmenopausalen Osteoporose stehen folgende zugelassene Substanzen mit vorwiegend antiresorptiver (beispielsweise Bisphosphonate, Denosumab, Raloxifen, Östrogene; siehe Tabelle 3) oder anbaustimulierender Wirkung (Beispiel Teriparatid) zur Verfügung, die alle eine A-Klassifizierung in den gängigen Osteoporoseleitlinien haben (entsprechend einer in randomisierten kontrollierten Studien nachgewiesenen frakturpräventiven Wirkung zumindest auf Wirbelkörperfrakturen) (1;2). Calcitoninpräparate sind für die Therapie der Osteoporose unzweckmäßig (12).
Östrogene, im Rahmen der postmenopausalen Substitutionstherapie verabreicht, haben ebenfalls eine nachgewiesene frakturpräventive Wirkung (13;14). Sie erhöhen allerdings das Risiko für Thrombembolien, Myokardinfarkt, Schlaganfall, Mammakarzinom, Uteruskarzinom und Alzheimer (15;16), weshalb sie nicht zur Osteoporosetherapie empfohlen werden – sofern nicht gravierende östrogendefizitbedingte Beschwerdebilder vorliegen.
Die Fluoridbehandlung der primären Osteoporose ist weiterhin in Deutschland für postmenopausale Frauen und für Männer zugelassen und möglich (17). Die Evidenz für ihre Wirksamkeit ist aber gering, weshalb die Fluoridtherapie hier nicht besprochen wird.
Für die Behandlung der männlichen Osteoporose sind zugelassen: Alendronsäure, Risedronsäure, Zoledronsäure, Teriparatid und Denosumab. Ibandronat sollte hier auch wirksam sein. Aus Sicht der Kostenträger liegt hier aber ein Off-Label-Use vor.
Für die Behandlung der Glukokortikoid-induzierten Osteoporose sind zugelassen: Alendronsäure, Risedronsäure, Zoledronsäure und Teriparatid.

Relative und absolute Frakturrisikoreduktion diverser Antiosteoporotika
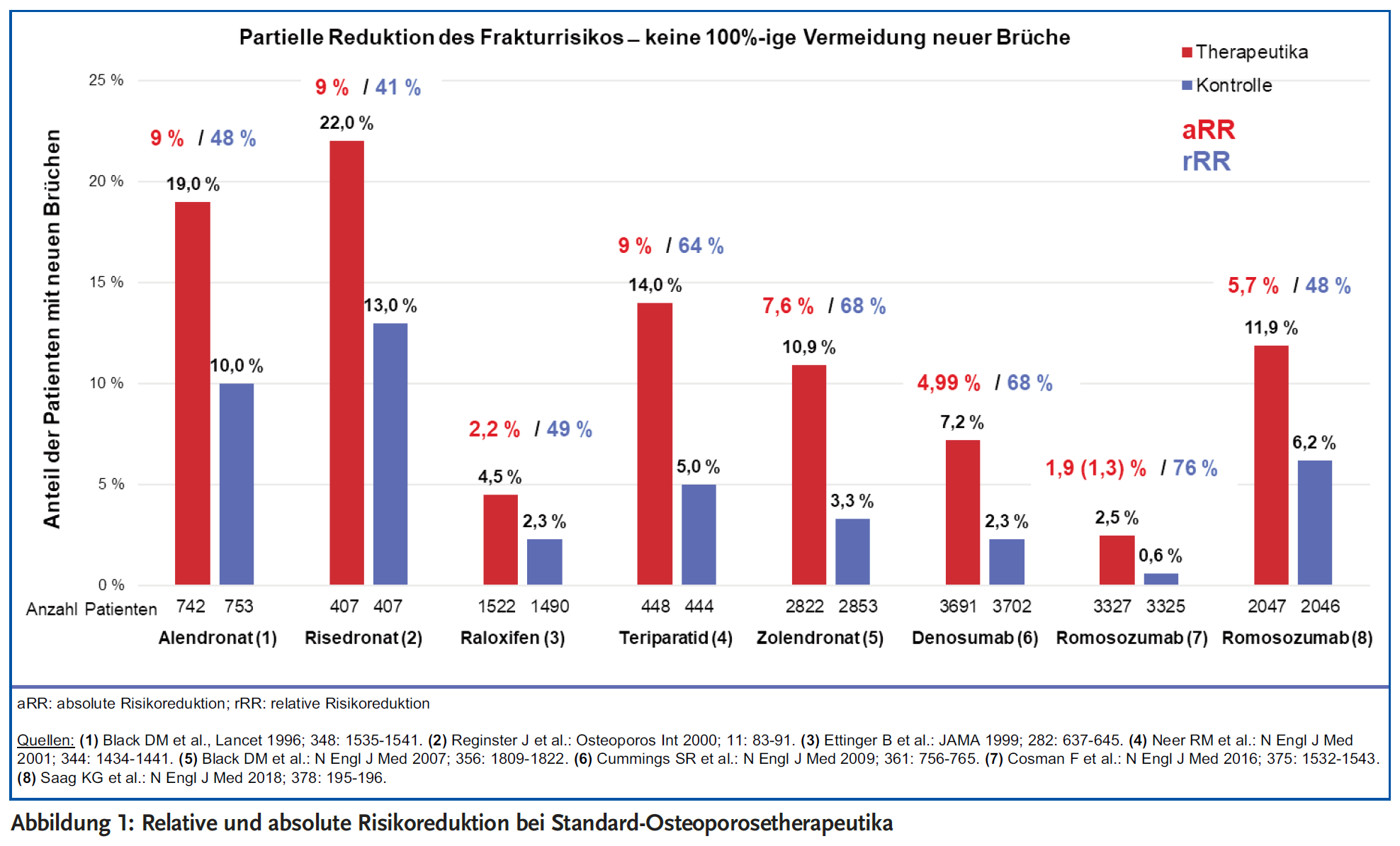
Alle randomisierten, kontrollierten klinischen Studien zeigen, dass das Risiko für das Auftreten neuer Knochenbrüche im Laufe der üblichen drei- bis fünfjährigen Osteoporosetherapie mit allen zugelassenen Antiosteoporotika sinkt, aber natürlich wird das Auftreten neuer Frakturen nicht gänzlich verhindert.
Die Osteoporosebehandlung sollte mindestens drei bis fünf Jahre erfolgen, bevor eine Pause der Osteoporosetherapie geprüft wird. Daher ist die Compliance des Patienten ein ganz wichtiger Punkt in der pharmakologischen Osteoporosebehandlung.
Betrachtet man weniger die relativen, sondern auch die absoluten Frakturrisiko-Reduktionen, ist die Wirkung auch der neueren Antiosteoporotika eher gering (Abbildung 1). Es stellt sich dann immer wieder die Frage, ab wann eine statistisch signifikante, aber hinsichtlich der absoluten Risikoreduktion eher geringe frakturpräventive Wirkung dem Patienten wirklich nützt oder nicht doch eher schadet. So sollte das erhöhte kardiovaskuläre Risiko einer Osteoporosetherapie mit dem erst kürzlich zugelassenen Sklerostin-Antikörper Romosozumab besondere Beachtung nicht nur bei kardiovaskulär vorbelasteten, sondern gerade auch bei Patienten mit kardiovaskulären Risikofaktoren finden. Es ergibt sich aus der ARCH-Studie im Vergleich zu Alendronat nach einer zwölfmonatigen Behandlung mit Romosozumab eine Hazard Ratio für den Endpunkt Myokardinfarkt von 3,21, für den Endpunkt Schlaganfall von 1,86 und für den Endpunkt kardiovaskulärer Tod von 1,42 (18). Die Diskussion über die Möglichkeit der kardiovaskulären Protektion durch eine Bisphosphonatbehandlung unterstreicht das Erfordernis, die Indikation für Romosozumab zukünftig sorgfältig abzuwägen (19;20).
Beginn einer medikamentösen Osteoporosetherapie
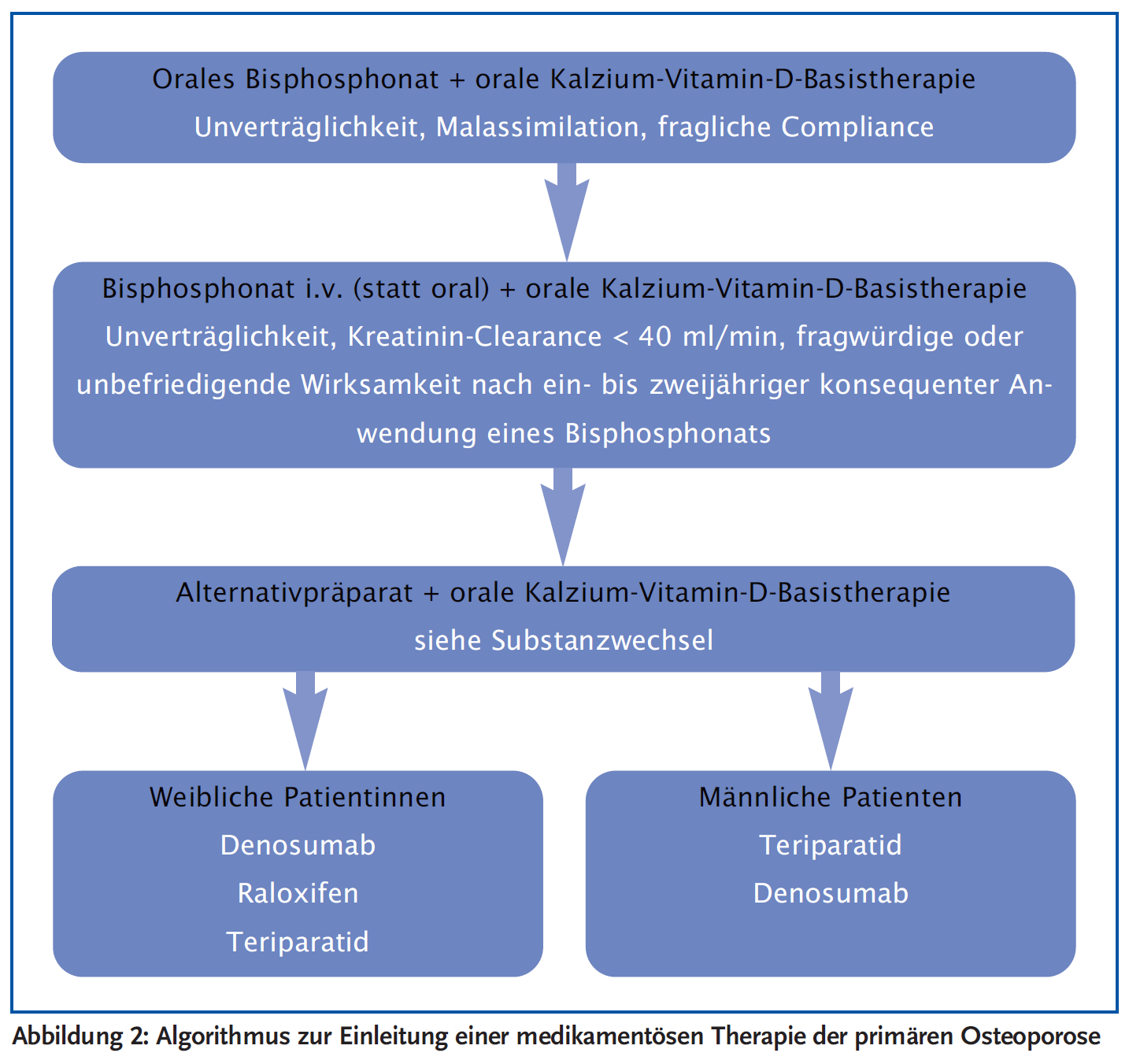
Die Einleitung einer Osteoporosetherapie erfolgt stets mit einer Kalzium-Vitamin-D-Basistherapie plus einem (häufig oral einzunehmenden) Bisphosphonat (1). Dabei ist die Verträglichkeit der Substanzen und bei oralen Bisphosphonaten die Einhaltung einer strikt regelmäßigen Einnahme unter Beachtung des Einnahmemodus (nüchtern, 60 Minuten vor dem Frühstück mit einem großen Glas Wasser in aufrechter Position) entscheidend. Außerdem ist zu beachten, dass orale Bisphosphonate nicht gleichzeitig mit Kalzium eingenommen werden sollen, da ansonsten die Aufnahme der Substanzen beeinträchtigt wird. Kalzium sollte zu oder nach einer Mahlzeit eingenommen werden.
Für den Beginn einer gezielten medikamentösen Osteoporosetherapie mit den oralen Bisphosphonaten Alendronsäure oder Risedronsäure sprechen das breite zugelassene Indikationsspektrum, die orale Darreichungsform, bekannte Langzeitwirkungen und der Preis.
Kommt es nach Beginn einer oralen Bisphosphonattherapie zeitlich eindeutig assoziierbar zu gastrointestinalen Beschwerden, erscheint es sinnvoll, ein intravenöses Bisphosphonat oder eine s.c. Therapieform der Osteoporose anzuwenden. Das Frakturrisiko lässt sich durch eine solche Verbesserung der Compliance des Patienten durch eine i.v. oder s.c. Applikation möglicherweise weiter reduzieren (21).
Bei 10–30 % der Patienten mit einer i.v. Bisphosphonatbehandlung kommt es zum Auftreten einer harmlosen, aber in Einzelfällen klinisch gravierenden Akute-Phase-Reaktion mit Temperaturanstieg, Knochen-, Gelenk-, Glieder-, Muskel- und Kopfschmerzen, die wenige Stunden oder Tage anhalten kann und in der Regel nur bei der ersten Applikation auftritt. (22). Die Wahrscheinlichkeit einer solchen Reaktion kann reduziert werden, indem sehr langsam infundiert wird (beispielsweise bei Ibandronat und Zoledronat über 30–60 Minuten) und auf eine ausreichende Flüssigkeitszufuhr von zwei bis drei Litern am Tag der Infusion geachtet wird. Die routinemäßige Verabreichung von NSAR oder Paracetamol zur Vorbeugung wird nicht empfohlen.
Das Vorliegen einer absoluten Arrhythmie bei Vorhofflimmern ist keine Kontraindikation für eine Bisphosphonattherapie, ebenso wenig wie eine kürzliche Fraktur, eine endoprothetische oder eine erfolgte zahnärztliche Versorgung (23).
Zahnärztliche Eingriffe, die den Kieferknochen mit betreffen (Zahnextraktionen, Wurzelspitzenresektionen, parodontalchirurgische Maßnahmen, Wurzelkanalbehandlungen), sollten zuerst durchgeführt werden und abheilen, bevor wenige Wochen später mit der Bisphosphonatbehandlung begonnen wird (eine Basistherapie mit Kalzium und Vitamin D kann sofort initiiert werden). Zahnärztliche Beschwerden, die nur eine Behandlung der Zahnkrone (Zahnreinigungen, Füllungen, Kronen, Inlays, Brücken) erfordern, können jederzeit durchgeführt werden. Eine prophylaktische zahnärztliche Untersuchung vor jedweder Bisphosphonatbehandlung einer primären Osteoporose bei einem zahnbeschwerdefreien Patienten ist nicht zweckmäßig. Auch für Osteoporosepatienten gilt die allgemeine zahnärztliche Empfehlung für die Bevölkerung, sich einmal jährlich einer zahnärztlichen Kontrolle zu unterziehen.
Das Risiko für subtrochantäre und atypische Femurschaftfrakturen scheint bei einer antiresorptiven Therapie über mehr als fünf Jahre hinaus erhöht (RR = 1,62) (24), weshalb nach dem üblichen Therapiezeitraum von etwa drei bis fünf Jahren eine Pause der Behandlung geprüft werden soll, in Abhängigkeit von den dann noch vorliegenden gravierenden Frakturrisiken (z. B. Immobilität, Knochendichte, Glukokortikoid- oder Aromatasehemmertherapie).
Wird eine Bisphosphonatbehandlung nicht vertragen oder ist die Wirksamkeit fragwürdig (siehe auch Substanzwechsel), können alternativ bei postmenopausalen Frauen Denosumab, Raloxifen, zukünftig Romosozumab und Teriparatid und bei Männern Denosumab oder Teriparatid eingesetzt werden (siehe unten „Spezifische Behandlungssituationen…“).
Verordnung von Kalzium und Vitamin D
Die Verordnungsfähigkeit von Kalzium- und Vitamin-D-Präparaten, die nicht verschreibungspflichtig sind, ist verbindlich in der Anlage I der Arzneimittel-Richtlinie (sog. OTC-Ausnahmeliste) geregelt (Tabelle 4). Seit 2013 können Vitamin-D-Präparate entsprechend den oben genannten Kriterien auch als Monopräparate zu Lasten der GKV verordnet werden, sofern eine ausreichende Kalziumzufuhr über die Nahrung gewährleistet ist.
Hochdosierte, verschreibungspflichtige Vitamin-D-haltige Präparate oder auch aktive Vitamin-D-Metabolite (z. B. 1,25-Dihydroxycholecalciferol) sind dagegen vorrangig für schwere Vitamin-D-Mangelernährungszustände als Initialtherapie oder für spezielle Kalzium- und Vitamin-D-Stoffwechselstörungen zugelassen. Die Dauertherapie mit sehr hohen Vitamin-D-Dosierungen könnte das Sturz- und Frakturrisiko sogar steigern und den Knochenabbau fördern (10;25).

Algorithmus zur Einleitung einer medikamentösen Therapie der primären Osteoporose
Simultane Kombinationstherapien mit mehr als einem Antiosteoporotikum (z. B. Bisphosphonat plus Teriparatid) zusätzlich zur Kalzium-Vitamin-D-Basistherapie sind nicht zweckmäßig, da eine additive Wirkung auf die Senkung des Frakturrisikos nicht belegt ist (24;26).
Substanzwechsel
Die Konstanz der Knochendichte im Verlauf ist ein realistisches Ziel einer medikamentösen Osteoporosetherapie. Trotz konstanter oder sogar leicht abfallender Knochendichte unter Bisphosphonatbehandlung sinkt das Frakturrisiko während des üblichen dreijährigen Therapiezeitraumes (27;28).
Bei einem Sturz oder Trauma können natürlich unter allen Antiosteoporotika neue Frakturen auftreten. Das Auftreten einer Wirbelkörper- oder Radiusfraktur nach Einleitung einer Osteoporosetherapie ist daher kein zwingender Grund für einen Substanzwechsel bei zumindest konstanter Knochendichte ohne relevante Knochendichteabnahme.
Eine relevant progrediente Osteoporose wird wie folgt definiert: Nimmt die Knochendichte unter einer laufenden und gut verträglichen Behandlung nach ein bis zwei Jahren an der LWS (z. B. Mittelwert LWK 1–4) oder im Gesamtfemurbereich um mehr als 3 % des DXA-Absolutwerts in g/cm2 pro Jahr ab (29;30) oder treten mindestens zwei Knochenbrüche ohne relevantes Trauma auf, sind zunächst:
- Die Zuverlässigkeit der Knochendichteverlaufsmessung (identisches = dasselbe – also nicht nur das gleiche – DXA-Gerät benutzt zur Verlaufsmessung? Lagerungsfehler bei der Messung?),
- die Diagnose primäre Osteoporose und
- die Compliance des Patienten zu prüfen und der Therapieerfolg gegebenenfalls durch den Übergang auf ein intravenöses Bisphosphonat sicherzustellen (31). Ist die Compliance des Patienten von vornherein fragwürdig oder ist ein gravierendes Malassimilationssyndrom (z. B. Morbus Crohn, Kurzdarm) bekannt, kann auch eine i.v. Bisphosphonattherapie oder eine s.c. Denosumabtherapie zweckmäßig sein.
Treten nach 18-monatiger konsequenter Behandlung mit einem Bisphosphonat oder einem anderen Antiosteoporotikum einschließlich Basistherapie mindestens zwei Osteoporose-assoziierte Knochenbrüche auf, kann nach Überprüfung eventuell vorliegender Sturzrisiken ein Substanzwechsel zweckmäßig sein. Der Einsatz einer Therapie mit Teriparatid ist insbesondere bei der Glukokortikoid-induzierten Osteoporose zu prüfen (32).
Spezifische Behandlungssituationen und -aspekte bei der medikamentösen Differenzialtherapie der Osteoporose
Raloxifen
Raloxifen kann als partieller Östrogenrezeptorantagonist postmenopausale Beschwerden (z. B. Hitzewallungen) auslösen oder verstärken, andererseits aber gerade bei Patientinnen mit östrogenrezeptorpositivem Mammakarzinom günstigerweise eingesetzt werden (33), wobei eine Doppeltherapie mit dem aus onkologischer Indikation verschriebenen Tamoxifen plus dem als Antiosteoporotikum verschriebenen Raloxifen nicht zweckmäßig ist.
Raloxifen verursacht außerdem ein erhöhtes thromboembolisches Risiko, sodass diese Substanz bei Patienten mit stattgehabten Thrombosen und Lungenembolien, Adipositas, Faktor-V-Leiden-Mutation kontraindiziert bzw. bei Immobilität, bei Tumorerkrankungen oder vorübergehend immobilisierten Patienten unzweckmäßig ist.
Denosumab
Liegt eine Einschränkung der Nierenfunktion unter eine Kreatinin-Clearance von ≤ 35 ml/min oder eine Dialysepflichtigkeit oder eine Bisphosphonat-Unverträglichkeit vor, kann Denosumab verabreicht werden. Wegen einer möglichen immunmodulatorischen Wirkung von Denosumab sollte dieser Antikörper eher nicht bei transplantierten, chronisch glukokortikoidbehandelten oder Patienten mit chronisch entzündlichen oder Autoimmunerkrankungen eingesetzt werden.
Gemäß Rote-Hand-Brief vom 3. September 2014 darf Denosumab nicht bei vorbestehender Hypokalziämie angewendet werden. Vor Beginn einer Behandlung mit Denosumab muss daher ein erniedrigter Serumkalzium-Wert korrigiert werden. Bei Niereninsuffizienten wird die klinische Überwachung der Kalziumspiegel (Kontrollmessung zwei Wochen nach der initialen Dosis sowie bei Auftreten von Hypokalziämie-Anzeichen) empfohlen (34).
Darüber hinaus sollten alle Patienten vor Beginn einer Denosumab- oder Bisphosphonat Behandlung auf mögliche Risikofaktoren für Kieferosteonekrosen (z. B. vorbestehende entzündliche Veränderungen im Kieferknochen oder an den Zahnwurzeln) hingewiesen werden. Das zweckmäßige Vorgehen nach Absetzen von Denosumab zur Vermeidung von sogenannten Anschlussfrakturen ist im folgenden Abschnitt über Teriparatid erläutert.
Teriparatid
Besteht die Indikation zu einem Substanzwechsel, kann Teriparatid (34-Parathormonpeptid) sinnvoll sein (35). Liegt bereits eine manifeste Glukokortikoid-induzierte Osteoporose mit mehreren Knochenbrüchen ohne eine adäquate Osteoporosetherapie (zum Bespiel nur Basistherapie ohne Bisphosphonat) nach mehrjähriger (> 2 Jahre) Glukokortikoidbehandlung vor, kann in solchen seltenen Fällen auch der primäre Einsatz von Teriparatid erwogen werden.
Auch die Teriparatidtherapie erfolgt immer zusammen mit der Kalzium- und Vitamin-D-Basistherapie unter Berücksichtigung der Ernährungsweise des Patienten. Die Behandlung wird immer nach maximal zwei Jahren beendet und im Laufe des Lebens beim gleichen Patienten nicht wiederholt. Danach wird wieder das übliche frakturrisikoadaptierte Vorgehen empfohlen. Eine Teriparatidtherapie sollte nicht bei bekannten malignen Grunderkrankungen, Niereninsuffizienz oder Kindern/Adoleszenten initiiert werden (35-37). Messungen des Parathormons im Serum unter der Behandlung mit Teriparatid sind unzweckmäßig.
Da allerdings die Wirkung von Teriparatid nach Pausieren der Applikation (ähnlich wie die Wirkung des Antikörpers Denusomab) nach wenigen Monaten abgeklungen ist, können ähnlich wie nach Absetzen von Denosumab Anschlussfrakturen auftreten (38-42). Daher erscheint nach Absetzen von Teriparatid oder Denosumab eine zumindest einjährige Behandlung mit einem langwirksamen Bisphosphonat (z. B. Zoledronat) zweckmäßig.
In jedem Fall ist Teriparatid zur Behandlung der manifesten Osteoporose bei postmenopausalen Frauen nur ein Mittel der zweiten Wahl, da es keine Evidenz für eine stärkere frakturrisikosenkende Wirkung gegenüber Bisphosphonaten gibt (35). Teriparatid ist wegen der im Vergleich zu Bisphosphonaten bis zu 35-fach höheren Tagestherapiekosten in der Regel unwirtschaftlich.
Unter folgenden kumulativen Bedingungen ist eine Verordnung von Teriparatid möglich:
- bei manifester Osteoporose mit mindestens zwei neuen osteoporotischen Frakturen in den letzten 18 Monaten unter laufender Bisphosphonattherapie und
- bei keinem ausreichenden Ansprechen bezüglich der Knochendichte auf eine adäquate Vorbehandlung über mindestens ein bis zwei Jahre oder
- nach Absetzen der Bisphophonatbehandlung oder anderer Antiosteoporotika aufgrund von Unverträglichkeiten oder
- bei Kontraindikationen gegenüber allen anderen Antiosteoporotika.
Bei einer jahrelang erforderlichen Glukokortikoiddauertherapie (z. B. transplantierte Patienten, rheumatoide Arthritis, Asthma bronchiale, Vaskulitis) und Indikation zum Substanzwechsel kann Teriparatid zweckmäßig sein. Bei einer renalen Osteopathie ist Teriparatid nicht sinnvoll einzusetzen auf Grund des sekundären renalen Hyperparathyreoidismus.
Romosozumab
Romosozumab ist nach Teriparatid der zweite osteoanabole Wirkstoff zur Behandlung der postmenopausalen manifesten Osteoporose bei deutlich erhöhtem Frakturrisiko. Die osteoanabole Wirkung hält allerdings nur einige Monate an, wobei überraschenderweise auch eine antiresorptive Wirkung vorliegt, was insgesamt in einem verminderten Knochenumbau (low turnover) resultiert (43). Die Zulassungsstudien wurden daher auch nur über einen Therapiezeitraum von zwölf Monaten durchgeführt, zumal kardiovaskuläre Nebenwirkungen und Endpunkte bei einer Langzeittherapie mit Romosozumab nicht ausgeschlossen werden können. Zudem gibt es Beobachtungen, die eine Anwendung von Romosozumab bei TNF-alpha-vermittelten Erkrankungen (z. B. rheumatoide Arthritis, M. Crohn) (44) oder bei immunkompromitierten Patienten (z. B. Transplantierte, Patienten mit einer Glukokortikoid-Dauertherapie) (45) ohne vorliegende weitere Studien ungünstig erscheinen lassen. Daher sollte dieser Wirkstoff nur als Ausweichbehandlung bei postmenopausalen Frauen mit gravierender manifester Osteoporose und ohne kardio- oder zerebrovaskuläre Risiken, nicht aber bei renaler Osteopathie, nierentransplantierten oder dialysepflichtigen Patienten (46), sowie TNA-alpha-vermittelten Erkrankungen oder immunkompromitierten Patienten angewendet werden. Zum Erhalt einer günstigen Wirkung auf die Knochenmasse erscheint auch nach Beendigung einer Romosozumabtherapie eine Nachbehandlung mit einem Bisphosphonat zweckmäßig, da ebenfalls innerhalb von Monaten mit einem Abfall der Wirkung (und damit der Knochendichte) dieses Antikörpers nach Pausieren der monatlichen Romosozumabgabe zu rechnen ist.
Romosozumab wurde am 11. Dezember 2019 in der EU zugelassen und war zum 15. Januar 2020 in Deutschland noch nicht verfügbar.
Wirkdauer der Antiosteoporotika
Bisphosphonate haben eine gewünschte nachhaltige antiresorptive Wirkung auf den Knochenstoffwechsel, häufig auch noch jahrelang nach dem Absetzen dieser Substanzen (22). Die Wirkung von Teriparatid, Denosumab, Romosozumab und Raloxifen auf die Knochendichte klingt innerhalb von wenigen Monaten ab, sodass die in der Regel nach zwei- und dreijähriger Therapie mit diesen Substanzen angestiegene Knochendichte innerhalb eines Jahres wieder auf das Ausgangsniveau abfällt, wobei die Bedeutung dieses Knochendichteabfalls nach Absetzen der Medikamente für das Frakturrisiko bisher unklar ist (47).
Nach Einleitung einer Therapiepause von Teriparatid, Denosumab, Romosozumab oder Raloxifen erscheint es daher vertretbar, nach neun bis zwölf Monaten bereits eine Knochendichte- und klinische Verlaufskontrolle durchzuführen, um einen neuen schnellen Knochendichteverlust nicht zu übersehen. Insbesondere nach einer Behandlung mit Denosumab und Teriparatid erscheint eine Bisphosphonat-Nachbehandlung über ein bis zwei Jahre zweckmäßig. Dies dürfte auch für die Behandlung mit Romosozumab gelten, wobei hierzu noch keine Daten vorliegen.
Behandlungsdauer, Behandlungspause und Knochendichteverlaufskontrollen
Die übliche Behandlungsdauer mit einem Antiosteoporotikum beträgt in der Regel drei bis fünf Jahre. Ob konsequent durchgeführte Behandlungszeiten einer Osteoporose über fünf Jahre hinaus noch den frakturpräventiven Nutzen weiter klinisch relevant und signifikant erhöhen, ist nicht erwiesen (48;49). Zudem sind gegenüber einem erhofften Behandlungsnutzen nach länger als fünf Jahre Therapie auch die bei jahrelanger Einnahme einer Substanz möglichen Behandlungsrisiken verstärkt zu bedenken.
Bei den atypischen Femurschaftfrakturen, die nach langjähriger Bisphosphonattherapie beschrieben wurden, scheint es sich um ein insgesamt allenfalls sporadisches Ereignis zu handeln, ohne dass der pathophysiologische Bezug zu einer Bisphosphonattherapie gesichert ist (50).
Langzeiterfahrungen über mehr als 20 Jahre wie bei den Bisphosphonaten liegen naturgemäß für die neueren Antiosteoporotika noch nicht vor. Nach dem üblichen drei- bis fünfjährigen Therapiezeitraum kann eine Behandlungspause folgen, sofern keine gravierenden Risiken fortbestehen (z. B. Glukokortikoid- oder Aromatasehemmertherapie, neue Brüche) und wobei weiterhin auf die Fortsetzung der ernährungsmedizinisch empfohlenen täglichen Kalzium- und Vitamin-D-Aufnahme zu achten ist. Verlaufskontrollen der Knochendichte zur Therapieüberwachung erscheinen bei oraler Osteoporosetherapie alle ein bis zwei Jahre, bei intravenöser Therapie alle zwei Jahre und nach dem Beginn einer Therapiepause jährlich sinnvoll.
Die Wiederaufnahme einer Osteoporosebehandlung sollte reevaluiert werden bei einem neuerlichen signifikanten Knochendichteabfall von mehr als 3 % des DXA-Absolutwerts in g/cm2 pro Jahr an der LWS oder im Gesamtfemurbereich, bei mehreren (mehr als zwei) neuen Frakturen ohne gravierende Traumata oder anderen neu oder wieder aufgetretenen Osteoporose-Risikosituationen.
Fazit für die Praxis
Liegt eine Risikokonstellation vor, sollte eine adäquate Diagnostik der Osteoporose erfolgen. Ab einem 10-Jahres-Risiko für Wirbelkörperfrakturen > 30 % ist eine medikamentöse Therapie indiziert. Zur Basistherapie gehören die Gabe von Vitamin D und Kalzium. Zusätzlich sind Bisphosphonate Mittel der ersten Wahl. Denosumab, Raloxifen, Romosozumab und Teriparatid können bei Unverträglichkeiten, Kontraindikationen oder Spezialfällen erwogen werden.
Interessenkonflikte
Ein Interessenkonflikt wird vom Autor verneint.
Literatur
- Osteoporose und andere Knochenerkrankungen. In: Arzneimittelkommission der deutschen Ärzteschaft (Hrsg.): Arzneiverordnungen. 22. Aufl.; Neu-Isenburg: Medizinische Medien Informations GmbH, 2009.; 1069-1095.
- Prophylaxe, Diagnostik und Therapie der Osteoporose bei postmenopausalen Frauen und bei Männern: www.dv-osteologie.org/dvo_leitlinien/dvo-leitlinie-2017 (letzter Zugriff: 1. November 2019). Leitlinie des Dachverbands der Deutschsprachigen Wissenschaftlichen Osteologischen Gesellschaften e. V.; AWMF-Register-Nr. 183/001; 2017.
- LaCroix AZ, Kotchen J, Anderson G et al.: Calcium plus vitamin D supplementation and mortality in postmenopausal women: the Women’s Health Initiative calcium-vitamin D randomized controlled trial. J Gerontol A Biol Sci Med Sci 2009; 64: 559-567.
- Nurmi-Lüthje I, Sund R, Juntunen M, Lüthje P: Post-hip fracture use of prescribed calcium plus vitamin D or vitamin D supplements and antiosteoporotic drugs is associated with lower mortality: a nationwide study in Finland. J Bone Miner Res 2011; 26: 1845-1853.
- Lewis JR, Radavelli-Bagatini S, Rejnmark L et al.: The effects of calcium supplementation on verified coronary heart disease hospitalization and death in postmenopausal women: a collaborative meta-analysis of randomized controlled trials. J Bone Miner Res 2015; 30: 165-175.
- Bischoff-Ferrari HA, Willett WC, Oray EJ et al.: A pooled analysis of vitamin D dose requirements for fracture prevention. N Engl J Med 2012; 367: 40-49.
- Holick MF, Binkley NC, Bischoff-Ferrari H et al.: Evaluation, treatment and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2011; 96: 1911-1930.
- Bolland MJ, Grey A, Gamble GD, Reid IR: The effect of vitamin D supplementation on skeletal, vascular, or cancer outcomes: a trial sequential meta-analysis. Lancet Diabetes Endocrinol 2014; 2: 307-320.
- Holick MF: Vitamin D status: measurement, interpretation, and clinical application. Ann Epidemiol 2009; 19: 73-78.
- Sanders KM, Stuart AL, Williamson EJ et al.: Annual high-dose oral vitamin D and falls and fractures in older women: a randomized controlled trial. JAMA 2010; 303: 1815-1822.
- Sanders KM, Nicholson GC, Ebeling PR: Is high dose vitamin D harmful? Calcif Tissue Int 2013; 92: 191-206.
- Rotexmedica GmbH Arzneimittelwerk: Rote-Hand-Brief zu Calcitonin: Wichtige Informationen zum Zusammenhang von Calcitonin und Malignität – neue Einschränkungen der Anwendung und Marktrücknahme des Nasensprays. Rote-Hand-Brief vom 15. August 2012.
- Jackson RD, Wactawski-Wende J, LaCroix AZ et al.: Effects of conjugated equine estrogen on risk of fractures and BMD in postmenopausal women with hysterectomy: results from the women’s health initiative randomized trial. J Bone Miner Res 2006; 21: 817-828.
- Torgerson DJ, Bell-Syer SE: Hormone replacement therapy and prevention of nonvertebral fractures. JAMA 2001; 285: 2891-2897.
- Hulley S, Furberg C, Barrett-Connor E et al.: Noncardiovascular disease outcome during 6.8 years of hormone therapy: Heart and Estrogen/progestin Replacement Study follow-up (HERS II). JAMA 2002; 288: 58-66.
- Prentice RL, Anderson GL: The women’s health initiative: lessons learned. Annu Rev Public Health 2008; 29: 131-150.
- Pak CY, Adams-Huet B, Sakhaee K et al.: Comparison of nonrandomized trials with slow-release sodium fluoride with a randomized placebo-controlled trial in postmenopausal osteoporosis. J Bone Miner Res 1996; 11: 160-168.
- Saag KG, Petersen J, Brandi ML et al.: Romosozumab or alendronate for fracture prevention in women with osteoporosis. N Engl J Med 2017; 377: 1417-1427.
- Sing CW, Wong AY, Kiel DP et al.: Association of alendronate and risk of cardiovascular events in patients with hip fracture. J Bone Miner Res 2018; 33: 1422-1434.
- Lee P, Ng C, Slattery A et al.: Preadmission bisphosphonate and mortality in critically Ill patients. J Clin Endocrinol Metab 2016; 101: 1945-1953.
- Gallagher AM, Rietbrock S, Olson M, van Staa TP: Fracture outcome related to persistence and compliance with oral bisphosphonates. J Bone Miner Res 2008; 23: 1569-1575.
- Russell RG, Watts NB, Ebetino FH, Rogers MJ. Mechanisms of action of bisphosphonates: similarities and differences and their potential influence on clinical efficacy. Osteoporos Int 2008; 19: 733-759.
- Barrett-Connor E, Swern AS, Hustad CM et al.: Alendronate and atrial fibrillation: a meta-analysis of randomized placebo controlled clinical trials. Osteoporos Int 2012; 23: 233-245.
- Gedmintas L, Solomon DH, Kim SC: Bisphosphonates and risk of subtrochanteric, femoral shaft, and atypical femur fracture: a systematic review and meta-analysis. J Bone Miner Res 2013; 28: 1729-1737.
- Burt LA, Billington EO, Rose MS: Effect of high-dose vitamin D supplementation on volumetric bone density and bone strength: a randomized clinical trial. JAMA 2019; 322: 736-745.
- Finkelstein JS, Hayes A, Hunzelman JL et al.: The effects of parathyroid hormone, alendronate, or both in men with osteoporosis. N Engl J Med 2003; 349:1216-1226.
- Cummings SR, Karpf DB, Harris F et al.: Improvement in spine bone density and reduction in risk of vertebral fractures during treatment with antiresorptive drugs. Am J Med 2002; 112: 281-289.
- Seeman E: Is a change in bone mineral density a sensitive and specific surrogate of anti-fracture efficacy? Bone 2007; 41: 308-317.
- Lenchik L, Kiebzak GM, Blunt BA: What is the role of serial bone mineral density measurements in patient management? J Clin Densitom 2002; Suppl.: S29-38.
- Ravaud P, Reny JL, Giraudeau B et al.: Individual smallest detectable difference in bone mineral density measurements. J Bone Miner Res 1999; 14: 1449-1456.
- Sampalis JS, Adachi JD, Rampakakis E et al.: Long-term impact of adherence to oral bisphosphonates on osteoporotic fracture incidence. J Bone Miner Res 2012; 27: 202-210.
- Kraenzlin ME, Meier C: Parathyroid hormone analogues in the treatment of osteoporosis. Nat Rev Endocrinol 2011; 7: 647-656.
- Kassenärztliche Bundesvereinigung (KBV), Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Raloxifen. Dtsch Arztebl 2014; 111: Beilage: "Wirkstoff aktuell" 4/2014.
- Amgen GmbH: Rote-Hand-Brief zu Denosumab (Prolia®): Wichtige aktualisierte Informationen für Angehörige der medizinischen Heilberufe, um die Risiken für das Auftreten von Kieferosteonekrosen und Hypokalzämien zu minimieren. Rote-Hand-Brief vom 3. September 2014.
- Hodsman AB, Bauer DC, Dempster DW et al.: Parathyroid hormone and teriparatide for the treatment of osteoporosis: a review of the evidence and suggested guidelines for its use. Endocr Rev 2005; 26: 688-703.
- Saag KG, Zanchetta JR, Devogelaer JP et al.: Effects of teriparatide versus alendronate for treating glucocorticoid-induced osteoporosis: thirty-six-month results of a randomized, double-blind, controlled trial. Arthritis Rheum 2009; 60: 3346-3355.
- Tastekin N: Probable osteosarcoma risk after prolonged teriparatide treatment: comment on the article by Saag KG et al.: Arthritis Rheum 2010; 62: 1837-1838.
- Meyer R: Effekte auf Endothelien. Dtsch Arztebl 2016; 113: 1103.
- Boonen S, Ferrari S, Miller PD et al.: Postmenopausal osteoporosis treatment with antiresorptives. J Bone Min Res 2012; 27: 963-974.
- Miller PD, Bolognese MA, Lewiecki EM et al.: Effect of denosumab on bone density and turnover in postmenopausal women with low bone mass after long term continued, discontinued and restarting of therapy. Bone 2008; 43: 222-229.
- Popp AW, Zysset PK, Lippuner K: Rebound associated vertebral fractures after discontinuation of denosumab. Osteop International 2016; 27: 1917-1921.
- Lamy O, Gonzalez-Rodriguez E, Stoll D et al.: Severe rebound associated vertebral fractures after denosumab discontinuation. J Clin Endocrinol Metab 2017; 102: 354-358.
- Chavassieux P, Chapurlat R, Portero-Muzy N et al.: Bone-forming and antiresorptive Effects of romosozumab in postmenopausal women with osteoporosis: bone histomorphometry and microcomputed tomography analysis after 2 and 12 months of treatment. J Bone Miner Res 2019; 34: 1597-1608.
- Wehmeyer C, Frank S, Beckmann D et al.: Sclerostin inhibition promotes TNF-dependent inflammatory joint destruction. Sci Transl Med 2016; 8: 330ra35.
- Cain CJ, Rueda R, McLelland B et al.: Absence of sclerostin adversely affects B-cell survival. J Bone Miner Res 2012; 27: 1451-1461.
- Evenepoel P, Goffin E, Meijers B et al.: Sclerostin serum levels and vascular calcification progression in prevalent renal transplant recipients. J Clin Endocrinol Metab 2015; 100: 4669-4676.
- Kassenärztliche Bundesvereinigung (KBV), Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Denosumab. Dtsch Arztebl 2011; 108: Beilage: "Wirkstoff aktuell" 3/2011.
- Boonen S, Ferrari S, Miller PD et al.: Postmenopausal osteoporosis treatment with antiresorptives: effects of discontinuation or longterm continuation on bone turnover and fracture risk – a perspective. J Bone Miner Res 2012; 27: 963-974.
- Whitaker M, Guo J, Kehoe T, Benson G: Bisphosphonates for osteoporosis – where do we go from here? N Engl J Med 2012; 366(22): 2048-2051.
- Black DM, Kelly MP, Genant HK et al.: Bisphosphonates and fractures of the subtrochanteric or diaphyseal femur. N Engl J Med 2010; 362: 1761-1771.
vorab online
Dieser Artikel wurde am 13. Februar 2020 vorab online veröffentlicht.
