Monoklonale Antikörper zur Prophylaxe von Migräne – Erenumab (Aimovig®), Galcanezumab (Emgality®) und Fremanezumab (Ajovy®) – Wechsel bei Nichtansprechen?
Zugelassene Indikation und Wirkmechanismus
Seit Mitte 2018 wurden in der EU bereits drei monoklonale Antikörper (monoclonal antibodies, mAbs) zur Prophylaxe von Migräne bei Erwachsenen mit mindestens vier Migränetagen pro Monat zugelassen: Erenumab (Aimovig®), Galcanezumab (Emgality®) und Fremanezumab (Ajovy®). Sie richten sich spezifisch gegen das migräneauslösende Neuropeptid Calcitonin-Gene-Related-Peptide (CGRP) bzw. gegen den CGRP-Rezeptor und haben damit ein neues Wirkprinzip, das an einem für die Pathophysiologie der Migräne zentralen Mechanismus angreift. CGRP reguliert die nozizeptive Signalübertragung und wirkt als Vasodilatator. Der CGRP-Spiegel steigt – im Gegensatz zu anderen Neuropeptiden – während eines Migräneanfalls an und normalisiert sich beim Abklingen der Kopfschmerzen. Die intravenöse Infusion von CGRP löst bei Patienten migräneähnliche Kopfschmerzen aus. Der CGRP-Rezeptor findet sich vor allem in Regionen, die für die Pathophysiologie der Migräne relevant sind, wie etwa dem Ganglion trigeminale.
Markteinführung und frühe Nutzenbewertung
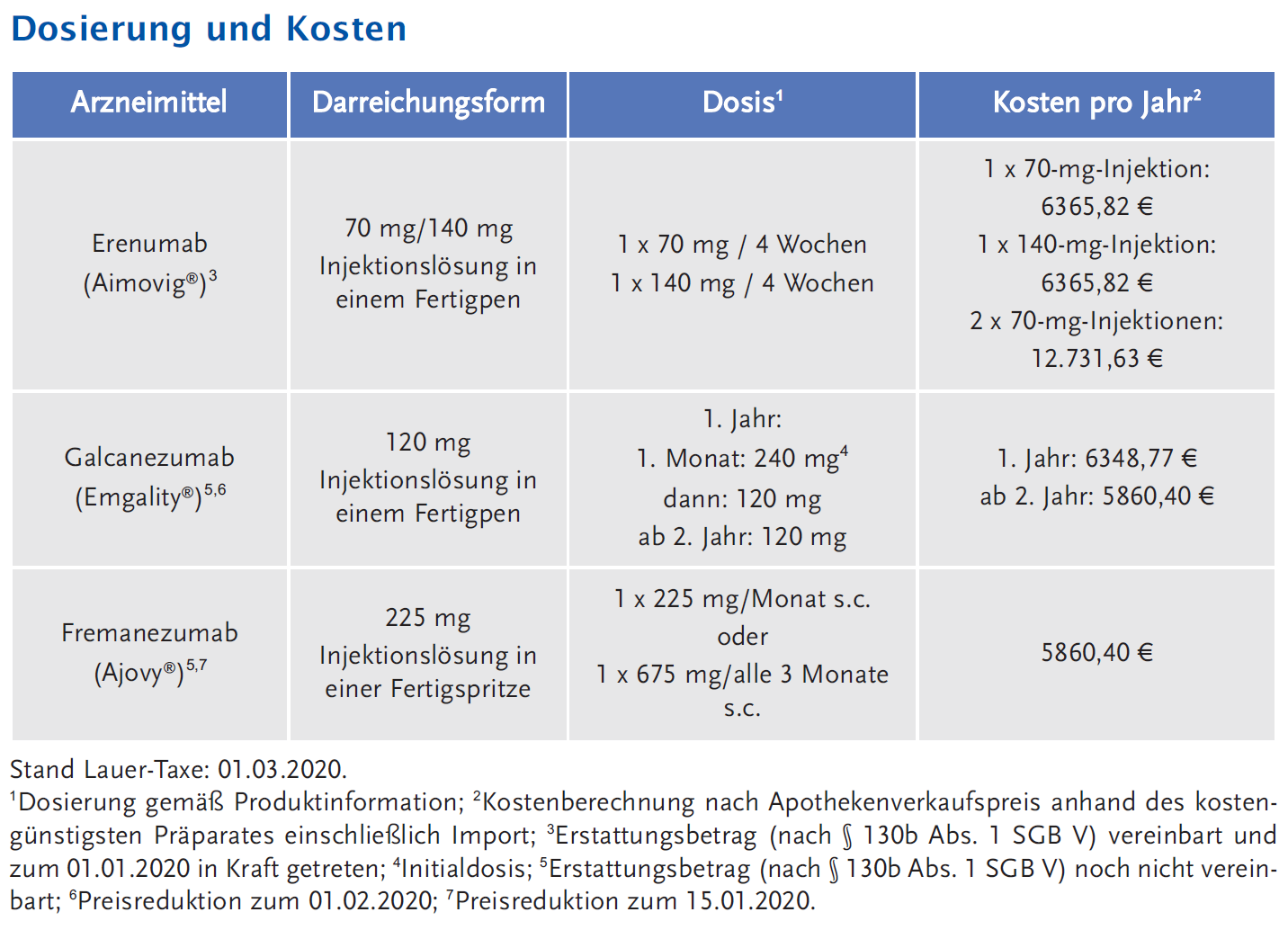
Informationen zur Zulassung der drei Wirkstoffe sind auf der Internetseite der AkdÄ verfügbar: Erenumab, Galcanezumab und Fremanezumab. Die AkdÄ hat zudem eine Übersicht über ihre Wirksamkeit und Sicherheit sowie über die jeweiligen Verfahren der frühen Nutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA) (§ 35a Absatz 1 SGB V) und die Jahrestherapiekosten veröffentlicht, um Ärzten eine Hilfestellung zur evidenzbasierten und rationalen Verordnung von Arzneimitteln zur Migräneprophylaxe zu geben: https://www.akdae.de/Arzneimitteltherapie/AVP/vorab/20191217-Migraeneprophylaxe.pdf.
Bewertung
Erenumab, Galcanezumab und Fremanezumab haben ein neues Wirkprinzip, welches an einem für die Pathophysiologie der Migräne zentralen Mechanismus angreift. Allerdings ist ihre prophylaktische Wirksamkeit lediglich als moderat einzustufen, ähnlich den bisher verfügbaren Arzneimitteln zur Migräneprophylaxe. Auch wenn Responderanalysen zum Anteil der Patienten mit einer mindestens 50-prozentigen Reduktion der Migränetage pro Monat die Wirksamkeit der Antikörper relativ hoch erscheinen lassen, betrug in den Zulassungsstudien die absolute Reduktion der monatlichen Migränetage gegenüber Placebo zwischen 1,2 und 2,3 Tage bei episodischer Migräne (EM) und zwischen 1,7 und 2,5 Tage bei chronischer Migräne (CM). Nur jeder fünfte bis sechste Patient hat durch einen der mAbs mehr als 50 % weniger Migränetage pro Monat. Dafür beträgt die Number needed to treat (NNT) im Vergleich zu Placebo 4–8 bei CM und 4–6 bei EM. Aus klinischer Sicht entspricht dies einem moderaten therapeutischen Nutzen.
Ein Vorteil gegenüber bisher verfügbaren Wirkstoffen scheint die bessere Verträglichkeit zu sein. Ein weiterer Vorteil könnte die vierwöchentliche bzw. die vierteljährliche Applikation (bei Fremanezumab) sein, die allerdings subkutan erfolgen muss. CGRP hat eine ausgeprägte vasodilatatorische Wirkung. Die Hemmung von CGRP oder seines Rezeptors birgt daher theoretisch das Risiko für kardiovaskuläre Ereignisse, das bei Migräne ohnehin gering erhöht ist. Die verfügbaren Studien ergaben keine eindeutigen Hinweise auf ein erhöhtes kardiovaskuläres Risiko, allerdings wurden vorbelastete Patienten ausgeschlossen. Die Risiken einer langfristigen Blockade von CGRP können zum jetzigen Zeitpunkt nicht abschließend beurteilt werden, da Langzeitdaten fehlen.
Der Einsatz von Erenumab, Galcanezumab und Fremanezumab sollte daher vorerst nur nach Versagen anderer Arzneimittel zur Migräneprophylaxe oder bei deren Unverträglichkeit erfolgen.
Ob es einen klinisch relevanten Unterschied zwischen CGRP-Antagonisten und CGRP-Rezeptorantagonisten gibt, kann nur anhand von Daten aus klinischen Studien beurteilt werden. Derzeit liegen keine Daten vor für die Umstellung bei Nichtansprechen der Therapie mit einem CGRP-Antagonisten auf einen CGRP-Rezeptorantagonisten bzw. vice versa. Eine Therapieumstellung ist daher nur auf individueller Basis möglich. Die Wirksamkeit einer Therapieumstellung bei Nichtansprechen sollte in klinischen Studien überprüft werden.
Wechsel bei Nichtansprechen?
Während die Wirkstoff-Rezeptor-Interaktion von Erenumab weitgehend mit der von klassischen Rezeptorantagonisten vergleichbar sein soll und CGRP-Rezeptoren wohl im Steady-State weitgehend von Erenumab besetzt sind, wirken CGRP-Antagonisten, indem sie das freie Peptid binden und seine Bindung an die Rezeptoren verhindern.
Aus diesem Unterschied und aus der Tatsache, dass nur jeder fünfte bis sechste Patient in den Zulassungsstudien unter der Behandlung mit einem der drei verfügbaren mAbs mehr als 50 % weniger Migränetage pro Monat hatte, lässt sich die Überlegung ableiten, ob bei Nichtansprechen der Therapie mit einem CGRP-Antagonisten ein Wechsel auf einen CGRP-Rezeptorantagonisten bzw. vice versa sinnvoll wäre. Die Unterschiede im Wirkungsmechanismus zwischen CGRP-Antagonisten und CGRP-Rezeptorantagonisten könnten aber auch in Bezug auf ihre Sicherheit und Verträglichkeit relevant sein (1).
Die aktuell erschienene Ergänzung der deutschen S1-Leitlinie „Therapie der Migräneattacke und Prophylaxe der Migräne“ zur Prophylaxe der Migräne mit monoklonalen Antikörpern gegen CGRP oder den CGRP-Rezeptor bewertet einen solchen Wechsel als gerechtfertigt, weist aber darauf hin, dass zu dieser Frage keine Daten aus randomisierten Studien oder Registern verfügbar sind (https://www.dgn.org/images/red_leitlinien/LL_2019/PDFs_Download/030057_LL_Addendum_Migr%C3%A4ne_2019_aktualisiert2.pdf).
Ob dieses Vorgehen – Wechsel bei Nichtansprechen von Erenumab auf Galcanezumab oder Fremanezumab bzw. vice versa – pharmakologisch nachvollziehbar ist, hängt davon ab, ob die beiden pharmakologischen Wirkmechanismen (einerseits direkter CGRP-Antagonist vs. andererseits CGRP-Rezeptorantagonist) als hinreichend verschieden betrachtet werden können, um damit einen Wechsel in der Therapie zu begründen. Es gibt eine Reihe von möglichen pharmakologisch plausiblen Erklärungen, weshalb die Blockade des Liganden (CGRP) vs. die direkte Blockade des Rezeptors unterschiedlich effektiv sein kann.
Tringali et al. beschreiben in einer Publikation aus dem Jahr 2019 ausführlich die CGRP-Biologie (1). CGRP existiert in zwei Isoformen, α- und β-CGRP; die beiden Isoformen zeigen eine ähnliche biologische Aktivität. Die α-Isoform wird in der Regel als die wesentliche neuronale Form angesehen, da sie in den sensorischen Nervenendigungen sowohl im peripheren als auch im zentralen Nervensystem freigesetzt wird. β-CGRP wurde ursprünglich im enterischen Nervensystem identifiziert, aber neuere Daten zeigen, dass es zusammen mit α-CGRP auch auf vaskulärer Ebene freigesetzt werden kann. CGRP wird in großen Vesikeln innerhalb der Nervenendigungen gespeichert, von wo aus es über klassische kalziumabhängige Depolarisationsmechanismen freigesetzt wird.
Mehr als 50 % aller Neuronen im Ganglion trigeminale enthalten CGRP, allerdings sind CGRP und der CGRP-Rezeptor selten in denselben Zellen lokalisiert: Etwa die Hälfte der CGRP-Neuronen exprimiert überwiegend CGRP-Rezeptoren, während der Rest CGRP exprimiert. Zudem werden CGRP und der CGRP-Rezeptor auch von Satellitengliazellen exprimiert.
Sowohl die Signalaktivität innerhalb des Nervensystems als auch die Vasodilatation auf Gefäßebene werden über die Aktivierung des spezifischen CGRP-Rezeptors vermittelt, eines G-Protein-gekoppelten Rezeptors. CGRP ist an physiologischen Mechanismen im gesamten Körper beteiligt, einschließlich der Aufrechterhaltung der kardio- und zerebrovaskulären Homöostase, der Wundheilung und der Modulation der gastrointestinalen Motilität (2). CGRP, das von Nervenendigungen auf Gefäßebene freigesetzt wird, bewirkt eine Vasodilatation durch direkte rezeptorvermittelte Entspannung der glatten Muskelzellen sowie durch einen endothelabhängigen, Stickstoffmonoxid-getriebenen Mechanismus. Die CGRP-induzierte Vasodilatation ist eine lokale, parakrine Wirkung, danach diffundiert CGRP in den Blutkreislauf, sodass der im Plasma nachgewiesene CGRP-Spiegel als Folge eines „Überschwappens“ vom Wirkungsort in den systemischen Kreislauf beschrieben wird. Dementsprechend sind physiologische CGRP-Plasmaspiegel sehr niedrig und sollen als ein zuverlässiger, wenn auch indirekter Indikator für die Aktivierung von vaskulären CGRP-Rezeptoren herangezogen werden (1).
Trigali et al. berichten von Untersuchungen, die gezeigt haben, dass der CGRP-Plasmaspiegel bei Patienten, die längerfristig mit einem CGRP-Antagonisten (Galcanezumab) behandelt werden, ansteigt, sodass die Aufrechterhaltung eines physiologischen Niveaus der Rezeptorstimulation trotz einer Anti-Migräne-Aktivität angenommen wird. Dies könnte aus Sicht der Autoren einen potenziellen Vorteil im Sicherheitsprofil von CGRP-Antagonisten im Vergleich zu CGRP-Rezeptorantagonisten darstellen, weil dadurch weitere physiologische Funktionen von CGRP aufrechterhalten werden können. Trotz der Unterschiede im Wirkungsmechanismus gehen die Autoren aber davon aus, dass das funktionelle Ergebnis der CGRP-Blockade mit dem der Rezeptorblockade vergleichbar ist, allerdings unter der Voraussetzung, dass bei der Behandlung mit CGRP-Antagonisten kein freies CGRP verbleibt (1).
Allerdings weisen die Autoren darauf hin, dass der Anstieg der Plasmaspiegel von CGRP mit der applizierten Antikörperdosis steigt, sodass es wahrscheinlich ist, dass vor allem antikörpergebundenes CGRP gemessen wird. Ob es eine Feedbackregulation gibt und die CGRP-Spiegel sich bei Ansprechen vs. Nichtansprechen unterscheiden, ist unbekannt (1).
Darüber hinaus muss berücksichtigt werden, dass auch andere Peptide als CGRP an den CGRP-Rezeptor binden und CGRP auch an Nicht-CGRP-Rezeptoren binden kann. Ebenso wurde kürzlich erkannt, dass CGRP-Rezeptoren nicht nur dann Signalwege auslösen können, wenn sie auf der Zelloberfläche exprimiert werden, sondern auch während der intrazellulären Internalisierung im Endosom, wobei sie allerdings für die aktuell verfügbaren CGRP-Rezeptorantagonisten unzugänglich sind (2).
Ob ein klinisch relevanter Unterschied zwischen CGRP-Antagonisten und CGRP-Rezeptorantagonisten besteht, lässt sich daher nur anhand von Daten aus weiteren klinischen Studien (z. B. unter Einbeziehung der Plasmaspiegel von CGRP als Biomarker für das Ansprechen) beurteilen, in denen getestet wird, ob Migränepatienten, die nicht auf CGRP-Antagonisten ansprechen, auf CGRP-Rezeptorantagonisten eine Besserung der Beschwerden zeigen. Bei zwei anderen pharmakologischen Ligand/Rezeptor-Targets – TNF-ɑ (Tumornekrosefaktor-α) und PD1 (Programmed cell death protein 1) – haben sich beispielsweise bisher keine gravierenden Unterschiede der Hemmung von Ligand und Rezeptor ergeben.
Weiterhin ist zu berücksichtigen, dass in klinischen Studien die Ansprechrate anhand der mindestens 50-prozentigen Reduktion der monatlichen Migränetage (MMT) klar definiert wird. In der klinischen Praxis lässt sich dies nicht immer anwenden. Tiseo et al. führen an, dass für die Patienten nicht nur die Verringerung der MMT, sondern auch die Reduktion der Schmerzintensität, die Dauer der Attacken, das Ansprechen auf die Akutbehandlung und der Effekt auf andere Migränesymptome relevant sein können. Bei Patienten mit CM kann sogar eine lediglich 30-prozentige Reduktion der MMT klinisch relevant sein, insbesondere wenn sie mit einer Reduktion der Schmerzintensität, einer Verbesserung der Lebensqualität oder mit der Steigerung der Anzahl der kopfschmerzfreien Tage einhergeht (2).
Nichols et al. weisen darauf hin, dass Patienten, die innerhalb der ersten zwei Monate nicht gut auf Galcanezumab ansprechen, bei fortgesetzter Therapie noch eine Verbesserung des Ansprechens zeigen können (3). Daher ist in klinischen Studien zu überprüfen, ob und wann eine Fortführung der Therapie oder ein Wechsel aussichtsreicher ist.
Solange für die CGRP-Antagonisten und CGRP-Rezeptorantagonisten keine Daten aus klinischen (nicht aus experimentell-pharmakologischen) Studien oder Registern verfügbar sind, wird die Frage, ob ein Wechsel bei Nichtansprechen gerechtfertigt ist, noch nicht belastbar beantwortet werden können. Zwischenzeitlich erscheint ein pragmatisches Vorgehen auf individueller Basis möglich.
„Neue Arzneimittel“ ist eine Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu neu zugelassenen Arzneimitteln oder zu neu zugelassenen Indikationen. Ziel ist es, den Ärzten zeitnah Informationen zu diesen Arzneimitteln zur Verfügung zu stellen, zunächst bei Markteinführung sowie nach der frühen Nutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA) (§ 35a Absatz 1 SGB V). „Neue Arzneimittel“ bei Markteinführung enthält Informationen basierend auf dem Europäischen Öffentlichen Bewertungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) sowie weiteren bei Markteinführung vorliegenden Daten aus klinischen Studien. Nach Abschluss der frühen Nutzenbewertung wird der Zusatznutzen des neuen Arzneimittels und seine therapeutische Bedeutung auf der Basis der Dossierbewertung des IQWiG, der Stellungnahme der AkdÄ und des Beschlusses des G-BA im Rahmen der frühen Nutzenbewertung dargestellt („Update – Neue Arzneimittel“).
Literatur
- Tringali G, Navarra P: Anti-CGRP and anti-CGRP receptor monoclonal antibodies as antimigraine agents. Potential differences in safety profile postulated on a pathophysiological basis. Peptides 2019; 116: 16-21.
- Tiseo C, Ornello R, Pistoia F, Sacco S: How to integrate monoclonal antibodies targeting the calcitonin gene-related peptide or its receptor in daily clinical practice. J Headache Pain 2019; 20 (1): 49.
- Nichols R, Doty E, Sacco S et al: Analysis of initial nonresponders to galcanezumab in patients with episodic or chronic migraine: results from the EVOLVE-1, EVOLVE-2, and REGAIN randomized, double-blind, placebo-controlled studies. Headache 2019; 59: 192-204.
vorab online
Dieser Artikel wurde am 13. Februar 2020 vorab online veröffentlicht.
