Welchen Stellenwert haben Insulinanaloga in der Behandlung des Diabetes?
Nachdruck aus: Zeitschrift für Allgemeinmedizin 2019; 95: 360-365
Hintergrund
Der Anteil der verordneten Insulinanaloga hat sich in den letzten zehn Jahren mehr als verdoppelt und ist auf einen Anteil von 69 % am Volumen aller Insulinverordnungen gestiegen. Die Frage stellt sich, ob es gute Argumente für ein solches Verordnungsverhalten gibt.
Suchmethodik
Recherche in Medline und Cochrane zu Insulinanaloga.
Wichtigste Botschaften
Kurz wirkende Analoga haben einen schnelleren Wirkbeginn und wirken meist kürzer als Normalinsulin. Die Wirkung lang wirkender Analoga hält länger an als die eines NPH-Insulins. Belege für einen Nutzen von Insulinanaloga hinsichtlich klinisch relevanter Endpunkte gibt es nicht. Auch hinsichtlich intermediärer Endpunkte konnte kein Vorteil belegt werden. Für Normalinsulin ist ein Spritz-Ess-Abstand nicht erforderlich. Die Reduktion nächtlicher Hypoglykämien um knapp 20 % (relative Reduktion) ist bei Normalinsulin nur dann relevant, wenn zu niedrige HbA1c-Ziele verfolgt werden. Schwere Hypoglykämien sind gleich häufig.
Schlussfolgerungen
Bis auf wenige spezielle Gruppen von Personen mit Typ-1-Diabetes haben Insulinanaloga kaum einen Stellenwert, ihre Verordnung ist in den meisten Fällen unwirtschaftlich.
Hintergrund
In Deutschland wurde bei ca. 7 % der Erwachsenen ein Typ-2-Diabetes diagnostiziert (1). 1921 wurde das Insulin entdeckt – zwei Jahre später begann die Insulinproduktion in Europa. 1955 wurde die gesamte Aminosäurensequenz des Insulins publiziert. Lange Zeit wurde ausschließlich Insulin aus Schweine- und Rinder-Pankreas verwendet – Letzteres ähnelte dem humanen Insulin weniger und ist nach dem BSE-Skandal sicherlich auch eher problematisch zu sehen. 1976 wurde erstmals humanes Insulin aus Schweineinsulin synthetisiert – beide unterscheiden sich nur durch eine Aminosäure, seit 1979 gibt es eine gentechnische Synthese von Humaninsulin, seit 1996 werden schnell wirkende Insulinanaloga vermarktet, seit dem Jahr 2000 auch lang wirkende.
Die kurz wirkenden Insulinanaloga unterscheiden sich in einigen Aminosäuren von Humaninsulin. Pharmakodynamisch hat Normalinsulin gegenüber dem natürlichen Insulin aus dem Pankreas einen Nachteil: Die Insulinmoleküle sind in Hexameren gruppiert, die nach einigen Minuten in Dimere zerfallen. Erst wenn diese endgültig in einzelne Moleküle zerfallen sind, wird das Insulin wirksam. Die kurz wirksamen Insulinanaloga fluten schnel ler an und haben eine kürzere Wirkdauer als Normalinsulin. Die Wirkdauer der Ana loga hängt auch von der applizierten Dosis ab (Tab. 1).

Humaninsulin kann durch Bindung des Insulins an Protamin retardiert werden (NPH-Insulin). NPH-Insulin muss vor der Injektion mindestens 20-mal geschwenkt werden, damit sich die Lösung gut durchmischt und die Wirkung gesichert ist.
Die Insulinanaloga Glargin, Detemir und Degludec sind klare Lösungen, die nicht mechanisch vorbereitet werden müssen.
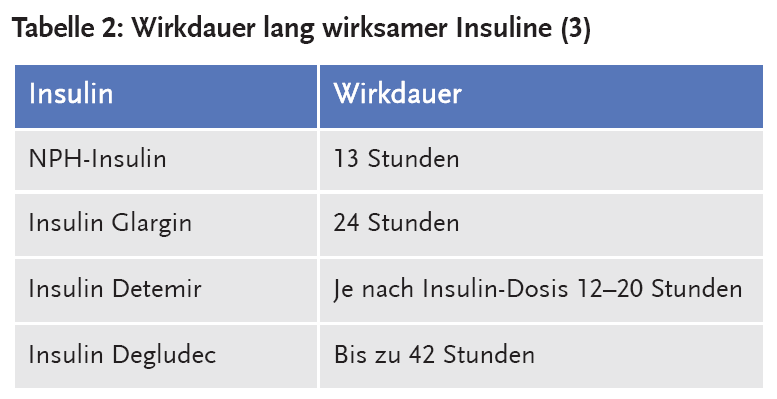
Die vom Hersteller behauptete Wirkdauer von Insulin Glargin von 24 Stunden kann allerdings in gewisser Weise als Marketing definiert werden – Glargin wirkt nur 24 Stunden lang, wenn nicht mehr als 10 % der biologischen Wirkung gefordert wird, um noch von einer Wirksamkeit zu sprechen (4) (Tab. 2).
Suchmethodik
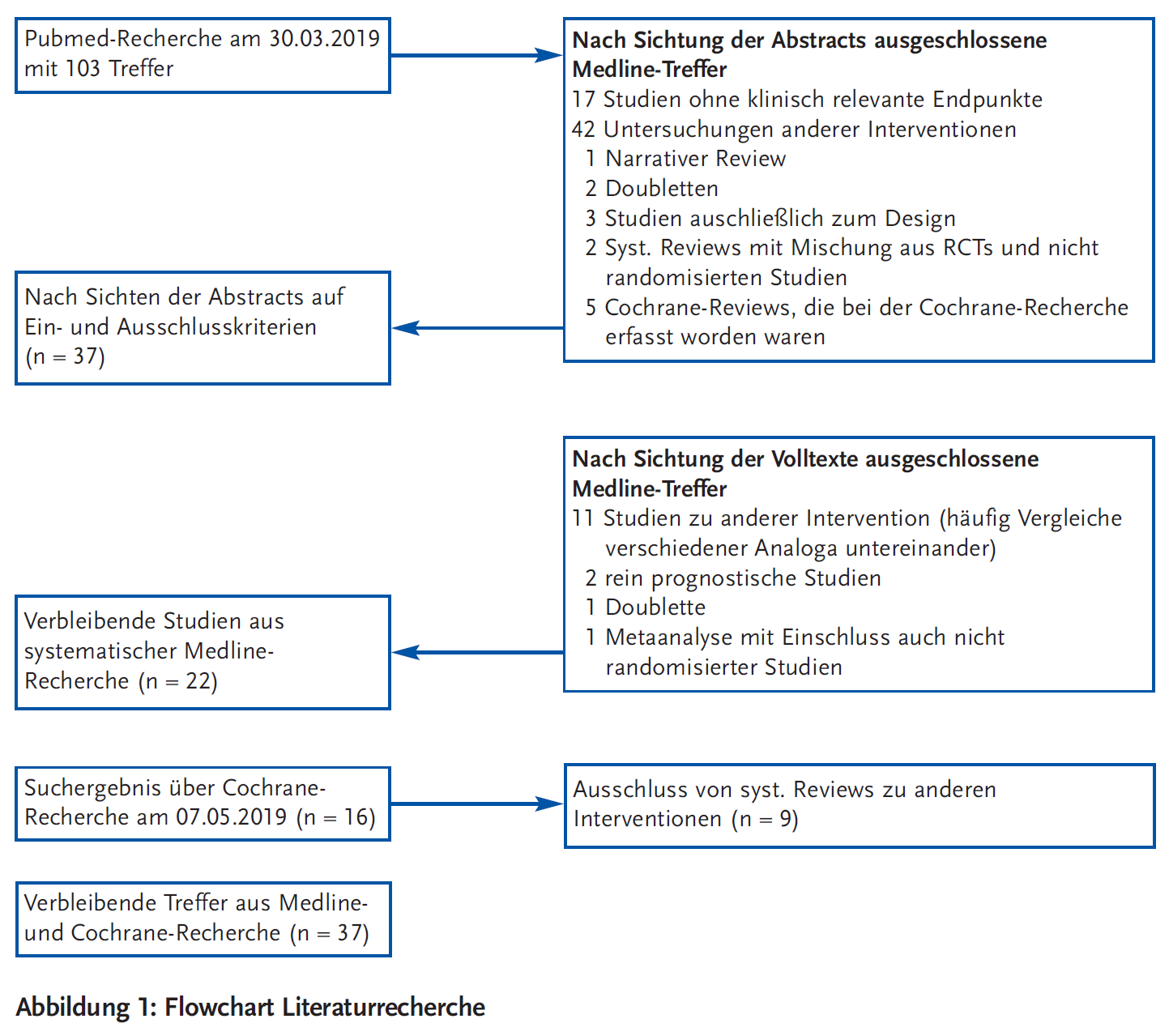
Am 30.3.2019 erfolgte eine Pubmed-Recherche mit den Suchbegriffen „Insulin analogues“ AND „mortality“ OR „end stage renal disease“ OR „amputation“ OR „blindness“ OR „hypoglycemia“ OR „myocardial infarction“ OR „stroke“ und den limits „humans“ sowie „ran domized controlled trials“ OR „metaanalysis“ OR „systematic review“, am 7.5.2019 eine Cochrane-Recherche mit den Suchbegriffen „Insulin analogues“. Die Ergebnisse der Recherche zeigt Abbildung 1.
Antworten auf häufige Fragen
1. Haben Insulinanaloga klinisch relevante Vorteile?
Bislang gibt es keine randomisierte, kontrollierte Studie, die belegt, dass Insulinanaloga klinische Endpunkte reduzieren. Ohne hin ist der Nutzennachweis für eine Insulin-Behandlung bei Typ-2-Diabetes (bei Typ-1-Diabetes ist der Nutzen natürlich evident) sehr dünn – einzig in der UKPDS 33 (5) kam es unter Senkung des HbA1c von 7,9 auf 7,0 % zu einer geringen Senkung mikrovaskulärer Endpunkte um 0,3 pro 100 Patientenjahre – um den Preis einer Zunahme schwerer hypoglykämischer Episoden um 2,3 %. Bei kardial vorerkrankten Patienten wird durch die Verfügbarkeit von Substanzen wie Empagliflozin und Liraglutid, für die anders als für Insulin auch eine Senkung der Gesamt-Sterblichkeit nachgewiesen werden konnte (6;7), die Indikation für eine Insulintherapie sicherlich sel tener gestellt werden.
In Ermangelung von Studien, die die Reduktion von Folgeerkrankungen eines Diabetes nachweisen könnten, werden intermediäre Endpunkte als Argumente für Insulinanaloga angeführt:
- Wegfallen des Abstands zwischen Insulin-Injektion und Nahrungsaufnahme bei kurz wirkenden Analoga (Spritz-Ess-Abstand)
- Verminderung vor allem von nächtlichen Hypoglykämien unter lang wirksamen Analoga
- Die Frage stellt sich: Sind diese beiden pharmakodynamischen Vorteile klinisch relevant?
2. Ist ein Spritz-Ess-Abstand bei Normalinsulin erforderlich?
In einem randomisierten Vergleich (8) wurde untersucht, ob sich das Weglassen eines Spritz-Ess-Abstands bei Normalinsulin negativ auswirkt. Dies war weder hinsichtlich des HbA1c noch bezüglich der Hypoglykämie-Rate der Fall – die Therapiezufriedenheit der Probanden war ohne Spritz-Ess-Abstand höher. Wenn aber ein Spritz-Ess-Abstand bei Gabe von Normalinsulin nicht nötig ist, entfällt ein wesentliches Argument für den Ein satz kurz wirkender Insulinanaloga.
In mehreren systematischen Reviews (9-11) wurde der Nutzen kurz wirkender Analoga im Vergleich zu Normalinsulin untersucht. Das HbA1c lag unter den Analoga bei Typ-2-Diabetes nicht unterschiedlich im Vergleich zu Humaninsulin und bei Typ-1-Diabetes – klinisch nicht relevant – um 0,1 %-Punkte niedriger, schwere Hypoglykämien traten bei erwachsenen Patienten mit Typ-1-Diabetes um 18 (Glargin) bis 26 % (Detemir) seltener als unter NPH-Insulin auf (relative Risikoreduktion), bei Kindern mit Typ-1-Diabetes um 29 %, bei Typ-2-Diabetes dagegen nicht.
3. Wie sind nächtliche Hypoglykämien zu bewerten?
Lang wirkende Insulinanaloga haben nach Angaben der Hersteller eine etwas länger anhaltende und flachere Wirkungskurve als NPH-Insulin. Sie werden häufig als abendliches Basalinsulin verabreicht. Hieraus ergibt sich die pharmakologische Konsequenz, dass es unter NPH-Insulin vermehrt nächtliche Hypoglykämien geben kann. Anders als beispielsweise in der Fachinformation dargestellt (12), unterscheiden sich Wirkanstieg und -dauer aber nicht wesentlich (13).
In drei Metaanalysen wurden Häufigkeit und Schwere der Hypoglykämie-Raten bei Be hand lung mit lang wirkenden Insulinanaloga bei Typ-1- (14;15) und Typ-2-Diabetes (16) unter sucht. Bei Typ-1-Diabetes lag das HbA1c unter den lang wirkenden Analoga um 0,07 %-Punkte niedriger, schwere Hypoglykämien traten um 0,02 % (0,86/Patientenjahr) seltener auf. Der Unterschied beim HbA1c ist klinisch nicht relevant, der bei den schwe ren Hypoglykämien zu gering ist, um daraus einen Vorteil der Analoga abzuleiten.
Zu diesem Ergebnis kommen auch die Autoren der deutschen S3-Leitlinie „Therapie des Typ-1-Diabetes“ (17), die in ihren Empfehlungen (anders als in Empfehlungen ande rer Länder) Insulinanaloga nicht präferieren und dies dezidiert begründen.
Bei Typ-2-Diabetes gab es weder beim HbA1c noch bei der Häufigkeit schwerer Hypoglykämien einen Unterschied. Leichte, auch nächtliche Hypoglykämien kamen bei den Analoga um 0,02 % seltener vor (16).
Hier ist Aufmerksamkeit für die in den eingeschlossenen Studien definierten Ziele für Nüchternglukose und HbA1c geboten: wie z. B. in einer Studie zum Vergleich zwischen Basis-Bolus-Behandlung mit zwei Analoga vs. NPH und Normalinsulin (18) trat ein Unterschied bei den nächtlichen Hypoglykämien (im konkreten Fall bei Patienten mit Typ-1-Diabetes auch bei schweren Hypoglykämien) nur dann zu Tage, wenn sehr niedrige gly kämische Therapieziele gesetzt wurden – konkret eine Nüchtern-Glukose von 102–131,5 mg/dl (5,7–7,3 mmol/l). Im Vergleich zwischen NPH und Detemir bei Typ-1-Diabetes (19) war das Behandlungsziel eine Nüchtern-Glukose unter 108 mg/dl (6 mmol/l). In den neuen Studien zum am längsten wirkenden Analog-Insulin Degludec (20-22) wurde – ohnehin nur im Vergleich zu Glargin, für das es, wie aufgeführt, keine Nutzenbelege gibt – die abendliche Basalinsulin-Gabe auf eine Nüchtern-Glukose von 71–108 mg/dl (3,9–6 mol/l) titriert, und ab der 8. Studienwoche wurde das HbA1c unter 7,0 % gesenkt. Für den Nutzen solch niedriger glykämischer Behandlungsziele gibt es aber keine Belege (23) – im Gegenteil: Es gibt eine Menge von Hinweisen darauf, dass wegen der Hypoglykämie-Gefahr bei Einsatz von Insulin das HbA1c nicht unter 7,0 % gesenkt werden sollte (24).
Zusammenfassend kann zum Thema nächtlicher Hypoglykämien festgehalten werden: Nur durch eine – medizinisch aber nicht zu begründende – Herabsetzung des Therapie ziels für HbA1c oder Plasmaglukose kann ein Wirkvorteil hinsichtlich einer Reduktion nächtlicher Hypoglykämien nachgewiesen werden. Zudem sind nächtliche Hypoglykämien dann von fraglicher Relevanz, wenn sie nicht schwer sind. Hinsichtlich schwerer Hypoglykämien haben Insulinanaloga aber kaum Vorteile.
4. Gibt es spezifische Risiken beim Einsatz von Insulinanaloga?
Diese Frage ist schwer zu beantworten. In einer metaanalytischen Auswertung von Kohor ten (25) fanden sich Hinweise auf eine gehäufte Koinzidenz von Diabetes und Krebs – unklar bleibt bei solchen Kohorten, ob es hier tatsächlich eine Kausalität gibt. Aus dem Vergleich der nationalen Register für Krebs und Diabetes in Dänemark (26) ergeben sich Hinweise darauf, dass eine Insulinbehandlung v. a. in den ersten fünf Jahren mit einem erhöhten Krebs-Risiko assoziiert ist. Pathophysiologische Überlegungen sprechen dafür: Insulin stimuliert auch dem IGF-1-Rezeptor ähnliche Rezeptoren (27) – eine entsprechende Wachstumshormon-ähnliche Wirkung könnte sowohl ein Tumorwachstum stimulieren als auch das Risiko für eine proliferative Retinopathie erhöhen. Mögliche Störfaktoren (Confounder) in den entsprechenden Kohorten-Studien machen eine kausale Zuordnung aber schwer, wenn nicht unmöglich.
In den letzten zehn Jahren erschien eine Reihe von Studien, die auf ein möglicherweise speziell durch Analoga erhöhtes Malignom-Risiko hinwiesen (28-30). In einer Kohorten-Studie (31) wurde dagegen ein niedrigeres Krebs-Risiko von Analoga im Vergleich zu Humaninsulin gefunden – allerdings ein um relativ 58 % höheres Risiko von Brustkrebs. In der letzten Metaanalyse von Kohorten-Studien (32) wurde kein konsistenter Zusammenhang zwischen lang wirkenden Analoga und Krebs gefunden.
5. Wie viel kosten die verschiedenen Insuline, und wie häufig werden sie verordnet?
10 mal 3 ml Penfill-Ampullen kosten bei Analoga zwischen 103,02 (Lispro) und 144,80 Euro (Levemir), dieselbe Anzahl Penfill-Ampullen bei Humaninsulin zwischen 70,90 (Hum insulin basal) und 89,65 Euro (33). Damit kosten Insulinanaloga durchschnittlich ca. 50 % mehr als Humaninsulin (Rabatt-Verträge beispielsweise zu Insulin Glargin bleiben intransparent – es ist nicht bekannt, wie viel Geld die Krankenkassen für die Verordnung real erstatten).
Der Kostenanstieg ist in den USA um ein Vielfaches höher. Dort hat bereits eine inten sive Diskussion begonnen, eben diesen Kosten auch mit Leitlinienempfehlungen entgegenzuwirken, weil die Preise des Insulins, die sich in den Jahren 2013 bis 2016 fast verdoppelt hatten und die um das fast Zehnfache über dem von Humaninsulin liegen, dazu führten, dass Insulin, auch wenn es indiziert war, nicht eingesetzt wurde (34).
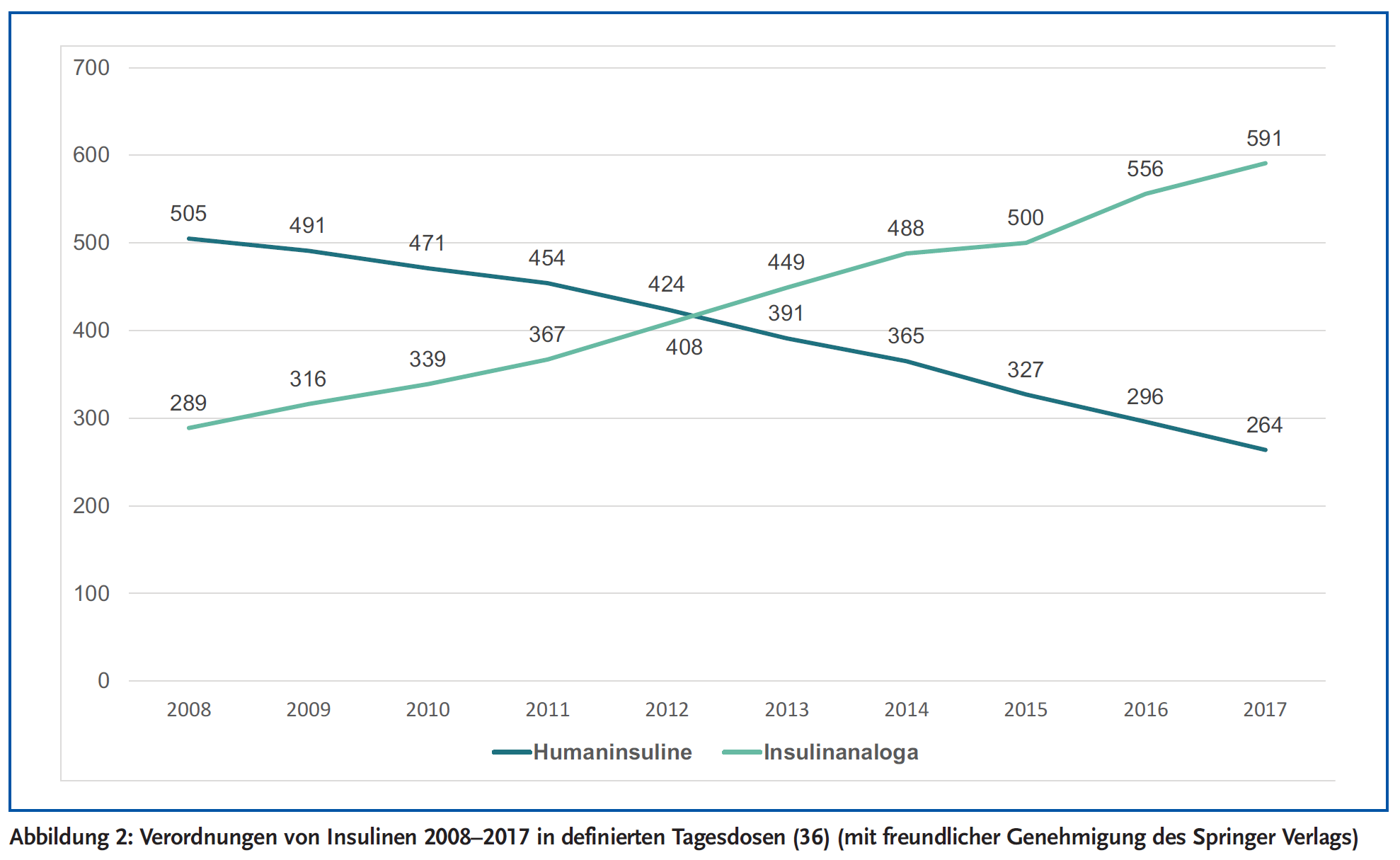
Die Verordnungszahlen (Abb. 2) haben sich auch in Deutschland komplett gedreht: Die Zahl der Verordnungen von Humaninsulin hat sich in den letzten Jahren fast halbiert, diejenige von Insulinanaloga mehr als verdoppelt. Insgesamt betrugen im Jahr 2017 die Nettokosten für alle Insulinpräparate 1290 Millionen Euro.
Der Gemeinsame Bundesausschuss erklärte in der Arzneimittelrichtlinie vom 15.2.2019 (35) die Verordnung von Insulinanaloga bei Patienten mit Typ-2-Diabetes in den meisten Fällen für unwirtschaftlich.
6. Ist es in der täglichen Versorgung möglich, von Insulinanaloga auf Normal- bzw. NPH-Insulin zu wechseln?
Hierzu liegen zwei aktuelle Untersuchungen aus der US-amerikanischen Gesundheitsfürsorge-Einrichtung Kaiser Permanente vor. Bei beiden handelt es sich um retrospektive Kohorten-Studien, die mit einem hohen Verzerrungsrisiko behaftet sind. Zugleich waren es Real-life-Anwendungsbeobachtungen, die möglicherweise mehr Ähnlichkeiten mit der täg lichen Praxis haben als die artifizielle Situation randomisierter Studien. In der einen Studie (37) wurde untersucht, wie häufig es bei neu auf Insulinanaloga oder NPH-Insulin eingestellten Patienten mit Typ-2-Diabetes zu so schweren Hypoglykämien kam, dass eine Klinikeinweisung notwendig wurde. Interessanterweise war dies häufiger unter lang wirkenden Analoga der Fall (11,9 vs. 8,1/1000 Patientenjahre), obwohl das HbA1c unter NPH-Insulin stärker vom Ausgangs-HbA1c von 9,4 % gesunken war.
In der zweiten Studie (38) wurde der HbA1c-Verlauf nach Wechsel von Analog- zu Humaninsulin beobachtet: Es kam anfangs zu einem geringen HbA1c-Anstieg (+ 0,14 %- Punkte), der am Ende der Studie nicht mehr nachzuweisen war. Die Rate schwerer Hypoglykämien stieg nicht.
Auch in Deutschland stieg die Rate schwerer Hypoglykämien von 2006–2011 trotz einer zunehmenden Verordnung von nicht mit Unterzuckerungen verbundenen Medikamenten. Schwere Hypoglykämien durch Sulfonylharnstoffe als Mono- oder Kombinationstherapie gingen signifikant zurück, desgleichen schwere Hypoglykämien unter Humaninsulin, während schwere Hypoglykämien unter einer intensivierten Therapie mit zwei Analog insulinen zunahmen (39).
Schlussfolgerungen
Ein Nutzen von Insulinanaloga konnte bislang nicht belegt werden. Sie haben allenfalls bei speziellen Patientengruppen mit Typ-1-Diabetes Vorteile:
- besonders stark von Hypoglykämien gefährdete Personen
- Personen mit kontinuierlichem Glukose-Monitoring, bei denen eine besonders schnelle Reaktion des via Pumpe applizierten Insulin von Bedeutung ist
- Personen, die nicht in der Lage sind, das erforderliche Schwenken von NPH-Insulin vor der Applikation durchzuführen.
Ansonsten ist in den allermeisten Fällen die Anwendung der deutlich teureren Insulinanaloga nicht gerechtfertigt.
Interessenkonflikte
Keine angegeben.
Literatur
- Kurth BM. Erste Ergebnisse aus der „Studie zur Gesundheit Erwachsener in Deutschland“ (DEGS). Bundesgesundheitsblt Gesundheitsforsch Gesundheitsschutz 2012; 55: 980-990.
- Fachinformationen von Insulin lispro Sanofi®, Apidra®, NovoRapid®, Fiasp® und Huminsulin® (letzter Zugriff am 14.05.2019).
- Fachinformationen von Insulin Huminsulin®, Lantus®, Levemir® und Tresiba® (letzter Zugriff am 14.05.2019).
- Heinemann L, Linkeschowa R, Rave K, et al. Time-action profile of the long-acting insulin analog insulin Glargine (HOE901) in comparison with those of NPH Insulin and Placebo. Diabetes Care 2000; 23: 644-649.
- Turner R, Holman R, C Cull, et al. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998; 352: 837-853.
- Zinman B, Wanner C, Lachin J, et al. for the EMPA-REG OUTCOME investigators. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015; 373: 2117-2128.
- Marso S, Daniels G, Brown-Frandsen K, et al.. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016; 375: 311-322.
- Müller N, Frank T, Kloos C, Lehmann T, Wolf G, Müller UA. Randomized crossover study to examine the necessity of an injection-to-meal interval in patients with type 2 diabetes mellitus and human insulin. Diabetes Care 2013; 36: 1865-1869.
- Siebenhofer A, Plank J, Berghold A, et al. Short acting insulin analogues versus regular human insulin in patients with diabetes mellitus. Cochrane Database Syst Rev 2006; 2: CD003287.
- Rys P, Pankiewicz O, Łach K, et al. Efficacy and safety comparison of rapid-acting insulin aspart and regular human insulin in the treatment of type 1 and type 2 diabetes mellitus: A systematic review. Diabetes Metab 2011; 37: 190-200.
- Pontiroli A, Miele L, Morabito A. Metabolic control and risk of hypoglycaemia during the first year of intensive insulin treatment in type 2 diabetes: systematic review and meta-analysis. Diabet Obes Metab 2012; 14: 433-446.
- Fachinformation Lantus®. www.fachinfo.de/suche/fi/007998 (letzter Zugriff am 14.05.2019).
- Heise T, Pieber TR. Towards peakless, reproducible and long-acting insulins. An assessment of the basal analogues based on isoglycaemic clamp studies. Diabet Obes Metab 2007; 9: 648-659.
- Monami M, Marchionni N, Mannucci E. Long-acting insulin analogues vs. NPH human insulin in type 1 diabetes. A meta-analysis. Diabet Obes Metab 2009; 11: 372-378.
- Laranjeira FO, de Andrade KRC, Figueiredo ACMG, Silva EN, Pereira MG. Long-acting insulin analogues for type 1 diabetes: An overview of systematic reviews and meta-analysis of randomized controlled trials. PLoS One 2018; 13: e0194801.
- Monami M, Marchionni N, Mannucci E. Long-acting insulin analogues versus NPH human insulin in type 2 diabetes: a meta-analysis. Diabet Res Clin Pract 2008; 81: 184-189.
- Deutsche Diabetes-Gesellschaft. S-3-Leitlinie Therapie des Typ-1-Diabetes. www.deutsche-diabetes-gesellschaft.de/fileadmin/Redakteur/Leitlinien/Evidenzbasierte_Leitlinien/2018/S3-LL-Therapie-Typ-1-Diabetes-Auflage-2-Langfassung-09042018.pdf (letzter Zugriff am 14.5.2019).
- Hermansen K, Fontaine P, Kukolja KK, et al. Insulin analogues (insulin detemir and insulin aspart) versus traditional human insulins (NPH insulin and regular human insulin) in basal-bolus therapy for patients with type 1 diabetes. Diabetologia 2004; 47: 622-629.
- Bartley PC, Bogoev M, Larsen J, Philotheou A. Long-term efficacy and safety of insulin detemir compared to Neutral Protamine Hagedorn insulin in patients with Type 1 diabetes using a treat-to-target basal-bolus regimen with insulin aspart at meals: a 2-year, randomized, controlled trial. Diabet Med 2008; 25: 442-449.
- Lane W, Bailey T, Gerety G, et al. Effect of insulin Degludec vs insulin Glargin U100 on hypoglycemia in patients with type 1 diabetes: The SWITCH 1 Randomized Clinical Trial. JAMA 2017; 318: 33-44.
- Wysham C, Bhargava A, Chaykin L et al. Effect of Insulin Degludec vs Insulin Glargine U100 on hypoglycemia in patients with type 2 diabetes. JAMA 2017; 318: 45-56.
- Marso S, McGuire G, Zinman B, et al. Efficacy and safety of Degludec versus Glargine in type 2 diabetes. N Engl J Med 2017; 377: 723-732.
- Horvath K, Jeitler K, Matyas E, et al. Rapid Report Nutzenbewertung einer langfristigen normnahen Blutzuckersenkung bei Patienten mit Diabetes mellitus Typ 2. www.iqwig.de/download/A05-07_Rapid-Report_Normnahe-Blutzuckersenkung-bei-Diabetes-mellitus-Typ-2.pdf (letzter Zugriff am 14.11.2018).
- Mc Coy R, Lipska K, Yao X, et al. Intensive treatment and severe hypoglycemia among adults with type 2 diabetes. JAMA Intern Med 2016; 176: 969-978.
- Tsilidis K, Kasimis J, Lopez D, Ntzani E, Ioannidis J. Type 2 diabetes and cancer: umbrella review of meta-analyses of observational studies. BMJ 2015; 350: g7607.
- Carstensen B, Witte D, Friis S. Cancer occurrence in Danish diabetic patients: duration and insulin effects. Diabetologia. 2012; 55: 948-958.
- Vigneri R, Frasca F, Sciacca L, Vigneri P, Frittitta L. Insulin, insulin-like growth factor-1, and risk of breast cancer in postmenopausal women. Letter. J Natl Cancer Inst 2009; 101: 1030-1031.
- Hemkens L, Grouven U, Bender R, et al. Risk of malignancies in patients with diabetes treated with human insulin or insulin analogues: a cohort study. Diabetologia 2009; 52: 1732-1744.
- Pocock S, Smeeth L. Insulin glargine and malignancy: an unwarranted alarm. Lancet 2009; 374: 511-513.
- Mannucci E, Monami M, Balzi D, et al. Doses of Insulin and Its analogues and cancer occurrence in insulin-treated type 2 diabetic patients. Diabetes Care 2010; 33: 1997-2003.
- Ruiter R, Visser LE, van Herk-Sukel M, et al. Risk of cancer in patients on insulin glargine and other insulin analogues in comparison with those on human insulin: results from a large population-based follow-up study. Diabetologia 2012; 55: 51-62.
- Wu J, Filion K, Azoulay L, Doll M, Suissa S. The effect of long-acting insulin analogs on the risk of cancer: A systematic review of observational studies. Diabetes Care 2016; 39: 486-494.
- IFAP-Liste zu Abasaglar®, Actraphane®, Apidra®, Fiasp®, Humalog®, Lantus®, Levemir® (letzter Zugriff am 14.05.2019).
- Herkert D, Vijayakumar P, Luo J, et al. Cost-related insulin underuse among patients with diabetes. JAMA Intern Med 2019; 179: 112-114.
- Gemeinsamer Bundesausschuss. Übersicht über Verordnungseinschränkungen und -ausschlüsse in der Arzneimittelversorgung durch die Arzneimittel-Richtlinie und aufgrund anderer Vorschriften (§ 34 Absatz 1 Satz 6 und Absatz 3 SGB V), Hinweise zur wirtschaftlichen Verordnungsweise von nicht verschreibungspflichtigen Arzneimitteln für Kinder bis zum vollendeten 12. Lebensjahr und für Jugendliche mit Entwicklungsstörungen bis zum vollendeten 18. Lebensjahr sowie Verordnungseinschränkungen und -ausschlüsse von sonstigen Produkten. Anlage III.
- Freichel M, Mengel K. Antidiabetika. In: Schwabe U, Paffrath D, Ludwig WD, Klauber J. Arzneiverordnungsreport 2018. Springer Verlag: Berlin.
- Lipska K, Parker M, Moffet H, Huang E, Karter A. Association of initiation of basal insulin analogs vs neutral protamine Hagedorn insulin with hypoglycemia-related emergency department visits or hospital admissions and with glycemic control in patients with type 2 diabetes. JAMA 2018; 320: 53-62.
- Luo J, Khan N, Manetti T, et al. Implementation of a health plan program for switching from analogue to human insulin and glycemic control among Medicare beneficiaries with type 2 diabetes. JAMA 2019; 321: 374-384.
- Müller N, Lehmann T, Gerste B, et al. Increase in the incidence of severe hypoglycaemia in people with Type 2 diabetes in spite of new drugs: analysis based on health insurance data from Germany. Diabet Med 2017; 34, 1212-1218.
