Fallbericht einer unter Brodalumab (Kyntheum®) aufgetretenen, passageren Rückenmarkserkrankung
Zusammenfassung
Wir berichten über einen Fall einer passageren Rückenmarkserkrankung unter Brodalumab.
Fall
Eine 64-jährige Patientin erhielt wegen einer Psoriasis vulgaris von März 2017 bis August 2018 im Rahmen einer Therapiestudie den monoklonalen IL-17-Antikörper Brodalumab (Kyntheum®) (210 mg alle 2 Wochen s.c.). Die letzte Brodalumab-Injektion erfolgte am 16.08.2018. Kurz danach traten akut Schwäche und Sensibilitätsstörungen auf – Schweregefühl rechts beim Beinhalteversuch, Pelzigkeit und Gefühl der Andersartigkeit des rechten Beins. Beim Laufen knickte das rechte Bein weg, zudem wurden passagere Missempfindungen rechts thorakal berichtet, sodass die Einweisung in die Stroke Unit des regionalen Krankenhauses erfolgte.
Nach Ausschluss eines Hirninfarktes und einer entzündlichen Hirnerkrankung wurde eine antiinflammatorische Therapie mit Methylprednisolon 1 g pro Tag, flankiert von Pantoprazol und Low-Dose-ASS begonnen. Darunter klangen die Beschwerden langsam ab. Eine ambulante Reha-Nachbehandlung wurde in die Wege geleitet.
Als Nebendiagnosen wurden gemeldet u. a. Hypothyreose bei Marine-Lenhart-Syndrom (M. Basedow mit gleichzeitigem autonomem Adenom), Hypercholesterinämie, Nikotinabusus und lumbaler Bandscheibenvorfall (LWK4/5 links). Weitere Befunde waren u. a. grenzwertiges LDL-Cholesterin (171 mg/dl), leichter Folsäuremangel (3,5 ng/ml), gering erhöhte ANA (1:160), ansonsten negatives ENA-Profil, Cardiolipin-AK und Lupusantikoagulans negativ, ANCA, Aquaporin- und MOG-Autoantikörper negativ; Rheumafaktoren, Complement und Gerinnungsfaktoren waren normal. Bei der Immunfixation ergab sich der Nachweis eines quantitativ geringen IgG-Kappa-Paraproteins. Die Hepatitis B/C-, HIV- und Syphilis-Serologie war negativ.
Der Liquorbefund – Leukozyten < 1/µl, Erythrozyten < 100/µl, Laktat, Eiweiß und Glukose im Referenzbereich; keine Störung der Blut-Liquor-Schranke, identische oligoklonale IgG-Banden in Liquor und Blut (höchstwahrscheinlich das Paraprotein) – entsprachen am ehesten einer systemischen Immunreaktion.
In der CT-Untersuchung des Schädels wurden weder intrakranielle Blutungen noch eine Raumforderung, noch ischämische Areale identifiziert. Der MRT-Befund (Kopf und BWS) wurde als mit einer Multiple Sklerose vereinbar bewertet, wobei eine akute disseminierte demyelinisierende Enzephalomyelitis (ADEM) nahezu identische Veränderungen im MRT zeigen kann. Der Befund der magnetstimulierten Potenziale zur Untersuchung der der peripher-motorischen Bahnen zum linken Musculus tibialis anterior war leicht pathologisch, zudem zeigten sich eine leichte, axonal-demyelinisierende, sensomotorische Polyneuropathie und ein Hinweis auf Wurzelirritation der LWK 4/5 links.
Die behandelnden Neurologen und Radiologen schlossen aufgrund der zerebralen Bildgebung und der kardiovaskulären Diagnostik einen frischen zerebrovaskulären Infarkt aus. Die disseminierten, hyperintensen Flair-/T2-Marklagerläsionen wurden am ehesten als mikroangiopathisch gewertet, die dem Balken nahe gelegenen Läsionen wurden einer möglichen chronisch-entzündlichen Genese zugeschrieben. Die vorliegende Klinik wird als gut vereinbar mit der MR-tomographisch nachweisbaren thorakalen Myelonläsion im Funiculus posterior in Höhe Th7 rechts bewertet, wobei nicht zwischen einer autoimmun-entzündlichen Genese und einer spinalen Ischämie differenziert werden konnte. Entsprechend wurde auch neben einer fünftägigen Methylprednison-Pulstherapie eine gefäßprotektive Behandlung mit ASS (100 mg/d) begonnen. Brodalumab als möglicher Auslöser der Beschwerden wurde abgesetzt. Eine MRT-Kontrolle der kraniospinalen Achse (Kopf, HWS, BWS) wurde in sechs Monaten empfohlen.
Arzneimittel
Brodalumab (Kyntheum®) ist ein rekombinanter, vollständig humaner, monoklonaler IgG2-Antikörper, der mit hoher Affinität an die IL17-Rezeptor A-Kette (IL17RA) bindet. Er blockiert die biologische Aktivität der proinflammatorischen Zytokine IL17A, IL17F, IL17A/F und IL25. Dies führt, ähnlich wie bei den beiden weiteren zugelassenen IL17-spezifischen monoklonalen Antikörpern (Secukinumab, Ixekizumab), zur Hemmung der bei Psoriasis auftretenden entzündlichen Reaktionen und damit auch der klinischen Symptome (Abbildung 1).
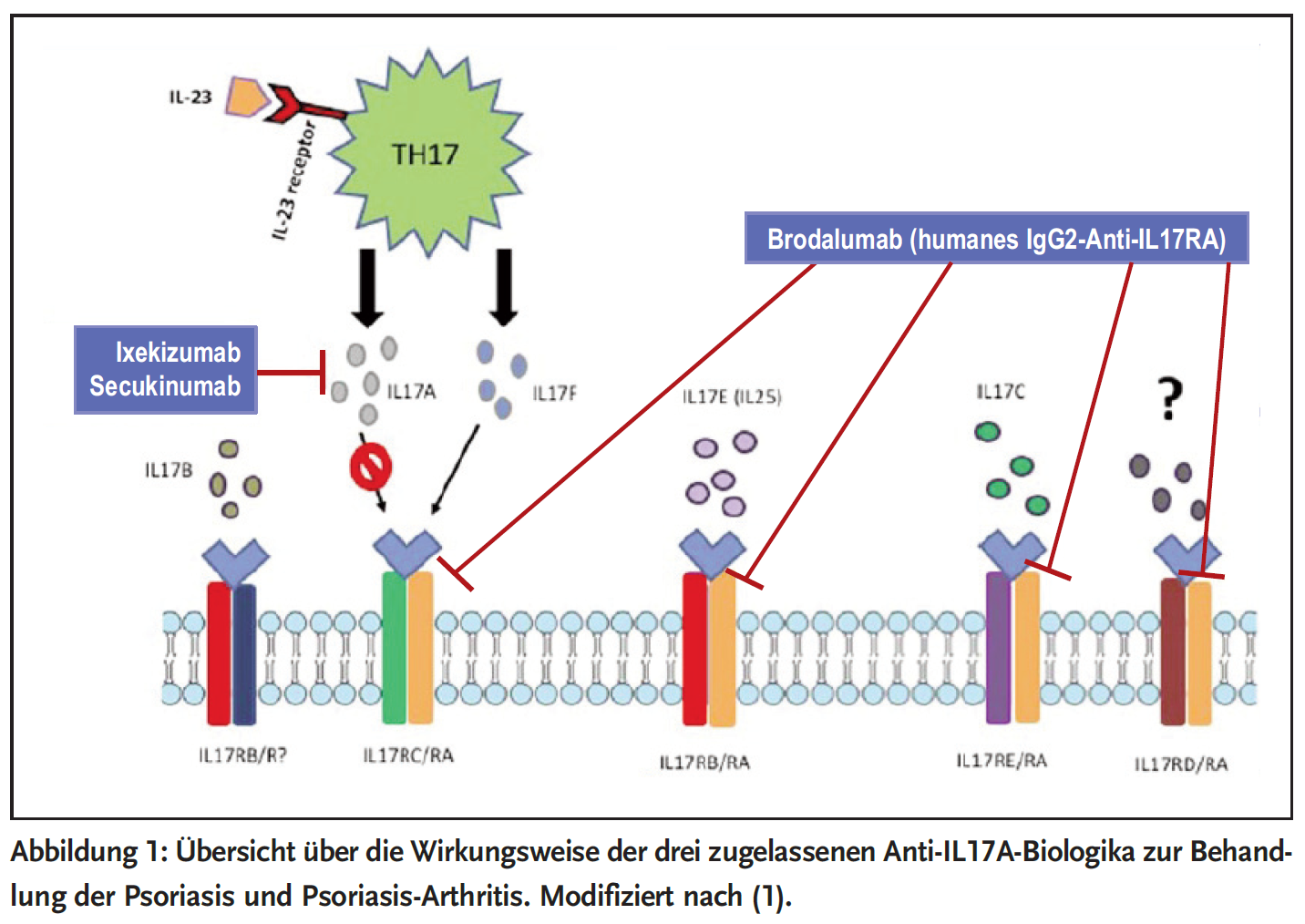
Nach s.c. Gabe von 210 mg wird die maximale Serumkonzentration nach drei Tagen erreicht. Die Pharmakokinetik ändert sich bei Dosiserhöhung (nicht lineare Elimination). Die geschätzte Halbwertszeit beträgt 10,9 Tage. In der Induktionphase erfolgt die Injektion von 210 mg s.c in Woche 0, 1, 2, anschließend in der Erhaltungsphase alle zwei Wochen s.c. (2). Brodalumab wurde im Juli 2017 für die Behandlung der mittelschweren bis schweren Plaque Psoriasis bei erwachsenen Patienten, für die eine systemische Therapie infrage kommt, zugelassen und im September 2017 in Deutschland eingeführt.
Informationen zu Nebenwirkungen von Brodalumab
Häufige Nebenwirkungen unter der Therapie mit Brodalumab sind Infektionen (Nasopharyngitis, Infektionen der oberen Atemwege, Pharyngitis, Harnwegsinfektionen, Bronchitis, Grippe und Tinea-Infektionen); zudem besteht ein erhöhtes Risiko für Candida-Infektionen der Haut und der Schleimhaut. In klinischen Studien wurden je ein schwerer Fall von Kryptokokken-Meningitis und einer Coccidioides-Infektion beobachtet. Weitere häufige Nebenwirkungen sind Neutropenie, Kopfschmerzen, Schmerzen im Oropharynx, Diarrhoe und Übelkeit sowie Ermüdung und Reaktionen an der Injektionsstelle. Des Weiteren kann Brodalumab eine Exazerbation einer bestehenden Morbus Crohn-Erkrankung verursachen. Gewarnt wird auch vor möglichen Suizidgedanken und Verhaltensänderungen (2-4).
In der Europäischen Datenbank gemeldeter Verdachtsfälle von Arzneimittelnebenwirkungen (EudraVigilance, (5)) finden sich 1237 Verdachtsberichte zu Brodalumab (Stand: 11.11.2019). Darunter führen eindeutig die Verdachtsfälle zu Infektionen mit ca. 349 Meldungen, gefolgt von Allgemeinsymptomen und Injektionsreaktionen mit ca. 314, Hautsymptomen mit 276, muskuloskeletalen Beschwerden ca. 230, psychiatrischen Symptomen mit ca. 123 und neurologischen Beschwerden mit 118 Meldungen. Eine genauere Aufschlüsselung der letzteren zeigt Kopfschmerzen (36 Fälle), Schwindel (11 Fälle), Lethargie (8 Fälle), Schlaganfall (6 Fälle), Migräne und Geschmacksstörungen (je 5 Fälle), Bewusstseinsverlust (4 Fälle), Synkopen (3 Fälle) und Parästhesien als häufigste neurologische Nebenwirkungen. Eine akute Enzephalomyelitis wurde bisher nicht gemeldet.
Zudem fanden sich in einer Pubmed-Recherche keine Berichte einer Enzephalitis disseminata (ED/MS) unter Brodalumab.
Bewertung
Die beschriebene Symptomatik könnte vaskulär sein. So wurde sie auch anfangs von den meldenden Neurologen eingeschätzt. Immerhin sind vaskuläre Risikofaktoren vorhanden – nämlich Hypercholesterinämie und Nikotinabusus. Dass ein Paraprotein, besonders wenn es Kryoglobulin-Eigenschaften hätte (was nicht geprüft wurde), in dieser geringen Ausprägung einen vaskulären Risikofaktor darstellt, ist denkbar, allerdings verursachen Kryoglobuline fast immer periphere Neuropathien und fast nie zentral-neurologische Schäden. Dennoch wäre es sinnvoll, das Paraprotein im Verlauf zu kontrollieren.
Den meldenden Ärzten kann dahin gehend zugestimmt werden, dass wahrscheinlich eine „autoimmun-entzündliche Genese“ vorliegt. Das Krankheitsbild könnte einer ADEM zugeordnet werden. Obwohl sich die Patientin nicht im krankheitstypischen Alter befindet, die Symptomatik nicht sehr ausgeprägt und der Liquorbefund unauffällig war, ist das Geschehen dennoch mit einer ADEM vereinbar. Die Therapie mit Kortikosteroiden war erfolgreich, zumal die ADEM zumeist (wie auch das Guillain-Barré-Syndrom) eine relativ gute Prognose mit partieller oder spontaner Selbstheilung aufweist. Vaskuläre Prozesse hinterlassen hingegen in der Regel bleibende Defekte.
Da es sich offenbar um ein einmaliges Geschehen einer zervikalen Myelitis unter Brodalumab handelt, wurde auch die Möglichkeit des Auftretens einer Querschnittsmyelitis bei Psoriasis diskutiert. Grundsätzlich können systemische Autoimmunkrankheiten oder Infektionen solche Läsionen auslösen. Tatsächlich zeigt die Literatur, dass bei Psoriasis Querschnittsmyelitiden auftreten können (6;7). Dabei spielen möglicherweise Einflüsse durch Biologikatherapien eine auslösende oder verstärkende Rolle, da je ein Fall unter Efalizumab (Raptiva®) (8) und Etanercept (Enbrel®) (9) beschrieben wurde. Hier käme nun noch ein Fall unter Brodalumab hinzu. Dass alle drei Substanzen unterschiedliche Wirkangriffe haben, irritiert vielleicht nur auf den ersten Blick: Efalizumab blockiert CD11a (Teil des Adhäsionsmoleküls LFA-1), Etanercept neutralisiert TNF-alpha und Brodalumab IL17. Da alle drei Substanzen wirksam in die immunpathologischen Prozesse der Psoriasis eingreifen, ist es durchaus denkbar, dass ihre pleomorphen Effekte auch ähnliche Nebenwirkungen verursachen können.
Fazit für die Praxis
Der Fallbericht zeigt, dass Biologika, die als immunmodulierende Arzneimittel zur Behandlung von Autoimmunerkrankungen zum Einsatz kommen, eine auslösende oder verstärkende Rolle für neurologische Symptome bzw. Krankheitsbilder wie ADEM oder Querschnittsmyelitiden haben können. Das positive Nutzen-Risiko-Verhältnis der Biologikatherapie bei Psoriasis wird durch solche seltenen Ereignisse zwar nicht generell infrage gestellt, aber eine erhöhte Wachsamkeit für neurologische Nebenwirkungen ist angebracht.
Verdachtsfälle im Zusammenhang mit der Behandlung mit Biologika sollen der AkdÄ gemeldet werden (https://www.akdae.de/Arzneimittelsicherheit/UAW-Meldung/).
Interessenkonflikte
Ein Interessenkonflikt wird von den Autoren verneint.
Literatur
- Frieder J, Kivelevitch D, Menter A: Secukinumab: a review of the anti-IL-17A biologic for the treatment of psoriasis. Ther Adv Chronic Dis 2018; 9: 5-21.
- LEO Pharma A/S: Fachinformation "Kyntheum® 210 mg Injektionslösung in einer Fertigspritze". Stand: Juli 2017.
- Hashim PW, Chen T, Lebwohl MG, Marangell LB, Kircik LH: What lies beneath the face value of a BOX WARNING: A deeper look at brodalumab. J Drugs Dermatol 2018; 17: s29-s34.
- Attia A, Abushouk AI, Ahmed H et al.: Safety and efficacy of brodalumab for moderate-to-severe plaque psoriasis: A systematic review and meta-analysis. Clin Drug Investig 2017; 37: 439-451.
- Europäische Datenbank gemeldeter Verdachtsfälle von Arzneimittelnebenwirkungen (EudraVigilance): Online-Zugriff auf Verdachtsfallmeldungen über Nebenwirkungen. www.adrreports.eu/de/. Letzter Zugriff: 25. September 2019.
- Rath JJ, Ronday HK, Wirtz PW: Acute transverse myelitis in psoriatic arthritis. J Neurol 2010; 257: 457-458.
- Kurz C, Wunderlich S, Spieler D et al.: Acute transverse myelitis and psoriasiform dermatitis associated with Sjoegren's syndrome: a case report. BMC Res Notes 2014; 7: 580.
- Scheinfeld N: Efalizumab: a review of events reported during clinical trials and side effects. Expert Opin Drug Saf 2006; 5: 197-209.
- Escalas J, Knöpfel N, Martin-Santiago A, Calles C: Acute transverse myelitis during treatment with etanercept for severe plaque psoriasis. J Am Acad Dermatol 2014; 70: e17-18.
vorab online
Dieser Artikel wurde am 16. Dezember 2019 vorab online veröffentlicht.
