Bewertung der krebsauslösenden Verunreinigung in sartanhaltigen Arzneimitteln
Evaluation of the cancerogenous contamination in sartan containing drugs
Zusammenfassung
In Valsartan-haltigen Arzneimitteln einer chinesischen Firma wurden geringe Mengen von Dimethyl-N-Nitrosamin (NDMA) gefunden. Dieser Stoff ist krebsauslösend. Die Risiken durch diese Verunreinigungen werden in diesem Artikel diskutiert.
Abstract
In valsartan containing drugs of a chinese manufacturer small amounts of dimethyl-n-nitrosamine were found. This substance is carcinogen. The risks of this contamination are discussed.
In den vergangenen Monaten wurden sartanhaltige Arzneimittel aufgrund einer Verunreinigung mit Dimethyl-N-Nitrosamin (NDMA) vom Markt zurückgerufen. Es ist inzwischen klar, dass die Verunreinigung mit NDMA als Beiprodukt einer bestimmten Synthese des Wirkstoffs des jeweiligen Sartans auftritt und dass die neuerlich festgestellte Verunreinigung durch eine einige Jahre nach Zulassung vorgenommene Änderung des Syntheseverfahrens bedingt ist.
NDMA ist eine krebsauslösende Substanz; der Mechanismus beruht auf einer Änderung des Erbguts (genotoxische Wirkung) (1). NDMA ist durch die International Agency on Research on Cancer (IARC) der WHO im Jahr 1987 als ein krebserzeugender Stoff der Klasse 2A, also eines krebsauslösenden Stoffes, dessen Wirkung im Tierversuch gezeigt wurde und das deshalb wahrscheinlich auch ein krebsauslösender Stoff beim Menschen ist, eingestuft worden (2). Unter Berücksichtigung, dass mittlerweile epidemiologische Studien beim Menschen vorliegen, in denen ein dosisabhängiger Anstieg von Tumoren insbesondere des Gastrointestinaltraktes gezeigt wurde (3-5), würde eine aktuelle Bewertung die Einstufung Klasse 1 (humanes Kanzerogen) ergeben.
Die Kenntnis, dass ein Stoff kanzerogen ist, erlaubt noch keine Abschätzung des Risikos. Auch bei kanzerogenen Stoffen trifft die Regel zu, dass bei geringer Exposition ein geringeres Risiko besteht als bei höherer Exposition.
Insofern benötigt man für eine Risikoabschätzung die Höhe der Exposition, mit anderen Worten die Beantwortung der Frage, wieviel NDMA nimmt ein Patient pro Tag auf, wenn er mit Valsartan-Tabletten behandelt wird. Messungen des Zentrallaboratoriums der deutschen Apotheker haben Konzentrationen des NDMA in Höhe von bis zu 22 µg pro 320 mg Tablette ergeben (6).
Üblicherweise kann aus entsprechenden Daten für toxikologische Endpunkte eine Dosis ermittelt werden, von der angenommen werden kann, dass sie unbedenklich ist, mit anderen Worten, bei der kein toxischer Effekt zu erwarten ist. Für genotoxische, d. h. durch Veränderung der Erbsubstanz bedingte, krebsauslösende Stoffe wie dem NDMA ist es nicht möglich, eine solche Dosis, die als unbedenklich gelten kann, zu bestimmen, weil davon ausgegangen wird, dass auch eine geringste Dosis noch einen Effekt haben kann (7).
Für viele derartige Stoffe – so auch für NDMA – liegen keine ausreichenden Daten aus epidemiologischen und anderen Studien am Menschen vor, die erlauben, die Höhe des Risikos beim Menschen in Anhängigkeit von der Dosis abzuschätzen. In diesen Fällen behilft man sich in der Risikoabschätzung dann damit, die Dosis (in mg/kg Körpergewicht (KG) pro Tag), die im Tierversuch eine zehnprozentige Erhöhung der Anzahl der Tumoren nach lebenslanger Gabe des Stoffes gegenüber einer mit Placebo behandelten Kontrollgruppe auslöst, zu vergleichen mit der Dosis, die ein Mensch aufnimmt (in mg/kg KG pro Tag) (8). Die Dosis beträgt im Falle von NDMA 62 µg/kg KG pro Tag (9).
Wenn die durch den Menschen aufgenommene Dosis mehr als 10.000-fach niedriger ist als die Dosis, die im Tierversuch eine zehnprozentige Erhöhung der Anzahl der Tumoren nach lebenslanger Gabe des Stoffes gegenüber einer mit Placebo behandelten Kontrollgruppe auslöst, geht man von einem sehr geringen Risiko aus (8). Das Risiko wird größer je geringer der Abstand ist (8). Diese Bewertung gilt für eine lebenslange Aufnahme des krebsauslösenden Stoffes.
Für NDMA und Valsartan-haltige Fertigarzneimittel ergibt eine solche Berechnung, dass 22 µg NDMA, die in einer Tablette enthalten sein können, nur etwa 200-fach unter der Dosis liegt, die im Tierversuch eine zehnprozentige Erhöhung der Anzahl der Tumoren nach lebenslanger Gabe des Stoffes gegenüber einer mit Placebo behandelten Kontrollgruppe auslöst.
Ein Vergleich mit der Exposition, das durch andere Quellen der NDMA-Exposition entsteht, ergibt sich aus Tabelle 1.
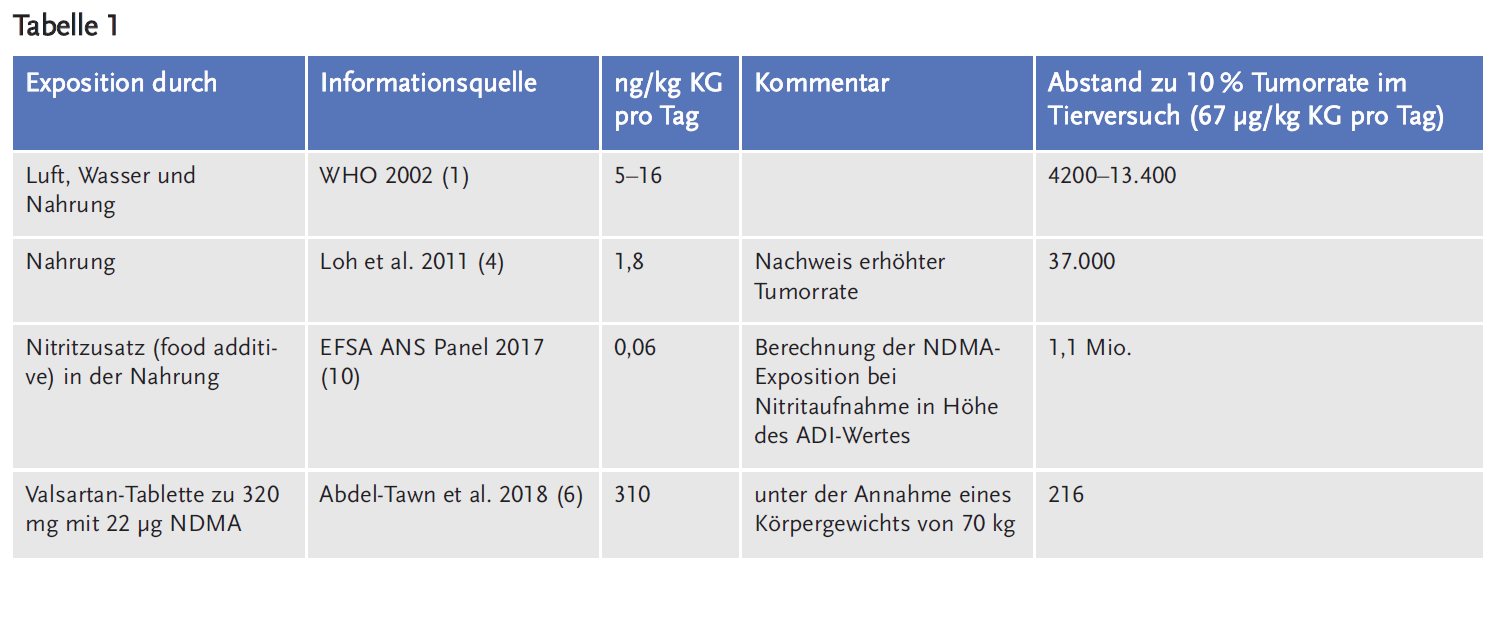
Danach ist klar, dass die NDMA-Verunreinigung in Valsartan-Tabletten eine größere Exposition bedeutet als dies von anderen Quellen erfolgt. Dieser Sachverhalt weist auf ein nicht geringes Risiko hin.
Bei der Bewertung des Risikos ist allerdings zu berücksichtigen, dass die Syntheseänderung mit der Erzeugung der Verunreinigung im Jahr 2012 erfolgte (11). Damit liegt eine weniger als lebenslange Exposition vor. Bedauerlicherweise verschwindet ein Krebsrisiko nicht, sobald der krebsauslösende Stoff nicht mehr aufgenommen wird, jedoch wird das Risiko mit der Zeit kleiner. Zum Beispiel haben Raucher ein fast 25-fach erhöhtes Risiko Lungenkrebs zu bekommen. Wenn ein Raucher mit Anfang 20 das Rauchen stoppt, ist das Risiko nur noch 1,56-fach (12).
In welcher Höhe NDMA als Valsartan-Verunreinigung krebsauslösend bei den Patienten gewirkt hat, kann erst nach längerer Zeit bewertet werden, da die Entstehung einer Krebserkrankung längere Zeit benötigt. Aus dem Tierversuch kann man für NDMA abschätzen, da die Hälfte der durch NDMA experimentell ausgelösten Tumoren nach etwa der Lebenshälfte der Tiere auftraten (13), dass auch beim Menschen die Hälfte der möglicherweise auftretenden Tumore erst nach Jahrzehnten auftreten würden. Insofern ist auch die kürzlich publizierte Studie, in der etwa 5000 exponierte Patienten bei einer Einnahme der kontaminierten Valsartan-Tabletten über vier bis fünf Jahre kein erhöhtes Tumorauftreten verzeichneten, wenig aussagekräftig und trägt eher zur Verunklarung bei (14).
Wie sollte das Risiko beurteilt werden?
Es existiert ein Risiko.
- Populationsbezogen ist das Risiko groß genug, um Maßnahmen als notwendig und gerechtfertigt anzusehen, und eine längere Exposition hätte das Risiko erhöht. Daher war die Marktrücknahme der verunreinigten Valsartan-Tabletten gerechtfertigt.
- Für den einzelnen Patienten/die einzelne Patientin ist das individuelle Risiko, an Krebs zu erkranken, nur sehr geringfügig erhöht. Zusätzlich ist zu sagen, dass bei den meisten Patientinnen/Patienten die natürliche Lebenserwartung kürzer sein wird, als dass zu erwarten steht, dass die Erkrankung auftritt.
Literatur
- World Health Organization (WHO): N-Nitrosodimethylamine, Concise International Chemical Assessment Document 38; Geneva, 2002.
- International Agency for Research on Cancer (IARC) 1978; 17: 125; and 1987; Suppl. 7: 67.
- Song P, Wu L, Guan W: Dietary nitrates, nitrites, and nitrosamines intake and the risk of gastric cancer: A meta-analysis. Nutriens 2015; 7: 9872-9895.
- Loh YH, Jakszyn P, Luben RN et al.: N-Nitroso compounds and cancer incidence: The European Prospective Investigation into Cancer and Nutrition (EPIC)-Norfolk Study. Am J Clin Nutr 2011; 92: 1053-1061.
- Zhu Y, Wang PP, Zhao J et al.: Dietary N-nitroso compounds and risk of colorectal cancer: a case-control study in Newfoundland and Labrador and Ontario, Canada Br J Nutr 2014; 111: 1109-1117.
- Abdel-Tawab M, Gröner R, Kopp T et al.: Valsartan. ZL findet NMDA in Tabletten. Pharm Ztg 2018; 163: 2072-2074.
- Gundert-Remy U, Kramer P-J: Regulatorische Toxikologie: Grundzüge, Testverfahren und Einrichtungen. In: Lehrbuch der Toxikologie. Marquardt H, Schäfer S. G., Barth H (Hrsg.). Stuttgart: Wissenschaftliche Verlagsgesellschaft, 2013: 1174-1204.
- EFSA: Opinion of the Scientific Committee on a request from EFSA related to A Harmonised Approach for Risk Assessment of Substances Which are both Genotoxic and Carcinogenic. The EFSA Journal 2005; 282: 1-31.
- O’Brien J, Renwick AG, Constable A et al.: Approaches to the risk assessment of genotoxic carcinogens in food: a critical appraisal. Food Chem Toxicol 2006; 44: 1613-1635.
- EFSA Panel on Food Additives and Nutrient Sources added to Food (EFSA ANS Panel): Opinion on the re-evaluation of potassium nitrite (E 249) and sodium nitrite (E 250) as food additives. EFSA Journal 2017; 15 (4786): 157 pp.
- European Medicines Agency (EMA): EMA reviewing medicines containing valsartan from Zhejiang Huahai following detection of an impurity: www.ema.europa.eu/docs/en_GB/document_library/Press_release/2018/07/WC500251498.pdf (letzter Zugriff: 12. Februar 2019). London, 5. Juli 2018.
- Pirie K, Peto R, Reeves GK et al.: The 21st century hazards of smoking and benefi ts of stopping:a prospective study of one million women in the UK. Lancet 2013; 381: 133-141.
- Peto R, Gray R, Brantom P, Grasso P: Dose and time relationships for tumor induction in the liver and esophagus of 4080 inbred rats by chronic ingestion of N-nitrosodiethylamine or N-nitrosodimethylamine. Cancer Res 1991; 51: 6452-6469.
- Pottegard A, Kristensen K, Ernst MT et al.: Use of N-nitrosodimethylamine (NDMA) contaminated valsartan products and risk of cancer:Danish nationwide cohort study. BMJ 2018; 362: k3851.
Interessenkonflikte
Ein Interessenkonflikt wird von der Autorin verneint.
