Hydrochlorothiazid: Risiko von nichtmelanozytärem Hautkrebs – Empfehlungen der AkdÄ zur Behandlung von Hypertonie und Herzinsuffizienz
Nachdruck einer Publikation auf der Website der AkdÄ vom 20. Dezember 2018
Zusammenfassung
Ein Rote-Hand-Brief vom Oktober 2018 weist auf das Risiko des nichtmelanozytären Hautkrebses im Zusammenhang Hydrochlorothiazid (HCT) hin. Die AkdÄ empfiehlt für die Behandlung der arteriellen Hypertonie und der Herzinsuffizienz mit HCT zusammenfassend Folgendes:
- Eine generelle Therapieumstellung aller mit HCT behandelten Patienten ist nicht erforderlich und sollte individuell geprüft werden.
- Chlortalidon ist eine mögliche Alternative zu HCT. Zum Hautkrebsrisiko im Zusammenhang mit Chlortalidon liegen keine Daten vor.
- Wenn HCT angewendet wird, sollten die im Rote-Hand-Brief genannten Empfehlungen befolgt werden (z. B. regelmäßige Hautinspektion; UV-Schutz).
- Weitere Studien zum Risiko von (Haut-)Krebs im Zusammenhang mit Diuretika und anderen Arzneimitteln zur Behandlung der Hypertonie und der Herzinsuffizienz sollten durchgeführt werden.
Hintergrund
Hydrochlorothiazid(HCT)-haltige Arzneimittel werden angewendet zur Behandlung der arteriellen Hypertonie, der chronischen Herzinsuffizienz sowie von kardialen, hepatischen und nephrogenen Ödemen (1). Nachfolgend werden Empfehlungen zum Umgang mit HCT bei der Behandlung der arteriellen Hypertonie und der Herzinsuffizienz gegeben.
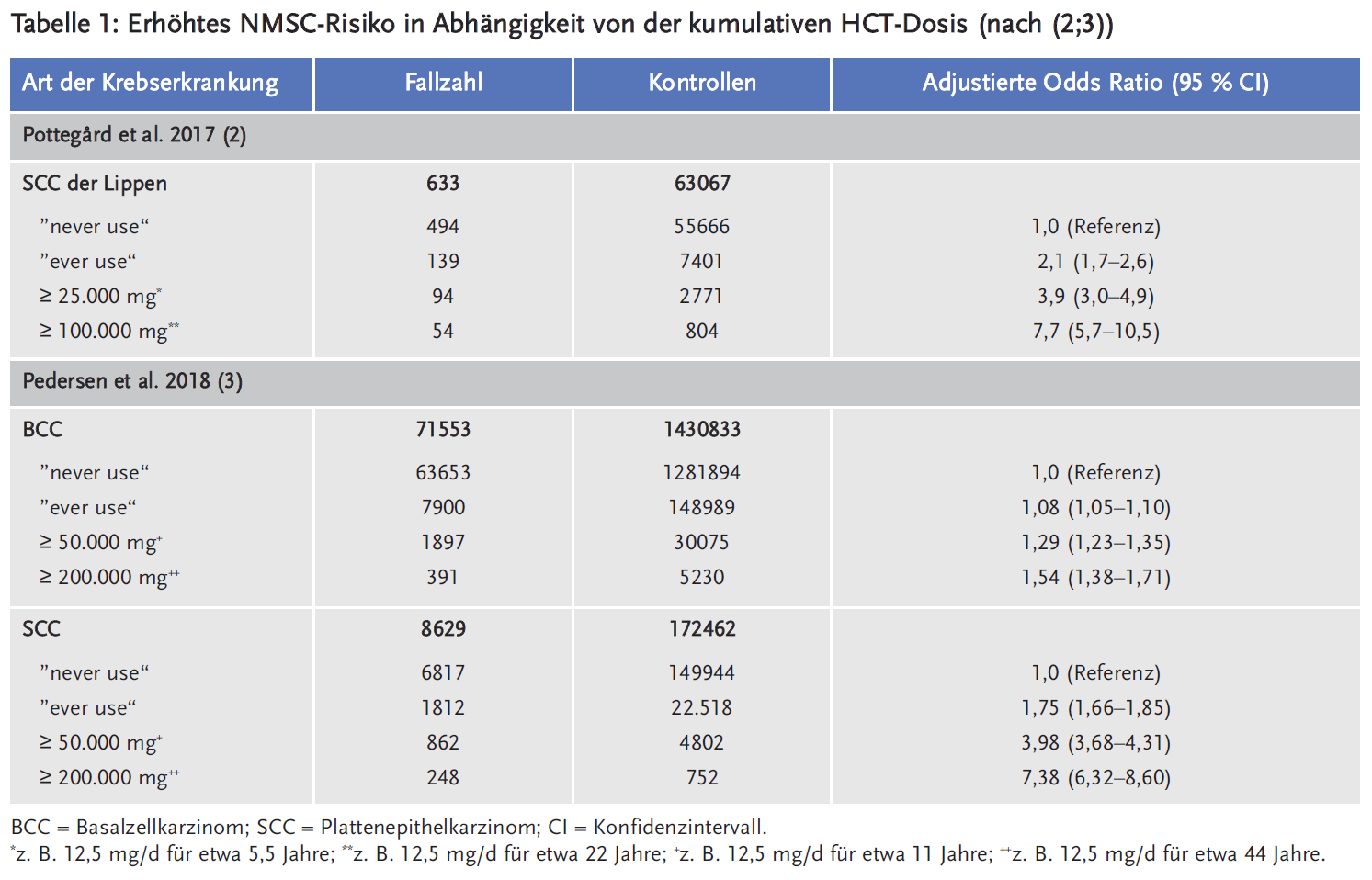
Auf der Basis von Ergebnissen zweier pharmakoepidemiologischer Studien wurde am 17. Oktober 2018 ein Rote-Hand-Brief versendet, der über das Risiko des weißen Hautkrebs (non melanoma skin cancer, NMSC) im Zusammenhang mit HCT informiert (1). Die beiden dort angeführten Studien zeigten anhand von dänischen Registerdaten ein erhöhtes NMSC-Risiko in Abhängigkeit von der kumulativen HCT-Dosis (vgl. Tabelle 1) (2;3).
Im Rote-Hand-Brief wird empfohlen, Patienten mit HCT-Behandlung über das Risiko von NMSC zu informieren und aufzufordern, regelmäßig ihre Haut zu kontrollieren und verdächtige Veränderungen umgehend dem Arzt zu zeigen. Suspekte Läsionen sollten untersucht werden, ggf. einschließlich einer histologischen Untersuchung von Biopsien. Patienten sollten die Exposition gegenüber Sonnenlicht und UV-Strahlung reduzieren. Ggf. sollten sie einen Sonnenschutz verwenden. Bei HCT-Patienten mit NMSC in der Vorgeschichte sollte der Einsatz von HCT erneut abgewogen werden (1).
Zu NMSC zählen vor allem Basalzellkarzinome (basal cell carcinoma, BCC) und Platten-epithelkarzinome (squamous cell carcinoma, SCC). Die Inzidenz hängt unter anderem vom Hautphänotyp und der UV-Exposition ab. In Deutschland erkrankten 2015 etwa 213.000 Menschen an NMSC, davon etwa Dreiviertel an BCC und ein Viertel an SCC. Etwa 750 Patienten in Deutschland sterben jährlich an NMSC (4). In Abhängigkeit von der kumulativen HCT-Dosis könnte sich das Risiko an NMSC zu erkranken bis auf das über 7-Fache für SCC und bis auf das 1,5-Fache für BCC erhöhen (1). Nach Schätzung der Autoren der o. g. Studien könnten 0,6 % der BCC und 9,0 % der SCC bzw. 11 % der SSC der Lippen auf HCT zurückzuführen sein (2;3).
Als ursächlich für das erhöhte NMSC-Risiko werden die photosensibilisierenden Eigenschaften von HCT diskutiert (2;3). Die wichtigste Limitierung der beiden Studien liegt darin, dass bei retrospektiven Studien nicht alle möglichen Confounder berücksichtigt werden können, und dass derartige Studien daher nicht geeignet sind, einen kausalen Zusammenhang zu belegen. Insbesondere wurden in den beiden Studien UV-Exposition sowie Hauttyp bzw. Raucherstatus nicht berücksichtigt (2;3). Allerdings spricht die dosisabhängige Beziehung für einen kausalen Zusammenhang. Es ist also zunächst von einem erhöhten NMSC-Risiko im Zusammenhang mit HCT auszugehen.
Empfehlung der AkdÄ zum Umgang mit Patienten, die mit HCT behandelt werden
Aus Sicht der AkdÄ kann es eine für alle Patienten gültige Empfehlung angesichts der heterogenen Patientenpopulation nicht geben. Um ein eigenständiges Absetzen der Medikation durch Patienten (mit der Gefahr negativer Folgen wie Herzinfarkt, Schlaganfall) zu vermeiden, sollten Patienten über das Risiko aufgeklärt und in die weitere Behandlungsplanung einbezogen werden. Die Indikation für eine diuretische Therapie sollte geprüft werden: Eventuell kann bei einigen Patienten auf ein Diuretikum verzichtet werden (z. B. milde Hypertonie).
Zwar zählt der weiße Hautkrebs zu den häufigsten Krebserkrankungen. Dennoch ist angesichts der insgesamt niedrigen Grundinzidenz trotz des erhöhten relativen Risikos das absolute Risiko für die Entwicklung eines NMSC bei Behandlung mit HCT nicht hoch. Durch regelmäßig wiederholte Hautinspektionen können NMSC rechtzeitig entdeckt und gut behandelt werden und weisen eine relativ günstige Prognose auf (5). Eine generelle Umstellung der Patienten auf eine alternative Therapie ist aus Sicht der AkdÄ daher nicht zwingend erforderlich. Eine Umstellung der Therapie sollte aber individuell geprüft werden, z. B. anhand von Patienteneigenschaften wie Alter, Hauttyp, Komorbidität/Vorerkrankungen (NMSC in Vorgeschichte?), Komedikation, Indikation für HCT sowie UV-Exposition in Beruf/Freizeit.
Bei der Behandlung der Hypertonie wird die Kombination mit Diuretika spätestens bei Stufe 2 des Therapiealgorithmus empfohlen. Der positive Effekt auf Morbidität und Mortalität ist gut belegt (6). Wenn eine Umstellung für sinnvoll erachtet bzw. nach Aufklärung vom Patienten gewünscht wird, so wären Chlortalidon oder Indapamid zu erwägen, die beide in Leitlinien zur Behandlung der arteriellen Hypertonie empfohlen werden (6-8) und in dieser Indikation zugelassen sind (9;10). Allerdings wurde für Indapamid in einer kleinen Studie ein erhöhtes Risiko für maligne Melanome festgestellt (11). Nach unserer Kenntnis liegen für Chlortalidon derzeit keine Studien zum Hautkrebsrisiko vor. Gerade vor dem Hintergrund der möglichen Umstellung einer großen Zahl von HCT-Patienten auf Chlortalidon sollten Studien zum Hautkrebsrisiko im Zusammenhang mit Chlortalidon durchgeführt werden. Die Wirksamkeit hinsichtlich kardiovaskulärer Endpunkte ist für Chlortalidon besser belegt als für HCT (6;12). Zu beachten ist, dass HCT und Chlortalidon nicht dosisäquivalent angewendet werden sollten. Zur Behandlung der Hypertonie werden 12,5–25 mg/d Chlortalidon empfohlen (7;13).
Die Behandlung der Herzinsuffizienz basiert primär auf Arzneimitteln, die das Renin-Angiotensin-Aldosteron-System beeinflussen sowie auf Betablockern, ggf. ergänzt um Mineralkortikoidrezeptor-Antagonisten (Spironolacton, Eplerenon). Diuretika, für die ein positiver Effekt auf die Mortalität nicht belegt ist, werden bei Patienten mit Zeichen der Flüssigkeitsretention empfohlen (14;15). Soll ein Thiazid oder thiazidähnliches Diuretikum verordnet werden, so könnte ebenfalls Chlortalidon angewendet werden, welches gemäß Fachinformation zur Behandlung der manifesten Herzinsuffizienz zugelassen ist (9).
Andere Diuretika (einschließlich Chlortalidon (9)) weisen ebenfalls photosensibilisierende Eigenschaften auf (16). Es ist derzeit unklar, ob dieser Mechanismus allein ursächlich für die Entstehung von NMSC ist. Das Risiko von NMSC und anderen Malignomen im Zusam-menhang mit HCT, anderen Diuretika und nicht diuretisch wirksamen Arzneimitteln zur Behandlung von Herzinsuffizienz und arterieller Hypertonie sollte daher weiter untersucht werden.
In den oben erwähnten pharmakoepidemiologischen Studien wird für das Thiaziddiuretikum Bendroflumethiazid kein erhöhtes NMSC-Risiko beschrieben (2;3). Bendroflumethiazid ist potenter als HCT, deshalb ist eine geringere Dosis erforderlich. Damit begründen die Autoren, dass sie trotz der breiten Anwendung in Dänemark kein NMSC-Risiko für diese Substanz feststellen konnten (2). Bendroflumethiazid könnte auch in Deutschland eine mögliche Alternative zu HCT sein. Es ist hierzulande allerdings bislang wenig gebräuchlich und es steht nur in Kombination mit Propranolol und Hydralazin (17) bzw. in Kombination mit Amilorid (18) zur Verfügung. Daher ist anzuregen, Bendroflumethiazid auch in den hier üblichen Kombinationen bzw. als Monotherapie anzubieten.
Arzneimittelkommission der deutschen Ärzteschaft
Fazit
Eine generelle Therapieumstellung aller mit HCT behandelten Patienten ist nach den beiden pharmakoepidemiologischen Studien nicht erforderlich und sollte individuell geprüft werden. Chlortalidon ist ein mögliches alternatives thiazidähnliches Diuretikum, das für ähnliche Indikationen zugelassen ist wie HCT (9) und insbesondere in der Indikation Hypertonie eine Alternative darstellt. In der Indikation Herzinsuffizienz sollten primär Schleifendiuretika angewendet werden (14). Soll ein Thiazid oder thiazidähnliches Diuretikum angewendet werden, so wäre ebenfalls Chlortalidon möglich. Zu diesem Arzneimittel liegen derzeit keine Erkenntnisse über ein mögliches Hautkrebsrisiko vor. Um die Compliance zu erhalten, wäre die Bereitstellung von Kombinationspräparaten z. B. mit ACE-Hemmern, Angiotensin-II-Rezeptor-Antagonisten oder Kalziumkanalblockern wünschenswert. Bei Anwendung von HCT sollten die im Rote-Hand-Brief genannten Empfehlungen befolgt werden: regelmäßige Hautinspektion durch die Patienten und Information des Arztes bei Auffälligkeiten; weitere Untersuchung (ggf. Biopsie) von verdächtigen Läsionen; Reduktion der Exposition gegenüber Sonnenlicht und UV-Strahlung; Anwendung von Sonnenschutz. Um das Risiko für (Haut-)Krebserkrankungen im Zusammenhang mit Diuretika und anderen Arzneimitteln zur Behandlung von Herzinsuffizienz und Hypertonie besser einschätzen und belastbare klinische Empfehlungen abgeben zu können, sollten weitere Studien durchgeführt werden.
Literatur
- Zulassungsinhaber, örtliche Vertreter der Zulassungsinhaber und Vertreiber hydrochlorothiazidhaltiger Arzneimittel in Deutschland: Hydrochlorothiazid - Risiko von nichtmelanozytärem Hautkrebs [Basalzellkarzinom (Basaliom); Plattenepithelkarzinom der Haut (Spinaliom)]. Rote-Hand-Brief vom 17. Oktober 2018.
- Pottegard A, Hallas J, Olesen M et al.: Hydrochlorothiazide use is strongly associated with risk of lip cancer. J Intern Med 2017; 282: 322-331.
- Pedersen SA, Gaist D, Schmidt SAJ et al.: Hydrochlorothiazide use and risk of nonmelanoma skin cancer: A nationwide case-control study from Denmark. J Am Acad Dermatol 2018; 78: 673-681.e679.
- Barnes B, Kraywinkel K, Nowossadeck E et al.: Robert Koch-Institut (RKI) (Hrsg.): Bericht zum Krebsgeschehen in Deutschland 2016: www.krebsdaten.de/krebsbericht. Berlin: RKI, 2016.
- Newlands C, Currie R, Memon A et al.: Non-melanoma skin cancer: United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol 2016; 130: S125-s132.
- Williams B, Mancia G, Spiering W et al.: 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J 2018; 39: 3021-3104.
- Whelton PK, Carey RM, Aronow WS et al.: 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on clinical practice guidelines. J Am Coll Cardiol 2018; 71: 2199-2269.
- Leung AA, Daskalopoulou SS, Dasgupta K et al.: Hypertension Canada's 2017 guidelines for diagnosis, risk assessment, prevention, and treatment of hypertension in adults. Can J Cardiol 2017; 33: 557-576.
- Trommsdorff GmbH & Co. KG: Fachinformation "Hygroton® 25 mg, Hygroton® 50 mg". Stand: September 2018.
- Les Laboratoires Servier: Fachinformation "Natrilix®". Stand: Januar 2018.
- Jensen AO, Thomsen HF, Engebjerg MC et al.: Use of photosensitising diuretics and risk of skin cancer: a population-based case-control study. Br J Cancer 2008; 99: 1522-1528.
- Roush GC, Holford TR, Guddati AK: Chlorthalidone compared with hydrochlorothiazide in reducing cardiovascular events: systematic review and network meta-analyses. Hypertension 2012; 59: 1110-1117.
- National Institute for Clinical Excellence (NICE): Hypertension in adults: diagnosis and management: nice.org.uk/guidance/cg127. Clinical guideline; veröffentlicht am 24. August 2011.
- Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF): Nationale VersorgungsLeitlinie Chronische Herzinsuffizienz – Langfassung, 2. Auflage. Version 3: www.leitlinien.de/nvl/herzinsuffizienz (letzter Zugriff: 29. November 2018). Berlin: ÄZQ, 2017.
- Ponikowski P, Voors AA, Anker SD et al.: 2016 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure. Rev Esp Cardiol (Engl Ed) 2016; 69: 1167.
- Monteiro AF, Rato M, Martins C: Drug-induced photosensitivity: photoallergic and phototoxic reactions. Clin Dermatol 2016; 34: 571-581.
- Cheplapharm Arzneimittel: Fachinformation "Pertenso® N 2,5 mg/25 mg/60 mg Hartkapseln". Stand: September 2017.
- Henning Arzneimittel: Fachinformation "Tensoflux®" Stand: April 2015.
