Erenumab (Aimovig®) ▼
Zugelassene Indikation und Wirkmechanismus
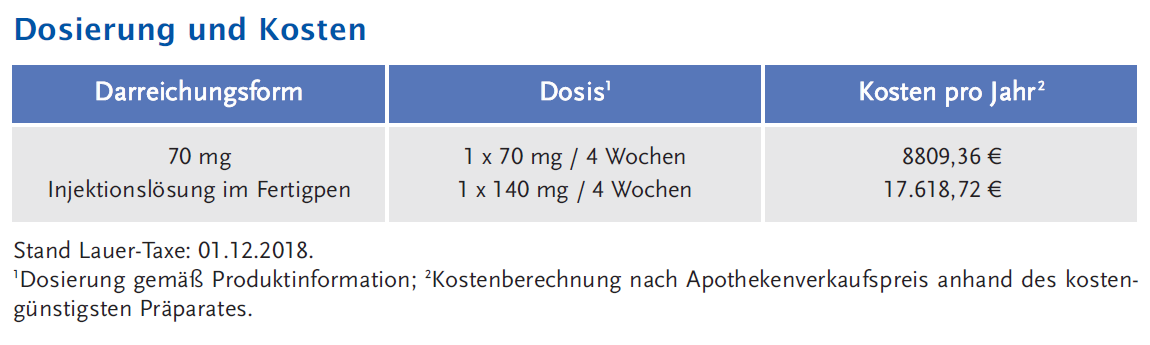
Erenumab (Aimovig®) wurde im Juli 2018 nach beschleunigter Beurteilung zur Migräneprophylaxe bei Erwachsenen mit mindestens vier Migränetagen pro Monat zugelassen. Die empfohlene Dosis beträgt 70 mg Erenumab alle vier Wochen. Zugelassen ist auch eine Dosis von 140 mg, ohne dass ein Vorteil der höheren Dosierung durch Studien belegt ist.
Erenumab ist ein rekombinanter humaner monoklonaler IgG2-Antikörper, der in Ovarialzellen chinesischer Hamster (Chinese hamster ovary, CHO) hergestellt wird. Er bindet an den Calcitonin-Gene-Related-Peptide(CGRP)-Rezeptor, der in der Pathophysiologie der Migräne eine zentrale Rolle spielt. CGRP ist ein Neuropeptid, das die nozizeptive Signalübertragung reguliert und als Vasodilatator wirkt. Der CGRP-Spiegel steigt während eines Migräneanfalls an und normalisiert sich beim Abklingen der Kopfschmerzen. Erenumab konkurriert spezifisch mit CGRP um die Bindung am CGRP-Rezeptor und hemmt dadurch seine Funktion.
Erenumab wird subkutan am Abdomen, am Oberschenkel oder an der Außenseite des Oberarms appliziert. Patienten sollen nach angemessener Schulung Erenumab selbst verabreichen. Erenumab muss im Kühlschrank bei 2–8°C gelagert werden.
Markteinführung
Aimovig® (Erenumab) ist seit dem 1. November 2018 als Fertigpen in der o. g. Indikation auf dem deutschen Markt.
Bewertung
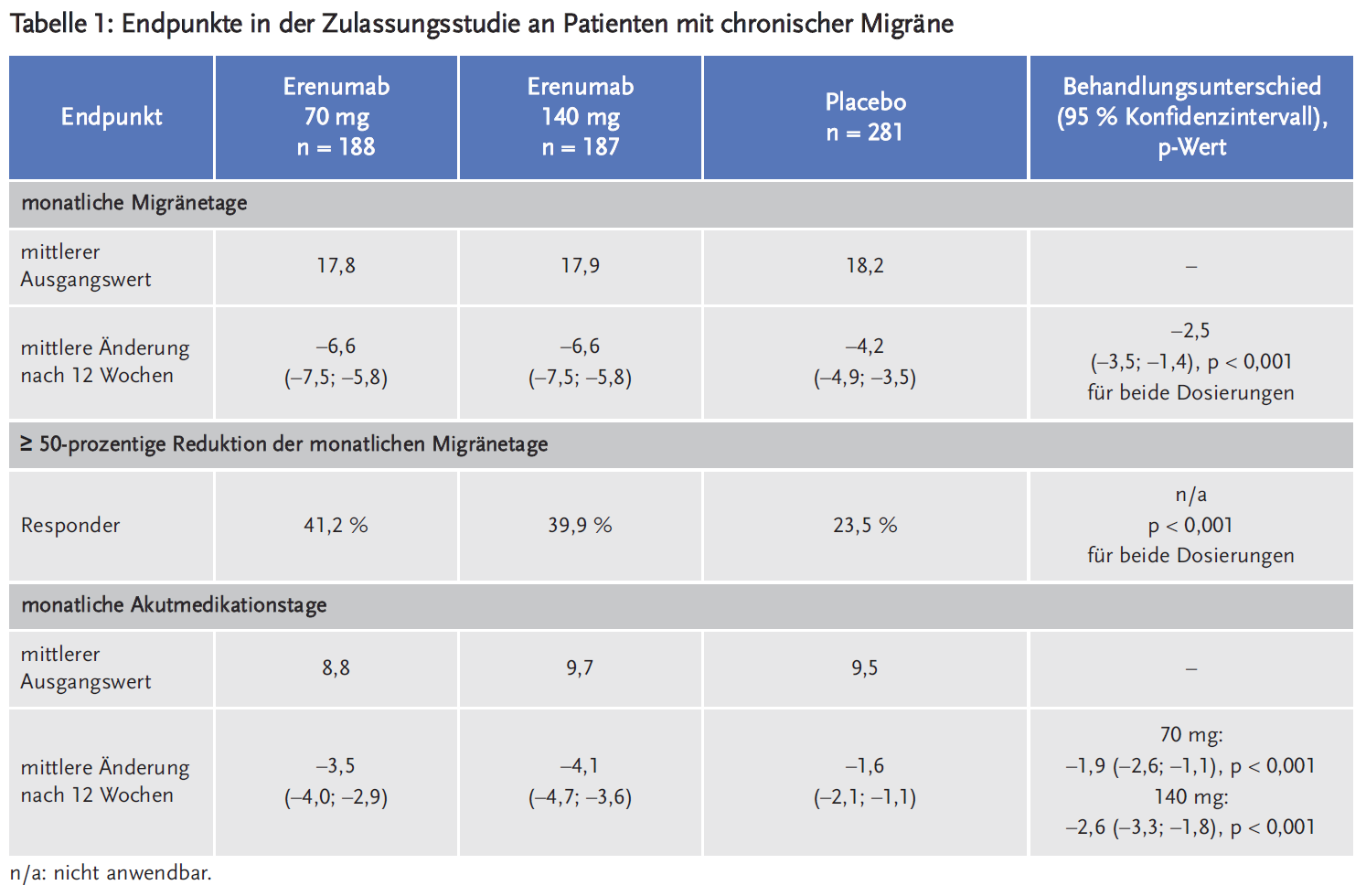
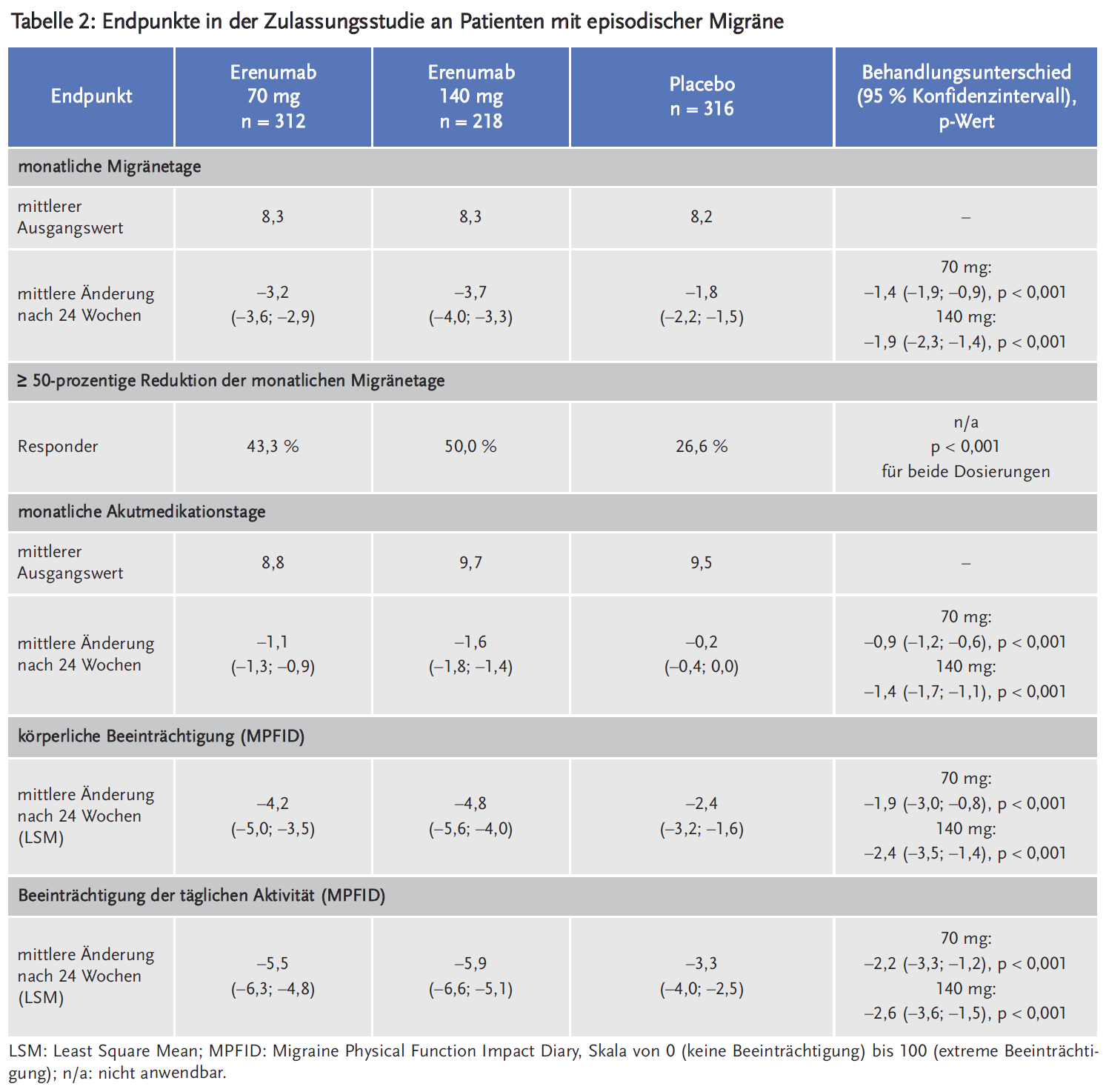
Erenumab ist der erste monoklonale Antikörper, der sich spezifisch gegen das migräneauslösende Neuropeptid Calcitonin Gene-Related Peptide (CGRP) richtet. Im Vergleich zu Placebo reduziert Erenumab statistisch signifikant die durchschnittlichen Migränetage um 1,4–1,9 Tage pro Monat (bei episodischer Migräne, EM) und um 2,5 Tage pro Monat (bei chronischer Migräne, CM). Unter Erenumab wird eine mindestens 50-prozentige Reduktion der monatlichen Migränetage bei etwa 40 % der Patienten mit CM (versus 24 % unter Placebo) sowie bei 43–50 % der Patienten mit EM (versus 27 % unter Placebo) berichtet. Begleitsymptome wie Übelkeit oder Lichtempfindlichkeit werden nicht verbessert. Erenumab verringert statistisch signifikant besser als Placebo die Anzahl der Tage, an denen eine akute Migränemedikation erforderlich ist: bei CM im Mittel um 3,5 (70 mg) bzw. 4,1 (140 mg) Tage versus 1,6 Tage unter Placebo, bei EM im Mittel um 1,1 (70 mg) bzw. 1,6 (140 mg) Tage versus 0,2 Tage unter Placebo.
Unerwünschte Wirkungen wie Reaktionen an der Injektionsstelle, Obstipation, Muskelspasmen und Juckreiz treten unter Erenumab häufiger als unter Placebo auf und zeigen eine gewisse Dosisabhängigkeit.
Erenumab bietet gegenüber den verfügbaren Alternativen zur Migräneprophylaxe einen vergleichbaren Effekt. Der Vorteil gegenüber bisher verfügbaren Wirkstoffen scheint in der besseren Verträglichkeit zu liegen. Ein weiterer Vorteil könnte die vierwöchentliche Applikation sein, die allerdings subkutan erfolgen muss. Es gibt keinen direkten Vergleich der beiden verfügbaren Dosierungen, laut Fachinformation sollen manche Patienten von der höheren Dosis von 140 mg profitieren, es ist aber unklar welche.
CGRP hat eine ausgeprägte vasodilatatorische Wirkung. Die Hemmung seines Rezeptors birgt daher theoretisch das Risiko für kardiovaskuläre Ereignisse, das bei Migräne ohnehin gering erhöht ist. Die verfügbaren Studien ergaben keine eindeutigen Hinweise auf ein erhöhtes kardiovaskuläres Risiko, allerdings wurden Patienten > 65 Jahre oder mit kardiovaskulären Ereignissen in der Vorgeschichte ausgeschlossen. Unter Erenumab traten in den Zulassungsstudien zwei kardiale Todesfälle auf, die auf Vorerkrankungen zurückgeführt wurden. Die Risiken einer langfristigen Blockade von CGRP mit Erenumab – insbesondere hinsichtlich kardiovaskulärer Nebenwirkungen – können zum jetzigen Zeitpunkt nicht abschließend beurteilt werden, da Langzeitdaten zur Anwendung von Erenumab fehlen. Der Einsatz von Erenumab sollte daher vorerst nur nach Versagen anderer Arzneimittel zur Migräneprophylaxe oder bei Unverträglichkeit erfolgen.
Wirksamkeit in den Zulassungsstudien
Erenumab wurde in zwei Zulassungsstudien untersucht. In der internationalen, multizentrischen, randomisierten, doppelblinden, placebokontrollierten Phase-IIb-Studie wurden 667 Patienten mit chronischer Migräne (CM) mit oder ohne Aura und mit ≥ 15 Kopfschmerztage/Monat und davon ≥ 8 Migränetage/Monat eingeschlossen. Sie wurden im Verhältnis 3 : 2 : 2 randomisiert und erhielten subkutan alle vier Wochen Placebo (n = 286), 70 mg Erenumab (n = 191) oder 140 mg Erenumab (n = 190), stratifiziert nach geografischer Region und Übergebrauch von Akutmedikation (dieser lag bei etwa 41 % der Patienten vor). Nach einer Beobachtungsphase von vier Wochen, in der die Ausgangsbefunde erhoben wurden, erfolgte die Behandlungsphase über zwölf Wochen.
Die Patienten waren im Median 43 Jahre alt und zu 83 % weiblich. Die mittlere Migränehäufigkeit bei Studienbeginn betrug etwa 18 Migränetage pro Monat. Als primärer Endpunkt wurde die Änderung der Anzahl der monatlichen Migränetage erhoben. Sekundäre Endpunkte waren u. a. die mindestens 50-prozentige Reduktion der monatlichen Migränetage, die Änderung der Anzahl der Tage mit akuter Migränemedikation und der Anzahl der Migräneattacken in den letzten vier Studienwochen (drittes Quartal) im Vergleich zum Studienbeginn. 94,6 % der Patienten verblieben in der Studie über die gesamte Studiendauer (92,7 % im Placebo-Arm, 96,3 % im 70-mg-Arm und 95,8 % im 140-mg-Arm).
Der Rückgang der durchschnittlichen monatlichen Migränetage im Vergleich zu Placebo war unter beiden Dosierungen signifikant höher. Signifikante Ergebnisse zugunsten von Erenumab zeigten sich auch bezüglich der Reduktion der monatlichen Akutmedikationstage (Tabelle 1).
Patientenrelevante Endpunkte wie u. a. die Änderung der migränespezifischen Lebensqualität (Migraine-specific Quality of Life Questionnaire) und der Einfluss der Kopfschmerzen auf die Alltagsaktivitäten (Headache Impact Test) wurden lediglich als zusätzliche exploratorische Endpunkte erhoben und ohne genaue Angabe der statistischen Signifikanz berichtet.
Die zweite Studie war eine internationale, multizentrische, randomisierte, doppelblinde placebokontrollierte Phase-III-Studie, die Patienten mit episodischer Migräne (EM) einschloss, die in den vorausgegangenen zwölf Monaten an Migräne mit oder ohne Aura litten und 4–14 Migränetage pro Monat oder weniger als 15 Kopfschmerztage pro Monat hatten. Die 955 Patienten wurden im Verhältnis von 1 : 1 : 1 randomisiert und erhielten 140 mg (n = 319) oder 70 mg (n = 317) Erenumab oder Placebo (n = 319). Die Ausgangsbefunde wurden mittels eines elektronischen Tagebuchs über vier Wochen erhoben, daran schloss sich eine Behandlungsphase von 24 Wochen an.
Die Patienten waren im Median 41 Jahre alt und zu 85 % weiblich. Die mittlere Migränehäufigkeit bei Studienbeginn betrug etwa acht Migränetage pro Monat. Primärer Endpunkt war die Änderung der monatlichen Migränetage. Als sekundäre Endpunkte wurden u. a. die mindestens 50-prozentige Reduktion der monatlichen Migränetage, die Änderung der Anzahl der Tage mit akuter Migränemedikation und die Änderung hinsichtlich körperlicher Beeinträchtigungen und Alltagsaktivitäten in den letzten drei Monaten erhoben, die mithilfe des MPFID (Migraine Physical Function Impact Diary) gemessen wurden. Die Reduktion der durchschnittlichen monatlichen Migränetage im Vergleich zu Placebo war unter beiden Dosierungen signifikant höher, wenn auch schwach ausgeprägt. Signifikante Ergebnisse zugunsten von Erenumab zeigten sich auch bezüglich der Reduktion der monatlichen Akutmedikationstage sowie hinsichtlich körperlicher Beeinträchtigungen und Alltagsaktivitäten (Tabelle 2).
Durchgeführt wurde auch eine weitere zwölfwöchige doppelblinde placebokontrollierte Phase-III-Studie (ARISE1 ), die 577 Patienten mit EM einschloss, die in den vorausgegangenen zwölf Monaten an Migräne mit oder ohne Aura litten und 4–14 Migränetage pro Monat oder weniger als 15 Kopfschmerztage pro Monat hatten. 286 Patienten bekamen Erenumab 70 mg; 291 Patienten Placebo. Die Ausgangsbefunde wurden über vier Wochen erhoben, daran schloss sich eine doppelblinde Behandlungsphase von zwölf Wochen sowie eine offene Extensionsphase von 28 Wochen an.
Im primären Endpunkt – Änderung der durchschnittlichen monatlichen Migränetage – zeigte sich unter Erenumab im Vergleich zu Placebo eine statistisch signifikante Reduktion von –1,0 (95 % Konfidenzintervall –1,6 bis –0,5; p < 0,001). 39,5 % der Patienten unter Erenumab und 29,5 % der Patienten unter Placebo erreichten eine mindestens 50-prozentige Reduktion der monatlichen Migränetage. Die Reduktion der Anzahl der Tage mit akuter Migränemedikation war unter Erenumab doppelt so hoch wie unter Placebo, wenn auch mit im Mittel 1,2 Tagen (vs. 0,6 Tagen unter Placebo) sehr gering. Die Änderung hinsichtlich körperlicher Beeinträchtigungen und Alltagsaktivitäten um mindestens fünf Punkte – erhoben in den letzten drei Monaten mithilfe des MPFID – waren nicht signifikant unterschiedlich zwischen beiden Behandlungsarmen.
Ausgewählte Nebenwirkungen
Die wichtigsten häufigen Nebenwirkungen waren Obstipation, Pruritus, Muskelspasmen und Reaktionen an der Injektionsstelle. Im Vergleich zu Placebo (gepoolte Ergebnisse der 12-wöchigen Studien) waren Studienabbrüche aufgrund von unerwünschten Ereignissen doppelt so hoch unter Erenumab (1,0 % im Placebo-Arm vs. 1,7 % unter 70 mg und 2,0 % unter 140 mg Erenumab).
Ausgewählte Warnhinweise/Kontraindikationen/Interaktionen
- Von der Teilnahme an den klinischen Studien waren ausgeschlossen: ältere Patienten (> 65 Jahre), Patienten mit Opioid-Übergebrauch (Studie an Patienten mit CM), Patienten mit Arzneimittelübergebrauch (Studie an Patienten mit EM) sowie Patienten mit vorbestehendem Myokardinfarkt, Schlaganfall, transitorischen ischämischen Attacken, instabiler Angina pectoris, koronarer arterieller Bypass-Operation oder anderen durchgeführten Revaskularisierungsverfahren innerhalb der letzten zwölf Monaten vor dem Screening sowie Patienten mit schlecht kontrolliertem Bluthochdruck oder BMI > 40 (Studie an Patienten mit CM) waren von der Teilnahme an den klinischen Studien ausgeschlossen. Für diese Patientengruppen liegen weder Wirksamkeits- noch Sicherheitsdaten vor.
- Die abnehmbare Kappe des Erenumab-Fertigpens enthält getrockneten Naturkautschuklatex, der bei Personen mit Latexempfindlichkeit zu allergischen Reaktionen führen kann.
Weiterführende Informationen
Das IQWiG wurde am 01.11.2018 mit der Bewertung des Zusatznutzens beauftragt, über den der G-BA entscheiden wird. Sollte sich die AkdÄ mit einer Stellungnahme äußern, wird diese auf der AkdÄ-Website veröffentlicht.
Quelle
Europäischer Öffentlicher Beurteilungsbericht (EPAR) Aimovig® vom 31. Mai 2018, erschienen am 8. August 2018. Die vorliegende Information erhebt keinen Anspruch auf Vollständigkeit. Für die Richtigkeit der angegebenen Dosierungen kann keine Gewähr übernommen werden.
Fußnote
1 Dodick DW, Ashina M, Brandes JL, Kudrow D et al.: ARISE: A Phase 3 randomized trial of erenumab for episodic migraine. Cephalalgia 2018; 38: 1026-1037.
Hinweise
Arzneimittel, die mit einem schwarzen Dreieck (▼) gekennzeichnet sind, unterliegen einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.
„Neue Arzneimittel“ ist eine Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu neu zugelassenen Arzneimitteln oder zu neu zugelassenen Indikationen. Ziel ist es, den Ärzten zeitnah Informationen zu diesen Arzneimitteln zur Verfügung zu stellen, zunächst bei Markteinführung sowie nach der frühen Nutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA) (§ 35a Absatz 1 SGB V). „Neue Arzneimittel“ bei Markteinführung enthält Informationen basierend auf dem Europäischen Öffentlichen Bewertungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) sowie weiteren bei Markteinführung vorliegenden Daten aus klinischen Studien. Nach Abschluss der frühen Nutzenbewertung wird der Zusatznutzen des neuen Arzneimittels und seine therapeutische Bedeutung auf der Basis der Dossierbewertung des IQWiG, der Stellungnahme der AkdÄ und des Beschlusses des G-BA im Rahmen der frühen Nutzenbewertung dargestellt („Update – Neue Arzneimittel“).
vorab online
Dieser Artikel wurde am 14. Dezember 2018 vorab online veröffentlicht.
