Verfahren der frühen Nutzenbewertung – Stellungnahmen der AkdÄ
Einführung
Mit Wirkung zum 1. Januar 2011 ist das Gesetz zur Neuordnung des Arzneimittelmarktes (AMNOG) nach § 35a SGB V in Kraft getreten, es regelt u. a. die Preisbildung für neu zugelassene Arzneimittel. Der Gemeinsame Bundesausschuss (G-BA) hat den Auftrag erhalten, den Zusatznutzen von Arzneimitteln mit neuen Wirkstoffen im Vergleich zum Therapiestandard zu bewerten. Bevor der G-BA einen Beschluss fasst, der Eingang in die Arzneimittel-Richtlinie nehmen wird und auf dessen Grundlage die Preisverhandlungen zwischen pharmazeutischem Hersteller und der GKV beginnen, wird ein Stellungnahmeverfahren (schriftlich und mündlich) durchgeführt.
Über den Ablauf des Verfahrens der frühen Nutzenbewertung wurde in AVP 1/2016 berichtet: https://www.akdae.de/Arzneimitteltherapie/AVP/Artikel/201601/043h/.
Stellungnahmen der AkdÄ
Die AkdÄ als Sachverständige der medizinischen Wissenschaft und Praxis wurde vom G-BA durch Beschluss als stellungnahmeberechtigte Organisation bestimmt (§ 92 Abs. 3a SGB V).
Die AkdÄ-Stellungnahmen werden auf der Homepage der AkdÄ veröffentlicht (https://www.akdae.de/Stellungnahmen/AMNOG/) und am Tag der mündlichen Anhörung beim G-BA über den AkdÄ-Newsletter „AkdÄ News“ an die Abonnenten versendet.
Zu ausgewählten versorgungsrelevanten Wirkstoffen findet sich nach Beschlussfassung durch den G-BA in AVP in der Rubrik „Update - Neue Arzneimittel“ eine Zusammenfassung: www.akdae.de/Arzneimitteltherapie/NA/.
Die AkdÄ hat sich im Zeitraum 2011 bis 2018 an insgesamt 111 Verfahren beteiligt (siehe Tabelle 1).
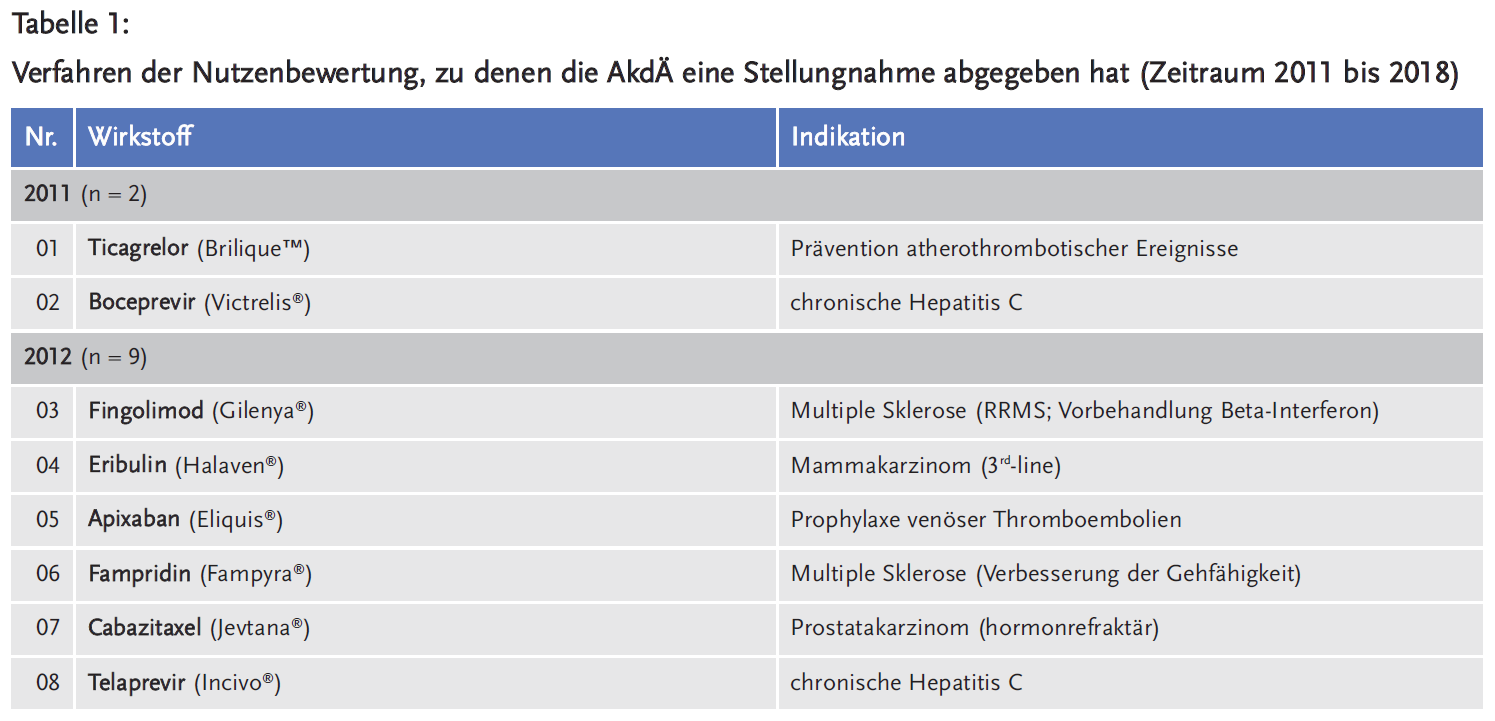
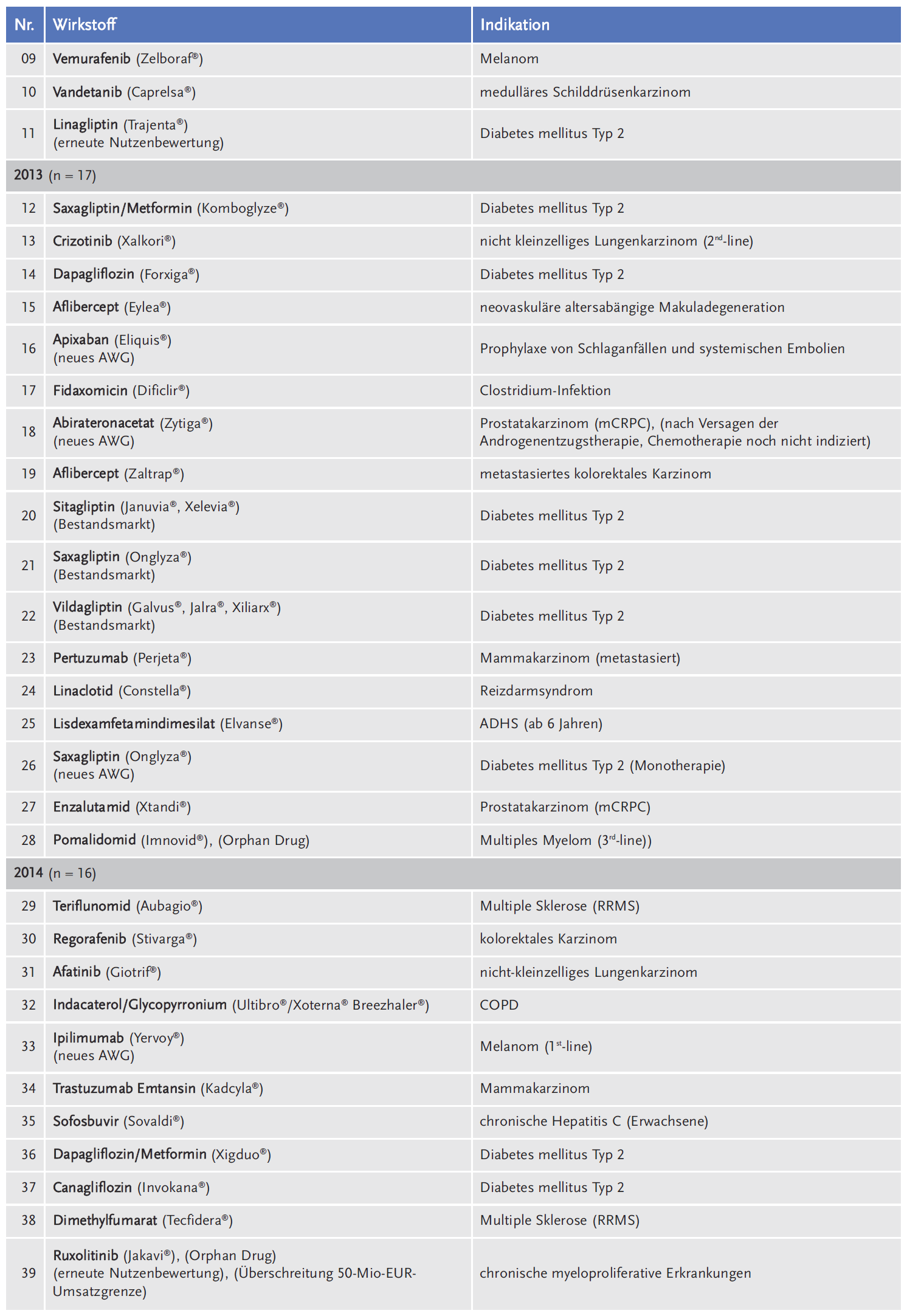
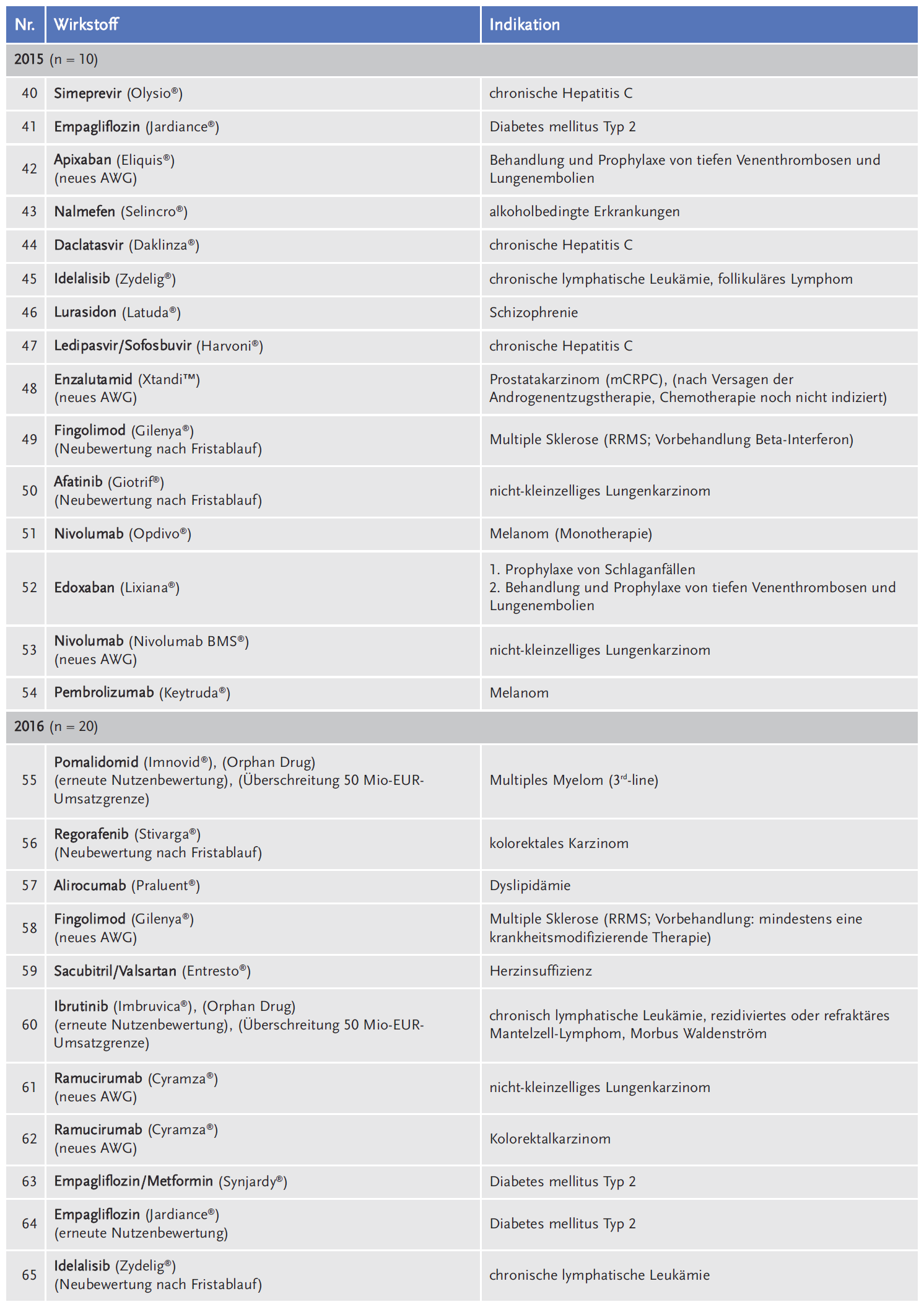
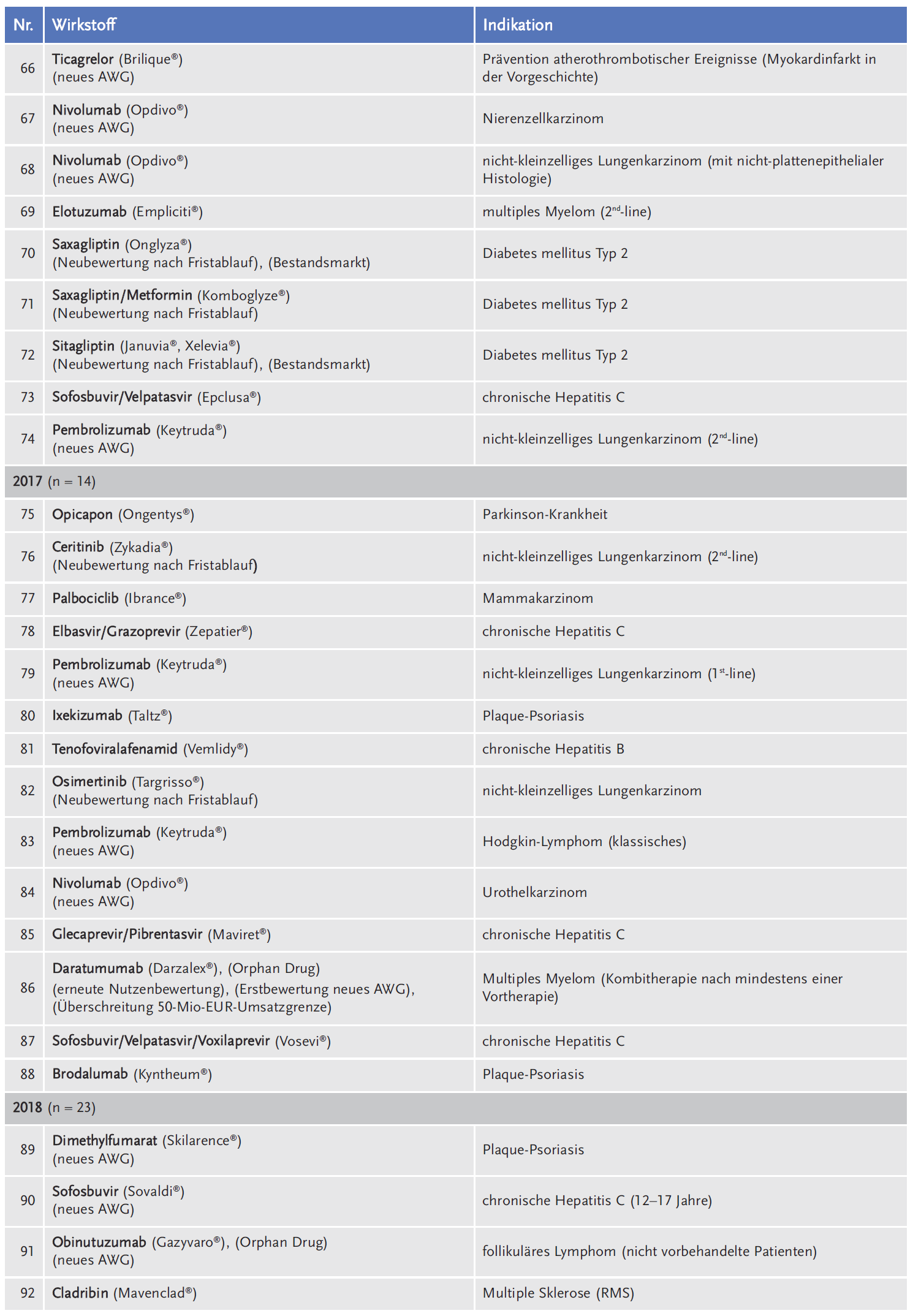
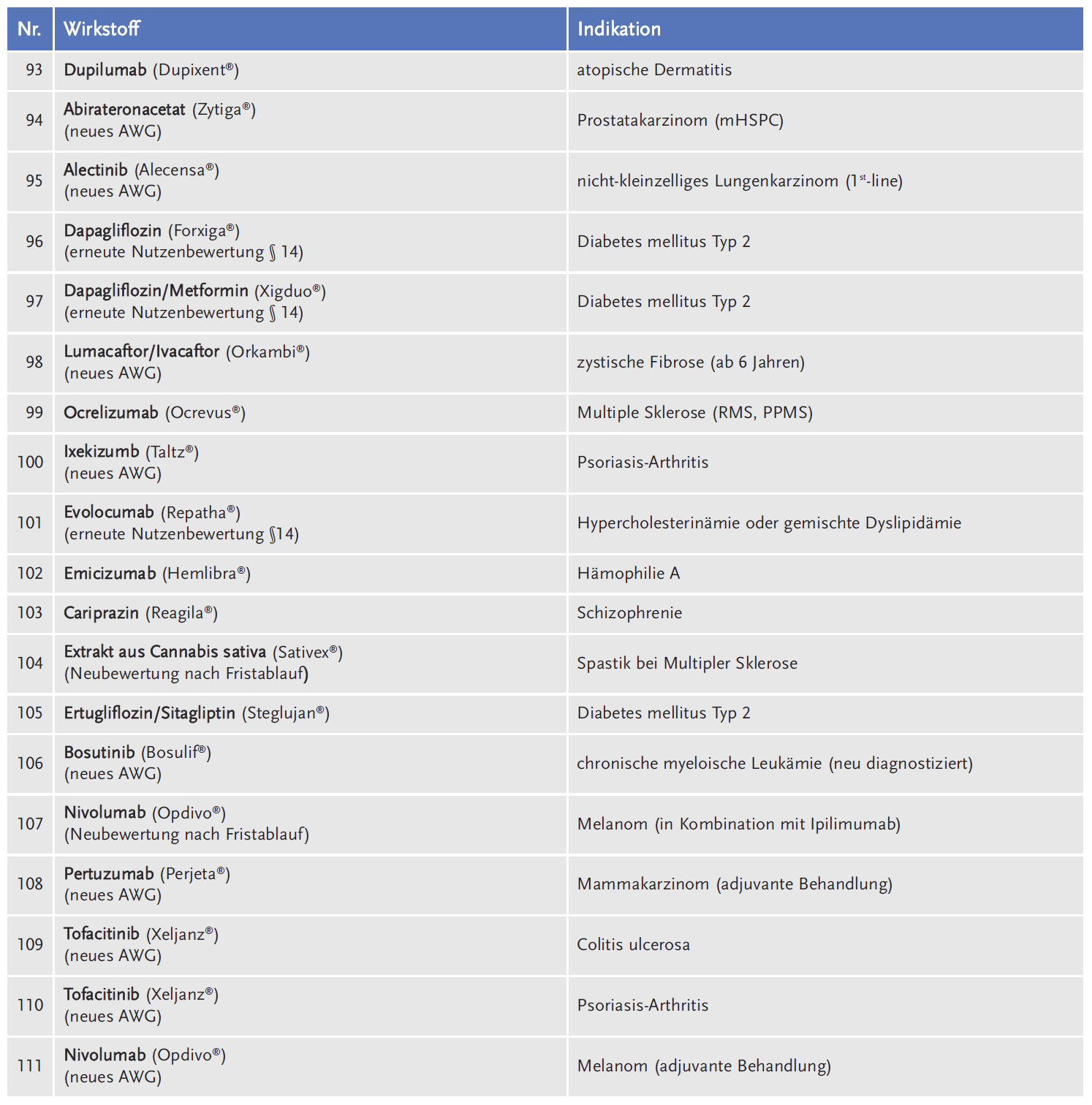
Legt man die Gesamtzahl der Verfahren beim G-BA von 359 zugrunde, liegt die durchschnittliche Beteiligung der AkdÄ bei 31 % (siehe Abbildung 1).
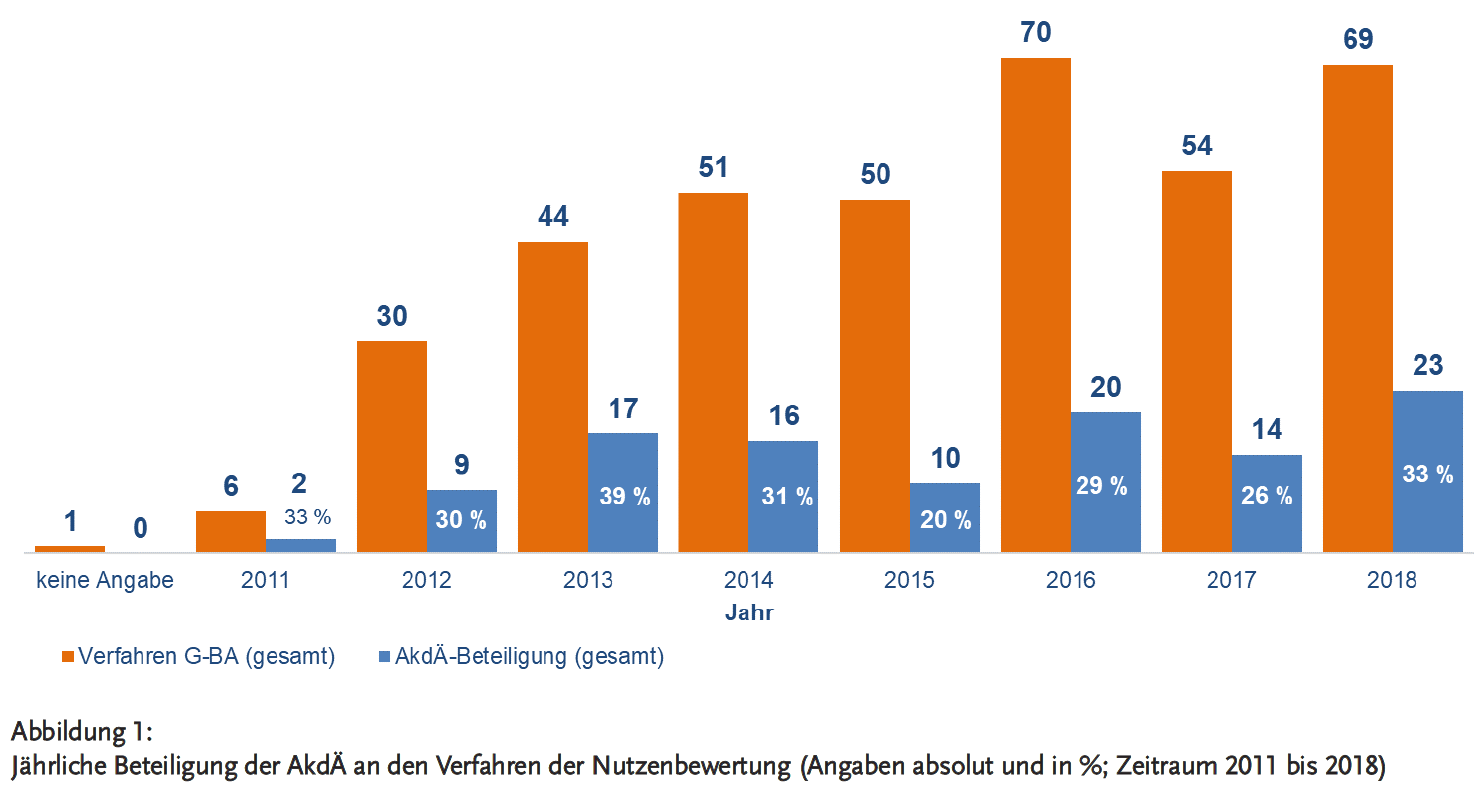
Bei Betrachtung der Arzneimittel mit neuen Wirkstoffen, zu denen der G-BA Beschlüsse gefasst hat, steht das Therapiegebiet der onkologischen Erkrankungen mit 38 % an erster Stelle (Quelle: www.g-ba.de/downloads/17-98-4599/2018-07-19_G-BA_Geschaeftsbericht_2017.pdf, Seite 44). Die Beteiligungsraten der AkdÄ an den Stellungnahmeverfahren nach Therapiegebieten zeigt Abbildung 2.
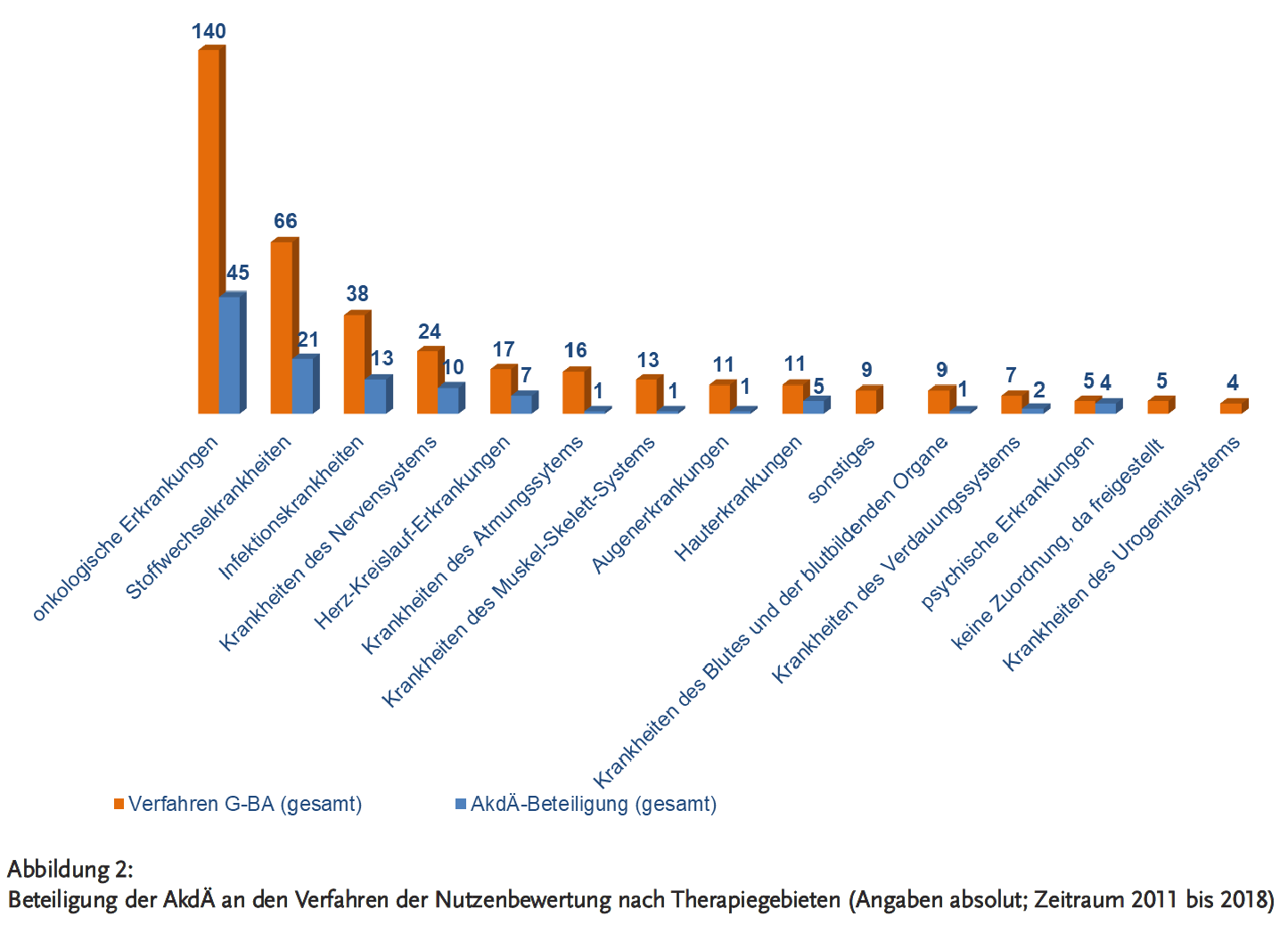
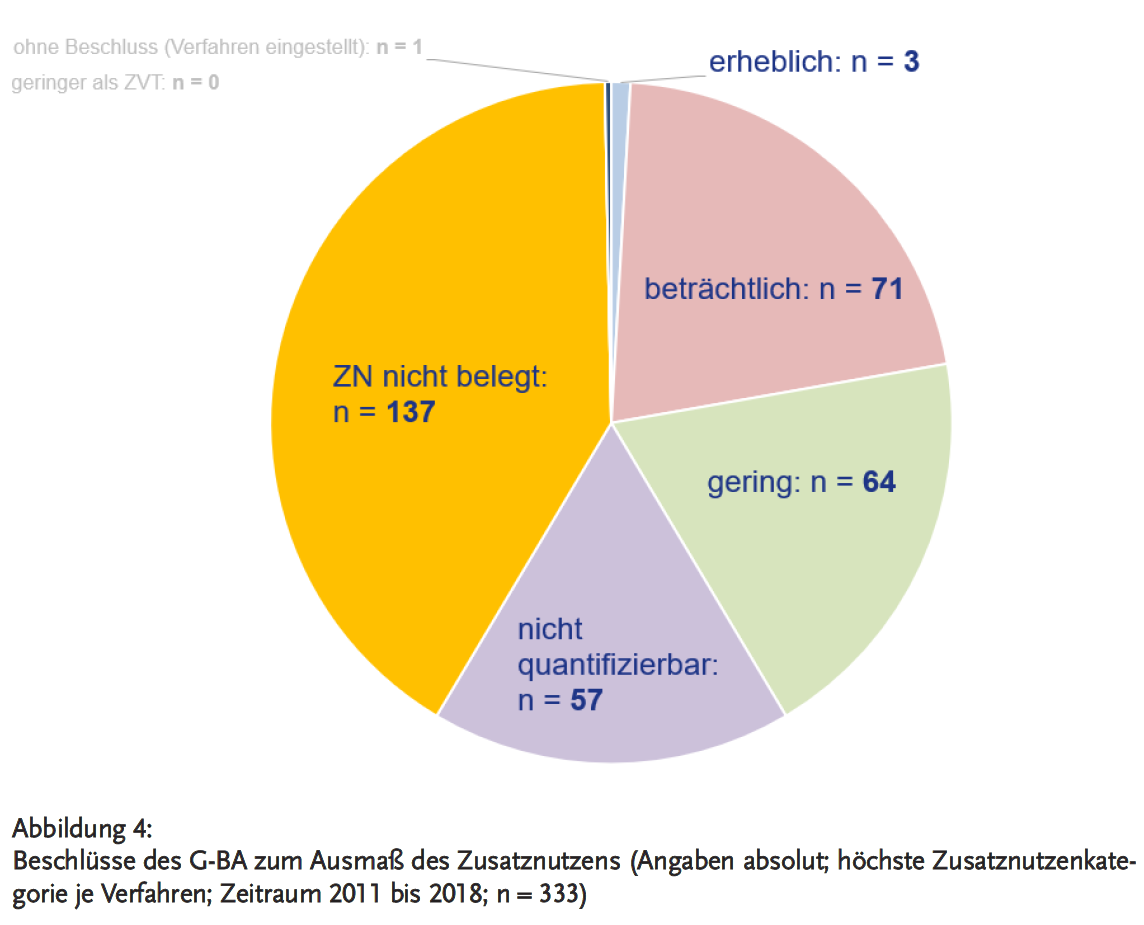
Empfehlungen der AkdÄ für die Bewertung des Zusatznutzens sind Bestandteil der AkdÄ-Stellungnahmeverfahren und werden in einem Fazit festgehalten. Dabei resümierte die AkdÄ bei 47 % der 108 eingereichten Stellungnahmen den Zusatznutzen als nicht belegt (siehe Abbildung 3), wohingegen der G-BA diese Kategorie bei 41 % der 333 gefassten Entscheidungen beschloss (siehe Abbildung 4).
In ihrem Fazit hat die AkdÄ bei 15 % ihrer Stellungnahmen einen nicht quantifizierbaren Zusatznutzen empfohlen, der G-BA beschloss bei 12 % der Verfahren einen nicht quantifizierbaren Zusatznutzen (siehe Abbildungen 3 und 4).
Experteneinschätzung des Verfahrens zur Nutzenbewertung
Wir haben an den AkdÄ-Stellungnahmeverfahren häufig beteiligte AkdÄ-Mitglieder um ihre Einschätzung zum Verfahren der frühen Nutzenbewertung gebeten:
Im Ergebnis wird die frühe Nutzenbewertung von Arzneimitteln als positiv und unverzichtbar angesehen. Begrüßt wird die mit der Veröffentlichung der Daten einhergehende Transparenz, die im Gegensatz zur Intransparenz der Preisverhandlungen zwischen gesetzlichen Krankenkassen und pharmazeutischen Unternehmern und der Nachvollziehbarkeit der Verhandlungsergebnisse bei der Preisbildung steht.
Gefordert wird die Bewertung ausgewählter Medikamente des Bestandsmarkts und übereinstimmend auch eine Nutzenbewertung zu einem späteren Zeitpunkt nach Markteinführung, wenn weitere Ergebnisse und Erfahrungen zum Nutzen und auch Nebenwirkungen zu den Wirkstoffen vorliegen.
Die bisherigen Erfahrungen zeigen, dass weder ein neuartiges Wirkprinzip oder eine innovative biochemische Struktur noch der Nachweis der pharmakologischen Wirksamkeit und Sicherheit im Rahmen der Zulassung garantieren, dass durch diesen Wirkstoff auch ein überzeugender, patientenrelevanter Zusatznutzen und damit ein therapeutischer Fortschritt erreicht wird.
AkdÄ-Stellungnahmen zum allgemeinen Verfahren der Nutzenbewertung
Die AkdÄ hat sich in zahlreichen Stellungnahmen für eine Verbesserung des Verfahrens der (frühen) Nutzenbewertung von Arzneimitteln ausgesprochen. So hat sich die AkdÄ 2014 gegen die Beendigung der Bewertung von Arzneimitteln des Bestandsmarktes positioniert: https://www.akdae.de/Stellungnahmen/AMNOG/Weitere/20141002.pdf , die Darstellung der Beschlüsse des G-BA zur Nutzenbewertung in der Praxisverwaltungssoftware bzw. im Arztinformationssystem kommentiert: https://www.akdae.de/Stellungnahmen/BMG/20170703.pdf und Vorschläge zur elektronischen Arzneimittelinformation unterbreitet: https://www.akdae.de/Stellungnahmen/BMG/20181119.pdf. Aktuelle Vorschläge zum AMNOG, insbesondere eine Positionierung gegen eine Sonderstellung der Orphan-Arzneimittel sind der Stellungnahme zum Referentenentwurf eines Gesetzes für mehr Sicherheit in der Arzneimittelversorgung (GSAV) zu entnehmen: https://www.akdae.de/Stellungnahmen/BMG/20181214.pdf.
Arzneimittelkommission der deutschen Ärzteschaft
