HIV-Präexpositionsprophylaxe
Zusammenfassung
Im HIV-Bereich hat die Präexpositionsprophylaxe (PrEP) für HIV-negative Personen mit bestimmter Risikokonstellation in Studien Wirkung bewiesen. Mit der Kombination Emtricitabin/Tenofovirdisoproxil (Truvada®) hat bereits ein Präparat die Zulassung zur kontinuierlichen Anwendung bekommen. Das Verschreiben und Überwachen der PrEP, einer „Therapie an Gesunden“, in erfahrenen Händen ist sinnvoll. Im Hinblick auf Substanzen, Darreichungsformen und Strategien ist in Zukunft noch einiges an Forschungsergebnissen und Neuerungen zu erwarten. Es werden ein Überblick über die aktuelle Studienlage zur PrEP und ihre Einbettung in Präventionsstrategien sowie Hinweise für die Praxis gegeben.
Abstract
In HIV-medicine pre exposition prophylaxis (PrEP) for HIV-negative patients has proven its efficacy. The combination of Emtricitabin/Tenofovirdisoproxil (Truvada®) has been approved for continous administration for this purpose. Being a „therapy for healthy patients“ the prescription and supervision of PrEP has to be conducted by HIV-centers and experienced physicians. In regard to other medications, galenic forms, and strategies new research results can be expected in the near future. This article delivers a short review on actual studies, state of the art of PrEP and their integration into daily patient care.
Einführung
Präventionsstrategien sind essentieller Bestandteil heutiger Medizin, um die HIV-Epidemie einzudämmen. Während Versuche, prophylaktische Impfungen zu etablieren, bislang ohne oder mit nur mäßigem Erfolg unternommen wurden (1), zeigen neben Aufklärungsarbeit und Kondomgebrauch eine Reihe medizinischer Maßnahmen Wirkung. Hierzu zählen neben der antiretroviralen Behandlung HIV-infizierter Patienten auch die Behandlung genitaler Infektionen (2-4) und die Zirkumzision (5). Nichtinfizierte können nach HIV-Exposition eine Postexpositionsprophylaxe erhalten. Nicht zuletzt hat sich die vorbeugende Anwendung antiretroviraler Medikamente an gesunden Personen, sei es topisch als vaginales Mikrobizid (6) oder systemisch, in klinischen Studien als effektiv gezeigt. Bei dieser Präexpositionsprophylaxe (PrEP) werden grundsätzlich kontinuierliche und anlassbezogene PrEP-Strategien unterschieden. Anfänglich noch mussten Studien in Patientengruppen mit Hochrisikoprofil – aus unterschiedlichen Gründen – abgebrochen werden (7;8), während seit 2010 zunehmend valide Studiendaten vorliegen.
Studienlage, aktuelle Empfehlungen und PrEP in der Praxis
Die Präexpositionsprophylaxe wurde als Weg einer möglichen HIV-Prävention in Situationen, in denen keine klassische Prävention mittels Kondomen oder Enthaltsamkeit möglich ist, erdacht. Insbesondere im Bereich der MSM („men who have sex with men“) mit häufig wechselnden Sexualpartnern oder sogenannten „Sexparties“ aber auch in soziokulturellen Umfeldern, in denen die Verwendung von Kondomen für Frauen nicht ohne Weiteres möglich ist, stellt sie einen sinnvollen Weg zur Reduktion der HIV-Inzidenz dar.
In den vergangenen Jahren konnten mehrere Studien zeigen, dass eine kontinuierliche oder anlassbezogene Einnahme einer PrEP zu einer Reduktion des Infektionsrisikos führt (siehe Tabelle 1). Hierbei wurden meist Tenofovirdisoproxil-haltige Präparate, meist Emtricitabin/Tenofovirdisoproxil (Truvada®) verwendet.
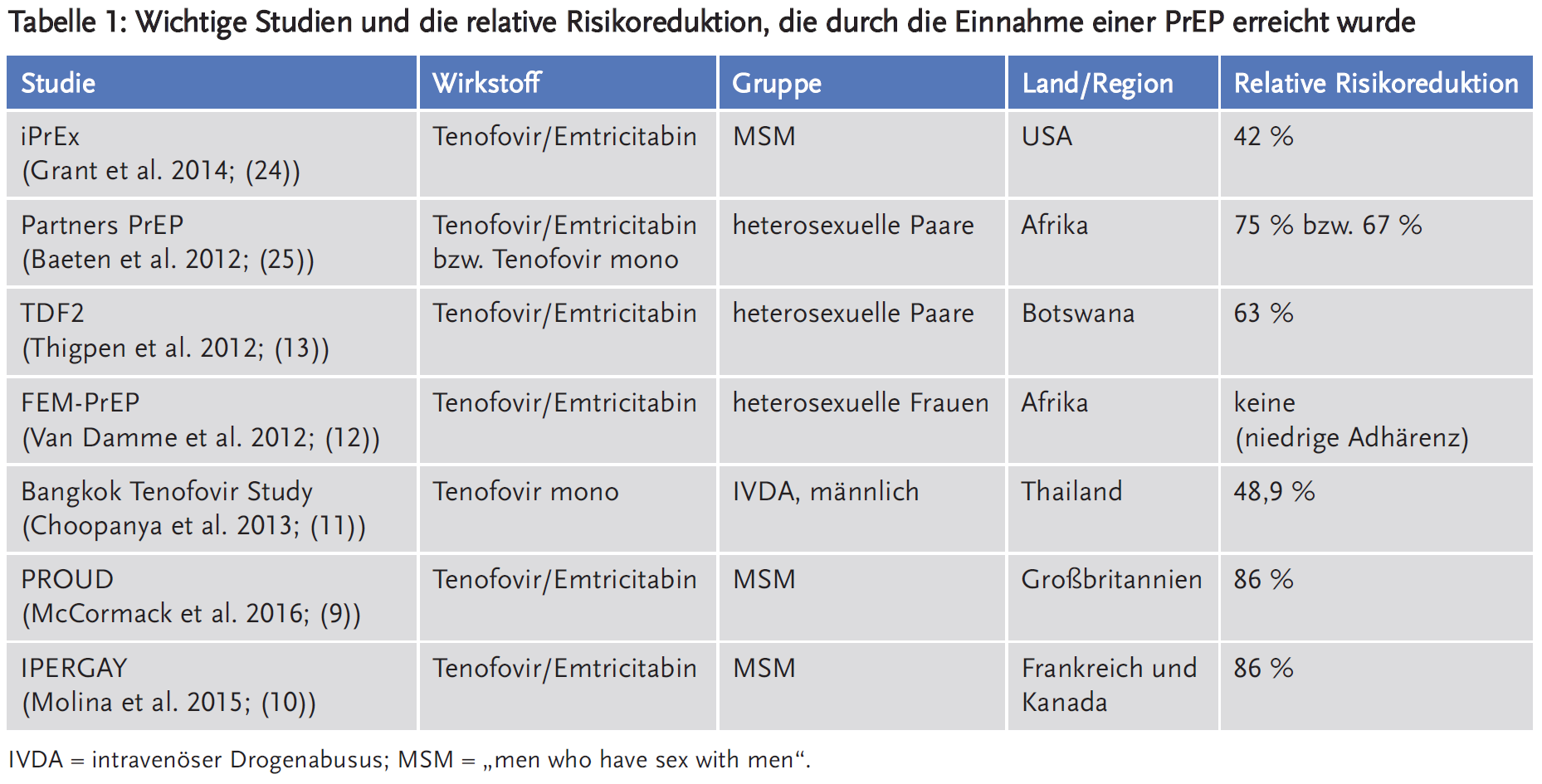
Vor allem für die Gruppe der MSM konnte dies belegt werden. Die PROUD-Studie zeigte eine 86-prozentige Reduktion des absoluten Risikos einer HIV-Neuinfektion bezogen auf gelebte Patientenjahre im Vergleich zur Plazebogruppe bei Patienten, die sexuellen Risikopraktiken nachgehen (9). Die IPERGAY-Studie konnte bei MSM eine ebenso 86-prozentige Reduktion der HIV-Inzidenz nachweisen, wenn eine PrEP vor und nach einem sexuellen Kontakt eingenommen wird (10).
Eine andere wichtige Risikogruppe stellen Patienten mit IVDA (intravenösem Drogenabusus) dar. Die Bangkok Tenofovir Study zeigte bei solchen Patienten eine 48,9-prozentige Risikoreduktion im Vergleich zur Plazebogruppe (11). Keine ausreichende Wirksamkeit war für Frauen in heterosexuellen Partnerschaften in Hochprävalenzländern im Rahmen der FEM-PrEP-Studie in Südafrika, Kenya und Tansania nachzuweisen. Die Studie musste vorzeitig abgebrochen werden (12).
Bei einer kontinuierlichen oder intermittierenden Einnahme eines Medikaments spielen die zu erwartenden Nebenwirkungen eine nicht unerhebliche Rolle. Wichtigste Nebenwirkungen von Emtricitabin/Tenofovirdisoproxil ist ein Anstieg der Nierenretentionsparameter (9;10;12). Des Weiteren wird eine diskrete Abnahme der Knochendichte beobachtet (13). Kopfschmerzen oder ein Anstieg der Lebertransaminasen sind ebenso möglich. In welchem Verhältnis diese Nebenwirkungen zur tatsächlichen Risikoreduktion stehen, müssen spätere Langzeitstudien noch klären. Eine zukünftige Rolle von Tenofovir/Alafenamid, welches weniger renale und ossäre Nebenwirkungen verursacht, wird ebenso zu evaluieren sein.
Ein weiterer offener Punkt ist die eventuelle Zunahme anderer sexuell übertragbarer Erkrankungen unter der Einnahme einer PrEP.
In Europa ist die PrEP seit August, in Deutschland seit Oktober 2016 zugelassen. Bisher werden die Kosten nicht von den Krankenversicherungen übernommen. Die Monatstherapiekosten mit Truvada® betragen aktuell ca. 800 Euro.
Welchem Patienten sollte eine PrEP angeboten werden?
Leitlinien sind noch nicht von allen Fachgesellschaften verabschiedet worden. Die EACS (European AIDS Clinical Society) empfiehlt die PrEP für Erwachsene mit Hochrisikoprofil sowie ohne beständigen Kondomgebrauch und fordert, zuvor einen Hepatitis-B-Serostatus zu erheben. Die Empfehlung bezieht sich hier insbesondere auf Männer, die Sex mit Männern haben (MSM), während für heterosexuelle Frauen und Männer eine PrEP zumindest in Betracht gezogen werden sollte (14). Auch gemäß der CDC PrEP Clinical Practical Guideline 2014 sollten MSM, die in den letzten sechs Monaten entweder ungeschützten rezeptiven analen Verkehr, eine andere sexuell übertragbare Erkrankung („sexually transmitted disease“, STD) oder eine aktive Beziehung mit einem HIV-positiven Partner hatten, eine PrEP angeboten bekommen (15) (siehe Tabelle 2). Ebenso sollte bei heterosexuellen Patienten mit diskordanten Partnerschaften oder bisexuellem Verhalten eine Empfehlung ausgesprochen werden. Für drogenabhängige Patienten stellen ein i.v.-Drogenabusus, Needlesharing in den letzten sechs Monaten, die Teilnahme in einem Substitutionsprogramm oder obenstehendes sexuelles Risikoverhalten Indikationen dar. Weitere Risikoindikatoren sind Postexpositionsprophylaxe oder Sexualverkehr unter dem Einfluss synthetischer Drogen (sog. Chemsex) in der Anamnese.

Für alle Gruppen gilt, dass eine chronische oder akute HIV-Infektion im Vorfeld ausgeschlossen sein muss. Dies sollte serologisch oder ggf. mittels PCR getestet worden sein.
Anwendung in der Praxis
Nicht zuletzt wegen der potenziellen Risiken ist es angeraten, Indikationsstellung und Überwachung in die Hände von mit der HIV-Therapie vertrauten Ärzten zu legen. Grundsätzlich sollten während einer PrEP dreimonatlich HIV-Tests durchgeführt und Nierenretentionswerte kontrolliert werden. Über Nebenwirkungen und Langzeittoxizitäten sollte ebenso aufgeklärt werden wie über das klinische Erscheinungsbild eines akuten retroviralen Syndroms.
Ausblick
Aufgrund der gezeigten PrEP-Erfolge werden auch in Zukunft Substanzen und Strategien Ziele klinischer Studien bleiben. Insbesondere im Hinblick auf sogenannte On-demand-Konzepte bleiben Fragen offen. Dabei zeigen ereignisbezogene PrEP-Einnahmen Wirksamkeit, wie z. B. in der IPERGAY-Studie zu sehen, siehe oben (10). Inwieweit diese und ähnliche Strategien den kontinuierlichen (täglichen) PrEP-Einnahmen vor dem Hintergrund verminderter Adhärenz unterlegen sind, wurde bereits angedeutet (16). Sie werden auch künftig noch Gegenstand der Forschung sein. Unklar bleibt, inwieweit gelegentliche Tenofovireinnahmen Resistenzentwicklungen für Hepatitis B bedingen können.
Auch ein Risiko für den Erwerb neuer Koinfektionen – sei es Hepatitis C oder andere STD – wird unter einer PrEP nicht geringer, insbesondere wenn der Gebrauch von Kondomen unter PrEP-Einnahme seltener wird (17;18;9). In der PROUD-Studie allerdings konnte eine Zunahme an STD zumindest unter MSM nicht demonstriert werden (9). Die bei weiterem Einsatz von PrEP entstehenden Daten werden aber auch hier noch abzuwarten sein.
Dass neuere Tenofoviralafenamid(TAF)-haltige Präparate im Rahmen der antiretroviralen Therapie (ART) günstigere Langzeittoxizitätsprofile aufweisen (Niere, Knochenstoffwechsel), konnte gezeigt werden (19), sodass künftige Studienergebnisse für die TAF-basierte PrEP mit Spannung erwartet werden dürfen.
Langwirksame, injizierbare Medikamente zur HIV-Therapie sind Bestandteil klinischer Studien, aber auch mit Cabotegravir werden bereits auf dem Gebiet der PrEP erste Daten gesammelt, die Erfreuliches in Bezug auf Patientenzufriedenheit und -sicherheit andeuten (20).
Breit neutralisierende Antikörper wie der monoklonale VRC01 haben bereits antivirale Aktivität in HIV-1-Infizierten bewiesen (21;22) und werden nun in randomisierten Phase-II-Präventionsstudien untersucht.
Bereits in Phase III untersucht wurde der nichtnukleosidische Reverse-Transkriptase-Inhibitor (NNRTI) Dapivirin als Vaginalring an sexuell aktiven, HIV-negativen afrikanischen Frauen und demonstrierte eine signifikante Risikoreduktion einer HIV-Infektion, was nicht zuletzt vor dem Hintergrund der Applikationsform ein Potenzial für eine bessere Adhärenz birgt (23).
Noch in den Kinderschuhen stecken die Entwicklungen wirksamer Vakzine sowie subdermaler Implantate und es bleibt offen, ob sich in naher Zukunft – insbesondere in Bezug auf Impfstoffe – ein Erfolg überhaupt einstellen wird.
Fazit für die Praxis
Eine HIV-PrEP mittels Emtricitabin/Tenofovir kann für Hochrisikogruppen infrage kommen; sie bedarf vor dem Hintergrund der Kosten, Langzeittoxizitäten und dem fehlenden Schutz vor anderen sexuell übertragbaren Erkrankungen einer ausführlichen Information. Das A und O der Prävention sind ferner Aufklärung und Kondomgebrauch sowie die Behandlung HIV-infizierter Patienten.
Aufgrund der noch zu erwartenden Entwicklungen und Erkenntnisse laufender Forschung lohnt es sich, auf dem Laufenden zu bleiben.
Interessenkonflikte
G. Kann hat für die Teilnahme am Kongress für Infektionskrankheiten und Tropenmedizin (2016) eine Reisekostenerstattung der Firma Abbvie erhalten. N. Wetzstein hat für die Teilnahme am Campus Infektiologie (2015) eine Reisekostenerstattung der Firma Gilead Sciences erhalten.
Literatur
- Karnasuta C, Akapirat S, Madnote S et al.: Comparison of antibody responses induced by RV144, VAX003, and VAX004 vaccination regimens. AIDS Res Hum Retroviruses 2017; 33: 410-423.
- Freeman EE, Weiss HA, Glynn JR et al.: Herpes simplex virus 2 infection increases HIV acquisition in men and women: systematic review and meta-analysis of longitudinal studies. AIDS 2006; 20: 73-83.
- LeGoff J, Weiss HA, Gresenguet G et al.: Cervicovaginal HIV-1 and herpes simplex virus type 2 shedding during genital ulcer disease episodes. AIDS 2007; 21: 1569-1578.
- Cohen CR, Lingappa JR, Baeten JM et al.: Bacterial vaginosis associated with increased risk of female-to-male HIV-1 transmission: a prospective cohort analysis among African couples. PLoS Med 2012; 9: e1001251.
- Mills E, Cooper C, Anema A, Guyatt G: Male circumcision for the prevention of heterosexually acquired HIV infection: a meta-analysis of randomized trials involving 11,050 men. HIV Med 2008; 9: 332-335.
- Abdool Karim Q, Abdool Karim SS, Frohlich JA et al.: CAPRISA 004 Trial Group: Effectiveness and safety of tenofovir gel, an antiretroviral microbicide, for the prevention of HIV infection in women. Science 2010; 329: 1168-1174.
- Singh JA, Mills EJ: The abandoned trials of pre-exposure prophylaxis for HIV: what went wrong? PLoS Med 2005; 2: e234.
- Cohen J: AIDS research. Cambodian leader throws novel prevention trial into limbo. Science 2004; 305: 1092.
- McCormack S, Dunn DT, Desai M et al.: Pre-exposure prophylaxis to prevent the acquisition of HIV-1 infection (PROUD): effectiveness results from the pilot phase of a pragmatic open-label randomised trial. Lancet 2016; 387: 53-60.
- Molina JM, Capitant C, Spire B et al.; ANRS IPERGAY Study Group: On-demand preexposure prophylaxis in men at high risk for HIV-1 infection. N Engl J Med 2015; 373: 2237-2246.
- Choopanya K, Martin M, Suntharasamai P et al.; Bangkok Tenofovir Study Group: Antiretroviral prophylaxis for HIV infection in injecting drug users in Bangkok, Thailand (the Bangkok Tenofovir Study): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet 2013; 381: 2083-2090.
- Van Damme L, Corneli A, Ahmed K et al.; FEM-PrEP Study Group: Preexposure prophylaxis for HIV infection among African women. N Engl J Med 2012; 367: 411-422.
- Thigpen MC, Kebaabetswe PM, Paxton LA et al.; TDF2 Study Group: Antiretroviral preexposure prophylaxis for heterosexual HIV transmission in Botswana. N Engl J Med 2012; 367: 423-434.
- European AIDS Clinical Society (EACS): European Guidelines for treatment of HIV-positive adults in Europe:http://www.eacsociety.org/guidelines/eacs-guidelines/eacs-guidelines.html
- US Public Health Service, Center for Disease Control and Prevention (CDC): Preexposure Prophylaxis for the Prevention of HIV Infection in the United States – 2017 Update, A Clinical Practice Guideline:https://www.cdc.gov/hiv/pdf/risk/prep/cdc-hiv-prep-guidelines-2017.pdf
- Mannheimer S, Hirsch-Moverman Y: What we know and what we do not know about factors associated with and interventions to promote antiretroviral adherence. Curr Infect Dis Rep 2015; 17: 466.
- Volk JE, Marcus JL, Phengrasamy T et al.: No New HIV infections with increasing use of HIV preexposure prophylaxis in a clinical practice setting. Clin Infect Dis 2015; 61: 1601-1603.
- Volk JE, Marcus JL, Phengrasamy T, Hare CB: Incident hepatitis C virus infections among users of HIV preexposure prophylaxis in a clinical practice setting. Clin Infect Dis 2015; 60: 1728-1729.
- Gallant JE, Daar ES, Raffi F et al.: Efficacy and safety of tenofovir alafenamide versus tenofovir disoproxil fumarate given as fixed-dose combinations containing emtricitabine as backbones for treatment of HIV-1 infection in virologically suppressed adults: a randomised, double-blind, active-controlled phase 3 trial. Lancet HIV 2016; 3: e158-e165.
- Markowitz M, Frank I, Grant RM et al.: Safety and tolerability of long-acting cabotegravir injections in HIV-uninfected men (ECLAIR): a multicentre, double-blind, randomised, placebo-controlled, phase 2a trial. Lancet HIV 2017; 4: e331-e340.
- Ledgerwood JE, Coates EE, Yamshchikov G et al.; VRC 602 Study Team: Safety, pharmacokinetics and neutralization of the broadly neutralizing HIV-1 human monoclonal antibody VRC01 in healthy adults. Clin Exp Immunol 2015; 182: 289-301.
- Lynch RM, Boritz E, Coates EE et al.; VRC 601 Study Team: Virologic effects of broadly neutralizing antibody VRC01 administration during chronic HIV-1 infection. Sci Transl Med 2015; 7: 319ra206.
- Baeten JM, Palanee-Phillips T, Brown ER et al.; MTN-020–ASPIRE Study Team: Use of a vaginal ring containing dapivirine for HIV-1 prevention in women. N Engl J Med 2016; 375: 2121-2132.
- Grant RM, Anderson PL, McMahan V et al.: Uptake of pre-exposure prophylaxis, sexual practices, and HIV incidence in men and transgender women who have sex with men: a cohort study. Lancet Infect Dis 2014; 14: 820-829.
- Baeten JM, Donnell D, Ndase P et al.: Antiretroviral prophylaxis for HIV prevention in heterosexual men and women. N Engl J Med 2012; 367: 399-410.
