Möglichkeiten der Fertilitätsprotektion
Zusammenfassung
Die aus unterschiedlichen Indikationen motivierte Fertilitätsprotektion ist in den letzten Jahren zunehmend in den Fokus sowohl des interdisziplinären Interesses als auch der Laienpresse gerückt. In dieser Arbeit werden Hintergründe der Thematik sowie die aktuellen Daten zum Kenntnisstand inklusive Chancen und Grenzen der bestehenden Möglichkeiten sowie noch offene Fragen dargestellt. Der Schwerpunkt liegt dabei auf der weiblichen Fertilitätsprotektion.
Abstract
In recent years fertility protection has increasingly come into the focus of interdisciplinary and public interest in a variety of indications. In this article, background and actual data regarding knowledge about chances, limits and open questions of actual possibilities will be described. Main focus lies on female fertility protection.
Einleitung
Insbesondere das Interesse an der Protektion der weiblichen Fertilität ist in den letzten Jahren deutlich gewachsen, wofür verschiedene Gründe verantwortlich sein können (Tabelle 1).

In dieser Arbeit sollen im Schwerpunkt die für das Verständnis der Problematik relevanten Aspekte der weiblichen, in einem kleineren Abschnitt auch der männlichen Fertilitätsprotektion dargelegt werden.
Weibliche Fertilitätsprotektion aus medizinischen Indikationen
Beurteilung der ovariellen Reserve und potenzielle Auswirkungen einer Chemotherapie und Radiatio
Die Basis einer Beratung zur Fertilitätsprotektion bildet die Antwort auf die Frage, ob und wie ausgeprägt die geplante Therapie (Operation, meist aber vor allem Chemo- und/oder Strahlentherapie) zu einer persistierenden Beeinträchtigung der ovariellen Reserve führen kann. Aus verschiedenen Gründen gestaltet sich diese Beratung oftmals schwierig:
a) Als Outcome-Parameter vieler Studien zum gonadotoxischen Effekt einer Chemotherapie wird die sogenannte Amenorrhoe-Rate angegeben. Mittlerweile ist aber bekannt, dass der sensibelste Parameter zur Einschätzung der ovariellen Reserve das Anti-Müller-Hormon (AMH) darstellt, welches von den frühen antralen Follikeln gebildet wird und histologisch auch mit der Primordialfollikeldichte korreliert (1). Eine durch die Therapie beeinträchtigte Ovarialfunktion bedeutet nicht automatisch eine Zyklusstörung bis zur Amenorrhoe. Wenn eine Patientin nach der Therapie zwar noch blutet, aber ein deutlicher AMH-Abfall vorliegt, kann das relevant sein, da sie dann aktuell zwar als fertil gilt, aber ihr eventuell nicht mehr die altersabhängig zu erwartende reproduktive Lebensphase zur Verfügung steht. Das mindert ebenfalls ihre Chancen zur Erfüllung des späteren Kinderwunsches, da zum Beispiel wegen der mitunter mehrjährigen adjuvanten Therapie (z. B. beim Hormonrezeptor-positiven Mammakarzinom) noch viel Zeit vergeht, in der die Ovarien ihre Funktion aufrecht erhalten müssen. Daten zu AMH-Verläufen nach den verschiedenen Chemotherapien liegen momentan nur eingeschränkt vor.
Im Gegensatz zum physiologischen Altern kann das AMH posttherapeutisch wieder ansteigen, sodass eine abschließende Bewertung der Ovarialfunktion mitunter eines längeren Follow-up von bis zu zwei bis drei Jahren nach Ende der Chemotherapie bedarf (2). Gleiches gilt in Analogie zur Radiatio, bei der die Ovarien im Bestrahlungsfeld liegen. Bedeutend kann hier allerdings auch eine Bestrahlung des Uterus sein, weil diese zu einer dauerhaften Endometriumatrophie führen kann, die – auch bei noch vorhandener Ovarialfunktion – eine Sterilität verursacht.
b) Von den einzelnen Chemotherapeutika sind unterschiedlich ausgeprägte gonadotoxische Effekte bekannt, die hinsichtlich der Amenorrhoe-Rate zu einem Ranking in hohes, mittleres und niedriges Risiko geführt haben (3). Allerdings wird die Beurteilung des Effektes dadurch erschwert, dass spezifische Untersuchungen zum AMH noch selten sind, die kumulativen Dosierungen der Medikamente sich unterscheiden und außerdem meist kombinierte Chemotherapien erfolgen, was zu Summationseffekten der Gonadotoxizität führen kann.
c) Die Auswirkungen auf die Ovarialfunktion hängen weiterhin wesentlich davon ab, in welchem Alter der Patientin und welchem Funktionszustand der Ovarien eine Therapie stattfindet. Je jünger eine Patientin und je höher ihr prätherapeutischer AMH-Wert liegt, desto geringer ist das Risiko einer Schädigung der Gonaden (4,5). In Analogie zur Chemotherapie sinkt mit dem Alter auch die zur Sterilisation erforderliche Strahlendosis auf die Ovarien (6).
Die dargestellten Probleme bedingen, dass die Wahrscheinlichkeit einer relevanten Einschränkung der Ovarialfunktion durch die geplante Therapie nicht immer mit der gewünschten Präzision sondern lediglich ungefähr prognostiziert werden kann.
Ovarielle Transposition
Ist ausschließlich eine Radiatio des kleinen Beckens geplant, kann eine operative Verlagerung der Ovarien (Transposition) aus dem Bestrahlungsfeld erfolgen. In einem Review von 32 Publikationen mit 1189 Patientinnen wurde über eine „erhaltene Ovarialfunktion“ bei ca. 70 % berichtet (7).
GnRH-Agonisten
Die Gabe von GnRH-Agonisten (GnRHa) – beginnend vor und fortgesetzt während einer Chemotherapie – beruht auf der Hypothese, dass eine hypophysäre Downregulation zu einem funktionellen Ruhezustand der Ovarien führt und Chemotherapeutika dadurch ihre gonadotoxischen Effekte nur eingeschränkt entwickeln können. Skepsis an dieser Hypothese besteht, weil die zu schützenden Primordial- und frühen antralen Follikel noch gar nicht Gonadotropin-sensitiv sind. Dennoch zeigen die in der aktuellsten Metaanalyse zusammengefassten – methodisch allerdings sehr heterogenen – Studien überwiegend eine signifikante Reduktion der Wahrscheinlichkeit einer vorzeitigen Ovarialinsuffizienz (premature ovarian insufficiency, POI), wenn GnRHa während der Chemotherapie appliziert wurden. Ob auch die spätere Schwangerschaftsrate dadurch steigt, beantworten die Studien uneinheitlich (8). Zu den GnRHa für die Fertilitätsprotektion besteht daher weiterer Studienbedarf.
Kryokonservierung unfertilisierter oder fertilisierter Eizellen
Eine weitere, ab der Menarche mögliche Option ist die ovarielle Stimulation und transvaginale Follikelpunktion. Die gewonnenen Eizellen können anschließend unfertilisiert (Abbildung 1) oder – wenn es einen festen Partner gibt – fertilisiert im Pronukleusstadium (Abbildung 2) kryokonserviert werden.
Für die späteren Schwangerschaftschancen ist neben dem Alter zum Zeitpunkt der Stimulation auch die Zahl der kryokonservierten Eizellen entscheidend. Mit dem Alter steigt die Aneuploidierate der Eizellen, wodurch die spätere Schwangerschaftsrate sinkt und die Abortrate zunimmt. Betrachtet man zum Beispiel die Aneuploidierate von Embryonen, so beträgt diese bei Frauen im 30. Lebensjahr etwa 20–25 %, im 40. Lebensjahr bereits etwa 60 % (9). Bewertet man die kumulative Lebendgeburtenrate bei Verwendung von Eizellen, die sowohl aus medizinischen als auch nichtmedizinischen Indikationen eingefroren wurden, hinsichtlich des Alters bei der Kryokonservierung, liegt diese in der Altersgruppe ≤ 35 Jahre z. B. bei zehn Eizellen bei 60,5 %, in der Altersgruppe ≥ 36 Jahre aber nur noch bei 29,7 % (10). Die Autoren empfehlen daher die Kryokonservierung von wenigstens acht bis zehn Metaphase-II-Oozyten bzw. in der Altersgruppe > 36 Jahre eine individuelle Festlegung dieser Zellzahl.
Unter Berücksichtigung des Alters sowie einer Einschätzung der zu erwartenden ovariellen Reaktion auf der Basis des AMH-Wertes muss daher der Nutzen dieser protektiven Option abgewogen werden.
Ein weiteres Kriterium stellt das verfügbare Zeitfenster zwischen der Beratung und der geplanten potenziell fertilitätseinschränkenden Therapie dar. Die ovarielle Stimulation kann zu jedem Zykluszeitpunkt begonnen werden, benötigt aber etwa zwei Wochen Zeit bis zur Follikelpunktion (11).
Kryokonservierung von Ovarialgewebe
Die schon seit über 15 Jahren praktizierte Kryokonservierung von Ovarialgewebe beweist zunehmend ihre Effektivität durch die mittlerweile häufigeren Retransplantationen und eintretenden Schwangerschaften. Umfassende Registrierungen der Ergebnisse erfolgen momentan allerdings nur in Dänemark sowie innerhalb des FertiPROTEKT-Netzwerkes (siehe unten). Die 2016 aus letzterem publizierten Daten von 74 transplantierten Frauen zeigen eine Schwangerschaftsrate/Transplantation von 28 % und eine Geburtenrate/Transplantation von 23 % (12). In einer 2017 publizierten Übersicht der weltweit verfügbaren Ergebnisse wurden 86 Geburten und 9 laufende Schwangerschaften berichtet (13).
Das Risiko einer Retransplantation im Ovar befindlicher Tumorzellen wird zwischen den unterschiedlichen Tumorentitäten gewichtet. Bis dato gibt es weltweit keine Berichte über eine solche Komplikation nach einer Retransplantation beim Menschen. Als „hoch“ wird das Risiko zum Beispiel bei Leukämien, Neuroblastomen und Burkitt-Lymphomen angesehen, bei denen eine Kryokonservierung von Ovarialgewebe daher kritisch betrachtet wird (14).
Männliche Fertilitätsprotektion aus medizinischen Indikationen
Die Kryokonservierung von Spermien ist unkompliziert, weil diese kaum Zytoplasma und damit intrazelluläres Wasser enthalten, was eine Kristallisation unwahrscheinlich macht, sodass sie grundsätzlich sogar ohne Kryoprotektiva eingefroren werden können. Eine Indikation besteht bei geplanten gonadotoxischen Therapien, bei Operationen, welche die spätere Ejakulation/Erektion negativ beeinflussen können sowie bei geplanten ablativen Eingriffen mit dem Verlust eines oder beider Hoden.
Es ist bekannt, dass Adoleszenten – unabhängig von ihrer Grunderkrankung – vergleichbare Ejakulatparameter aufweisen wie Erwachsene (15). Lassen sich im Ejakulat keine oder nur wenige Spermien nachweisen, ist eine Hodengewebeentnahme (testikuläre Spermienextraktion, TESE) und – beim Nachweis darin befindlicher Spermien – Kryokonservierung möglich (Kryo-TESE). Je nach Qualität der nach Ejakulation kryokonservierten Spermienproben ist später eine intrauterine Insemination oder intrazytoplasmatische Spermieninjektion (ICSI) möglich. Bei Verwendung testikulärer Spermien bedarf es später immer einer ICSI.
FertiPROTEKT Netzwerk e.V.
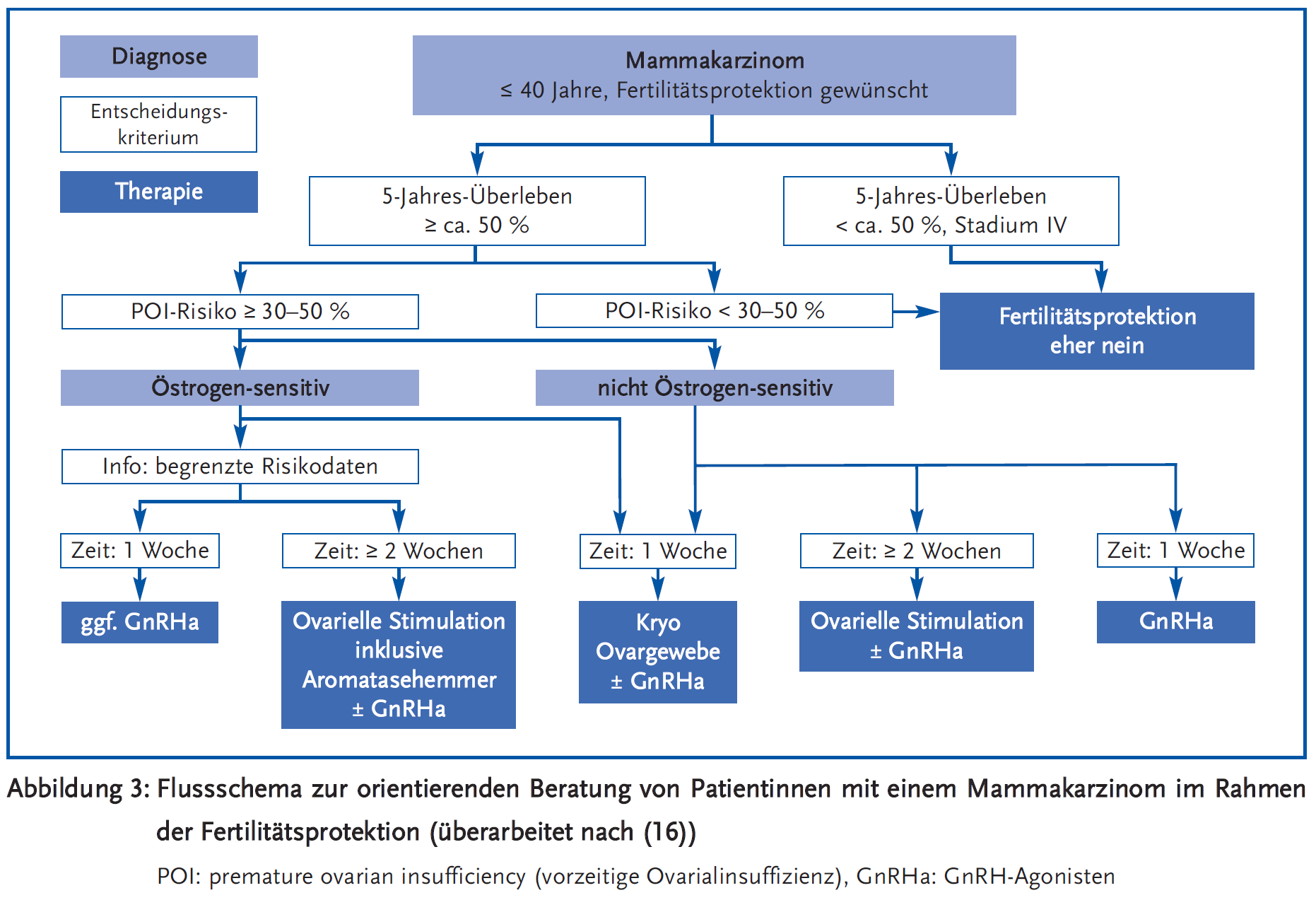
Im FertiPROTEKT Netzwerk e.V. (www.fertiprotekt.de) sind über 100 Mitgliedszentren aus Deutschland, Österreich und der Schweiz zusammengeschlossen. Im Register des Vereins werden alle Beratungen und durchgeführten Maßnahmen dieser Zentren zur weiblichen Fertilitätsprotektion erfasst und in regelmäßigen Arbeitstreffen zusammenfassend dargestellt. Der Verein nutzt die Daten und das Mitgliedernetzwerk für zahlreiche Studien und wissenschaftliche Publikationen. Auf der Homepage findet sich die Anleitung zum kostenfreien Download eines 2016 erschienen Buches (16). Dieses stellt komprimiert und übersichtlich die praxisrelevanten Aspekte und Erkrankungen sowohl der weiblichen als auch der männlichen Fertilitätsprotektion dar. Für die im Buch thematisierten Erkrankungen wurden übersichtliche Flussschemata erarbeitet, welche die Entscheidungen im Alltag erleichtern sollen. Beispielhaft dargestellt ist nachfolgend das Schema für das Mammakarzinom (Abbildung 3).
Fazit für die Praxis
Die Beratung von Frauen und Männern im reproduktiven Alter (sowie in bestimmten Situationen auch von Kindern und Adoleszenten mit ihren Eltern) über Möglichkeiten der Fertilitätsprotektion ist heute etablierter und in vielen Leitlinien obligater Bestandteil von Erkrankungen und Therapiekonzepten, die gonadotoxische Behandlungen (Chemotherapien, aber auch Bestrahlungen und/oder Operationen mit resultierender Einschränkung der Fertilität) beinhalten. Das Ziel ist die Beurteilung der individuellen Notwendigkeit und der Möglichkeiten der Fertilitätsprotektion, welche singulär oder kombiniert erfolgen können.
Beratung und Diagnostik zur Fertilitätsprotektion sind Leistungen der Krankenkassen, während die durch fertilitätsprotektive Maßnahmen entstehenden Kosten momentan meist selber getragen werden müssen.
Aufgrund des oftmals bestehenden engen Zeitfensters und zahlreichen, von Arzt und Patientin zu treffenden Entscheidungen sind Grundkenntnisse über den aktuellen Stand der Fertilitätsprotektion sowie das Vorhalten einer Logistik (zur Beratung, Kooperation mit Zentren z. B. mit dem FertiPROTEKT Netzwerk e.V.) wünschenswert. Das erleichtert in der Akutsituation das Handeln aller Beteiligten, die notwendigen Entscheidungen sowie die Realisierung der unterschiedlichen Konzepte.
Interessenkonflikte
F. Nawroth hat in den Jahren 2014 und 2015 Honorare für Vortragstätigkeiten von Merck Serono, MSD und Ferring erhalten. Für die Teilnahme an Jahrestagungen (2014, 2015) der American Society for Reproductive Medicine erhielt er von Merck Serono Reisekosten erstattet.
Literatur
- Hansen KR, Hodnett GM, Knowlton N et al.: Correlation of ovarian reserve tests with histologically determined primordial follicle number. Fertil Steril 2011; 95: 170-175.
- Hamy AS, Porcher R, Cuvier C et al.: Ovarian reserve in breast cancer: assessment with anti-Müllerian hormone. Reprod Biomed Online 2014; 29: 573-580.
- Liedtke C, Kiesel L: Chemotherapy-induced amenorrhea – an update. Geburtsh Frauenheilkd 2012; 72: 809-818.
- Sukumvanich P, Case LD, Van Zee K et al.: Incidence and time course of bleeding after long-term amenorrhea after breast cancer treatment: a prospective study. Cancer 2010; 116: 3102-3111.
- Anderson RA, Cameron DA: Pretreatment serum anti-müllerian hormone predicts long-term ovarian function and bone mass after chemotherapy for early breast cancer. J Clin Endocrinol Metab 2011; 96: 1336-1343.
- Wallace WH, Thomson AB, Saran F et al.: Predicting age of ovarian failure after radiation to a field that includes the ovaries. Int J Radiat Oncol Biol Phys 2005; 62: 738-744.
- Mossa B, Schimberni M, Di Benedetto L et al.: Ovarian transposition in young women and fertility sparing. Eur Rev Med Pharmacol Sci 2015; 19: 3418-3425.
- Hickman LC, Valentine LN, Falcone T: Preservation of gonadal function in women undergoing chemotherapy: a review of the potential role for gonadotropin-releasing hormone agonists. Am J Obstet Gynecol 2016; 215: 415-422.
- Franasiak JM, Forman EJ, Hong KH et al.: The nature of aneuploidy with increasing age of the female partner: a review of 15,169 consecutive trophectoderm biopsies evaluated with comprehensive chromosomal screening. Fertil Steril 2014; 101: 656-663.e1.
- Cobo A, García-Velasco JA, Coello A et al.: Oocyte vitrification as an efficient option for elective fertility preservation. Fertil Steril 2016; 105: 755-764.e8.
- Cakmak H, Katz A, Cedars MI et al.: Effective method for emergency fertility preservation: random-start controlled ovarian stimulation. Fertil Steril 2013; 100: 1673-1680.
- Van der Ven H, Liebenthron J, Beckmann M et al.: Ninety-five orthotopic transplantations in 74 women of ovarian tissue after cytotoxic treatment in a fertility preservation network: tissue activity, pregnancy and delivery rates. Hum Reprod 2016; 31: 2031-2041.
- Jensen AK, Macklon KT, Fedder J et al.: 86 successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet 2017; 34: 325-336.
- Dolmans MM, Luyckx V, Donnez J et al.: Risk of transferring malignant cells with transplanted frozen-thawed ovarian tissue. Fertil Steril 2013; 99: 1514-1522.
- Kamischke A, Jürgens H, Hertle L et al.: Cryopreservation of sperm from adolescents and adults with malignancies. J Androl 2004; 25: 586-592.
- von Wolff M (Hrsg.): Perspektive Fertilität: Indikation und Durchführung fertilitätsprotektiver Maßnahmen bei onkologischen und nicht-onkologischen Erkrankungen. Kiel: Schmidt & Klaunig, 2016.
