Unerwünschte Wirkungen von DPP-4-Inhibitoren
Zusammenfassung
Die aktuelle blutzuckersenkende Therapie des Typ-2-Diabetes mellitus orientiert sich nicht mehr an fixen HbA1c-Zielwerten, sondern definiert individualisierte Therapieziele, unter anderem unter Berücksichtigung des hier besonders wichtigen kardiovaskulären Risikoprofils. Im Instrumentarium der oralen antidiabetischen Therapie sind seit 2006 ubiquitär wirksame Dipeptidylpeptidase(DPP)-4-Inhibitoren (DPP4-I) verfügbar, deren Langzeit¬wirkungen allerdings bis dato unzureichend untersucht wurden. Hinsichtlich des Spektrums der unerwünschten Wirkungen fokussiert sich die Pharmakovigilanz derzeit auf das pankreatische System: Die Datenlage bezogen auf die akute Pankreatitis und das Pankreaskarzinom ist widersprüchlich, bei bestehendem Pankreatitis-Risiko, bestehenden Karzinomen und Lipase-Erhöhungen sollte allerdings auf eine DPP4-I-Therapie verzichtet respektive diese abgesetzt werden. Insgesamt scheint das Nutzen-Schaden-Verhältnis der Gliptine unklar: Ein kardiovaskulärer Nutzen ist nicht nachgewiesen und es besteht der Verdacht auf ein vermehrtes Auftreten von zur Hospitalisierung führender Herzinsuffizienz.
Abstract
The current blood glucose lowering therapy of type 2 diabetes mellitus is no more based on fixed HbA1c thresholds but defines individualised therapeutic goals, amongst other things incorporating the especially important cardiovascular risk profile. Since 2006 the ubiquitous effective dipeptidyl peptidase(DPP)-4 inhibitors belong to the therapeutic armamentarium of oral antidiabetic agents, with until today inadequately investigated long-term effects. With regard to the range of adverse effects pharmacovigilance currently focuses on the pancreatic system: data on acute pancreatitis and pancreatic cancer are conflicting. However, with present risk for pancreatitis, present cancer und elevated lipase levels a DPP4-I therapy should not be initiated or should be stopped, respectively. Overall, the risk-benefit ratio of gliptins appears unclear: a cardiovascular benefit could not be established and an increased number of hospitalisations due to congestive heart failure is suspected.
Einleitung
Obwohl einige Daten bezüglich einer Reduktion mikrovaskulärer Komplikationen bei verbesserter langzeitglykämischer Kontrolle des Typ-2-Diabetes mellitus (T2DM) vorliegen, konnte eine solche Assoziation für makrovaskuläre Komplikationen, die bei diesen Patienten das Hauptmorbiditäts- und Mortalitätsrisiko darstellen, nicht nachgewiesen werden (1-4), weshalb heutzutage eine generelle „Treat to target“-Therapie im Sinne eines starren HbA1c-Zielwertes als überholt gilt. Dies war einer der Gründe für die 2008 publizierte Empfehlung der Food and Drug Administration (FDA) zur Evaluation des kardiovaskulären Risikos neuerer antidiabetischer Therapien in der Behandlung des T2DM (5-7). Diese schlägt vor, dass das obere Ende eines zweiseitigen 95-%-Konfidenzintervalls (95 % CI) des relativen Risikos kardiovaskulärer Ereignisse eines neuen Antidiabetikums im Vergleich zu einer Kontrollintervention geringer als 1,8 sein sollte (d. h. eine Steigerung um weniger als 80 %). Es soll mithin primär geprüft werden, ob neuere Antidiabetika keine negativen kardiovaskulären Auswirkungen haben, positive Effekte auf die entsprechenden Outcomes sind keine Voraussetzung.
Neben anderen Substanzen wurden auch die Dipeptidylpeptidase(DPP)-4-Inhibitoren (DPP4-I) oder „Gliptine“ in das jüngst eingeführte europäische, zusätzliche Pharmakovigilanz-Sicherheitsmonitoring aufgenommen, da sich nach deren Zulassung neue Sicherheitsaspekte wie z. B. Verdacht auf Pankreatitis und Herzinsuffizienz ergeben haben (8). In diesem Zusammenhang aufhorchen lässt auch der abrupte Abbruch weiterer Forschung an dem DPP4-I Dutogliptin ohne Angabe von Gründen (9).
Der Erstzulassungsverlauf maßgeblicher Gliptine verlief wie folgt: 2006 Sitagliptin (FDA), 2007 Vildigliptin (European Medicines Agency – EMA), 2009 Saxagliptin (FDA), 2011 Linagliptin (FDA), 2012 Anagliptin und Teneligliptin (beide Japan) und 2013 Alogliptin (FDA).
Wenn immer möglich, wurde auf neuere bzw. neueste Publikationen insbesondere systematischer Reviews Bezug genommen, wobei die Qualität der entsprechenden Publikationen im Rahmen dieses Beitrags nicht überprüft werden konnte, obwohl hier signifikante Unterschiede existieren (10).
Pharmakologie/Pharmakokinetik und Daten zur Niereninsuffizienz
Die DPP4-I verstärken die glukoseabhängige Insulinsekretion der pankreatischen β-Zellen durch Hemmung des DPP-4 vermittelten Abbaus endogen freigesetzter Inkretine (11;12). Zielhormon des Wirkmechanismus ist dabei das Inkretin GLP-1 (glucagon-like peptide 1), das partiell für die Verstärkung der glukoseabhängigen Insulinsekretion als Reaktion auf Nahrungsaufnahme (Inkretineffekt) verantwortlich ist. GLP-1 kann die insuffiziente Reaktion pankreatischer β-Zellen auf das Haupt-Inkretinhormon GIP (glucose-dependent insulinotropic polypeptide) kompensieren. Gegenwärtig existieren zwei Arten inkretinbasierter Therapien: GLP-1-Rezeptoragonisten stimulieren in pharmakologischen Dosen den GLP-1-Rezeptor, wohingegen DPP4-I den Abbau des endogen freigesetzten GLP-1 verhindern. Beide Substanzen reduzieren die Plasmaglukose, inhibieren die Glukagonfreisetzung und führen aufgrund des glukoseabhängigen Wirkmechanismus zu geringen Hypoglykämieraten.
Trotz des insgesamt vergleichbaren Wirkmechanismus weisen die DPP4-I relevante strukturelle Heterogenitäten auf, wie etwa unterschiedliche Pharmakokinetik und -dynamik, sowie differenzielle Selektivität für die mit DPP-4 strukturell verwandten Enzyme (u. a. DPP-8/9). Dies kann mit unterschiedlichen Profilen hinsichtlich erwünschter klinischer und unerwünschter Effekte assoziiert sein.
Die Halbwertszeit der bisher zugelassenen Gliptine rangiert zwischen ca. 2,5 Stunden (Vildagliptin, Saxagliptin, hier noch partiell aktive Metaboliten) und bis zu 120 Stunden (Linagliptin, hier besteht auch eine hohe Bindung an Plasmaproteine). Außer dem primär biliär eliminierten Linagliptin erfolgt die Ausscheidung aller anderen Gliptine vorwiegend renal. Die meist verwandten Dosierungen betragen einmal täglich 5 mg (Linagliptin, Saxagliptin), 25 mg (Alogliptin), 100 mg (Sitagliptin) und zweimal täglich 50 mg (Vildagliptin). Damit werden 70–80 % der DPP-4-Aktivität gehemmt und ein 1,5- bis 4-facher Anstieg der GLP-1-Spiegel erreicht. Die Gliptine werden mit Ausnahme des Saxagliptin (CYP3A4/5) nur gering metabolisiert (13).
Hinsichtlich der langfristigen HbA1c-Senkung ist anzumerken, dass während des zweiten Behandlungsjahres bei Gliptin-Langzeitstudien die ohnehin moderate metabolische Kontrolle um etwa 0,2 % schlechter wird (14).
DPP-4 wird ubiquitär auf den Zelloberflächen (T-Zellen, Makrophagen, Epithelialzellen, Endothelialzellen) im ganzen Körper exprimiert, inhibiert die verschiedensten Substrate und moduliert die Immunregulation, die Entzündungsreaktion sowie die neoplastische Transformation. Untersuchungen der Langzeiteffekte der Hemmung dieses Enzyms existieren bis auf wenige Endpunktstudien bis dato nicht.
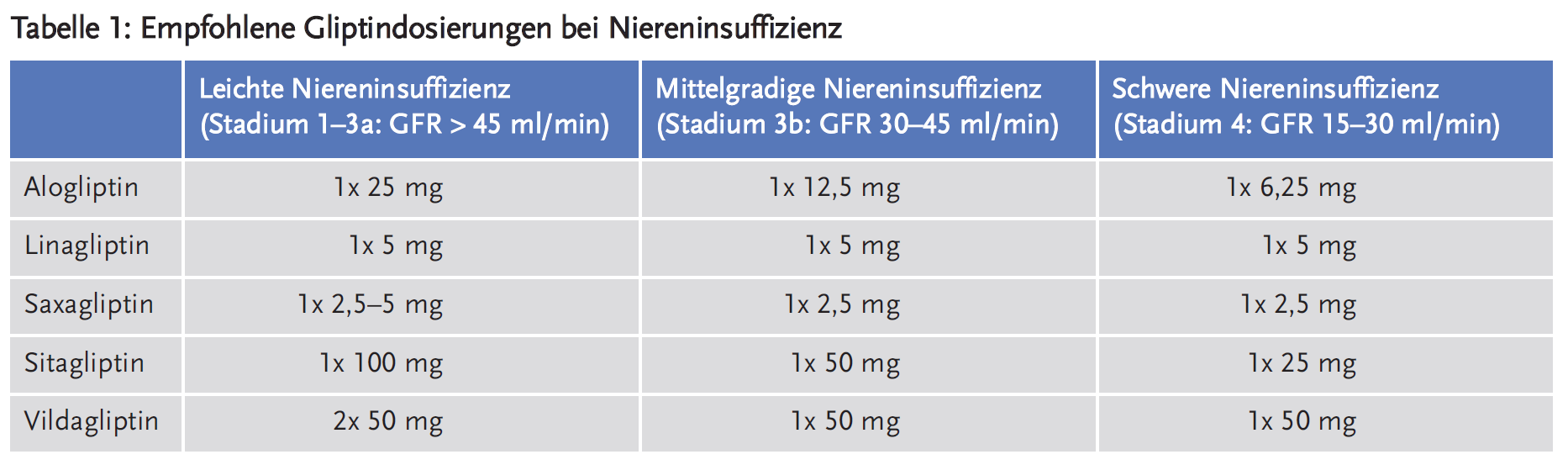
Die empfohlenen Dosierungen verschiedener Gliptine bei unterschiedlichen Graden der Niereninsuffizienz sind in Tabelle 1 zusammengefasst (15;16).
Eine Untersuchung einer taiwanesischen Versichertendatenbank der Sitagliptinmedikation bei 205 T2DM-Patienten nach akutem Myokardinfarkt und chronischer Nierenerkrankung evaluierte u. a. die kardiovaskuläre Gliptinsicherheit (Komposit aus Myokardinfarkt, ischämischer Apoplex und kardiovaskulärer Tod): Die HR lag bei 1,32 (95 % CI 0,97–1,79; p = 0,079) bei einem mittleren Follow-up von einem Jahr. Die Hospitalisierung aufgrund von Herzinsuffizienz unterschied sich nicht relevant, allerdings wurde ein höheres Risiko unter Sitagliptin für erneuten Myokardinfarkt und PTCA postuliert (17).
Eine retrospektive Analyse der Sitagliptingabe nach Nierentransplantation bei 22 Patienten mit neu aufgetretenem Diabetes und einjährigem Follow-up zeigte keine negativen Effekte auf die Nierenfunktion und Immunsuppression (18).
Endpunktstudien
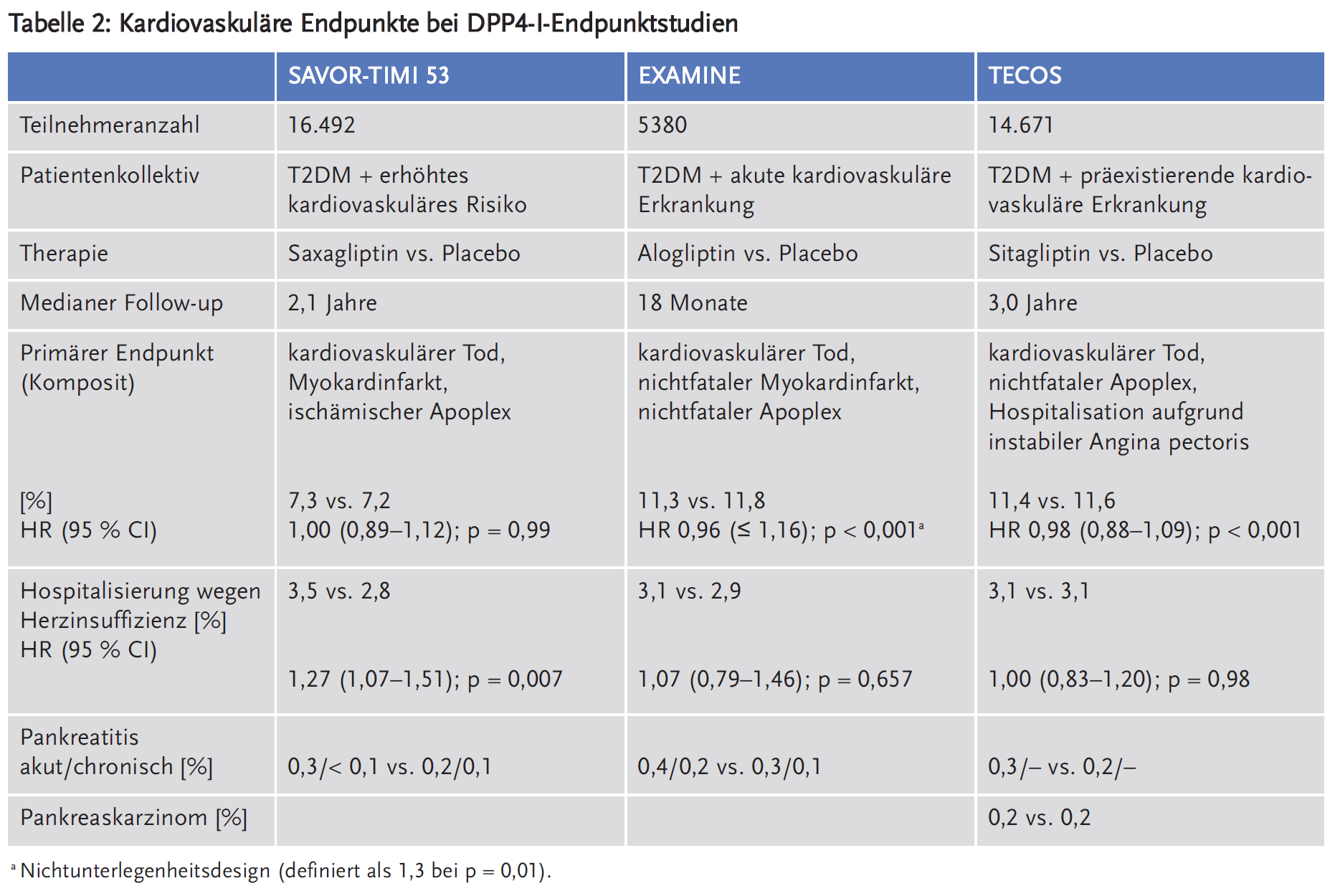
Bis dato wurden drei DPP4-I-Endpunktstudien publiziert: SAVOR-TIMI 53 (Saxagliptin Assessment of Vascular Outcomes Recorded in Patients with Diabetes Mellitus – Thrombolysis in Myocardial Infarction 53) (19;20), EXAMINE (Examination of Cardiovascular Outcomes with Alogliptin versus Standard of Care) (21;22) und TECOS (Trial Evaluating Cardiovascular Outcomes with Sitagliptin) (23). Anzumerken ist, dass hier Gliptine oder Placebo als zusätzliche Medikation zu einer oralen Antidiabetika-Standardtherapie gegeben wurden, d. h. es wurden überwiegend Kombinationstherapien miteinander verglichen. In Tabelle 2 werden die Hauptergebnisse bezüglich kardiovaskulärer Endpunkte inklusive Herzinsuffizienz wiedergegeben.
Eine weitere Studie mit Rekrutierungsbeginn Dezember 2010 und Komplettierung Dezember 2012 ist CAROLINA (CARdiovascular Outcome Trial of LINAgliptin Versus Glimepiride) (24), deren Studienende für 2018 antizipiert ist: 6051 Teilnehmer mit T2DM und erhöhtem kardiovaskulären Risiko wurden zu Linagliptin oder Glimepirid randomisiert. Der primäre Endpunkt ist ein Komposit aus kardiovaskulärem Tod, nichtfatalem Myokardinfarkt, nichtfatalem Apoplex oder Hospitalisierung aufgrund instabiler Angina pectoris und wird primär auf Nichtunterlegenheit (HR ≤ 1,3) getestet. Hospitalisierungen und Tod aufgrund von Herzinsuffizienz werden ebenfalls untersucht.
Infektions- und Entzündungsrisiko (inklusive Pankreatitis, Pankreaskarzinom)
Eine jüngere Metaanalyse wies kein erhöhtes Infektionsrisiko unter DPP4-I nach. Eingeschlossen wurden 74 Studien bei T2DM mit mindestens zwölfwöchiger Dauer. Die Infektionsrisiken von Alogliptin, Linagliptin, Sitagliptin, Saxagliptin und Vildagliptin waren mit denen unter Placebo vergleichbar (25). Andererseits zeigte eine Analyse von Krankenversicherungsdaten aus Asien, dass der kurzfristige Gebrauch sowie auch höhere Gliptindosierungen mit einem erhöhten Risiko an Herpes-zoster-Infektionen assoziiert waren (26). Ein randomisierte kontrollierte Studie (RCT) mit Sitagliptin für bis zu 24 Wochen bei 20 nichtdiabetischen Personen mit HIV-Positivität wiederum erbrachte keinen Hinweis auf eine Reduktion der CD4+-T-Helferzellen (27). Eine japanische Fallkontrollstudie bei T2DM zeigt allerdings eine Assoziation zwischen DPP4-I und einem erhöhten Risiko für ein Wiederaufflammen polyarthritischer Gelenkbeschwerden (28). Eine Fallkontrollstudie untersuchte das Risiko von ambulant auftretenden Pneumonien unter mit Gliptinen behandelten 49.653 T2DM-Patienten (562 Hospitalisierungen wegen Pneumonie) und wies keine relevanten Differenzen im Vergleich zu anderen oralen Antidiabetika auf (29). Weiterhin existieren Fallberichte eines vermehrten Auftretens von Angioödemen einer Komedikation von Vildagliptin und Sitagliptin mit ACE-Inhibitoren/Angiotensin-Rezeptorenblockern (30;31).
Pankreatitis/Pankreaskarzinom: Die Frage der Assoziation zwischen der Einnahme verschiedener Antidiabetika und einer Pankreatitis datiert bis auf 1970 zurück. Dabei ist zu beachten, dass der Diabetes als solcher einen Risikofaktor für eine Pankreatitis darstellt und die medikamentenassoziierte Pankreatitis kein häufiges Phänomen ist, was eine adäquate Untersuchung erschwert. Weiterhin muss von einer langen Latenzzeit bei der Entstehung eines Pankreaskarzinoms ausgegangen werden (32;33). Insgesamt erscheint die Datenlage nicht eindeutig: Ein systematisches Review von Fallberichten, Observationsstudien, RCTs und Metaanalysen von RCTs beschäftigte sich mit der Frage der Assoziation von Gliptingabe mit Pankreatitis. Dabei ergab sich kein eindeutiges Bild einer Risikoerhöhung oder -erniedrigung (34). Ein weiteres systematisches Review mit vergleichbaren Inklusionen, das 55 RCTs mit 33.350 T2DM-Teilnehmern umfasste, evaluierte 37 Fälle von Pankreatitis und zeigte ein Odds Ratio bei DPP4-I von 1,06 (95 % CI 0,46–2,45), Subgruppenanalysen erbrachten keine relevanten differenziellen Effekte bezüglich der verschiedenen Substanzen (35). Eine jüngere Kohortenstudie aus Taiwan allerdings wies in Subgruppenanalysen die Assoziation eines erhöhten Pankreatitisrisikos bei Frauen und älteren Menschen mit Gliptineinnahme nach (36). Zumindest für eine Sitagliptineinnahme älterer Diabetiker konnten diese Befunde in einer kanadischen retrospektiven Kohortenstudie jedoch nicht bestätigt werden (37). Weiterhin konnte eine neuere Metaanalyse der Assoziation inkretinbasierter Therapien mit einer akuten Pankreatitis kein statistisch signifikantes Risiko nachweisen (38). Andererseits wies eine neuere Metaanalyse von RCTs inkretinbasierter Therapien, die die drei großen Endpunktstudien einschloss, ein Odds Ratio von 1,57 (95 % CI 1,09–2,26) zuungunsten der Inkretine nach (39).
Weiterhin zeigte eine komplexe Analyse der FDA-Datenbank von Berichten über unerwünschte Arzneimitteleffekte eine statistische Assoziation zwischen dem Gebrauch von DPP4-I und einem Pankreaskarzinom, ohne natürlich einen Kausalzusammenhang etablieren zu können (40). Bestätigt wurde dieser Befund durch eine retrospektive Analyse einer taiwanesischen Versichertendatenbank, die ebenfalls eine Assoziation zwischen Sitagliptineinnahme bei 71.137 Typ-2-Diabetikern und einem erhöhten Pankeaskarzinomrisiko etablierte (41).
Angesichts der derzeit unsicheren Datenlage sollte daher bis auf Weiteres aus Sicherheitsgründen bei Patienten mit bereits bestehender oder mit Risiko für eine Pankreatitis keine Gliptineinnahme erfolgen (32).
Weniger bekannte unerwünschte Wirkungen
Es erfolgt eine Kurzdarstellung von relativ selten genannten unerwünschten Wirkungen, die mit DPP4-I assoziiert wurden:
- Nach einer dänischen Fallkontrollstudie war der kurzfristige Gebrauch von Gliptinen nicht mit einem erhöhten Frakturrisiko assoziiert (42). In diesem Zusammenhang wies eine Querschnittsuntersuchung darauf hin, dass hohe DPP-4-Spiegel mit multiplen vertebralen Frakturen bei Männern mit T2DM assoziiert sind (43). Eine diesbezügliche Analyse der SAVOR-TIMI-53-Studie mit einem medianen Follow-up von 2,1 Jahren erbrachte ebenfalls keinen Hinweis auf ein erhöhtes Frakturrisiko nach Saxagliptineinnahme. Interessanterweise ergab sich hier eine entsprechende Assoziation zwischen erhöhtem Frakturrisiko und längerer Diabetesdauer (44).
- Bekannterweise wird DPP-4 ubiquitär im Körper einschließlich der Haut exprimiert. Ein Fallbericht beschreibt das Auftreten eines bullösen Pemphigoids nach Sitagliptineinnahme (45), ein weiterer ein Arzneimittelexanthem, ebenfalls nach Sitagliptineinnahme und Reexposition (46).
- Neben der Inaktivierung der Inkretinhormone kann DPP-4 auch Neuropeptid Y hemmen und damit zu einer antilipolytischen Wirkung mit konsekutiver Akkumulation von Körperfett beitragen (47).
- Unter einem bis dato noch relativ unbekannten DPP4-I, Teneligliptin, wurde eine Erhöhung des Harnsäurespiegels beschrieben (48).
- Eine weitere Fallbeschreibung erwähnt lebertoxische Effekte von Linagliptin, das primär biliär eliminiert wird und eine lange Halbwertszeit aufweist (49).
- Weiterhin sind drei Ileusfälle unter Gliptingabe beschrieben (50).
- Zuletzt existiert eine Fallbeschreibung eines nichtkardialen pulmonalen Ödems bei einem T2DM nach nur einwöchiger Sitagliptingabe (51).
Kardiovaskuläre Ereignisse (inklusive Herzinsuffizienz)
Die Herzinsuffizienz ist eine wichtige primäre Todesursache weltweit. Einerseits weisen Menschen mit Herzinsuffizienz eine erhöhe Inzidenz an Diabetes mellitus auf und andererseits verschlechtert Diabetes mellitus als Komorbidität die Prognose der Herzinsuffizienz (50). Die Herzinsuffizienz aufgrund von Diabetes wird auch als „diabetische Kardiomyopathie“ bezeichnet und eine jüngere Kohortenstudie (CALIBER-Register) aus England deutete an, dass die Herzinsuffizienz und die pAVK die häufigsten initialen Manifestationen einer kardiovaskulären Erkrankung beim T2DM sind (52). Studien beim T2DM werden heutzutage zwar auch auf kardiovaskuläre Endpunkte ausgelegt, jedoch ist die Herzinsuffizienz nur selten ein primärer Endpunkt (53). Es ist fraglich, ob das heutzutage am häufigsten anzutreffende Design zum Monitoring der kardiovaskulären Sicherheit, die Nichtunterlegenheitsstudie, ausreicht, um die Ergebnisse dieser Untersuchungen auf den klinischen Alltag zu übertragen.
Wie die Ergebnisse einer Querschnittsuntersuchung zeigten, sind exzessive Aktivitäten zirkulierender DPP-4 mit einer subklinischen linksventrikulären systolischen und/oder diastolischen Dysfunktion assoziiert (54). DPP-4 gilt als ein Schlüsselenzym bezüglich der Modifikation von Brain Natriuretic Peptide (BNP; Herzinsuffizienzmarker). In einem Follow-up über sechs Monate wurden 164 hospitalisierte Patienten (darunter 63 mit T2DM), einem medianen Alter von 78 Jahren sowie akuter Herzinsuffizienz untersucht. Insgesamt 59 % wiesen eine linksventrikuläre systolische Dysfunktion auf. Diese Untersuchung zeigte, dass erhöhte DPP-4-Werte innerhalb von sechs Monaten nach Entlassung mit einer Dreifacherhöhung des Mortalitätsrisikos aufgrund von Herzinsuffizienz assoziiert waren (55).
Andererseits deuten sich Assoziationen eines erhöhten Risikos für Hospitalisierung infolge Herzinsuffizienz unter Gabe verschiedener DPP4-I aufgrund der Ergebnisse diverser Publikationen an (56). Dieses widersprüchliche Bild soll im Folgenden kurz skizziert werden:
Eine Metaanalyse von Linagliptin versus Placebo/aktivem Komparator von RCTs ≥ 12 Wochen Dauer bei Teilnehmern mit T2DM untersuchte ein Komposit aus kardiovaskulärem Tod, nichtfatalem Myokardinfarkt, nichtfatalem Apoplex und Hospitalisierung aufgrund instabiler Angina pectoris (18 Studien, 7746 Teilnehmer: HR 0,78 (95 % CI 0,55–1,22)). Weiterhin wurde Hospitalisierung aufgrund einer Herzinsuffizienz untersucht (acht Studien, 3314 Teilnehmer): HR 1,04 (95 % CI 0,43–2,47) (57).
Eine andere Metaanalyse untersuchte 84 RCTs ≥ 24 Wochen verschiedener DPP4-I und Herzinsuffizienz als gemessenem Outcome: Das RR einer akuten Herzinsuffizienz im Vergleich zu Placebo/aktivem Komparator war 1,19 (95 % CI 1,03–1,37); p = 0,015. Klare Differenzen zwischen den einzelnen Substanzen waren nicht sichtbar (58).
Eine weitere Metaanalyse (59) verschiedener Gliptine von insgesamt 94 Studien mit 85.224 T2DM-Teilnehmern (medianer Follow-up 29 Wochen) zeigte ein erhöhtes Risiko für neu aufgetretene Herzinsuffizienz nach längerer Gliptintherapie: HR 1,16 (95 % CI 1,01–1,33); p = 0,034.
Eine Metaanalyse von 40 Vildagliptin RCTs bei 17.446 T2DM-Teilnehmern und partiell erhöhtem Risiko für kardiovaskuläre Erkrankungen untersuchte den Komposit aus Myokardinfarkt, Apoplex und kardiovaskulärer Tod im Vergleich zu Placebo/aktivem Komparator: RR 0,82 (95 % CI 0,61–1,11). Bestätigte Herzinsuffizienzfälle (Hospitalisierungen oder neu aufgetreten) zeigten ein RR von 1,08 (95 % CI 0,68–1,70) (60).
Eine Analyse koreanischer Versicherungsdaten bei 935.519 Versicherten mit Diabetes und mittlerem Follow-up von 337 Tagen untersuchte Inzidenzraten für Hospitalisierung wegen Herzinsuffizienz mit den folgenden Ergebnissen (jeweils pro 100.000 Patientenjahre): 118 (Pioglitazon) vs. 106 (Sitagliptin) vs. 136 (Vildagliptin) mit einer HR von 1,85 (Pioglitazon), 2,00 (Sitagliptin) und 1,79 (Vildagliptin). Die Hinweise auf diese unerwünschten Effekte waren v. a. in den ersten 30 Tagen der Behandlung zu beobachten (61). Eine populationsbasierte Fallkontrollstudie administrativer Daten aus Italien mit 282.000 Versicherten, die mit Antidiabetika behandelt wurden, ermittelte 14.613 Hospitalisierungen wegen Herzinsuffizienz, darunter 7212 inzidente Fälle und 1727 Rehospitalisierungen. In dieser Untersuchung fand sich kein Hinweis auf ein erhöhtes Risiko an Herzinsuffizienz unter DPP4-I (62). Eine italienische retrospektive Studie an 127.555 T2DM Patienten unter Antidiabetika mit einem durchschnittlichen Follow-up von 2,6 Jahren zeigte die Assoziation eines reduzierten Risikos für Hospitalisierung wegen Herzinsuffizienz von DPP4-I im Vergleich zu Sulfonylharnstoffen (63). Eine Fallkontrollstudie US-amerikanischer Patienten mit Diabetes unter Sitagliptin untersuchte das Auftreten von Herzinsuffizienz innerhalb 30 Tage nach Hospitalisierung aufgrund eines akuten Koronarsyndroms. Sitagliptin musste innerhalb 90 Tage vor dem akuten Koronarsyndrom eingenommen werden. Sitagliptin war nicht mit einem erhöhten Risiko für den kombinierten Endpunkt Mortalitätsrisiko oder Herzinsuffizienz assoziiert (64).
Weitere Signale bezüglich Pankreasschädigungen
Die ersten Signale eventueller Schädigungen des Pankreas durch Inkretinmimetika wurden der FDA im Zeitraum 2005 bis 2006 für das erste GLP1-Analogon Exenatid gemeldet (65) und wurden später mit praktisch allen inkretinbasierten Therapien (sowohl GLP1-Analoga als auch DPP4-Inhibitoren) assoziiert. Bei den GLP-1 basierten Therapien ist zu beachten, dass die physiologischen Wirkungen nur kurzwirkend erfolgen, während die Konsequenzen einer langwirksamen pharmakologischen Rezeptorstimulation weitgehend unbekannt sind. Dabei könnte die momentan im Fokus stehende akute Pankreatitis nur die Spitze eines Eisbergs darstellen: Bisher nur beschrieben, aber in Humanstudien anscheinend nicht systematisch erfasst sind Wirkungen auf den exokrinen Pankreas, subklinische Pankreasgang-Proliferationen und Gangmetaplasien, subklinische Pankreatitiden und damit assoziierte gesteigerte intrapankreatische Druckverhältnisse, die eine Prädisposition zum Pankreaskarzinom darstellen könnten (66-68). In diesem Zusammenhang ist anzumerken, dass auch eine Hypertriglyceridämie ein Risiko für eine akute Pankreatitis darstellt (69). Schließlich wurden in einer vor Kurzem publizierten Arbeit Hypothesen dargelegt, die eine Erklärung liefern, warum DPP4-I zu einem Wachstum und zu einer Metastasierung insbesondere vorhandener maligner Entitäten führen könnten (via Steigerung der endogenen Antioxidans-Abwehr der Zelle und damit herabgesetzter Tumorsuppressor-p53-Aktivität (70)).
Abschließend soll darauf hingewiesen werden, dass bei praktisch allen Dossierbewertungen des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) den DPP4-I in Gestalt von Linagliptin, Saxagliptin, Sitagliptin und Vildagliptin kein Zusatznutzen im Vergleich zu einer zweckmäßigen Vergleichstherapie attestiert wurde (71;72). Lediglich bei einer Sitagliptin-Metformin-Therapie wurde beim Therapieziel normnahe Blutzuckereinstellung (was kein akzeptiertes Therapieziel beim Typ-2-Diabetes mellitus darstellt) bei Männern ein beträchtlicher Zusatznutzen respektive bei Frauen ein Anhaltspunkt für einen Zusatznutzen festgestellt (73;74). Die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) konnte auf Basis der jeweilig gegenwärtigen Datenlage in keiner der zugelassenen Indikationen einen Zusatznutzen für DPP4-I gegenüber der jeweiligen zweckmäßigen Vergleichstherapie sehen (75-83).
Fazit für die Praxis
Hinsichtlich der blutzuckersenkenden Therapie des Typ-2-Diabetes mellitus gilt eine generelle „Treat-to-target“-Vorgehensweise, etwa im Sinne eines HbA1c-Zielwertes von 6,5 %, als überholt. Vielmehr muss die metabolische „Kontrolle“ individualisiert werden, insbesondere bezüglich Alter bzw. antizipierte Restlebenszeit, Komedikationen und Komorbiditäten sowie bestehendem kardiovaskulärem Risikoprofil.
Sowohl das IQWiG als auch die AkdÄ sehen bei den untersuchten DPP-4-Inhibitoren (DPP4-I) für die praktisch relevante Therapie des Diabetes mellitus Typ 2 keinen Zusatznutzen.
DPP4-I wirken ubiquitär im Körper, was potenzielle Relevanz für erwünschte und unerwünschte Effekte beinhaltet. Die Langzeitwirkungen dieser physiologisch kurzwirksamen Substanzen sind bisher unzureichend untersucht, drei Endpunktstudien hatten eine mediane Nachbeobachtungszeit von 1,5 bis 3 Jahren.
Das DPP4-I-Infektions-/Entzündungsrisiko wird insgesamt als eher gering eingeschätzt. Die Evidenzsituation hinsichtlich der akuten Pankreatitis und des Pankreaskarzinoms ist widersprüchlich, erfordert aber auf jeden Fall eine erhöhte Vigilanz: DPP4-I sollten keinem Karzinompatienten (insbesondere Pankreaskarzinom, Schilddrüsenkarzinom, MEN-Syndrom Typ 2) verabreicht werden. Weiterhin solle eine DPP4-I-Therapie nicht erfolgen bei Pankreatitis-Anamnese, Gallenblasen-/Gallengangserkrankungen, erhöhtem Pankreatitis-Risiko (Familienanamnese, Alkoholabusus, erhöhte Triglyceride). Bei einer Lipase-Erhöhung (valideres Leitenzym als die Amylase) nach DPP4-I-Gabe sollte der DPP4-I aus Vorsichtsgründen abgesetzt werden.
Insgesamt besteht aufgrund des unklaren Nutzen-Schaden-Verhältnisses der DPP4-I kein Anlass, diese in die Breite der Versorgung von Patienten mit T2DM einzusetzen. Stattdessen sollten individuell abgewogene Einzelfallentscheidungen bezüglich dieser Therapieart erfolgen.
Interessenkonflikte
Ein Interessenkonflikt wird vom Autor verneint.
Literatur
- Hemmingsen B, Lund SS, Gluud C et al.: Intensive glycaemic control for patients with type 2 diabetes: systematic review with meta-analysis and trial sequential analysis of randomised clinical trials. BMJ 2011; 343: d6898.
- Hemmingsen B: Interventions aiming for lower versus higher glycaemic levels in adults with type 2 diabetes mellitus. Cochrane Database Syst Rev 2015; Cochrane Protocol in peer review.
- Kahler P, Grevstad B, Almdal T et al.: Targeting intensive versus conventional glycaemic control for type 1 diabetes mellitus: a systematic review with meta-analyses and trial sequential analyses of randomised clinical trials. BMJ Open 2014; 4: e004806.
- Montori VM, Fernandez-Balsells M: Glycemic control in type 2 diabetes: Time for an evidence-based about-face? Ann Intern Med 2009; 150: 803-808.
- Ferrannini E, DeFronzo RA: Impact of glucose-lowering drugs on cardiovascular disease in type 2 diabetes. Eur Heart J 2015; 36: 2288-2296.
- Yudkin JS, Richter B, Gale EA: Intensified glucose control in type 2 diabetes – whose agenda? Lancet 2011; 377: 1220-1222.
- Naci H, Lehman R, Wouters OJ et al.: Rethinking the appraisal and approval of drugs for type 2 diabetes. BMJ 2015; 351: h5260.
- Sportiello L, Rafaniello C, Scavone C et al.: The importance of pharmacovigilance for the drug safety: Focus on cardiovascular profile of incretin-based therapy. Int J Cardiol 2015; 202: 731-735.
- Timmerman L: Phenomix diabetes drug dumped by forest labs, after hitting clinical trial goals:http://www.xconomy.com/san-diego/2010/04/20/phenomix-diabetes-drug-dumped-by-forest-labs-after-hitting-clinical-trial-goals/
- Gamble JM, Clarke A, Myers KJ et al.: Incretin-based medications for type 2 diabetes: an overview of reviews. Diabetes Obes Metab 2015; 17: 649-658.
- Richter B, Bandeira-Echtler E, Bergerhoff K, Lerch C: Emerging role of dipeptidyl peptidase-4 inhibitors in the management of type 2 diabetes. Vasc Health Risk Manag 2008; 4: 753-768.
- Richter B, Bandeira-Echtler E, Bergerhoff K, Lerch CL: Dipeptidyl peptidase-4 (DPP-4) inhibitors for type 2 diabetes mellitus. Cochrane Database Syst Rev 2008: Cd006739.
- Baetta R, Corsini A: Pharmacology of Dipeptidyl Peptidase-4 Inhibitors. Drugs 2011; 71: 1441-1467.
- Esposito K, Chiodini P, Maiorino MI et al.: Glycaemic durability with dipeptidyl peptidase-4 inhibitors in type 2 diabetes: a systematic review and meta-analysis of long-term randomised controlled trials. BMJ Open 2014; 4: e005442.
- Evans M, Dejager S, Schweizer A, Foley JE: Is there evidence of any safety differences among DPP-4 inhibitors in the treatment of people with type 2 diabetes mellitus and reduced GFR due to chronic kidney disease? Diabetes Ther 2015; 6: 1-5.
- Ioannidis I: Diabetes treatment in patients with renal disease: Is the landscape clear enough? World J Diabetes 2014; 5: 651-658.
- Chen DY, Wang SH, Mao CT et al.: Sitagliptin after ischemic stroke in type 2 diabetic patients: a nationwide cohort study. Medicine (Baltimore) 2015; 94: e1128.
- Boerner BP, Miles CD, Shivaswamy V: Efficacy and safety of sitagliptin for the treatment of new-onset diabetes after renal transplantation. Int J Endocrinol. 2014; 2014: 617638.
- Scirica BM, Bhatt DL, Braunwald E et al.: Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med 2013; 369: 1317-1326.
- Scirica BM, Braunwald E, Raz I et al.: Heart failure, saxagliptin and diabetes mellitus: observations from the SAVOR – TIMI 53 Randomized Trial. Circulation 2015; 132: e198.
- White WB, Cannon CP, Heller SR et al.: Alogliptin after acute coronary syndrome in patients with type 2 diabetes. N Engl J Med 2013; 369: 1327-1335.
- Zannad F, Cannon CP, Cushman WC et al.: Heart failure and mortality outcomes in patients with type 2 diabetes taking alogliptin versus placebo in EXAMINE: a multicentre, randomised, double-blind trial. Lancet 2015; 385: 2067-2076.
- Green JB, Bethel MA, Armstrong PW et al.: Effect of sitagliptin on cardiovascular outcomes in type 2 diabetes. N Engl J Med 2015; 373: 232-242.
- Marx N, Rosenstock J, Kahn SE et al.: Design and baseline characteristics of the CARdiovascular Outcome Trial of LINAgliptin Versus Glimepiride in Type 2 Diabetes (CAROLINA(R)). Diab Vasc Dis Res 2015; 12: 164-174.
- Yang W, Cai X, Han X, Ji L: DPP-4 inhibitors and risk of infections: a meta-analysis of randomized controlled trials. Diabetes Metab Res Rev 2016; 32: 391-404.
- Chen HH, Lin CL, Yeh SY, Kao CH: Short-term dipeptidyl peptidase-4 inhibitors use increase the risk of herpes zoster infection in asian patients with diabetes. QJM 2016; 109: 91-95.
- Goodwin SR, Reeds DN, Royal M et al.: Dipeptidyl peptidase IV inhibition does not adversely affect immune or virological status in HIV infected men and women: a pilot safety study. J Clin Endocrinol Metab 2013; 98: 743-751.
- Saito T, Ohnuma K, Suzuki H et al.: Polyarthropathy in type 2 diabetes patients treated with DPP4 inhibitors. Diabetes Res Clin Pract 2013; 102: e8-e12.
- Faillie JL, Filion KB, Patenaude V et al.: DPP-4 inhibitors and the risk of community-acquired pneumonia in patients with type 2 diabetes. Diabetes Obes Metab 2015; 17: 379-385.
- Brown NJ, Byiers S, Carr D et al.: Dipeptidyl peptidase-IV inhibitor use associated with increased risk of ACE inhibitor-associated angioedema. Hypertension 2009; 54: 516-523.
- Gosmanov AR, Fontenot EC: Sitagliptin-associated angioedema. Diabetes Care 2012; 35: e60.
- de Heer J, Goke B: Are incretin mimetics and enhancers linked to pancreatitis and malignant transformations in pancreas? Expert Opin Drug Saf 2014; 13: 1-13.
- Giorda CB, Sacerdote C, Nada E et al.: Incretin-based therapies and acute pancreatitis risk: a systematic review and meta-analysis of observational studies. Endocrine 2015; 48: 461-471.
- Giorda CB, Nada E, Tartaglino B et al.: A systematic review of acute pancreatitis as an adverse event of type 2 diabetes drugs: From hard facts to a balanced position. Diabestes Obes Metab 2014; 16: 1041-1047.
- Li L, Shen J, Bala MM et al.: Incretin treatment and risk of pancreatitis in patients with type 2 diabetes mellitus: systematic review and meta-analysis of randomised and non-randomised studies. BMJ 2014; 348: g2366.
- Lai YJ, Hu HY, Chen HH, Chou P: Dipeptidyl peptidase-4 inhibitors and the risk of acute pancreatitis in patients with type 2 diabetes in Taiwan: a population-based cohort study. Medicine (Baltimore) 2015; 94: e1906.
- Clemens KK, McArthur E, Fleet JL et al.: The risk of pancreatitis with sitagliptin therapy in older adults: a population-based cohort study. CMAJ open 2015; 3: E172-181.
- Wang T, Wang F, Gou Z et al.: Using real-world data to evaluate the association of incretin-based therapies with risk of acute pancreatitis: a meta-analysis of 1,324,515 patients from observational studies. Diabetes Obes Metab 2015; 17: 32-41.
- Roshanov PS, Dennis BB: Incretin-based therapies are associated with acute pancreatitis: Meta-analysis of large randomized controlled trials. Diabetes Res Clin Pract 2015; 110: e13-17.
- Nagel AK, Ahmed-Sarwar N, Werner PM et al.: Dipeptidyl peptidase-4 inhibitor-associated pancreatic carcinoma: a review of the FAERS database. Ann Pharmacother 2016; 50: 27-31.
- Tseng CH: Sitagliptin and pancreatic cancer risk in patients with type 2 diabetes. Eur J Clin Invest 2016; 46: 70-79.
- Driessen JH, van Onzenoort HA, Henry RM et al.: Use of dipeptidyl peptidase-4 inhibitors for type 2 diabetes mellitus and risk of fracture. Bone 2014; 68: 124-130.
- Notsu M, Kanazawa I, Tanaka S et al.: Serum dipeptidyl peptidase-4 is associated with multiple vertebral fractures in type 2 diabetes mellitus. Clin Endocrinol (Oxf) 2016; 84: 332-337.
- Mosenzon O, Wei C, Davidson J et al.: Incidence of fractures in patients with type 2 diabetes in the SAVOR-TIMI 53 Trial. Diabetes Care 2015; 38: 2142-2150.
- Attaway A, Mersfelder TL, Vaishnav S, Baker JK: Bullous pemphigoid associated with dipeptidyl peptidase IV inhibitors. A case report and review of literature. J Dermatol Case Rep 2014; 8: 24-28.
- Gupta M, Gupta A: Fixed drug eruption to sitagliptin. J Diabetes Metab Disord. 2015; 14: 18.
- Kos K, Baker AR, Jernas M et al.: DPP-IV inhibition enhances the antilipolytic action of NPY in human adipose tissue. Diabetes Obes Metab 2009; 11: 285-292.
- Kutoh E, Hirate M, Ikeno Y: Teneligliptin as an initial therapy for newly diagnosed, drug naive subjects with type 2 diabetes. J Clin Med Res 2014; 6: 287-294.
- Kutoh E: Probable linagliptin-induced liver toxicity: a case report. Diabetes Metab 2014; 40: 82-84.
- Kanasaki K, Konishi K, Hayashi R et al.: Three ileus cases associated with the use of dipeptidyl peptidase-4 inhibitors in diabetic patients. J Diabetes Investig 2013; 4: 673-675.
- Belice T, Yuce S, Kizilkaya B et al: Noncardiac Pulmonary Edema induced by Sitagliptin Treatment. J Family Med Prim Care 2014; 3: 456-457.
- Bando YK, Murohara T: Heart failure as a comorbidity of diabetes: role of dipeptidyl peptidase 4. J Atheroscler Thromb 2016; 23: 147-154.
- McMurray JJV, Gerstein HC, Holman RR, Pfeffer MA: Heart failure: a cardiovascular outcome in diabetes that can no longer be ignored. Lancet Diabetes Endocrinol 2014; 2: 843-851.
- Ravassa S, Barba J, Coma-Canella I et al.: The activity of circulating dipeptidyl peptidase-4 is associated with subclinical left ventricular dysfunction in patients with type 2 diabetes mellitus. Cardiovasc Diabetol 2013; 12: 143.
- Lourenco P, Frioes F, Silva N et al: Dipeptidyl peptidase IV and mortality after an acute heart failure episode. J Cardiovasc Pharmacol 2013; 62: 138-142.
- Clifton P: Do dipeptidyl peptidase IV (DPP-IV) inhibitors cause heart failure? Clin Ther 2014; 36: 2072-2079.
- Rosenstock J, Marx N, Neubacher D et al.: Cardiovascular safety of linagliptin in type 2 diabetes: a comprehensive patient-level pooled analysis of prospectively adjudicated cardiovascular events. Cardiovasc Diabetol 2015; 14: 57.
- Monami M, Dicembrini I, Mannucci E: Dipeptidyl peptidase-4 inhibitors and heart failure: A meta-analysis of randomized clinical trials. Nutr Metab Cardiovasc Dis 2014; 24: 689-697.
- Savarese G, Perrone-Filardi P, D'Amore C et al.: Cardiovascular effects of dipeptidyl peptidase-4 inhibitors in diabetic patients: a meta-analysis. Int J Cardiol 2014; 181: 239-244.
- McInnes G, Evans M, Del Prato S et al.: Cardiovascular and heart failure safety profile of vildagliptin: a meta-analysis of 17 000 patients. Diabetes Obes Metab 2015; 17: 1085-1092.
- Suh S, Seo GH, Jung CH et al.: Increased risk of hospitalization for heart failure with newly prescribed dipeptidyl peptidase-4 inhibitors and pioglitazone using the Korean Health Insurance Claims Database. Diabetes Metabol J 2015; 39: 247-252.
- Giorda CB, Picariello R, Tartaglino B et al.: Hospitalisation for heart failure and mortality associated with dipeptidyl peptidase 4 (DPP-4) inhibitor use in an unselected population of subjects with type 2 diabetes: a nested case-control study. BMJ Open 2015; 5: e007959.
- Fadini GP, Avogaro A, Degli Esposti L et al.: Risk of hospitalization for heart failure in patients with type 2 diabetes newly treated with DPP-4 inhibitors or other oral glucose-lowering medications: a retrospective registry study on 127,555 patients from the Nationwide OsMed Health-DB Database. Eur Heart J 2015; 36: 2454-462.
- Eurich DT, Weir DL, Simpson SH et al.: Risk of new-onset heart failure in patients using sitagliptin: a population-based cohort study. Diabet Med 2016; 33: 621-630.
- FDA: Exenatide (marketed as BYETTA): Acute Pancreatitis:https://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm119034.htm
- Gale EA: GLP-1 based agents and acute pancreatitis: drug safety falls victim to the three monkey paradigm. BMJ 2013; 346: f1263.
- Gale EA: Smoke or fire? Acute pancreatitis and the liraglutide trials. Diabetes Care 2015; 38: 948-950.
- Butler AE, Campbell-Thompson M, Gurlo T et al.: Marked expansion of exocrine and endocrine pancreas with incretin therapy in humans with increased exocrine pancreas dysplasia and the potential for glucagon-producing neuroendocrine tumors. Diabetes 2013; 62: 2595-2604.
- Pedersen SB, Langsted A, Nordestgaard BG: Nonfasting mild-to-moderate hypertriglyceridemia and risk of acute pancreatitis. JAMA Intern Med 2016; 176: 1834-1842.
- Tschöp MH, Stumvoll M, Ristow M: Opposing effects of antidiabetic interventions on malignant growth and metastasis. Cell Metab 2016; 23: 959-960.
- Gemeinsamer Bundesausschuss (G-BA): Saxagliptin (Diabetes mellitus Typ 2) – Dossierbewertung A16-42: Kurzfassung der Nutzenbewertung:https://www.iqwig.de/download/A16-42_Saxagliptin_Kurzfassung_Nutzenbewertung-35a-SGB-V.pdf
- Gemeinsamer Bundesausschuss (G-BA): Saxagliptin/Metformin (Diabetes mellitus Typ 2) – Dossierbewertung A16-43: Kurzfassung der Nutzenbewertung:https://www.iqwig.de/download/A16-43_Saxagliptin-Metformin_Kurzfassung_Nutzenbewertung-35a-SGB-V.pdf
- Gemeinsamer Bundesausschuss (G-BA): Sitagliptin (Diabetes mellitus Typ 2) – Dossierbewertung A16-44: Kurzfassung der Nutzenbewertung:https://www.iqwig.de/download/A16-44_Sitagliptin_Kurzfassung_Nutzenbewertung-35a-SGB-V.pdf
- Gemeinsamer Bundesausschuss (G-BA): Sitagliptin/Metformin (Diabetes mellitus Typ 2) – Dossierbewertung A16-45: Kurzfassung der Nutzenbewertung:https://www.iqwig.de/download/A16-45_Sitagliptin-Metformin_Kurzfassung_Nutzenbewertung-35a-SGB-V.pdf
- Arzneimittelkommission der deutschen Ärzteschaft: Schriftliche Stellungnahme zur Nutzenbewertung nach § 35a SGB V "Linagliptin (Absatz 5b), Nr. 144, A12-11, Version 1.0, 29.11.2012":http://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Linagliptin/Linagliptin.pdf
- Arzneimittelkommission der deutschen Ärzteschaft: Schriftliche Stellungnahme zur Nutzenbewertung nach § 35a SGB V "Saxagliptin, Nr. 174, A 13-01, Version 1.0, 27.06.2013":http://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Saxagliptin/Erstbewertung-Kombinationstherapie/Saxagliptin.pdf
- Arzneimittelkommission der deutschen Ärzteschaft: Schriftliche Stellungnahme zur Nutzenbewertung nach § 35a SGB V: "Saxagliptin (neues Anwendungsgebiet), Nr. 197, A13-32, Version 1.0, 28.11.2013":http://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Saxagliptin/Indikationserweiterung-Monotherapie/Saxagliptin.pdf
- Arzneimittelkommission der deutschen Ärzteschaft: Schriftliche Stellungnahme zur Nutzenbewertung nach § 35a SGB V: "Saxagliptin (Neubewertung nach Fristablauf), Nr. 442, A16-42, Version: 1.0, Stand: 29. September 2016":http://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Saxagliptin/Neubewertung-Kombinationstherapie/Saxagliptin.pdf
- Arzneimittelkommission der deutschen Ärzteschaft: Schriftliche Stellungnahme zur Nutzenbewertung nach § 35a SGB V "Saxagliptin/Metformin, Nr. 152, A12-16, Version 1.0, 13.02.2013":http://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Saxagliptin-Metformin/Erstbewertung/Saxagliptin-Metformin.pdf
- Arzneimittelkommission der deutschen Ärzteschaft: Schriftliche Stellungnahme zur Nutzenbewertung nach § 35a SGB V: "Saxagliptin/Metformin (Neubewertung nach Fristablauf), Nr. 443, A16-43, Version: 1.0, Stand: 29. September 2016":http://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Saxagliptin-Metformin/Neubewertung/Saxagliptin-Metformin.pdf
- Arzneimittelkommission der deutschen Ärzteschaft: Schriftliche Stellungnahme zur Nutzenbewertung nach § 35a SGB V "Sitagliptin, Nr. 175, A 13-02, Version 1.0, 27.06.2013":http://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Sitagliptin/Erstbewertung/Sitagliptin.pdf
- Arzneimittelkommission der deutschen Ärzteschaft: Schriftliche Stellungnahme zur Nutzenbewertung nach § 35a SGB V: "Sitagliptin, Nr. 444, A16-44, Version 1.0, Stand: 30. September 2016":http://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Sitagliptin/Neubewertung/Sitagliptin.pdf
- Arzneimittelkommission der deutschen Ärzteschaft: Schriftliche Stellungnahme zur Nutzenbewertung nach § 35a SGB V "Vildagliptin, Nr. 178, A 13-16, Version 1.0, 27.06.2013":http://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Vildagliptin/Vildagliptin.pdf
